米氏凱倫藻胞內多聚磷酸鹽對環境磷變化的響應研究*
金文育 姚煒民 歐林堅 鄭立極
米氏凱倫藻胞內多聚磷酸鹽對環境磷變化的響應研究*
金文育1姚煒民1①歐林堅2鄭立極3
(1. 國家海洋局溫州海洋環境監測中心站 浙江溫州 325035; 2. 暨南大學赤潮與海洋生物學研究中心 廣東廣州 510632; 3. 浙江浙能溫州發電有限公司 浙江樂清 325602)
米氏凱倫藻()赤潮常發生在磷限制海域, 且能長時間維持, 可能具有獨特的胞內磷儲庫利用能力和機制, 但相關認識很少。因此, 論文通過研究不同磷濃度對米氏凱倫藻的生長和生理特征的影響, 重點分析了胞內多聚磷酸鹽(polyP)對環境不同磷含量的響應變化, 初步闡明胞內磷儲庫對米氏凱倫藻生長和維持的作用。結果表明, 當環境磷匱乏時, 米氏凱倫藻以0.15 d–1的比生長速率維持生長, 光合活性和生長能力與磷飽和時無顯著差異, 表明其可適應低磷環境。米氏凱倫藻胞內磷庫可支持細胞分裂近2次。磷脅迫下, 米氏凱倫藻胞內polyP被保留, 直到磷限制時才被利用, 表明polyP不是其優先利用且唯一的磷儲庫。研究結果從營養生理學角度為磷儲庫在米氏凱倫藻赤潮發生中的作用提供一定的科學解釋。
米氏凱倫藻; 磷限制; 顆粒磷; 多聚磷酸鹽
米氏凱倫藻()是世界廣布種, 能夠產生毒素, 無需大量細胞就可以嚴重危害當地生態環境。近年來在我國珠江口、閩江口和長江口頻發赤潮, 給養殖業造成了巨大損失, 受到廣泛關注(郜鈞璋等, 2017; 李曉東, 2018; 呂頌輝等, 2019)。通常認為赤潮的暴發與富營養化有關, 但是米氏凱倫藻赤潮常發生在潛在的磷限制海區(Xu, 2008; Liu, 2009), 可見其對于低磷環境可能有著特殊的適應機制。
目前學者認為浮游植物的低磷適應策略, 主要有三個方面: 提高對外界磷源的吸收水解利用能力(Ou, 2015)、利用胞內磷儲庫(Martin, 2014)和減少細胞磷需求(Martin, 2011)。已有對米氏凱倫藻耐低磷機制的研究多集中在對胞外磷源利用方面, 如米氏凱倫藻通過5′-核苷酸酶水解ATP, 吸收利用水解產物磷酸鹽基團(Luo, 2017); 直接吸收利用葡萄糖-6-磷酸(Zhang, 2017); 吞噬細菌和微藻獲得顆粒態的磷源(Zhang, 2011)。目前, 有關米氏凱倫藻對胞內磷儲庫利用機制的研究很少, 無法揭示其對胞內磷儲庫的利用能力和機制。
多聚磷酸鹽(polyphosphate, polyP)作為胞內磷儲庫的重要組成部分, 由幾個到上百個磷酸基團經高能磷酸酐鍵連接形成的鏈狀無機化合物, 是細胞內重要的磷酸鹽儲庫, 也是細胞內能量儲庫及ATP來源(Achbergerová, 2011)。在環境中無機磷酸鹽基團(inorganic phosphate, Pi)充足時, 大多數浮游植物具有過量吸收Pi的能力, 在滿足細胞代謝和生長的同時, 將多余的Pi以polyP的形式儲存起來。這部分磷將保證細胞在低磷時繼續維持短時間的高生長速率(Rao, 2009)。然而浮游植物調控polyP的機制并不完全清楚。近年來, 對于polyP的研究大多是大尺度的環境調查(Martin, 2014, 2018; Diaz, 2016)。有必要開展更精細的室內研究, 在復雜的磷變化下, 研究polyP的動態響應。本研究通過分析外界環境磷濃度變化下米氏凱倫藻的生理生長狀態, 分析細胞polyP含量變化, 闡明米氏凱倫藻對polyP儲存和利用策略, 以期從磷營養鹽動力學角度為米氏凱倫藻赤潮的發生提供科學解釋。
1 材料與方法
1.1 藻種來源與培養條件
米氏凱倫藻(No. HK-5)由暨南大學赤潮與海洋生物學研究中心藻種室提供, 采用人工海水L1培養基進行培養, 溫度(20±1) °C, 光照條件為100 μmol/(m2·s),光暗周期為12 h : 12 h。培養期間添加抗生素合劑(氨芐青霉素200 μg/mL、鏈霉素100 μg/mL和卡那霉素100 μg/mL)抑制細菌的生長。正式實驗前, 培養藻液經5 μg/mL DAPI (Sigma)染色過濾到黑膜上(Millipore), 置于熒光顯微鏡(Olympus, BX61)下用100×鏡觀察計數, 檢測藻液是否受到細菌污染。
1.2 不同磷濃度及磷恢復下對米氏凱倫藻的影響實驗設計
米氏凱倫藻的起始細胞密度為5.0×103cells/mL, 設置2個實驗組別: 高磷組(NaH2PO4終濃度為40 μmol/L)和低磷組(NaH2PO4終濃度為5 μmol/L), 每組3個平行樣。每天檢測細胞密度、溶解態無機磷(dissolved inorganic phosphorus, DIP)含量。選擇在第0、3、4、7和10 d檢測顆粒磷(particulate phosphorus, PP)和polyP含量。待低磷組DIP濃度低于檢出限(0.10 μmol/L) 7 d后, 進行磷恢復實驗。兩組處理組同時添加NaH2PO4恢復DIP含量至~32 μmol/L, 在添加后的0、24和48 h, 檢測細胞密度、葉綠素(chl)含量、最大光化學量子效率(vm)、堿性磷酸酶活性(alkaline phosphatase activity, APA)、polyP和PP含量。
1.3 磷酸鹽及生理參數檢測方法
浮游植物細胞樣品經酸性Lugol’s試劑固定后, 采用100 μL浮游計數框在光學顯微鏡(Olympus CX23, Janpan)下計數。微藻培養液經離心(2 400, 5 min)收集, 用于polyP測定; 微藻培養液經GF/F濾膜(450 °C煅燒2 h)過濾, 濾液和濾膜分別用于DIP和PP測定。采用磷鉬藍法(Murphy, 1962)檢測DIP、Solórzano等(1980)方法測定PP、Ou等(2015)方法測定APA、丙酮萃取法測定chl含量(Jespersen, 1987), 以及Phyto-PAM法測定光化學效率vm。PolyP樣品通過離心(2 400, 5 min)方法收集。測定方法參照Martin等(2013) DAPI熒光定量法: 收集的藻細胞超聲破碎細胞后, 添加DNA酶、RNA酶和蛋白酶K, 重復萃取3~4次; 取500 μL萃取液加入60 μL 100μmol/L DAPI溶液, 黑暗染色7 min, 搖勻定容至1.5 mL, 采用熒光分光光度計(HITACHI, F-4600)在Ex: 415 nm和Em: 550 nm條件下檢測。
1.4 polyP凈產生速率計算及數據分析
參考Anderson等(1990)毒素凈產生速率的計算公式計算polyP凈產生速率, 如下:
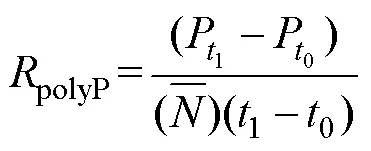
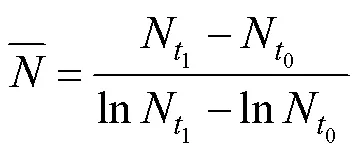
實驗數據采用Sigmaplot 14作圖, 采用One-way ANOVA(Turkey test)分析顯著性水平(<0.05)。
2 結果
2.1 米氏凱倫藻的生長和生理活性
高磷組和低磷組DIP濃度均隨時間逐漸下降, 從第4 d起低磷組DIP濃度低于檢出限, 而高磷組至第10 d DIP濃度為(8.02±0.64) μmol/L; 在第11 d重新添加NaH2PO4, 恢復DIP含量至~32 μmol/L, 添加后低磷組DIP被快速消耗, 至第13 d DIP濃度再次低于檢出限(圖1a)。低磷組細胞生長與高磷組無顯著差異(>0.05), 均以0.15 d–1生長速率生長, 細胞密度從(5.17±0.26)×103cells/mL增至(2.22±0.14)×104cells/mL, 約增長4.29倍(圖1b); 在磷恢復階段, 低磷組米氏凱倫藻以0.12 d–1生長速率持續生長, 在實驗結束時達到最大細胞密度(4.64±0.26)×104cells/mL, 而高磷組在第12 d進入穩定期, 最大細胞密度到達(3.68±0.12)×104cells/mL, 高、低磷組最大細胞密度無顯著差異(>0.05)。
在長時間的磷饑餓后, 低磷組第11 d檢測到APA為(208.58±27.56) fmol/(cell·h), 約為高磷組的25倍(<0.05, 圖2a); 加磷恢復后, 低磷組APA迅速降至(73.04±10.67) fmol/(cell·h), 但仍顯著高于高磷組(<0.05)。磷恢復當天和之后兩天, 兩組間的單位細胞chl含量及vm無顯著性差異(>0.05, 圖2b, 2c)。
2.2 米氏凱倫藻細胞PP和polyP含量
第1 d, 高磷組細胞PP含量顯著上升至(2.13±0.13) pmol/cell, 維持在1.84~1.97 pmol/cell至第11 d (圖3); 加磷恢復后, 小幅下降至1.41~ 1.64 pmol/cell。第1 d, 低磷組細胞PP含量達到最大(1.63±0.06) pmol/cell, 之后持續下降至(0.42±0.08) pmol/cell; 這個過程中低磷組細胞PP顯著低于高磷組(<0.05), 最大差別可達3.88倍。添加NaH2PO4后24 h即第12 d, 低磷組單位細胞PP含量恢復至高磷組水平(<0.05), 第13 d又開始下降, 與高磷組有顯著差異(<0.05)。
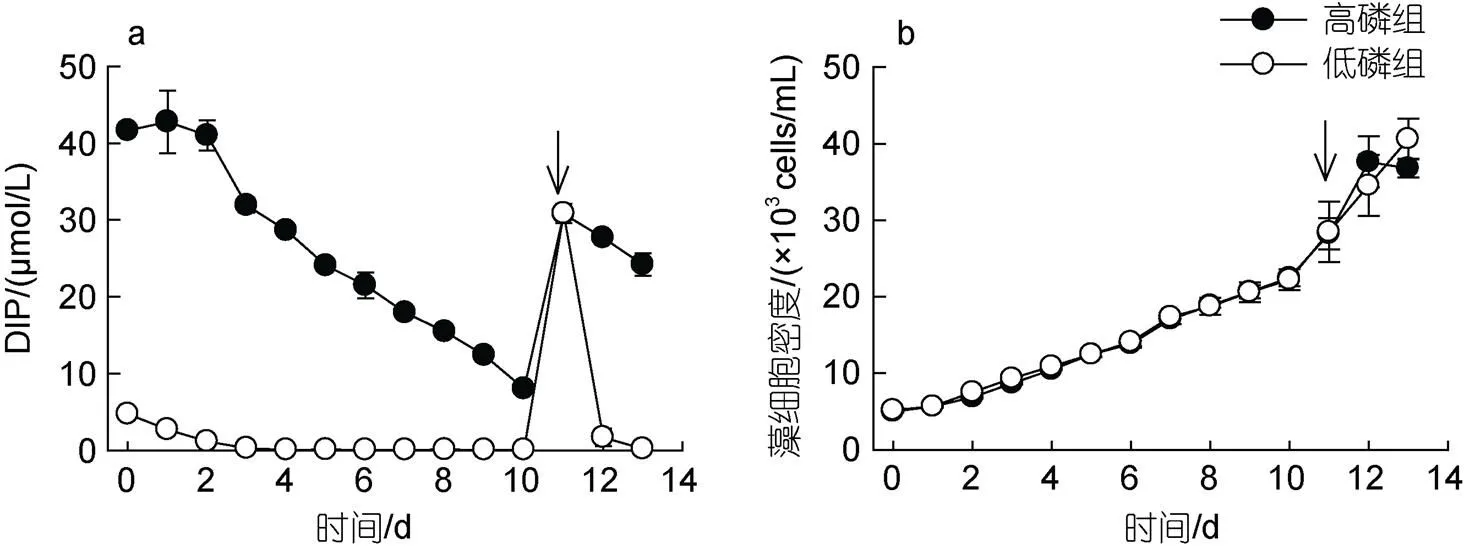
圖1 培養基中溶解態無機磷酸鹽濃度(DIP, a)和米氏凱倫藻細胞密度(b)變化
注: 箭頭表示加磷恢復
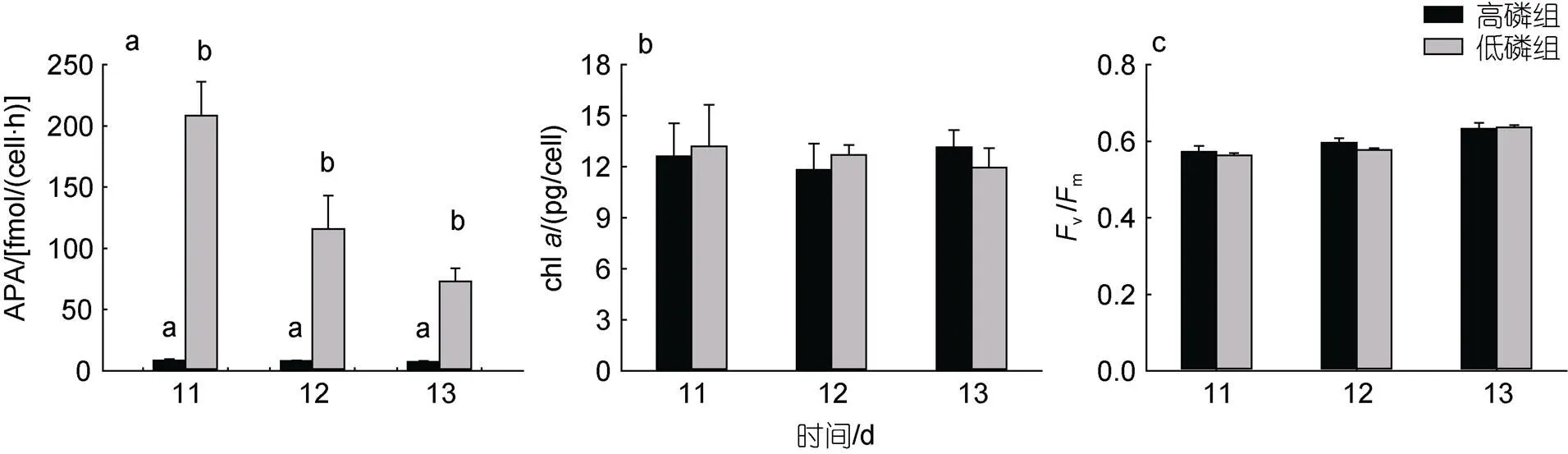
圖2 米氏凱倫藻堿性磷酸酶活性(a)、葉綠素a含量(b)、光化學效率Fv/Fm(c)的變化
注: a, b表示同一時間組別間存在顯著差異,<0.05
整個實驗過程中, 高磷組和低磷組的米氏凱倫藻單位細胞polyP含量均呈現下降、上升再下降的變化趨勢, 兩組之間沒有顯著差異(>0.05, 圖4a)。但低磷組polyP : PP比值在DIP耗盡時(第4 d)開始高于高磷組, 約為高磷組的2.9~3.3倍(<0.05)至第11 d磷恢復前。加磷恢復后, 低磷組polyP : PP比值因PP上升而回落, 與高磷組無差異(>0.05, 圖4b)。對比不同磷濃度下polyP凈產生率, 發現環境磷酸鹽富余時米氏凱倫藻合成polyP。第3 d高磷組polyP凈產生率到達(8.57±1.14)×10–7neq/(cell·d), 隨后迅速下降達到穩態; 而低磷組在第3和4 d維持較高凈產生率, 最大值為(3.85±2.93)×10–7neq/(cell·d), 第7 d達到穩態, 第11 d時再次發生下降(圖4c)。
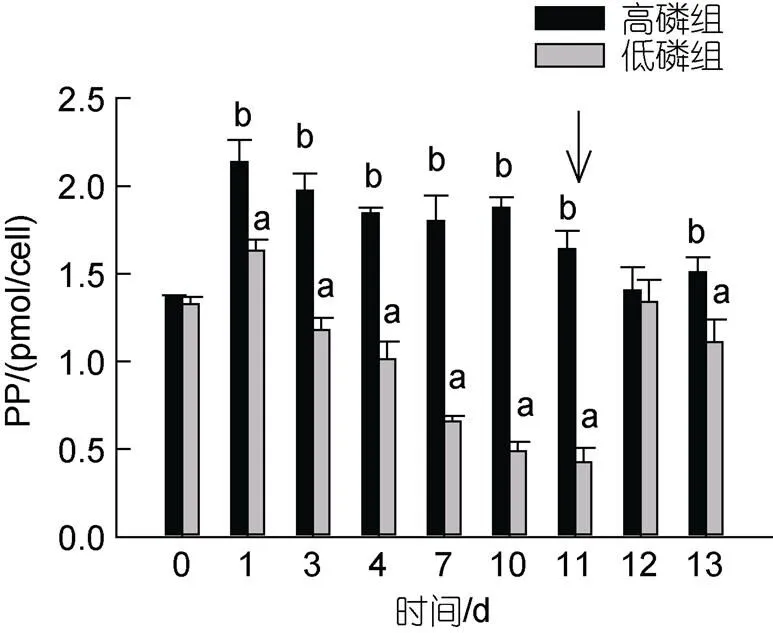
圖3 米氏凱倫藻單位細胞顆粒磷含量變化
注: 箭頭表示加磷恢復時間, a, b表示組別間存在顯著差異,<0.05
3 討論
本研究發現米氏凱倫藻有較強的耐磷特性。在環境中DIP耗盡(<0.12 μmol/L)后的7 d內, 仍以0.15 d–1生長速率維持生長, 細胞密度增長4.29倍, 其生物量及v/m與同時期高磷組無顯著差異, 同時, 缺磷條件下, 米氏凱倫藻單位細胞PP含量逐漸下降, 不斷接近最低閾值, 為米氏凱倫藻細胞最低磷需求, 高低磷組間PP含量最大差別可達3.88倍, 表明米氏凱倫藻在DIP不足時能夠立刻轉向利用胞內磷儲庫來維持生長, 滿足細胞分裂將近2次, 同時光合速率不受影響。該結果與馮青靚(2021)研究一致。而在磷補充后, 經過一段時間磷脅迫下的米氏凱倫藻從環境中快速獲取DIP, 單位細胞PP含量迅速恢復至磷飽和水平, 這表明在外界波動的磷環境條件下, 米氏凱倫藻的胞內磷儲庫有具有重要的調節作用。
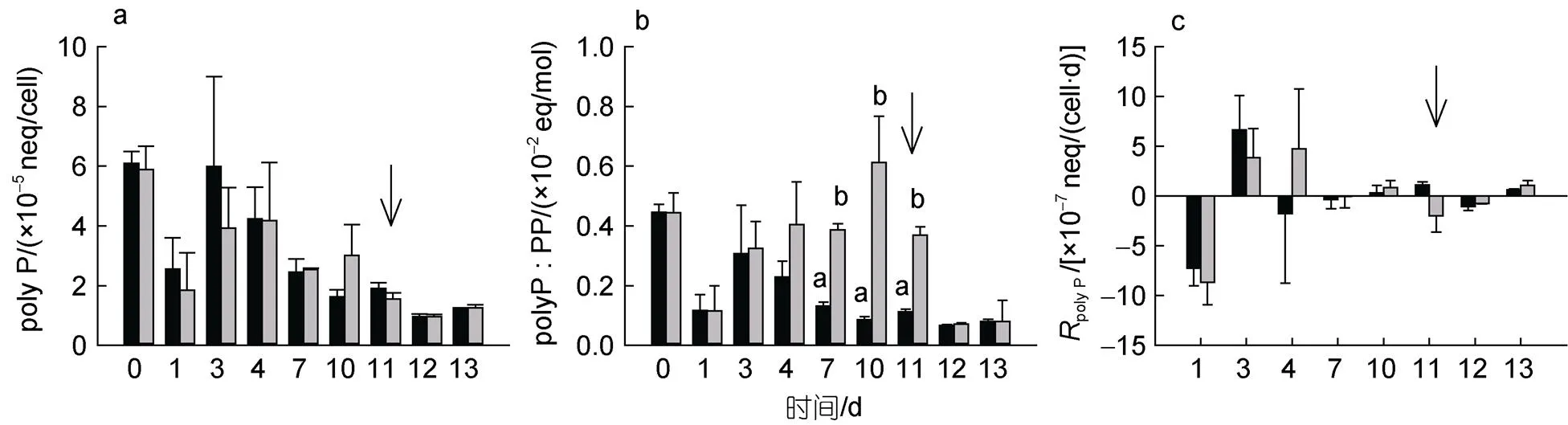
圖4 米氏凱倫藻胞內多聚磷酸鹽(polyP)含量(a)、多聚磷酸鹽與顆粒磷比例(polyP : PP)(b)及多磷酸鹽凈產生率(RpolyP)(c)變化
PP作為浮游植物總磷儲庫概念, 包括細胞內絕大部分磷組分, 能夠在磷匱乏時提供磷源(Karl, 2014)。本研究中, PP能夠支持米氏凱倫藻至少7 d的生長, 該結果與黃銀爽(2018)和馮青靚(2021)研究相近, 兩者結果均顯示PP能夠滿足米氏凱倫藻5 d生長。若將胞內磷儲庫細分, 一般認為浮游植物中有4種重要的磷儲庫: polyP、磷脂、核酸和胞內DIP (Karl, 2014)。其中, polyP作為重要的胞內磷儲庫, 廣泛存在于原核和真核細胞中(Kulaev, 2004)。在外界環境營養充足的情況下, 浮游植物會過量攝取Pi, 滿足自身生長分裂需求后, 將多余的磷以polyP形式儲存(Rao, 2009)。此外, polyP也是能量儲庫, 是ATP的主要來源(Achbergerová, 2011)。本次實驗米氏凱倫藻中檢測到polyP含量約4×10–5neq/cell, 第4 d后單位細胞polyP含量逐漸下降, 即使磷恢復也無明顯增加。推測磷恢復后, 米氏凱倫藻細胞分裂加快, 稀釋細胞polyP含量增加, 掩蓋了其變化趨勢。
細胞polyP凈產生率較細胞polyP含量更好地反映細胞內polyP合成與利用。通過polyP凈產生率結果發現, 米氏凱倫藻可能通過利用胞內polyP度過適應階段, 隨后吸收DIP合成polyP以補充消耗及儲存, 即磷的過量吸收(luxury uptake, Elizabeth, 2010)。磷飽和狀態下, 米氏凱倫藻先達到穩態, polyP凈產生率0.33×10–7neq/(cell·d), polyP合成與利用達到平衡。磷脅迫狀態下, 米氏凱倫藻前期維持相對較高polyP凈產生率[4.72×10–7neq/(cell·d)], 以充分利用外界的磷酸鹽, 直至環境中磷耗盡, 合成過程終止。此時polyP : PP比值上升, 這與Martin等(2014)的研究結果一致。若浮游植物受到磷脅迫時主要動用polyP儲庫來維持生長, polyP : PP應下降, 相較于傳統觀點認為胞內polyP是浮游植物在磷脅迫下利用的最重要的胞內磷庫, 可見polyP不是米氏凱倫藻優先利用且唯一的磷儲庫。這可能與細胞大小有關, polyP相比Pi所需的空間要小(聚集形成顆粒), 小細胞的浮游植物更加需要累積polyP做為磷儲庫(Raven, 2010)。因此polyP對大細胞的米氏凱倫藻可能不是首選, 只有達到極度磷限制時才被利用[polyP的凈產生率為-1.98×10–7neq/(cell·d)]。在實驗后期的磷補充恢復階段, 極度磷限制的米氏凱倫藻吸收大量DIP, 此時polyP凈產生率為-0.76×10–7neq/(cell·d), 未出現過剩反應(overplus response, 即磷脅迫下因另補充Pi出現polyP累積現象(Elizabeth, 2010)), 表明吸收入細胞內的磷并未用于合成polyP, 而是優先補充其他磷儲庫。如甘油磷脂是細胞膜的基本組成部分, 占細胞總磷10%~20%, 在營養限制條件下是一個可被利用潛在的磷庫(Liang, 2019)。假威海鏈藻()添加磷恢復后能夠快速將非磷脂轉換回磷脂(Martin, 2011)。米氏凱倫藻也可能存在這種能力, 隨后將富余的磷酸鹽逐漸合成polyP。
4 結論
米氏凱倫藻有較強的耐磷特性能, 利用胞內磷儲庫應對低磷環境, 維持生長速率并保持生理活性。PP能夠支持米氏凱倫藻至少7 d, 比生長速率0.15 d–1的生長, 可以滿足細胞分裂將近2次, 同時光合速率不受影響。一旦磷恢復, 米氏凱倫藻會迅速吸收DIP補充自身PP消耗。磷脅迫狀態下米氏凱倫藻polyP : PP比值上升, 可見polyP不是米氏凱倫藻優先利用且唯一的磷儲庫, 相較于傳統觀點認為胞內polyP是浮游植物在磷脅迫下利用的最重要的胞內磷庫, 米氏凱倫藻對胞內磷資源的分配利用上可能存在其他更為經濟、高效的通路, 值得進一步研究。
馮青靚, 2021. 米氏凱倫藻細胞膜脂對環境中磷變化的生理生化響應機制[D]. 廣州: 暨南大學.
呂頌輝, 岑競儀, 王建艷, 等, 2019. 我國近海米氏凱倫藻()藻華發生概況、危害及其生態學機制[J]. 海洋與湖沼, 50(3): 487-494.
李曉東, 2018. 米氏凱倫藻(福建株)毒性效應與毒理機制的研究[D]. 青島: 中國科學院大學(中國科學院海洋研究所).
郜鈞璋, 劉亞林, 林義, 等, 2017. 近10年溫州近岸海域赤潮災害特征分析[J]. 海洋湖沼通報(4): 86-90.
黃銀爽, 2018. 米氏凱倫藻()對胞外磷源轉運及水解機制的初步研究[D]. 廣州: 暨南大學.
ACHBERGEROVá L, NAHáLKA J, 2011. Polyphosphate-an ancient energy source and active metabolic regulator [J]. Microbial Cell Factories, 10(1): 63.
ANDERSON D M, KULIS D M, SULLIVAN J J,, 1990. Dynamics and physiology of saxitoxin production by the dinoflagellatesspp. [J]. Marine Biology, 104(3): 511-524.
DIAZ J M, BJ?RKMAN K M, HALEY S T,, 2016. Polyphosphate dynamics at Station ALOHA, North Pacific subtropical gyre [J]. Limnology and Oceanography, 61(1): 227-239.
JESPERSEN A M, CHRISTOFFERSEN K, 1987. Measurements of chlorphyll-a from phytoplankton using ethanol as extraction solvent., 109(3): 445-454.
KARL D M, 2014. Microbially mediated transformations of phosphorus in the sea: new views of an old cycle [J]. Annual Review of Marine Science, 6: 279-337.
KULAEV I S, VAGABOV V M, KULAKOVSKAYA T V, 2004. The Biochemistry of Inorganic Polyphosphates [M]. Chichester, UK: Wiley.
LIANG J B, IQBAL S Y, WEN F,, 2019. Phosphorus-induced lipid class alteration revealed by lipidomic and transcriptomic profiling in oleaginous microalgasp. PJ12 [J]. Marine Drugs, 17(9): 519.
LIU S M, HONG G H, ZHANG J,, 2009. Nutrient budgets for large Chinese estuaries [J]. Biogeosciences, 6(10): 2245-2263.
LUO H, LIN X, LI L,, 2017. Transcriptomic and physiological analyses of the dinoflagellatereveal non-alkaline phosphatase-based molecular machinery of ATP utilisation [J]. Environmental Microbiology, 19(11): 4506-4518.
MARTIN P, DYHRMAN S T, LOMAS M W,, 2014. Accumulation and enhanced cycling of polyphosphate by Sargasso Sea plankton in response to low phosphorus [J]. Proceedings of the National Academy of Sciences of the United States of America, 111(22): 8089-8094.
MARTIN P, LAURO F M, SARKAR A,, 2018. Particulate polyphosphate and alkaline phosphatase activity across a latitudinal transect in the tropical Indian Ocean [J]. Limnology and Oceanography, 63(3): 1395-1406.
MARTIN P, VAN MOOY B A S, 2013. Fluorometric quantification of polyphosphate in environmental plankton samples: extraction protocols, matrix effects, and nucleic acid interference [J]. Applied and Environmental Microbiology, 79(1): 273-281.
MARTIN P, VAN MOOY B A S, HEITHOFF A,, 2011. Phosphorus supply drives rapid turnover of membrane phospholipids in the diatom[J]. The ISME Journal, 5(6): 1057-1060.
MURPHY J, RILEY J P, 1962. A modified single solution method for the determination of phosphate in natural waters [J]. Analytica Chimica Acta, 27: 31-36.
ORCHARD E D, BENITEZ-NELSON C, PELLECHIA P J,, 2010. Polyphosphate infrom the low-phosphorus Sargasso Sea [J]. Limnology and Oceanography, 55(5): 2161-2169.
OU L J, HUANG X Y, HUANG B Q,, 2015. Growth and competition for different forms of organic phosphorus by the dinoflagellatewith the dinoflagellateand the diatoms.l. [J]. Hydrobiologia, 754(1): 29-41.
RAO N N, GóMEZ-GARCíA M R, KORNBERG A, 2009. Inorganic polyphosphate: essential for growth and survival [J]. Annual Review of Biochemistry, 78: 605-647.
RAVEN J A, KNOLL A H, 2010. Non-skeletal biomineralization by eukaryotes: matters of moment and gravity [J]. Geomicrobiology Journal, 27(6/7): 572-584.
SOLóRZANO L, SHARP J H, 1980. Determination of total dissolved phosphorus and particulate phosphorus in natural waters [J]. Limnology and Oceanography, 25(4): 754-758.
XU J, YIN K D, HE L,, 2008. Phosphorus limitation in the northern South China Sea during late summer: influence of the Pearl River [J]. Deep Sea Research Part I: Oceanographic Research Papers, 55(10): 1330-1342.
ZHANG C, LUO H, HUANG L M,, 2017. Molecular mechanism of glucose-6-phosphate utilization in the dinoflagellate[J]. Harmful Algae, 67: 74-84.
ZHANG Q C, YU R C, SONG J J,, 2011. Will harmful dinoflagellategrow phagotrophically? [J]. Chinese Journal of Oceanology and Limnology, 29(4): 849-859.
RESPONSE OF INTRACELLULAR POLYPHOSPHATE INTO THE VARIATION OF PHOSPHORUS IN THE ENVIRONMENT
JIN Wen-Yu1, YAO Wei-Min1, OU Lin-Jian2, ZHENG Li-Ji3
(1. Wenzhou Marine Environmental Monitoring Center Station, Wenzhou 325035, China; 2. Research Center of Harmful Algae and Marine Biology, Jinan University, Guangzhou 510632, China; 3. Zhejiang Zheneng Wenzhou Power Co., Ltd., Yueqing 325602, China)
blooms often occur in phosphorus (P)-limited sea areas and can last for a long time under P deficiency. To classify the major role of P pool during blooms, the growth and the physiological response of intracellular P pool, especially polyphosphate, inwere examined under different P conditions.could sustain growth at a growth rate of 0.15 d–1under P depleted environment and its photosynthetic activity and growth capability showed no difference with those in P-replete conditions, showing the ability of acclimation ofto P deficiency. The particulate phosphorus content in the intracellular P pool could support cells to divide almost twice. Under a low-phosphate condition, intracellular polyphosphate was synthesized adequately, and did not decrease until cell growth was suppressed under P-limited condition, suggesting that polyphosphate was not a preferred utilized intracellular P pool nor the unique P pool. This study provided an insight for understanding P regulation induring its bloom from the perspective of nutritional physiology.
; P-limitation; particulate phosphorus; polyphosphate
*國家重點研發計劃, 2017YFC1404300號; 國家自然科學基金, 41776121號。金文育, 碩士研究生, E-mail: jinwenyu@ stu2016.jnu.edu.cn
姚煒民, 高級工程師, E-mail: ywm@ecs.mnr.gov.cn
2021-06-19,
2021-09-30
X173
10.11693/hyhz20210600140

