DRD1基因和OPRM1基因功能區(qū)多態(tài)性與海洛因依賴的關(guān)系
侯巧芳 賈 偉 張 蕊 吳 東 劉清波 廖世秀▲
1.河南省人民醫(yī)院醫(yī)學(xué)遺傳研究所,河南鄭州 450003;2.陜西省西安市精神衛(wèi)生中心,陜西西安 710061;3.西安交通大學(xué)醫(yī)學(xué)院法醫(yī)系,陜西西安 710061
DRD1基因和OPRM1基因功能區(qū)多態(tài)性與海洛因依賴的關(guān)系
侯巧芳1賈 偉2張 蕊2吳 東1劉清波3廖世秀1▲
1.河南省人民醫(yī)院醫(yī)學(xué)遺傳研究所,河南鄭州 450003;2.陜西省西安市精神衛(wèi)生中心,陜西西安 710061;3.西安交通大學(xué)醫(yī)學(xué)院法醫(yī)系,陜西西安 710061
目的 探討物質(zhì)依賴候選基因多巴胺D1受體(Dopamine receptor D1,DRD1)和μ阿片受體(μ-Opioid receptor,OPRM1)基因多態(tài)性與海洛因依賴之間是否存在關(guān)聯(lián)。方法 采用直接測(cè)序的方法對(duì)中國西安漢族海洛因依賴者和正常對(duì)照群體的DRD1和OPRM1基因進(jìn)行檢測(cè),并對(duì)OPRM1基因的rs1799971位點(diǎn)與海洛因依賴關(guān)聯(lián)研究進(jìn)行了 Meta分析。結(jié)果 DRD1基因共發(fā)現(xiàn) rs1799914、rs4532、rs5326 3個(gè)多態(tài)性位點(diǎn),OPRM1基因共發(fā)現(xiàn)rs1799971和rs6912029兩個(gè)多態(tài)性位點(diǎn);關(guān)聯(lián)分析未發(fā)現(xiàn)這5個(gè)單核苷酸多態(tài)性位點(diǎn)與海洛因依賴之間存在關(guān)聯(lián);Meta分析結(jié)果也不支持OPRM1基因的A118G多態(tài)性位點(diǎn)與海洛因依賴的關(guān)聯(lián)性,但這一結(jié)果尚未能排除基因上位性效應(yīng)的可能影響。結(jié)論 rs1799914、rs4532、rs5326、rs1799971和rs6912029位點(diǎn)及其構(gòu)成的單倍型與海洛因依賴之間可能不存在關(guān)聯(lián)。
海洛因依賴;多巴胺受體;阿片受體;單核苷酸多態(tài)性;關(guān)聯(lián)研究
遺傳原因造成藥物精神依賴的個(gè)體易感性差異[1]。μ阿片受體(OPRM1)是海洛因等多數(shù)阿片類物質(zhì)產(chǎn)生軀體依賴、戒斷癥狀、條件性位置偏愛等反應(yīng)的分子基礎(chǔ)[2]。研究發(fā)現(xiàn),OPRM1基因的單核苷酸多態(tài)性 (Single Nucleotide Polymorphism,SNP)影響受體的結(jié)合力和信號(hào)轉(zhuǎn)導(dǎo)[2-3]。單胺能通路中,多巴胺能投射是中腦-皮質(zhì)-邊緣系統(tǒng)即獎(jiǎng)賞中樞的神經(jīng)物質(zhì)基礎(chǔ),多巴胺受體 D1(DRD1)、D2(DRD2)可能都參與藥物依賴的強(qiáng)化、獎(jiǎng)賞、動(dòng)機(jī)調(diào)控和行為敏感化。本研究以O(shè) PRM1和DRD1基因5’端調(diào)控區(qū)和第一外顯子為目標(biāo),利用直接測(cè)序的方法,分析這一段區(qū)域在中國西安漢族人群中的多態(tài)性分布情況,并通過病例-對(duì)照分析探索是否存在與海洛因依賴相關(guān)聯(lián)的多態(tài)性位點(diǎn)。
1 資料與方法
1.1 一般資料
病例組為2009年10月~2011年2月在西安市精神衛(wèi)生中心接受美沙酮維持治療的海洛因依賴者,共102名,男90 名,女 12 名,平均年齡為(37.66±4.21)歲,吸毒史(10.64±3.35)年。入組標(biāo)準(zhǔn):(1)符合DSM-IV阿片類物質(zhì)依賴診斷標(biāo)準(zhǔn);(2)入組時(shí)尿嗎啡試驗(yàn)陽性;(3)海洛因成癮1年以上,曾多次脫毒(≥2);(4)無其他藥物濫用。對(duì)照組120名健康人來源于西安市中心血站,男103名,女17名,平均年齡為(31.66±2.43)歲,經(jīng)調(diào)查無成癮性藥物使用史(香煙和酒精分別按照平均每天使用量小于5支和50 g作為標(biāo)準(zhǔn))。兩組均排除嚴(yán)重呼吸、循環(huán)等內(nèi)科及其他精神科疾病。所有樣本為無親緣關(guān)系西安漢族,樣本采集符合“知情同意”的原則。由于DNA樣本質(zhì)量或測(cè)序質(zhì)量等原因,最終成功分型的樣本數(shù)各個(gè)位點(diǎn)之間略有差別。
1.2 方法
1.2.1 基因組DNA提取、擴(kuò)增及測(cè)序 鹽析法提取全血基因組DNA。引物由北京奧科生物技術(shù)有限公司合成,DRD1正向和反向擴(kuò)增引物分別為:5'TCCGAAACGTTGAGGAAGCG 3'和 5'GGAGGGCAAGCACTCACCG 3';OPRM1 正向和反向擴(kuò)增引物分別為:5'TGAT GAGCCTCTGTGAACTAC3'和5'CTTAAGCCGCTGAACCCT3'。PCR反應(yīng)體系:為2×Taq PCR Mix 15 μL、引物 100 nmol/L、DNA 模板約 100 ng,去離子水補(bǔ)足體積至30 μL。PCR反應(yīng)條件:預(yù)變性 95℃,5 min;95℃變性 30 s、64℃退火 40 s(OPRM1 基因?yàn)?60℃退火 40 s)、72℃延伸 50 s;72℃總延伸,10 min。PCR 產(chǎn)物經(jīng)純化、雙向測(cè)序擴(kuò)增后,由ABI 3730 DNA序列分析儀直接測(cè)序。
1.2.2 統(tǒng)計(jì)分析 利用DNAMAN軟件包對(duì)測(cè)序峰圖進(jìn)行序列判讀及比對(duì);SPSS 13.0軟件包進(jìn)行哈迪溫伯格 (Hardy-Weinberg,HWE)平衡檢驗(yàn)、基因、基因型頻率及關(guān)聯(lián)性檢驗(yàn);Haploview軟件進(jìn)行單倍型重構(gòu)及單倍型關(guān)聯(lián)分析。ReviewManage4.2(Oxford England)軟件進(jìn)行 Meta分析。
2 結(jié)果
2.1 DRD1、OPRM1基因SNP多態(tài)性分析
本次研究中,DRD1 共發(fā)現(xiàn) rs1799914 (240T/C)、rs4532(485 C/T)、rs5326 (531T/C)3 個(gè)位點(diǎn)在西安漢族人群中具有多態(tài)性。OPRM1共發(fā)現(xiàn)rs1799971(A118G)和rs6912029(G172T)兩個(gè)位點(diǎn)具有多態(tài)性(見圖1、2)。 rs1799914、rs4532、rs5326、rs1799971、rs6912029位點(diǎn)在人群中的分布均符合HWE,最小等位基因頻率分別為 0.043、0.169、0.266、0.088、0.317,均大于或接近5%,在人群中的分布具有多態(tài)性(見表1)。

2.2 多態(tài)性位點(diǎn)的關(guān)聯(lián)分析
2.2.1 等位基因、基因型在海洛因依賴及對(duì)照人群中的關(guān)聯(lián)分析 對(duì) rs1799914、rs4532、rs532、rs1799971、rs6912029 的等位基因、基因型在對(duì)照組和海洛因依賴組之間的分布進(jìn)行關(guān)聯(lián)分析,5個(gè)位點(diǎn)χ2檢驗(yàn)P值均大于0.05,表明這5個(gè)SNP位點(diǎn)在海洛因依賴組和健康對(duì)照組之間的分布差異均無統(tǒng)計(jì)學(xué)意義(見表2、3)。

表1 多態(tài)性位點(diǎn)HWE檢驗(yàn)及群體遺傳學(xué)基本信息
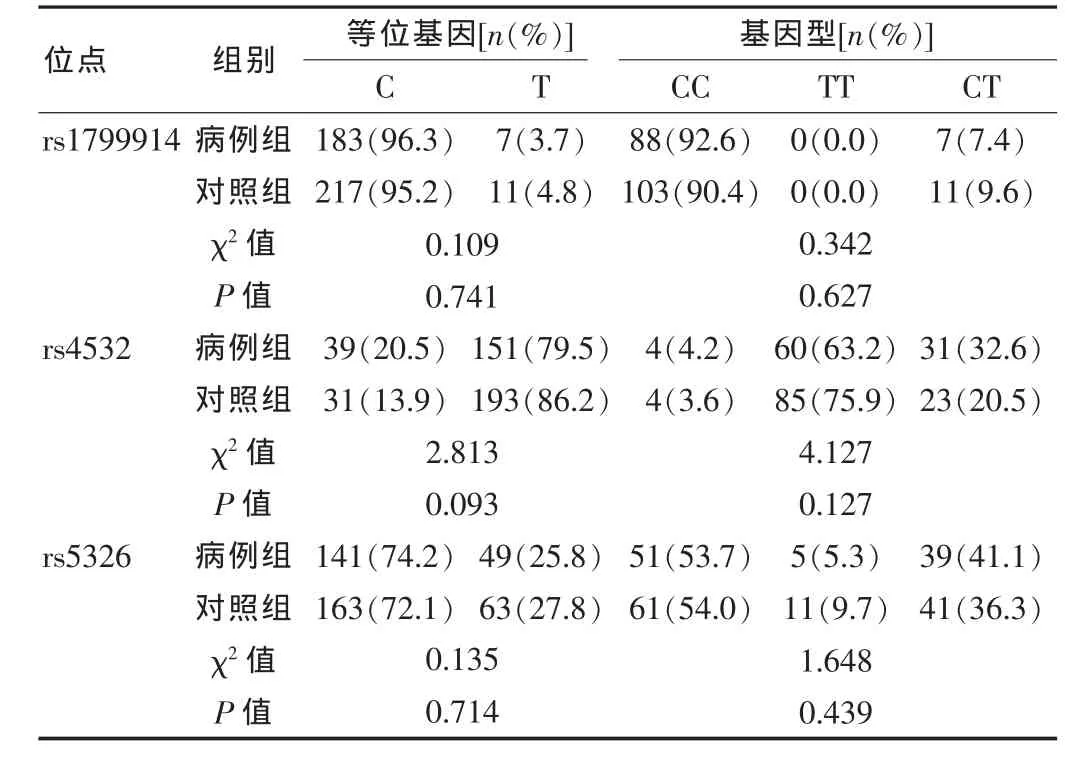
表2 DRD1基因 rs1799914、rs4532、rs532位點(diǎn)在海洛因依賴及對(duì)照人群中的關(guān)聯(lián)分析
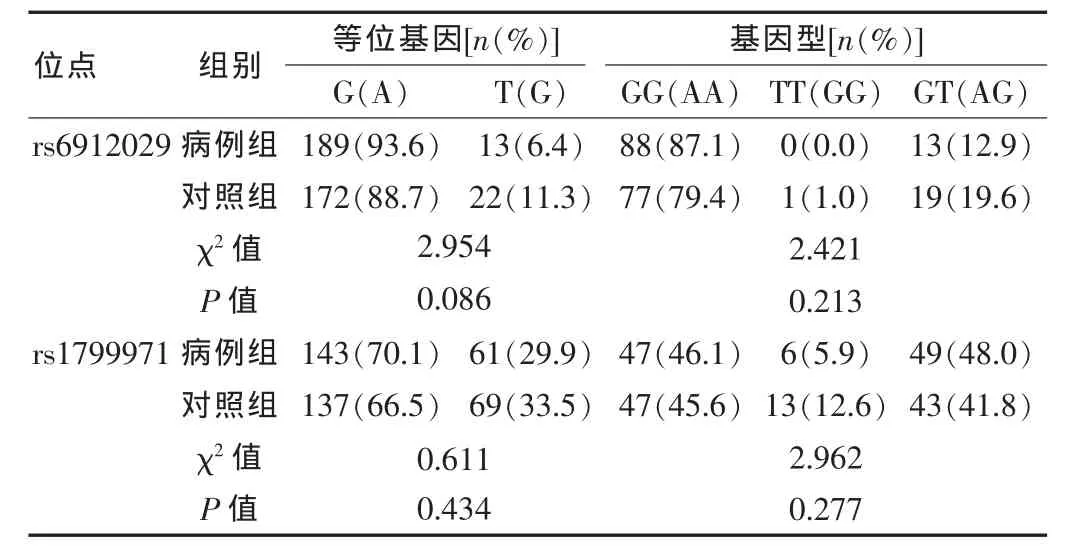
表3 rs6912029、rs1799971在海洛因依賴及對(duì)照人群中的關(guān)聯(lián)分析
2.2.2 DRD1及OPRM1單倍型關(guān)聯(lián)分析 使用Haploview4.1軟件分別對(duì)DRD1和OPRM1的SNP位點(diǎn)進(jìn)行連鎖不平衡及單倍型關(guān)聯(lián)分析。為了避免多重檢驗(yàn)所帶來的統(tǒng)計(jì)學(xué)偏倚,利用置換檢驗(yàn)對(duì)所得χ2檢驗(yàn)P值進(jìn)行修正檢驗(yàn),置換次數(shù)設(shè)置為10 000次。χ2檢驗(yàn)和置換檢驗(yàn)結(jié)果表明DRD1 3個(gè)SNP位點(diǎn)構(gòu)成的4種單倍型,OPRM1兩個(gè)SNP構(gòu)成的3種單倍型分布在海洛因依賴組和正常對(duì)照組之間差異無統(tǒng)計(jì)學(xué)意義。
3 討論
DRD1基因被認(rèn)為是精神依賴性物質(zhì)、孤獨(dú)癥、精神分裂癥等多種精神類疾病的候選基因。rs4532位點(diǎn)的關(guān)聯(lián)研究則比較廣泛且令人關(guān)注,在孤獨(dú)癥研究中,研究者發(fā)現(xiàn)rs4532 AA基因型與孤獨(dú)癥相關(guān)聯(lián),并且與其他位點(diǎn)以單倍型的形式影響患者社會(huì)適應(yīng)能力、刻板癥等行為[4],并且該位點(diǎn)與DRD2多態(tài)性位點(diǎn)之間存在交互作用,共同影響部分藥物依賴行為特征[5]。而 DRD1 rs4532(485 C/T)和rs1799914(40T/C)與海洛因依賴的關(guān)聯(lián)研究尚未見其他報(bào)道。但是DRD1基因rs4532多態(tài)性位點(diǎn)在精神分裂癥、美沙酮耐受等精神藥物反應(yīng)的關(guān)聯(lián)研究中卻有陽性發(fā)現(xiàn)[6-7]。因此筆者推測(cè),本實(shí)驗(yàn)的陰性關(guān)聯(lián)結(jié)果可能是因?yàn)檫x擇的群體不同、藥物不同;或者這兩個(gè)位點(diǎn)可能通過與其他基因共同作用,參與調(diào)控海洛因依賴的某些特殊行為特征,如渴求、復(fù)吸等具有刻板癥特征的行為。這將是以后研究的方向和注意點(diǎn)。
人們對(duì)于OPRM1 rs1799971(A118G)位點(diǎn)的研究興趣由來已久。Bond C等[3]1998年報(bào)道,A118G Asp40(G/G)等位基因與β-內(nèi)啡肽親和力是Asn40(A/A)等位基因的3倍。Drakenberg K等[8]對(duì)海洛因依賴者尸體腦組織的分析表明OPRM1 118G個(gè)體中前腦啡肽原和前腦啡肽原基因的下調(diào)表現(xiàn)突出,該研究小組認(rèn)為,118G個(gè)體通過改變阿片神經(jīng)肽系統(tǒng)曾強(qiáng)了阿片類物質(zhì)依賴的易感性。但是,在本研究中,OPRM1 rs1799971(A118G)和 rs6912029(G172T)位點(diǎn)基因型與等位基因的分布在海洛因依賴組和健康對(duì)照組之間不存在差異,基于單體型的關(guān)聯(lián)分析結(jié)果即便是在進(jìn)行置換檢驗(yàn)后仍遠(yuǎn)大于0.05。這種陰性結(jié)果同樣也在Gelernter J等[9]、苑成梅等[10]、杜江等[11]、Arias A[12]等的研究中存在。 但是,值得特別注意的是,杜江等的一項(xiàng)研究結(jié)果表明,A118G多態(tài)性與海洛因依賴無陽性關(guān)聯(lián),但是在酒精依賴組的分析卻認(rèn)為該位點(diǎn)G等位基因可能是酒精依賴的危險(xiǎn)因素。對(duì)于這個(gè)結(jié)論與腦神經(jīng)生化研究的結(jié)果相悖離現(xiàn)象,Albert Arias認(rèn)為這可能與各個(gè)研究對(duì)于對(duì)照人群的設(shè)立缺乏嚴(yán)格、一致的標(biāo)準(zhǔn)有關(guān),部分對(duì)照人群的選取未能排除煙、酒精依賴者。此外筆者認(rèn)為該結(jié)果可能還受到以下幾個(gè)方面的影響:(1)臨床異質(zhì)性。海洛因依賴是突出表現(xiàn)為慢性腦病的全身性復(fù)雜疾病,同時(shí)包含多種精神神經(jīng)表型的改變,比較粗略的表型-基因關(guān)聯(lián)研究可能影響結(jié)果的準(zhǔn)確性。(2)基因-基因、基因-環(huán)境交互作用。復(fù)雜疾病存在多個(gè)微效基因,因此,所研究位點(diǎn)的參與度可能受到其他遺傳因素及不同環(huán)境因素的影響。(3)隨機(jī)因素的影響。關(guān)聯(lián)分析樣本量較低、對(duì)照樣本的匹配程度等。(4)基因上位性效應(yīng)可能存在。由于與神經(jīng)生化研究的結(jié)果相悖,Albert Arias認(rèn)為,這種情況下應(yīng)當(dāng)排除海洛因依賴中基因上位性效應(yīng)的存在,但目前尚未見到該方面的報(bào)道。
本研究未發(fā)現(xiàn)DRD1基因rs1799914、rs4532、rs5326位點(diǎn),OPRM1基因rs1799971和rs6912029位點(diǎn)與海洛因依賴的關(guān)聯(lián)性。但是,這些位點(diǎn)對(duì)神經(jīng)生化改變的影響,以及是否存在與其他基因或者位點(diǎn)的交互作用,尚有待進(jìn)一步研究。
[1]Uhl GR.Molecular genetic underpinnings of human substance abuse vulnerability:likely contributions to understanding addiction as a mnemonic process[J].Neuropharmacology,2004,47(Suppl 1):140-147.
[2]Mague SD,Blendy JA.OPRM1 SNP (A118G):Involvement in disease development,treatment response,and animal models[J].Drug Alcohol Depend,2010,108(3):172-182.
[3]Bond C,La Forge KS,Tian M,et al.Single-nucleotide polymorphism in the human mu opioid receptor gene alters beta-endorphin binding and activity:possible implications for opiate addiction[J].Proc Natl Acad Sci USA,1998,95(16):9608-9613.
[4]Luo X,Kranzler HR,Zuo L,et al.Multiple ADH genes modulate risk for drug dependence in both African and European-Americans[J].Hum Mol Genet,2007,16(4):380-390.
[5]Hettinger JA,Liu X,Schwartz CE,et al.A DRD1 haplotype is associated with risk for autism spectrum disorders in male-only affected sib-pair families[J].Am J Med Genet B Neuropsychiatr Genet,2008,147(5):628-636.
[6]Crettol S,Besson J,Croquette-Krokar M,et al.Association of dopamine and opioid receptor genetic polymorphisms with response to methadone maintenance treatment[J].Prog Neuropsychopharmacol Biol Psychiatry,2008,32(7):1722-1727.
[7]Zhu F,Yan CX,Wang Q.An association study between dopamine D1 receptor gene polymorphisms and the risk of schizophrenia[J].Brain Res,2011,28(1420):106-113.
[8]Drakenberg K,Nikoshkov A,Horvath MC,et al.Mu opioid receptor A118G polymorphism in association with striatal opioid neuropeptide gene expression in heroin abusers[J].Proc Natl Acad Sci USA,2006,103(20):7883-7888.
[9]Gelernter J,Kranzler H,Cubells J.Genetics of two mu opioid receptor gene (OPRM1) exon I polymorphisms:population studies,and allele frequencies in alcohol-and drug-dependent subjects[J].Mol 16.Psychiatry,1999,4(5):476-483.
[10]苑成梅,方貽儒,趙敏,等.海洛因依賴臨床特征與μ阿片受體基因多態(tài)的關(guān)聯(lián)[J].中國藥物依賴性雜志,2004,13(1):22-25.
[11]杜江,謝斌,崔東紅,等.Mu阿片受體多態(tài)性與海洛因依賴的關(guān)聯(lián)研究[J].臨床精神病學(xué)雜志,2007,17(2):73-75.
[12]Arias A,F(xiàn)einn R,Kranzler HR.Association of an Asn40Asp (A118G)polymorphism in the mu-opioid receptor gene with substance dependence:a meta-analysis[J].Drug Alcohol Depend,2006,83(3):262-268.
Potential association of Dopamine Receptor D1 and μ-Opioid Receptor gene variation with heroin dependenc
HOU Qiaofang1JIA Wei2ZHANG Rui2WU Dong1LIU Qingbo3LIAO Shixiu1▲
1.Institute of Medical Genetics,Henan Provincial People's Hospital,Zhengzhou 450003,China;2.Xi'an Mental Health Centre,Xi'an 710061,China;3.Institued of Forensic Science,Xi'an Jiao Tong University,Xi'an 710061,China;
Objective To detect the polymorphism of the Dopamine receptor D1(DRD1)gene and μ-Opioid receptor(OPRM1)gene.And explore the potential association between the polymorphism loci and heroin dependence.Methods In the study,5’UTR and exon 1 of the DRD1 and OPRM1 gene sequenc were detected by direct sequencing method in 102 heroin-addicted individuals and 120 control subjects.Then case-control association analysis and Meta analysis were performed.Results Three SNP loci as rs1799914、rs4532 and rs5326 and two SNP loci as rs1799971 (A118G)and rs6912029 were found in DRD1 gene and OPRM1 respectivly in the studied population.But there were no evidence demonstrates the association relationship between any locus or haplotype and heroin dependence status.Moreover,the Meta-analysis of the association between OPRM1 A118G and heroin dependence suggested no association.But this results connot excluded the possibility epistasis effects.Conclusion There may not exists association between rs1799914,rs4532,rs5326,rs1799971,rs6912029 locus and heroin dependence even considered with the constructed haplotypes.
Heroin dependence;Dopamine receptor D1;μ-Opioid receptor;Single Nucleotide Polymorphism;Association study
R749.6
A
1674-4721(2012)08(c)-0008-03
▲通訊作者
2012-05-08 本文編輯:趙麗萍)

