沙門氏菌感染腸上皮細胞外泌體宿主蛋白質(zhì)組學分析
張 彪,路娟娥,韓文英,劉素可,武 陶,阮海華
(天津商業(yè)大學生物技術(shù)與食品科學學院,天津市食品生物技術(shù)重點實驗室,天津 300134)
近年來,隨著新型食品生產(chǎn)工藝的應(yīng)用、人們飲食習慣的改變以及衛(wèi)生環(huán)境的惡化等,食源性疾病的發(fā)生率明顯增加,食源性疾病已成為影響食品安全的主要問題之一[1]。沙門氏菌屬腸桿菌科,革蘭氏陰性桿菌,是導(dǎo)致食源性疾病發(fā)生的重要致病菌之一[2]。沙門氏菌通過不潔食物或者水源進入人體胃腸道后,可黏附于腸黏膜上皮細胞并迅速增殖,侵入腸道固有層細胞,引起機炎癥性腹瀉甚至敗血癥[3]。據(jù)統(tǒng)計,法國每年發(fā)生的食源性感染病例中,幾乎一半是由沙門氏菌引起;在美國,沙門氏菌每年導(dǎo)致約120萬 種疾病發(fā)生、23 000 例住院治療和450 例死亡[4]。因此,為維護公共健康和提高食品安全性,研究沙門氏菌感染機制對于降低沙門氏菌危害性及預(yù)防沙門氏菌感染至關(guān)重要。
外泌體是細胞向外分泌的小型囊泡,幾乎能被所有的細胞分泌,尺寸在30~150 nm之間,具有穩(wěn)定的雙層膜結(jié)構(gòu)[5],其內(nèi)含有多種類型的生物活性成分,如蛋白質(zhì)、脂質(zhì)和核酸等[6]。大量研究表明,當外泌體分泌至細胞外環(huán)境后,外泌體可通過質(zhì)膜融合的方式,將其內(nèi)所含供體細胞內(nèi)容物傳遞至受體細胞,在供體細胞與受體細胞間搭建起信號交流的橋梁,進而影響受體細胞的基因表達和生理功能[7-9]。近期研究發(fā)現(xiàn),外泌體在細菌感染過程中也發(fā)揮著重要作用。一方面,宿主細胞可通過水解病原菌,產(chǎn)生多類病原體相關(guān)分子模式(pathogenassociated molecular patterns,PAMPs)分子;后者可通過外泌體與受體細胞toll樣受體發(fā)生特異性結(jié)合,刺激細胞表達一系列促炎分子[10]。例如,Beatty等[11]發(fā)現(xiàn)被結(jié)核分枝桿菌感染的巨噬細胞所釋放外泌體中含有結(jié)核分枝桿菌PAMPs(LAM和PIM),被感染外泌體可被未感染的巨噬細胞吞噬,引起后者白介素(interleukin,IL)-6、IL-8、IL-10、γ-干擾素和腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)的分泌增加[12]。另一方面,被感染的宿主細胞所分泌的外泌體內(nèi)含有特異性的病原分子[10]。例如,Singh等[13]發(fā)現(xiàn)結(jié)核病患者血清外泌體內(nèi)含有5 種分枝桿菌RNA(包括Rv2976和Rv1369c),這些RNA可抑制宿主細胞分泌促炎因子或釋放抗炎因子,從而抑制或誘導(dǎo)免疫細胞的凋亡。
蛋白質(zhì)是外泌體的重要內(nèi)含物,其組成與來源細胞的生理狀態(tài)密切相關(guān),蛋白質(zhì)組成的差異賦予了外泌體不同的生物學特性及功能。例如,沙門氏菌感染巨噬細胞外蛋白質(zhì)組學分析表明,巨噬細胞外泌體內(nèi)OTU去泛素化酶1的含量顯著增高,當其作用于未感染巨噬細胞后,可引起TNF-α、調(diào)節(jié)的活化正常T細胞表達和分泌、白細胞介素1受體拮抗劑、巨噬細胞炎癥蛋白1、趨化因子配體1等細胞因子的釋放[14]。此外,利用液相色譜-串聯(lián)質(zhì)譜(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法觀察經(jīng)結(jié)核分枝桿菌感染的J774細胞釋放外泌體的蛋白質(zhì)表達,共鑒定出41 種分枝桿菌蛋白,及一些宿主結(jié)核特異性膜蛋白和脂蛋白,這些特異性蛋白可刺激激活樹突狀細胞并促進其抗原提呈[15-17]。
本實驗采用Label free蛋白質(zhì)組學分析方法,對沙門氏菌感染的外泌體宿主來源蛋白質(zhì)組成及其含量的變化進行了系統(tǒng)分析。外泌體作為細胞間信號交流的重要途徑之一,闡明經(jīng)沙門氏菌感染后宿主細胞所釋放外泌體內(nèi)宿主蛋白質(zhì)的變化情況,可揭示沙門氏菌感染期間病理細胞與正常細胞間進行信號交流的內(nèi)容,從而為進一步的沙門氏菌感染及擴散機制研究提供新的科學依據(jù)和素材。此外,本研究以外泌體的角度解釋機體細胞對沙門氏菌感染所產(chǎn)生生理變化的原因,對沙門氏菌感染機制研究提供了新的方向,旨在對預(yù)防沙門氏菌或其他食源性治病菌的感染提供新的思路。
1 材料與方法
1.1 材料、培養(yǎng)基與試劑
人腸上皮細胞Henle-407購于美國模式培養(yǎng)物集存庫(ATCC);野生型鼠傷寒沙門氏菌(Salmonella typhimurium)LT2由西南大學李洪濤教授惠贈;DMEM(Dulbecco’s modified eagle medium)高糖培養(yǎng)基美國Corning公司;Gibco胎牛血清、胰蛋白酶、酵母提取物 美國Thermo公司;熱休克蛋白(heat shock protein,HSP)70抗體(鼠源)、四跨膜蛋白(cluster of differentiation,CD)9抗體(鼠源)、CD63抗體(鼠源)、辣根過氧化物酶(horseradish peroxidase,HRP)偶聯(lián)二抗 美國System Biosciences公司;外泌體提取試劑盒(exoRNeasy Serum/Plasma Maxi Kit)德國QIAGEN公司;慶大霉素、聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白濃度測定試劑盒北京索萊寶科技有限公司;化學發(fā)光試劑盒(ClarityTMWestern ECL Substrate) 美國Bio-Rad公司;其他化學試劑均為國產(chǎn)分析純。
1.2 儀器與設(shè)備
細胞培養(yǎng)皿等細胞培養(yǎng)耗材 美國Corning公司;HERACELL 150i CO2培養(yǎng)箱、RC-3BP+大容量低速冷凍離心機 美國Thermo公司;SpectraMax M5多功能讀板機 美國Molecular Device公司;TransBlot SD半干轉(zhuǎn)印槽 美國Bio-Rad公司;Tanon-5200Multi化學發(fā)光凝膠成像系統(tǒng) 上海天能公司;Allegra 64R臺式高速冷凍離心機 美國Beckman Coulter公司;高速離心機 日本Hitachi公司;0.8 μm濾膜 德國Sartorius公司;Tecnai Spirit T12透射電子顯微鏡 美國FEI公司;粒徑分析儀 廈門福流生物科技有限公司。
1.3 方法
1.3.1 細胞培養(yǎng)與感染
人腸上皮細胞Henle-407培養(yǎng)于含10%胎牛血清的高糖DMEM培養(yǎng)基中,并置于37 ℃、5% CO2飽和濕度的培養(yǎng)箱中,以0.25%胰蛋白酶消化傳代。當單層細胞融合度達到70%~80%時更換為無血清高糖DMEM培養(yǎng)基饑餓2 h,后續(xù)進行沙門氏菌感染實驗。將活化后的鼠傷寒沙門氏菌于液體LB培養(yǎng)基中培養(yǎng)至對數(shù)生長期收集菌體,以感染復(fù)數(shù)(multiplicity of infection,MOI)為30加入Henle-407細胞內(nèi)為實驗組(EXP),同時,以未感染沙門氏菌的Henle-407細胞為對照組(CK)。感染30 min后,吸去細胞培養(yǎng)基上清液,用預(yù)熱的磷酸鹽緩沖液潤洗細胞2 次,用含有100 μg/mL慶大霉素的高糖DMEM培養(yǎng)細胞30 min以殺死培養(yǎng)皿中殘留的細胞外沙門氏菌。最后用預(yù)熱的磷酸鹽緩沖液潤洗細胞2 次后,吸去細胞培養(yǎng)基上清液更換為含1 μg/mL慶大霉素的DMEM培養(yǎng)Henle-407細胞至8 h,收集細胞培養(yǎng)基上清液。
1.3.2 外泌體分離
將所收集細胞培養(yǎng)基上清液于2 000×g、4 ℃離心20 min以去除死細胞及細胞碎片,將離心后的上清液通過0.8 μm濾膜后,使用exoRNeasy Serum/Plasma Maxi Kit試劑盒提取外泌體。
1.3.3 蛋白免疫印跡分析
采用蛋白質(zhì)免疫印跡法對外泌體樣本標志性蛋白進行檢測,包括HSP70、CD9和CD63。即取50 μL外泌體樣本制備成樣品,十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)后轉(zhuǎn)膜,用5%脫脂乳粉封閉。將一抗按照體積比1∶1 000稀釋后于4 ℃孵育過夜。以等滲Tris-HCl緩沖鹽溶液(tris buffered saline with 0.1%Tween-20,TBST)洗滌3 次后加入體積比1∶2 000稀釋的二抗,室溫孵育2 h,用TBST溶液洗滌3 次,加入增強型化學發(fā)光試劑(enhanced chemiluminescence,ECL)顯色,使用Tanon 5200全自動化學發(fā)光圖像分析系統(tǒng)成像。
1.3.4 外泌體的透射電鏡分析
取10 μL外泌體樣本滴加至銅網(wǎng)上,室溫下靜置5 min后用濾紙吸去浮液,再用超純水清洗3 次,待其風干之后滴加10 μL磷鎢酸于銅網(wǎng)上,靜置染色2 min之后用無塵濾紙吸去浮液,室溫靜置風干,制成電鏡樣本,上機觀察。
1.3.5 蛋白質(zhì)提取及肽段酶解
外泌體樣本采用SDT(4 g/100 mL SDS,100 mmol/L pH 7.6 Tris-HCl,0.1 mol/L二硫蘇糖醇)裂解法提取蛋白質(zhì),然后采用BCA法進行蛋白質(zhì)定量。每個樣品取適量蛋白質(zhì)采用過濾輔助樣品制備(filter-aided sample preparation,F(xiàn)ASP )方法進行胰蛋白酶酶解[18],采用C18Cartridge對肽段進行脫鹽,肽段凍干后加入40 μL 0.1%甲酸溶液復(fù)溶,肽段定量。
1.3.6 LC-MS/MS 數(shù)據(jù)采集
每份樣本采用納升流速的HPLC液相系統(tǒng)Easy nLC進行分離。緩沖液A液為0.1%甲酸溶液,B液為0.1%甲酸-乙腈溶液(乙腈為84%)。色譜柱以95%的A液平衡,樣品由自動進樣器上樣到上樣柱(Thermo Scientific Acclaim PepMap100,100 μm×2 cm,nanoViper C18),經(jīng)過分析柱(Thermo scientific EASY column,10 cm×75 μm,3 μm,C18-A2)分離,流速為300 nL/min。樣品經(jīng)色譜分離后用Q-Exactive質(zhì)譜儀進行質(zhì)譜分析。檢測方式為正離子,母離子掃描范圍m/z300~1 800,一級質(zhì)譜分辨率為70 000,m/z為200,自動增益控制為1×106,ITmax為50 ms,動態(tài)排除時間為60.0 s。多肽和多肽碎片的質(zhì)量電荷比按照下列方法采集:每次全掃描后采集20 個碎片圖譜(MS2scan),MS2Activation Type為HCD,Isolation window為m/z2,二級質(zhì)譜分辨率17 500,m/z為200,Normalized Collision Energy為30 eV,Underfil為0.1%。
1.3.7 生物信息學分析
利用BLAST2GO對目標蛋白質(zhì)集合進行基因本體論(Gene Ontology,GO)注釋,過程大致可以歸納為序列比對(BLAST)、GO條目提取、GO注釋和 InterProScan補充注釋4 個步驟。利用KAAS(京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)Automatic Annotation Server)軟件,對目標蛋白質(zhì)集合進行KEGG通路注釋,采用Fisher精確檢驗,比較各個GO分類或KEGG通路在目標蛋白質(zhì)集合和總體蛋白質(zhì)集合中的分布情況,對目標蛋白質(zhì)集合進行GO注釋或KEGG通路注釋的富集分析。
1.4 數(shù)據(jù)統(tǒng)計及圖表繪制
對沙門氏菌感染及未感染的Hen-407細胞所分泌外泌體各提取3 次,記為3 組平行以進行蛋白質(zhì)組學分析。采用SPSS V18.0軟件進行單因素方差分析,同時通過Student’st檢驗進行組間比較,P<0.05,差異顯著,P<0.01,差異極顯著,所有實驗至少重復(fù)3 次。本實驗圖表均采用Origin及Adobe illustrator軟件繪制。
2 結(jié)果與分析
2.1 外泌體的鑒定和表征
以經(jīng)沙門氏菌感染的Henle-407細胞所分泌外泌體為EXP組,同時以未感染的Henle-407細胞所分泌外泌體為CK組。為了對外泌體質(zhì)量進行表征,本研究采用電鏡、蛋白質(zhì)免疫印跡和納米粒子追蹤分析3 種方法對沙門氏菌感染或未感染的宿主細胞所釋放外泌體進行鑒定和分析。外泌體電鏡結(jié)果如圖1a所示,所提取外泌體直徑約100 nm,呈橢圓形茶杯狀囊泡結(jié)構(gòu),與文獻報道的外泌體形態(tài)特征一致[19]。為了分析所獲得外泌體的特異性,根據(jù)文獻[20],選取CD9、CD63及HSP70作為外泌體標志蛋白進行免疫印跡分析,同時以Henle-407細胞全蛋白(C)、細胞培養(yǎng)基上清液(M)、過試劑盒后細胞培養(yǎng)基上清液(S)作為對照,結(jié)果如圖1b所示,在EXP組和CK組外泌體中均成功檢測到這3 種外泌體特異標志物的表達,而在細胞培養(yǎng)基上清液和過試劑盒后的培養(yǎng)基上清液中這3 種蛋白的表達量明顯偏低或沒有,表明本研究所提樣本明確包含有外泌體。接著,為了進一步表征EXP組與CK組外泌體樣本中外泌體的純度與質(zhì)量,采用納米粒子追蹤分析法對外泌體樣本進行粒徑分布分析,結(jié)果如圖1c所示,兩組外泌體樣本粒徑范圍均分布于30~150 nm之間,其中CK組峰值為79.75 nm,平均粒徑90.35 nm,濃度為5.06×109particles/mL;EXP組峰值為76.75 nm,平均粒徑81.38 nm,濃度為7.78×109particles/mL,均符合外泌體的粒徑范圍,表明本次實驗所提取樣本外泌體純度良好。綜上所述,從形態(tài)特征、標志蛋白表達和粒徑分布3 個方面的數(shù)據(jù)可知,本研究所提取外泌體樣本純度良好,質(zhì)量較高。最后,為了對所提外泌體樣本的蛋白質(zhì)水平進行平行性檢測,利用SDS-PAGE對3 次所提取外泌體進行分析,結(jié)果如圖1d所示。各個平行樣品的SDS-PAGE圖條帶分布正常,樣品之間平行性較好,且蛋白提取樣本量足夠,樣品純度良好,適于進行后續(xù)蛋白質(zhì)組學實驗。
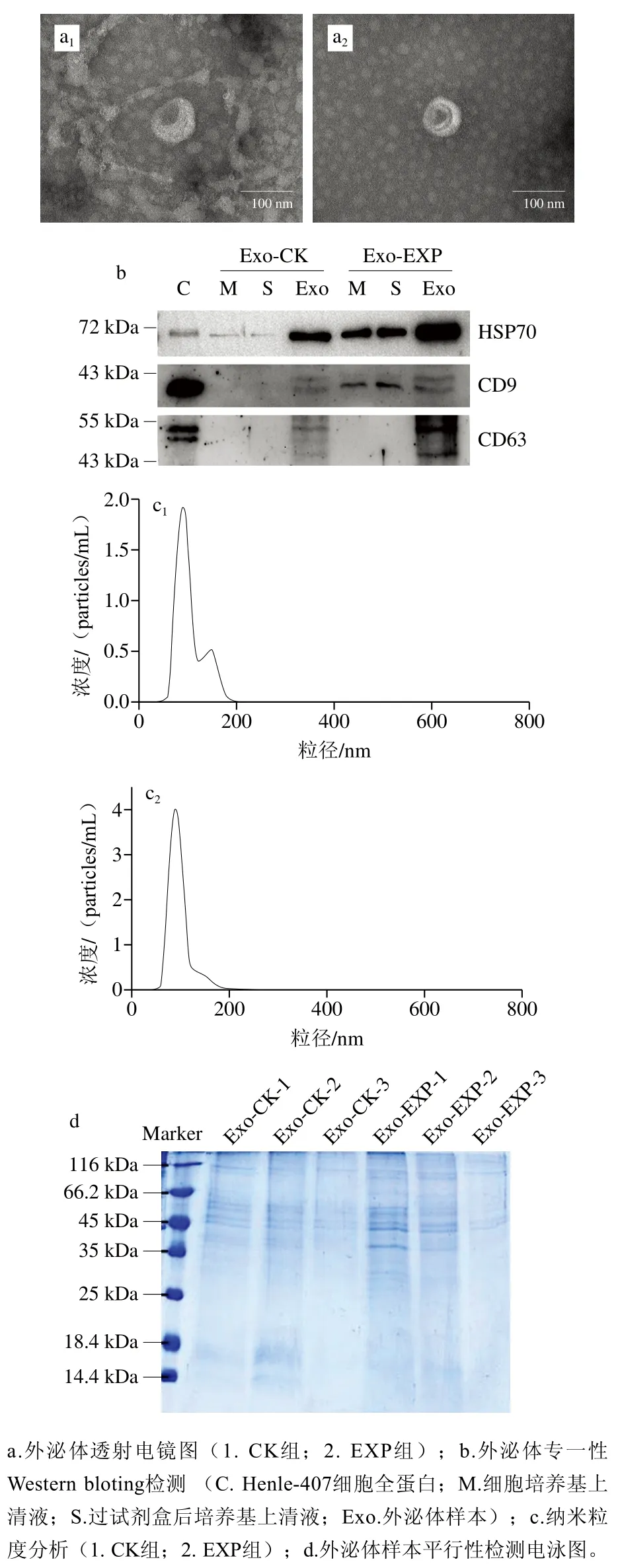
圖1 外泌體的鑒定及表征Fig. 1 Identification and characterization of exosomes
2.2 差異表達蛋白的篩選及聚類分析
采用Label free相對定量蛋白質(zhì)組學方法對兩組外泌體樣本進行比較分析。經(jīng)質(zhì)譜分析和蛋白質(zhì)理論數(shù)據(jù)庫比對后,如圖2a所示,共鑒定到2 490 種蛋白質(zhì),包括CK組蛋白2 151 種,EXP組蛋白質(zhì)1 615 種,兩組共有蛋白1 276 種。共有蛋白中采取以倍數(shù)變化大于2.0 倍(上調(diào)大于2 倍或下調(diào)小于0.5 倍)且P<0.05的標準篩選差異表達蛋白。如圖2b所示,EXP組與CK組外泌體中共有的差異表達蛋白有7 種,包括3 種表達上調(diào)蛋白和4 種表達下調(diào)蛋白(表1)。發(fā)現(xiàn)上述7 種蛋白中有4 種蛋白與細胞增殖有關(guān),分別為上調(diào)蛋白GOLM1、BTF3與下調(diào)蛋白EBNA1BP2、U2AF1L5。
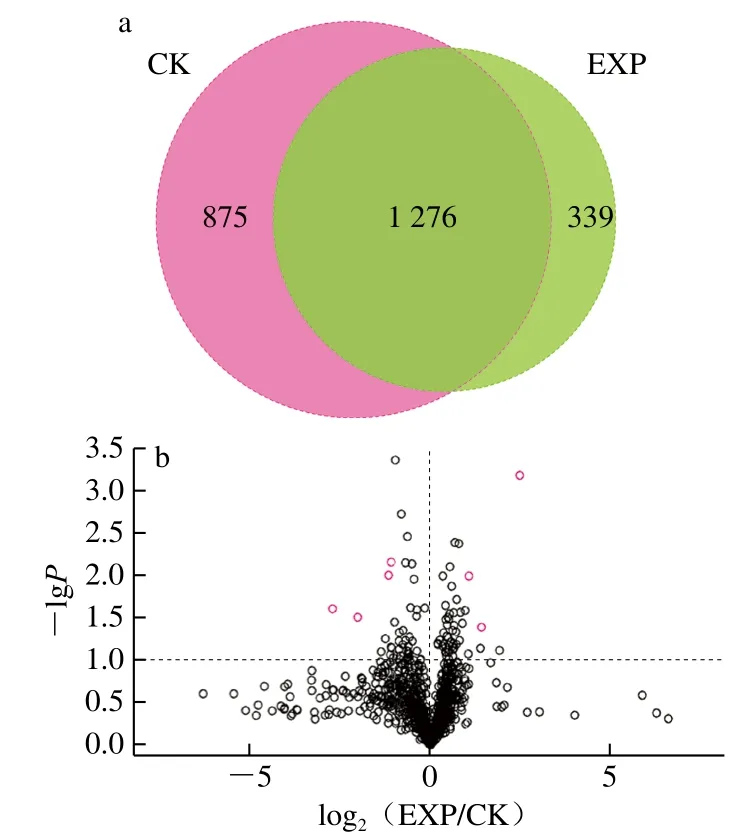
圖2 沙門氏菌感染與未感染宿主細胞外泌體差異蛋白Venn(a)及火山圖(b)Fig. 2 Venn (a) and volcano maps (b) of DEPs in host cell exosomes infected and not infected with S. typhimurium

表1 EXP組與CK組共有的差異表達蛋白Table 1 Shared DEPs between infected and non-infected groups
沙門氏菌感染與腸上皮細胞的增殖和凋亡具有拮抗作用。一方面,沙門氏菌可通過激活宿主細胞AKT/mTOR信號通路抑制因細菌入侵介導(dǎo)的細胞凋亡,為沙門氏菌在細胞內(nèi)的存活提供條件[21]。GOLM1是AKT/mTOR信號通路的正向調(diào)控因子,使用siRNA沉默GOLM1的內(nèi)源性表達后,前列腺癌細胞的增殖被抑制,細胞凋亡增加,而高表達GOLM1的腫瘤細胞增值和遷移更快,細胞凋亡減少[22-23]。GOLM1主要參與內(nèi)質(zhì)網(wǎng)蛋白質(zhì)的合成后修飾并協(xié)助高爾基體完成對蛋白質(zhì)的轉(zhuǎn)運及分泌[24],促進細胞的生長和增殖。基于此,推測沙門氏菌可能通過對外泌體中GOLM1蛋白的上調(diào)調(diào)控并抑制臨近細胞的凋亡,從而促進細胞內(nèi)沙門氏菌的繁殖。此外,JAK2/STAT3信號通路在調(diào)節(jié)細胞增殖、凋亡中也起到關(guān)鍵作用,STAT3的激活會促進細胞間充質(zhì)轉(zhuǎn)化并保護細胞免于凋亡[25]。BTF3是一種轉(zhuǎn)錄調(diào)控因子,其可通過激活JAK2/STAT3信號通路參與胃癌上皮細胞間充質(zhì)轉(zhuǎn)化、刺激細胞增殖[26]。同樣,推測BTF3蛋白于EXP組外泌體內(nèi)的表達量增高會起到與GOLM1蛋白類似的作用,即通過調(diào)控受體細胞JAK2/STAT3信號通路,促進細胞增殖,減緩宿主細胞凋亡速率,從而為沙門氏菌的繁殖提供合適的宿主環(huán)境。
而另一方面,被感染的腸上皮細胞可通過啟動自身程序性死亡以清除其內(nèi)含沙門氏菌,進而抑制沙門氏菌的繁殖[27]。蛋白質(zhì)組學數(shù)據(jù)顯示,與rRNA、mRNA成熟過程相關(guān)的核仁蛋白EBNA1BP2和U2AF1L5在EXP組外泌體內(nèi)分別下調(diào)至0.15 倍和0.45 倍。EBNA1BP2可通過對pre-rRNA的加工參與核糖體40S和60S亞單位的合成,若將該基因沉默,細胞增殖將受到嚴重抑制[28-29]。U2AF1L5是一種RNA剪接體復(fù)合物蛋白,參與pre-mRNA至成熟mRNA的剪接過程[30],下調(diào)U2AF1L5的蛋白表達可損害細胞有絲分裂進程,誘導(dǎo)G2/M期阻滯,降低細胞增殖速率[31]。由此,推測經(jīng)沙門氏菌感染的宿主細胞可通過外泌體降低鄰近細胞的增殖速率,為接下來細胞的程序性死亡提供前期引導(dǎo),以達到抑制沙門氏菌感染的作用。

表2 EXP組外泌體中特異性存在的蛋白Table 2 Specific proteins in exosomes from the infected group
尤為重要的是,在篩選差異表達蛋白的過程中發(fā)現(xiàn),以EXP組(或CK組)樣品3 次平行中2 次以上不為空值;CK組(或EXP組)樣品中3 次平行均為空值的條件篩選差異表達蛋白,稱其為非共有蛋白,共得到314 種蛋白質(zhì)。其中,與CK組外泌體相比,在EXP組外泌體中特異性存在的蛋白有9 種(表2),而缺失的蛋白卻多達305 種(未表出)。在特異性存在的9 種蛋白中,與細胞骨架動力學相關(guān)的2 種蛋白(CALD1與MARCKSL1)尤為重要。在感染初期,沙門氏菌可通過其T3SS分泌的效應(yīng)蛋白刺激宿主細胞骨架重排,使細菌內(nèi)化進入細胞[32],而肌動蛋白是其作用的重要靶點。CALD1蛋白在其C端具有鈣調(diào)蛋白、原肌球蛋白和肌動蛋白的結(jié)合區(qū)[33],其可通過刺激肌動蛋白而促使細胞骨架重排[34]。同樣,MARCKSL1也是一種肌動蛋白結(jié)合蛋白,主要在未成熟腦中表達[35],MARCKSL1蛋白在廣泛的癌癥類型中被上調(diào),但其在沙門氏菌感染后于宿主細胞所分泌外泌體中特異性表達屬首次發(fā)現(xiàn)。MARCKSL1蛋白可與肌動蛋白結(jié)合調(diào)節(jié)肌動蛋白束,使細胞骨架重排,促進細胞遷移[36]。調(diào)控宿主細胞骨架重排是沙門氏菌能否被成功內(nèi)化的關(guān)鍵。以上2 個蛋白在被沙門氏菌感染的外泌體中特異性表達,推測沙門氏菌感染極有可能特異性激活宿主細胞CALD1與MARCKSL1的表達,并使其通過外泌體調(diào)節(jié)臨近細胞的細胞骨架,進而幫助沙門氏菌在腸上皮細胞中的感染和擴散。
2.3 差異蛋白質(zhì)GO功能富集分析
為進一步了解腸上皮細胞在沙門氏菌感染后所釋放外泌體內(nèi)差異表達蛋白的生物學功能,采用BLAST2Go軟件對本研究鑒定的所有差異表達蛋白質(zhì)(共321 種差異表達蛋白,包括7 種共有蛋白和314 種非共有蛋白)進行GO功能注釋,然后通過Fisher精確檢驗方法對差異表達蛋白質(zhì)進行GO功能富集分析。從生物過程、細胞組成和分子功能3 個分類進行富集分析,如圖3所示,外泌體內(nèi)宿主來源差異表達蛋白主要參與代謝、生物調(diào)節(jié)、細胞成分組織或生物發(fā)生和定位等生物過程,主要為細胞、細胞器、細胞膜和蛋白質(zhì)復(fù)合物的組成成分,具有結(jié)合、催化、轉(zhuǎn)運、轉(zhuǎn)錄調(diào)控等分子功能。
GO分析表明,其中一部分宿主來源差異表達蛋白參與生物調(diào)節(jié)、細胞成分組織和定位3 種生物過程,位于細胞器、細胞膜和蛋白質(zhì)復(fù)合物3 種細胞組分分類,可發(fā)揮結(jié)合、轉(zhuǎn)運、分子結(jié)構(gòu)等分子功能,如四跨膜蛋白超家族(CD9、CD63、CD81和CD82)、HSP、核糖體蛋白等。猜測此類蛋白極大可能與細胞內(nèi)外泌體的產(chǎn)生及外泌體內(nèi)含蛋白的篩選有關(guān),而剩余其他蛋白(如肌動蛋白、高爾基體膜蛋白、黏附蛋白等)可能與沙門氏菌感染特異性相關(guān)。結(jié)合EXP組與CK組外泌體內(nèi)蛋白質(zhì)的數(shù)量差異(存在314 個非共有蛋白)與所提樣本外泌體濃度的差異(EXP組7.78×109particles/mL明顯大于未EXP組5.06×109particles/mL),猜測沙門氏菌感染一方面抑制宿主細胞蛋白向外泌體的轉(zhuǎn)運,另一方面刺激被感染細胞釋放更多特異性外泌體,進而幫助沙門氏菌在腸上皮細胞中感染和擴散。
2.4 差異表達蛋白質(zhì)KEGG通路富集分析
在生物體中,蛋白質(zhì)并不獨立行使其功能,而是不同蛋白質(zhì)相互協(xié)調(diào)完成一系列生化反應(yīng)以行使其生物學功能。為進一步了解宿主細胞外泌體受到沙門氏菌感染時其代謝通路的具體信息,本研究對上述321 種外泌體宿主來源的蛋白質(zhì)進行了KEGG通路分析。在P<0.05的范圍內(nèi),有113 種蛋白與17 條KEGG通路相關(guān)。如圖4所示,最顯著的5 條途徑分別為脂肪酸降解、產(chǎn)熱、蛋白質(zhì)合成、精氨酸及脯氨酸代謝和三羧酸循環(huán)。參與其途徑的差異表達蛋白分別為10、19、7、7、8 種,富集因子分別為0.4、0.26、0.41、0.37和0.33。KEGG通路富集數(shù)據(jù)顯示,參與這5 條通路的相關(guān)差異表達蛋白均為EXP組缺失蛋白,由此,推測在沙門氏菌感染期間宿主細胞中此5 種代謝途徑均受到嚴重抑制。從沙門氏菌角度講,侵入宿主細胞內(nèi)的沙門氏菌的生長和繁殖所需營養(yǎng)物質(zhì)均需從宿主細胞內(nèi)獲得,因此,抑制宿主細胞相關(guān)代謝途徑有利于沙門氏菌對營養(yǎng)物質(zhì)如脂肪酸、葡萄糖和氨基酸等物質(zhì)的占據(jù)和掠奪。研究表明,在侵入宿主細胞后沙門氏菌體內(nèi)對精氨酸的合成量顯著降低[37],結(jié)合本研究KEGG數(shù)據(jù)(精氨酸及脯氨酸代謝通路被抑制),推測沙門氏菌在宿主細胞內(nèi)通過抑制宿主細胞對精氨酸的代謝達到對細胞內(nèi)精氨酸的占有及利用,以補充自身的合成空缺。同樣,脂肪酸降解、產(chǎn)熱、蛋白質(zhì)合成和三羧酸循環(huán)途徑均為宿主細胞利用自身營養(yǎng)物質(zhì)的過程,此4 條代謝通路受到抑制可使宿主細胞對營養(yǎng)物質(zhì)的利用顯著降低進而有利于沙門氏菌的生長和繁殖。從宿主細胞角度講,三羧酸循環(huán)途徑與蛋白質(zhì)合成途徑是細胞生長增殖所需能量和蛋白的直接來源,此2 條途徑同時受阻無疑會嚴重抑制細胞生長。此外,研究表明脂肪酸降解途徑受阻將直接抑制細胞的生長和增殖[38]。由此,推測沙門氏菌感染會導(dǎo)致腸上皮細胞增殖減緩,此結(jié)果與文獻[39]報道基本一致。
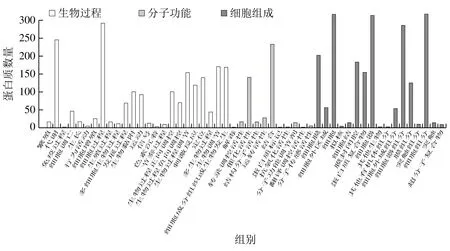
圖3 差異蛋白質(zhì)GO分類圖Fig. 3 GO classification of DEPs
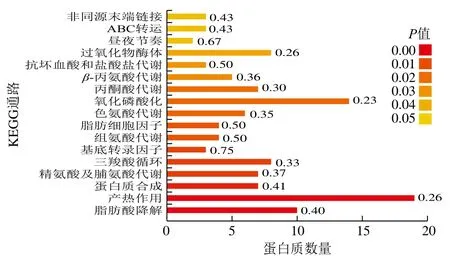
圖4 差異表達蛋白質(zhì)KEGG通路富集分析圖Fig. 4 KEGG pathway enrichment analysis of DEPs
2.5 蛋白質(zhì)組學數(shù)據(jù)準確性驗證
Western bloting技術(shù)是驗證蛋白質(zhì)組學數(shù)據(jù)準確性的最佳方法。本實驗利用Western bloting技術(shù)以甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作為對照,挑選上調(diào)蛋白GOLM1(5.5 倍)、下調(diào)蛋白EBP2(0.15 倍)和EXP組外泌體特異性表達蛋白GAPDHS以驗證蛋白質(zhì)組學數(shù)據(jù)的可靠性。如圖5所示,在EXP組外泌體中此3 個蛋白表達情況與蛋白質(zhì)組學數(shù)據(jù)基本一致,表明本研究蛋白質(zhì)組學結(jié)果真實可靠。
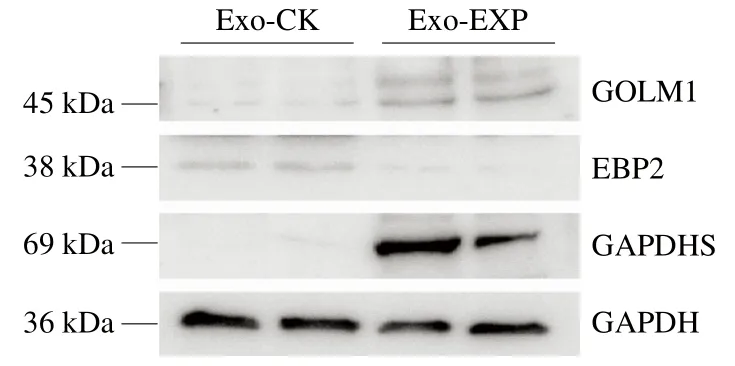
圖5 沙門氏菌感染與未感染外泌體內(nèi)關(guān)鍵差異蛋白Western bloting驗證結(jié)果Fig. 5 Western blotting validation of key DEPs in exosomes infected and not infected with S. typhimurium
3 討 論
利用Label free相對定量蛋白質(zhì)組學方法系統(tǒng)分析了沙門氏菌感染后宿主細胞外泌體內(nèi)宿主來源蛋白質(zhì)的變化。本研究發(fā)現(xiàn),EXP組與CK組外泌體共有蛋白中有7 種蛋白質(zhì)的含量變化在2.0 倍以上;相比于CK組,EXP組外泌體中特異性增加了9 種蛋白質(zhì),而缺失的蛋白質(zhì)卻多達305 種。GO分析表明差異蛋白主要參與細胞過程、代謝過程和生物調(diào)節(jié)過程,與結(jié)合、催化和轉(zhuǎn)運等分子功能有關(guān)。KEGG分析表明差異蛋白主要富集在17 種代謝通路中。其中,與脂肪酸降解、產(chǎn)熱、精氨酸與脯氨酸代謝、蛋白質(zhì)合成和三羧酸循環(huán)途徑有關(guān)的蛋白質(zhì)均為EXP組缺失蛋白。由此可見,沙門氏菌感染對宿主細胞外泌體內(nèi)的蛋白組成具有直接調(diào)控作用。
在沙門氏菌感染過程中,沙門氏菌與宿主細胞之間存在互相對抗,而宿主細胞所產(chǎn)生外泌體是沙門氏菌與宿主細胞所共同調(diào)控的結(jié)構(gòu)。從沙門氏菌角度講,本研究推測在沙門氏菌感染過程中,被感染宿主細胞所釋放的外泌外可作為沙門氏菌侵染的先鋒軍。在鄰近細胞被沙門氏菌侵染前,EXP組外泌體可提前被鄰近細胞所吸收,其內(nèi)含特異性存在的CALD1與MARCKSL1蛋白可通過肌動蛋白促進鄰近細胞骨架重排,有利于接下來沙門氏菌的侵染。之后,共有蛋白中表達上調(diào)的GOLM1和BTF3蛋白可通過調(diào)節(jié)鄰近細胞AKT/mTOR、JAK2/STAT3與FOXM1信號通路,促進細胞增殖,抑制細胞凋亡,為接下來的沙門氏菌在細胞內(nèi)的繁殖創(chuàng)造條件。此外,結(jié)果顯示,沙門氏菌感染宿主細胞后,宿主細胞所釋放外泌體內(nèi)宿主來源蛋白質(zhì)相比于CK組缺失達305個,并且結(jié)合上述GO分析結(jié)果。本研究推測,在沙門氏菌感染過程中,沙門氏菌極有可能抑制了宿主細胞外泌體對宿主來源來源蛋白的攝取,以阻礙感染細胞與正常細胞間的正常信息傳遞從而為沙門氏菌感染創(chuàng)造條件。KEGG分析結(jié)果——脂肪酸降解、產(chǎn)熱、精氨酸與脯氨酸代謝、蛋白質(zhì)合成和三羧酸循環(huán)途徑有關(guān)差異表達蛋白均為EXP組缺失蛋白也證明了這一推論。
從宿主細胞角度講,被感染宿主細胞所釋放外泌體也可作為其向鄰近細胞傳遞信號的載體。例如,共有蛋白中表達下調(diào)的EBNA1BP2和U2AF1L5蛋白可通過調(diào)節(jié)mRNA的成熟抑制鄰近及宿主細胞的增殖,以增強宿主細胞程序性死亡清除沙門氏菌的作用。但此作用能否成功發(fā)揮,需要進一步實驗驗證,因為作為沙門氏菌感染后宿主細胞向細胞外釋放的信息載體,外泌體所包含的信息內(nèi)容十分豐富,既存在有利于沙門氏菌存活的部分,也存在有利于宿主細胞清除沙門氏菌的部分,體現(xiàn)了沙門氏菌與宿主細胞間的拮抗作用。此外,本研究推測,包含有沙門氏菌特異性蛋白質(zhì)組的外泌體被巨噬細胞吞噬后,極有可能刺激巨噬細胞發(fā)生免疫應(yīng)答,以增強機體對沙門氏菌的清除作用。類似現(xiàn)象已于結(jié)核分枝桿菌感染過程中發(fā)現(xiàn),被結(jié)核分枝桿菌感染的巨噬細胞所釋放外泌體可誘導(dǎo)CD4/CD8T細胞產(chǎn)生THI型免疫應(yīng)答,增強機體對結(jié)核分枝桿菌的清除作用[40]。
沙門氏菌作為全球主要的食源性病原菌之一,對人類健康和食品安全具有嚴重影響,然而,有效抑制沙門氏菌疾病的方法仍然有限,研發(fā)用于預(yù)防及治療沙門氏菌感染的有效藥劑仍是食品相關(guān)行業(yè)的重中之重。本實驗應(yīng)用蛋白質(zhì)組學對沙門氏菌感染期間宿主細胞產(chǎn)生外泌體中所含宿主來源的蛋白質(zhì)進行了系統(tǒng)研究,全面了解宿主細胞對細菌感染的反應(yīng)以及細胞間通訊的內(nèi)容,提供了沙門氏菌-宿主細胞-其他靶細胞相互作用的新思路與新靶點。外泌體作為一種雙層膜囊泡結(jié)構(gòu),其可作為傳遞藥物的天然載體,了解其內(nèi)部構(gòu)成,可為挖掘外泌體的藥物載體功能,開發(fā)抗感染藥物或保健食品提供堅實的理論基礎(chǔ)。

