“探秘加碘鹽”復習課的項目式教學實踐
葛海祥




摘要:基于項目開展氧化還原反應的復習,以“探秘加碘鹽”為項目,以補碘劑的選擇、補碘劑的性質預測、補碘劑的實驗探究為學習任務,呈現項目式學習的教學設計思路和實踐過程,并總結基于項目式學習開展復習課的課堂特色。
關鍵詞:氧化還原反應;項目式學習;加碘鹽
文章編號:1008-0546(2022)04x-0067-04
中圖分類號:G632.41
文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2022.04x.019
一、項目主題分析
項目式學習,是以建構主義理論為指導,以小組合作方式進行規劃和解決項目任務的學習方式。已有對項目式學習案例和效果的影響研究表明,項目式學習在學生學業成績、問題解決能力、學生參與度、學習興趣及合作和解決沖突技能等方面都有很大地促進作用[1]。氧化還原反應是高中化學課程的重要內容,并作為核心概念貫穿高中化學學習的始終。《普通高中課程標準(2017年版(2020年修訂)》中提到“能利用典型代表物質的性質和反應,設計常見物質的制備、分離、提純、檢驗等簡單任務的方案,能從物質類別和元素價態變化的視角說明物質的轉化途徑”[2]。筆者認為在氧化還原反應新課教學后安排一節基于項目式教學的復習課,既能幫助學生形成氧化還原反應的整體觀,建構氧化還原反應的認識視角,又能落實課標要求。“探秘加碘鹽”項目貼近生活,接近學生,可操作性強,涉及的物質化合價豐富,是開展氧化還原反應項目式學習的很好載體。在教學中,通過將項目拆解成“補碘劑的選擇”“補碘劑的性質預測”“補碘劑的實驗探究”三個任務展開,將生活中的實際問題轉化為化學問題,在問題解決過程中應用氧化還原反應的認識模型、性質比較方法模型,根據類別和價態預測物質性質,并會選擇試劑來檢驗,能與同學合作設計實驗方案,展開實驗研究,逐步形成物質性質研究的一般思路,發展科學探究與創新意識核心素養,學會將復雜的實際問題轉化為化學問題,感悟化學學科魅力。
二、項目教學目標
結合課程標準的內容要求、學業要求和學情,教學目標如下:
1掌握氧化還原反應的發生原理,厘清幾組概念(培養模型認知素養);
2能根據核心元素的價態來預測新物質的性質,認識物質之間的相互轉化(培養證據推理素養);
3能從氧化還原反應視角分析物質,并嘗試運用氧化還原的認識模型和方法模型解決問題(培養模型認知素養);
4在探秘加碘鹽過程中,逐步形成“提出問題—猜想假設—實驗分析—得出結論”的科學探究思路
(培養科學探究、創新意識素養)。
三、項目教學流程
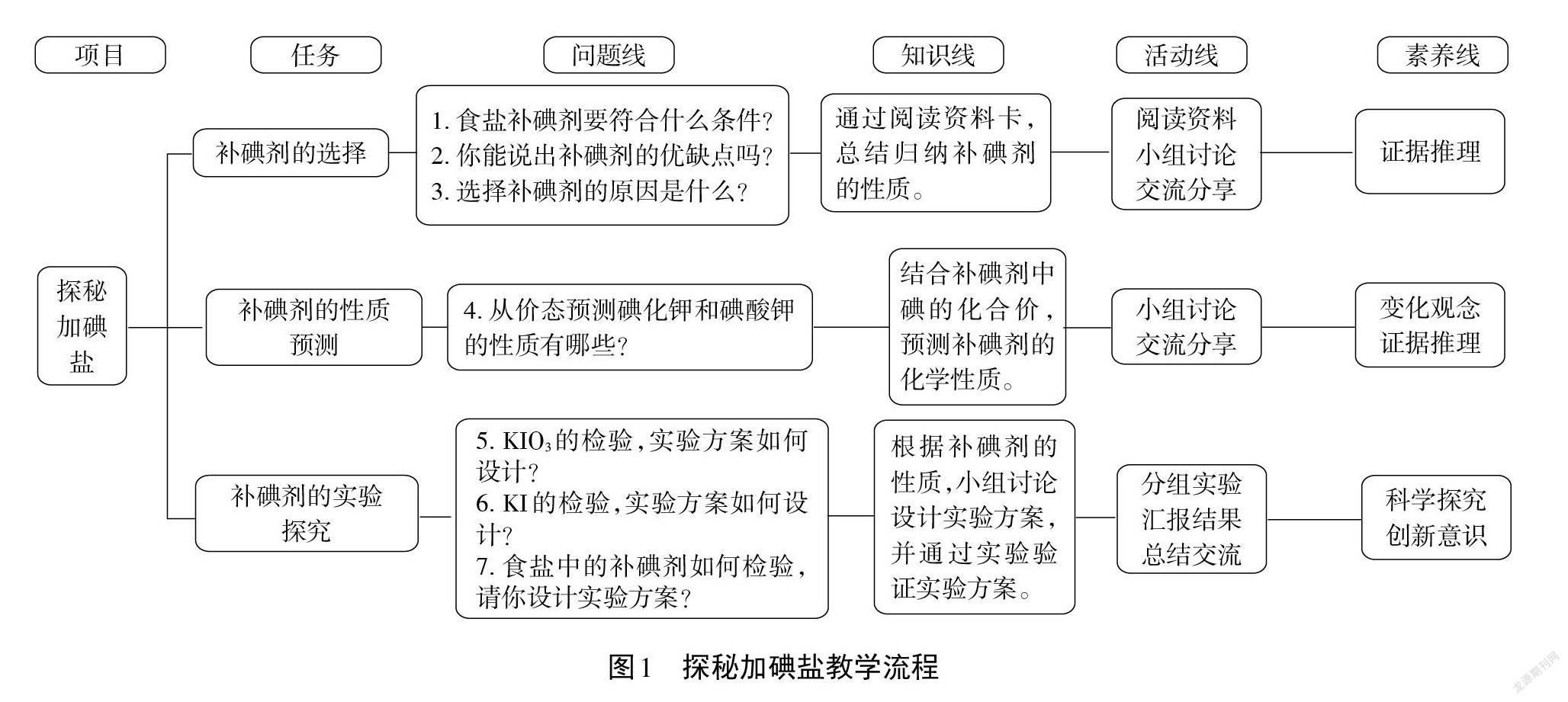
依據項目式教學活動設計特點和教學目標,以探秘加碘鹽為活動載體,設計三個任務:補碘劑的選擇、補碘劑的性質預測、補碘劑的實驗探究。在任務探索的過程中體會氧化還原的認識模型和方法模型在認識陌生物質性質及其應用中的重要價值。具體教學流程(見圖1)。
四、項目學習過程
[問題引入]你知道食鹽中為什么加碘嗎?[學生觀點]補碘、防止大脖子病......
[任務1]補碘劑的選擇。
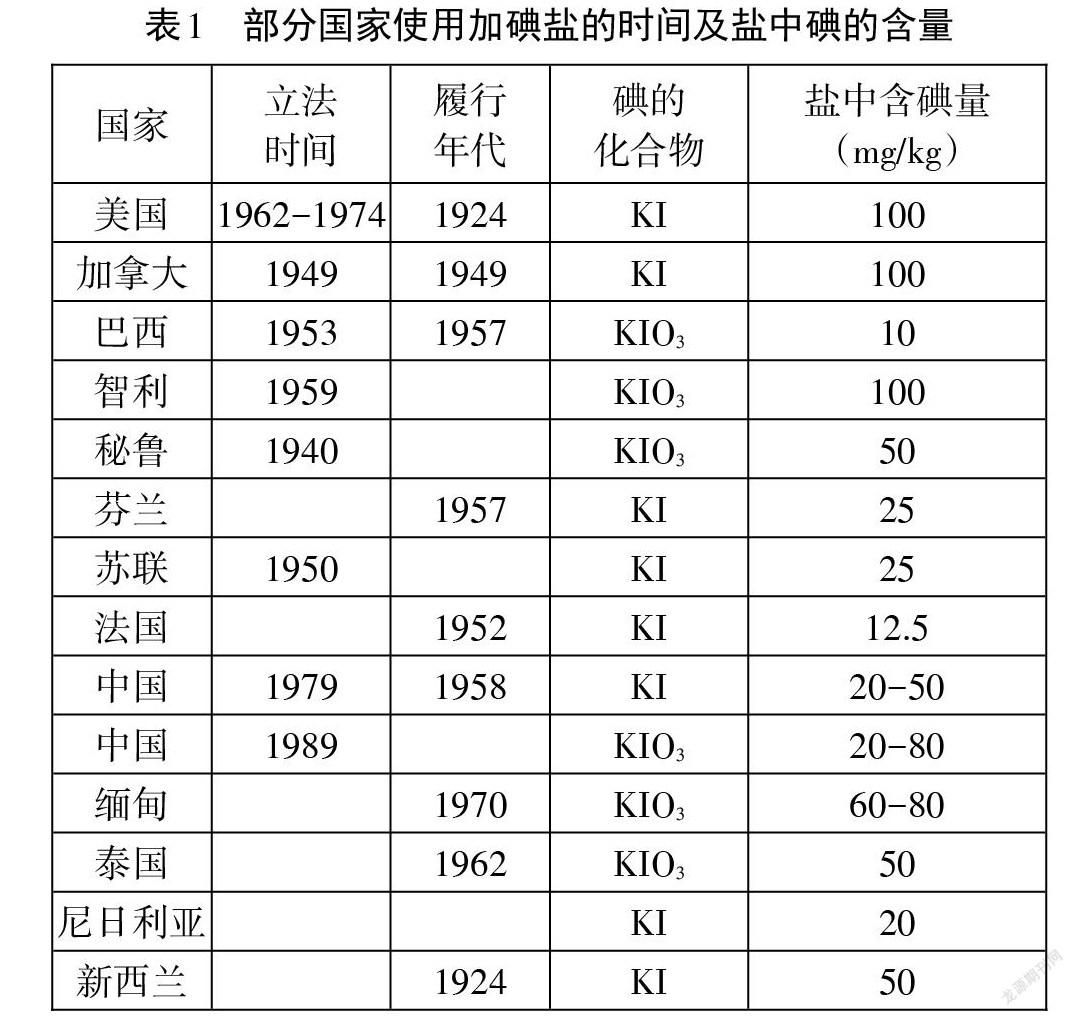
[問題深入]閱讀資料(見表1),世界各國對加碘鹽進行多項規定,我們觀察發現加碘鹽中主要涉及的碘的化合物有兩種:KI、KIO3。你認為食鹽補碘劑要符合什么條件?
[學生觀點]是否可食用、穩定性、價格、味道、對人體的影響等。
[驅動問題]補碘劑的選用一般考慮碘酸鉀或碘化鉀,結合資料卡1,你覺得二者的優缺點分別在什么地方?
[資料卡1]碘化鉀(KI)是白色立方結晶或粉末。無毒,在潮濕空氣中微有吸濕性,久置析出游離碘而變成黃色,并能形成微量碘酸鹽。在水中溶解度:20°C時140g。其水溶液也會氧化而漸變為黃色,可加少量堿防止氧化。碘酸鉀(KIO3)是無色或白色結晶粉末,無臭,無毒。能溶于水和碘化鉀水溶液、稀硫酸,不溶于乙醇和液氨。在水中溶解度:0°C時4.74g,100°C時32.3g。常溫下較穩定。
[學生觀點]二者都無毒,KI的水溶性好,KIO3的水溶性不好,KI穩定性比KIO3差。選用KI作為補碘劑一般要考慮加入一些穩定劑(堿性物質)。
[反思評價]學生結合信息能夠分析出KI、KIO3的差異。
[驅動問題]補碘劑的選擇還需要考慮鹽的組成,結合資料卡2,你覺得他們選擇補碘劑的原因是什么?
[資料卡2]關于補碘劑的選擇一般還需要考慮鹽的成分,若原鹽中含有還原性雜質,如Fe2+等成分較多時,則不宜選用KIO3作為加碘劑,選用Kl作為加碘劑更好;若原鹽中含有氧化性雜質較多時,如Fe3+等,則不宜選用Kl作為加碘劑,選用KIO3作為加碘劑更好。
[學生觀點]如果原鹽中含有Fe2+會和KIO3發生反應,則此時應該選擇Kl,而原鹽中含有Fe3+會和KI發生反應,則此時應該選擇KIO3。少部分學生發現,還原性物質會與KIO3發生反應,證明KIO3具有氧化性;氧化性物質會與KI發生反應,證明KI具有還原性。
[反思評價]結合資料,學生可以發現選用補碘劑的兩種具體情況,但是在深挖碘化鉀具有氧化性和碘酸鉀具有還原性的過程中,需要教師引導。
[任務2]補碘劑的性質預測。
[驅動問題]從價態預測碘化鉀和碘酸鉀的性質有哪些?
[學生觀點]碘化鉀中碘-1價,具有還原性,可嘗試使用氧化劑檢驗,如:O2、H2O2、KMnO4、Fe3+;從化合價角度,碘酸鉀中碘+5價,既具有氧化性又具有還原性,針對氧化性可嘗試使用還原劑檢驗,如:CO、H2、金屬單質(Fe、Cu),針對還原性與碘化鉀類似。
[反思評價]學生探究兩種陌生的物質碘化鉀與碘酸鉀,引導學生從核心元素價態的視角分析二者的區別,+5、-1,并嘗試運用氧化還原的方法檢驗出這兩種物質。
[任務3]補碘劑的實驗探究。
[驅動問題]KI的檢驗,實驗方案如何設計?[學生設計]學生設計實驗方案(表2)。
[反思評價]學生們檢驗KI思路基本一致,將KI氧化為I2,再通過淀粉溶液檢驗碘單質的存在,運用氧化還原反應的知識分析出KI具有還原性,設計加入氧化劑檢驗。
[驅動問題]KIO3的檢驗,實驗方案如何設計?
[學生設計]學生設計實驗方案(表3)。
[學生匯報]無明顯現象,碘酸鉀和碘化鉀沒有發生反應。再滴加2-3滴稀硫酸溶液,出現藍色。說明有碘單質生成。
[教師追問]我們加入硫酸就能看到藍色,那么硫酸在這里有什么作用呢?
[學生觀點]硫酸氧化了KI,產生I2,所以產生藍色;硫酸作為一種催化劑,催化反應;硫酸提供了一種酸性環境。
[反思評價]實驗中加入硫酸使得反應更容易發生,說明氧化性和還原性會受到環境的影響(酸堿性、溫度等)。
[驅動問題]食鹽中補碘劑如何檢驗,請你設計實驗方案?
[學生設計]學生設計實驗方案(表4)。
[評價反饋]學生在分析了KI、KIO3的基礎上很快設計出實驗方案,在小組討論中,學生覺得KI的加入也有可能被溶液中氧氣氧化而產生碘單質使淀粉變藍。所以第二小組的學生提出增加空白實驗對照組,實驗方案更加科學嚴謹。
[歸納總結]對于陌生物質的研究,我們可以站在化合價的角度預測物質可能存在的性質,并通過理論分析尋找合適的氧化劑或還原劑,設計實驗驗證,最終得出結論。物質性質(氧化性、還原性)的研究模型(見圖2)。
[評價反饋]學生通過前面問題地解決,知道碘酸鉀和碘化鉀的檢驗方法,知道從化合價角度分析其氧化性和還原性。在小組合作實驗的過程中,培養學生的動手操作能力和團隊合作精神,在項目探究的最后,教師幫助學生得出物質性質(氧化性、還原性)的研究模型,將知識內容升華,將知識能力內化,促進學生形成一定的探究模型,達到科學探究的學科素養。
[課堂收獲]暢所欲言,談一談本節課你有哪些收獲?
[學生收獲1]熟悉了碘的存在形式,碘的相關化合物的檢驗方法。
[學生收獲2]研究陌生物質的性質可以從物質類別和價態兩個角度去分析。
[學生收獲3]學會了用實驗探究的方法驗證假設是否正確,并且需要注重實驗方案的嚴謹。
五、項目學習特色
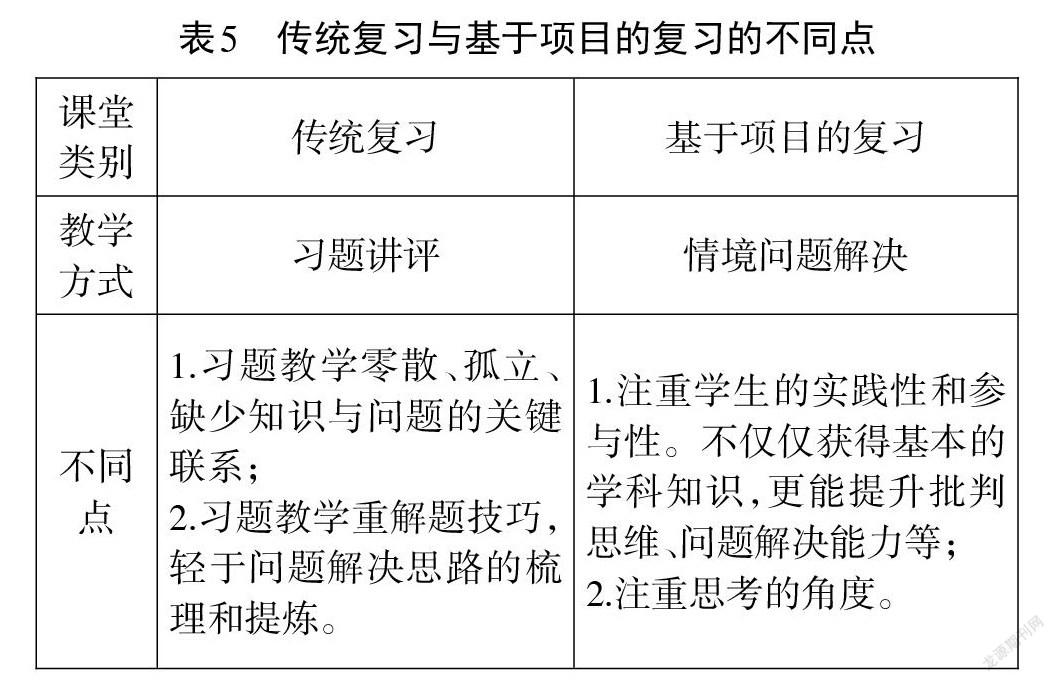
氧化還原反應的復習,在學生學完氧化還原的基本概念和規律后,是一次運用項目式學習進行復習教學的嘗試。傳統氧化還原復習主要進行習題講評,對比兩種復習課的呈現方式,我們可以發現許多不同點(見表5)。
以“探秘加碘鹽”為項目的復習課堂,將該項目拆解為補碘劑的選擇、補碘劑的性質預測、補碘劑的實驗探究三個課堂任務,在任務解決的過程中設置驅動性問題引發學生的思考與思維的碰撞,在思考問題的同時提取氧化還原的基本概念和規律并嘗試解決問題。比如:在性質預測時,學生需要結合元素化合價提出其可能的性質;在設計實驗方案時學生需要分析氧化還原的反應規律;在進行實驗論證時學生需要結合實驗現象歸納整理實驗結論。因此在項目式學習過程中知識得到了整合運用,學生對知識內容的認識更加系統化。
氧化還原反應項目學習以學生為主體,通過“探秘加碘鹽”的項目研究,讓學生在真實的問題情境中去實踐,注重學生的實踐性和參與性,不僅可以獲得基本的學科知識,而且在探究和解決問題的過程中獲得基本知識和技能,關鍵能力和必備品格,有利于學生學科核心素養的發展。
此外,教師是學生在項目學習中的合作者,引導學生選擇合適的解決問題的思路和方法。教師需要不斷地和項目學習小組成員溝通,請他們匯報合作學習結果、分析答題思路或對其他同學的思路方法進行點評等。教師通過追問、評價和示范等行為有效促進學生用化學知識解決問題,使得課堂中師生互動觸及高階思維。課堂中師生互動更加有效,將化學知識融入生活,讓化學學科知識有了人情味。
參考文獻
[1]侯肖,胡久華.在常規課堂教學中實施項目式學習——以化學教學為例[N].教育學報,2016-8-12(4).
[2]中華人民共和國教育部.普通高中化學課程標準(2017年版2020年修訂)[S].北京:人民教育出版社,2020:2.

