凍干人用狂犬病疫苗(MRC-5細胞)非臨床安全性研究
譚小東,楊世龍,王麗,許娜娜,徐文龍,周沛,張艷飛,周鋒
狂犬病是一種由狂犬病病毒引起的人獸共患傳染病,一旦發病,病死率幾乎100%[1]。接種疫苗是預防狂犬病唯一有效的方式,其中人二倍體細胞基質(如MRC-5 細胞)生產的狂犬病疫苗有著免疫效果好、副反應低、免疫持久性強的優點[2-7]。本研究根據相關指導原則要求,分別從全身主動過敏試驗(研究專題代號12006-14001)、肌肉刺激性(研究專題代號12006-13004,12006-16001)、單次給藥毒性(研究專題代號12006-13001)和溶血性(研究專題代號12006-13002)四個方面,評價凍干人用狂犬病疫苗(MRC-5 細胞)的非臨床安全性。現將研究結果報告如下。
1 材料與方法
1.1 疫苗凍干人用狂犬病疫苗(MRC-5細胞)按照企業標準制備,檢定合格后用于動物安全性評價研究,批號分別為20140101和20141104。系采用MRC-5細胞培養PM株狂犬病病毒,經滅活、純化和凍干后制得。疫苗成品中含有人血白蛋白等賦形保護劑。
對照疫苗系市售凍干人用狂犬病疫苗(Vero 細胞,廣州諾誠生物制品股份有限公司,批準文號S20083040,批號201308073-2),含有人血白蛋白等賦形保護劑。
1.2 實驗動物安全性研究用清潔級新西蘭白兔購自山東青島康大生物科技有限公司[實驗動物質量合格證編號分別為0021455和0025613,青島康大生物科技有限公司簽發;實驗動物生產許可證號分別為SCXK(魯)20110001 和SCXK(魯)20160002,由山東省科學技術廳簽發],SPF級Hartley豚鼠購自北京維通利華實驗動物技術有限公司[實驗動物質量合格證編號11400700063326,由北京維通利華實驗動物技術有限公司簽發;實驗動物生產許可證編號為SCXK(京)2012-0001,由北京市科學技術委員會簽發],SPF級ICR小鼠購自上海西普爾-必凱實驗動物有限公司[實驗動物質量合格證編號為2008001639387,由上海西普爾-必凱實驗動物有限公司簽發,實驗動物生產許可證編號為SCXK(滬)2013-0016]。
本研究起止時間為2014年3月至2016年10月,試驗結束時,所有存活的動物均實施安樂死。
1.3 安全性研究該研究根據國家食品藥品監督管理總局(NMPA)《藥物非臨床研究質量管理規范》[8]、《預防用生物制品臨床前安全性評價技術審評一般原則》[9]、《化學藥物急性毒性試驗技術指導原則》[10]和《化學藥物刺激性、過敏性和溶血性研究技術指導原則》[11]要求,制定相關研究方案并執行。
1.3.1 全身主動過敏試驗 取SPF 級Hartley 豚鼠共84只,稱重后按其性別和體質量通過簡單隨機化分配步驟分為六組,每組12只動物,雌雄各半。
試驗分為兩個階段,第一階段為致敏階段,隔日注射1 次,共給藥3 次。低劑量和高劑量給藥組給予凍干人用狂犬疫苗(MRC-5 細胞),每只劑量分別為不低于1.25 IU 和不低于2.5 IU,上市對照組每只不低于2.5 IU 給予凍干人用狂犬病疫苗(vero 細胞)、陽性對照組每只給予卵清蛋白2 mg、兩種賦形劑對照組分別為含人血白蛋白和不含人血白蛋白。通過腹腔注射,低劑量組每只按0.5 mL 給藥,其余組均按每只1.0 mL給藥。
第二階段為激發階段。各組在末次致敏注射后第14天或第21天激發一次。通過足靜脈推注給藥,低劑量組按日1.0 mL給藥、其余組均按日2.0 mL給藥。
實驗期間每天進行一次詳細的動物臨床觀察,并根據觀察結果評價動物全身致敏性情況。全身致敏性評價標準參見文獻[12],分別標記為陰性“-”、弱陽性“+”、陽性“++”、強陽性“+++”和極強陽性“++++”。
1.3.2 單次給藥肌肉刺激試驗 取清潔級新西蘭白兔,稱重后按其性別和體質量通過簡單隨機化分配步驟分為兩組,每組雌雄各2只,分別作為賦形劑對照組和給藥組。
賦形劑對照組給予疫苗賦形劑(含人血白蛋白),給藥組給予疫苗。賦形劑對照組和給藥組每只按1.0 mL 給藥體積,通過左側股四頭肌給藥1 次(d0)。動物分2 次解剖檢查,每組首次各剖檢2 只,雌雄各半;第二次剖檢余下動物。兩次解剖時間分別為給藥后96 h(d4)和恢復末期(d17),肉眼觀察肌肉刺激反應并參照文獻[13]分級,同時進行局部組織病理學檢查。
1.3.3 多次給藥肌肉刺激試驗 分組、給藥體積和注射部位按照1.3.2項方法,分別在d0、d3、d7、d14和d28給藥1次,共5次。動物分2次解剖檢查,每組首次各剖檢2只,雌雄各半;第二次剖檢余下動物。兩次解剖時間分別為末次給藥后96 h(d4)和恢復末期(末次給藥后d17),肉眼觀察肌肉刺激反應并參照文獻[13]分級,同時進行局部組織病理學檢查。
1.3.4 單次給藥毒性 取SPF 級ICR 小鼠共60 只,稱重后按其性別和體質量通過簡單隨機化分配步驟分為3組,每組20只動物,雌雄各半。
參考小鼠經肌內注射的最大給藥容量(10 mL/kg)及供試品最大給藥濃度設定本試驗的高劑量,將高劑量的1/2 作為本試驗的低劑量,即25 IU/kg 和50 IU/kg兩個劑量水平的給藥組,同時設置1個賦形劑對照組。對照組和50 IU/kg劑量組按10 mL/kg 的給藥體積,25 IU/kg 劑量組按照5 mL/kg 的給藥體積。左右后肢肌肉各選取1 個位點注射,兩個位點注射體積相同。單次給藥,觀察其臨床反應,監測體質量、耗食量、大體解剖、臟器重量等指標,并計算臟器重量與體質量比值、臟器重量與腦重比值。
1.3.5 溶血性試驗 制備兔血紅細胞用氯化鈉注射液配成2%體積分數的混懸液,備用。
參照文獻方法[14],設置供試品組為1-5 號管,陰性對照組為6 號管,陽性對照組為7 號管;另外增加8號管為賦形劑對照組。依次加入2%紅細胞懸液、氯化鈉注射液或去離子水、不同體積供試品,混勻后,立即置(37±1.0)℃的恒溫培養箱中溫育3 h。期間觀察并記錄結果。
1.4 統計學方法采用Office Excel 2016 軟件統計分析,豚鼠全身主動過敏試驗結果數據比較采用χ2檢驗,P<0.05 表示差異有統計學意義;單次給藥毒性試驗結果數據比較采用One way ANOVA 檢驗,P<0.05表示差異有統計學意義。
2 結果
2.1 全身主動過敏試驗結果所有動物均存活到激發前,分組當日、首次致敏、末次致敏以及兩次激發當日稱重結果表明,各組雌雄豚鼠體質量均呈增長趨勢。第14 天和第21 天激發結果見表1,2。從過敏反應程度和發生率來看,除不含人血白蛋白的賦形劑組未見過敏反應外,其余各組均發生不同程度的過敏癥狀,過敏發生率為100%。從豚鼠過敏病死率來看,第14 天或第21 天激發后,不含人血白蛋白的賦形劑對照組病死率均為0,含有人血白蛋白的賦形劑對照組病死率分別為0 和33.33%,低劑量組病死率分別為0 和50%,高劑量組病死率分別為16.67%和33.33%,上市對照組病死率分別為66.67%和83.33%,陽性對照組病死率均為100%。低劑量組、高劑量組和賦形劑對照組(含人血白蛋白)之間病死率比較,第14 天激發后組間差異無統計學意義(χ2=2.12,P=0.347),第21天激發后組間差異無統計學意義(χ2=0.47,P=0.792)。
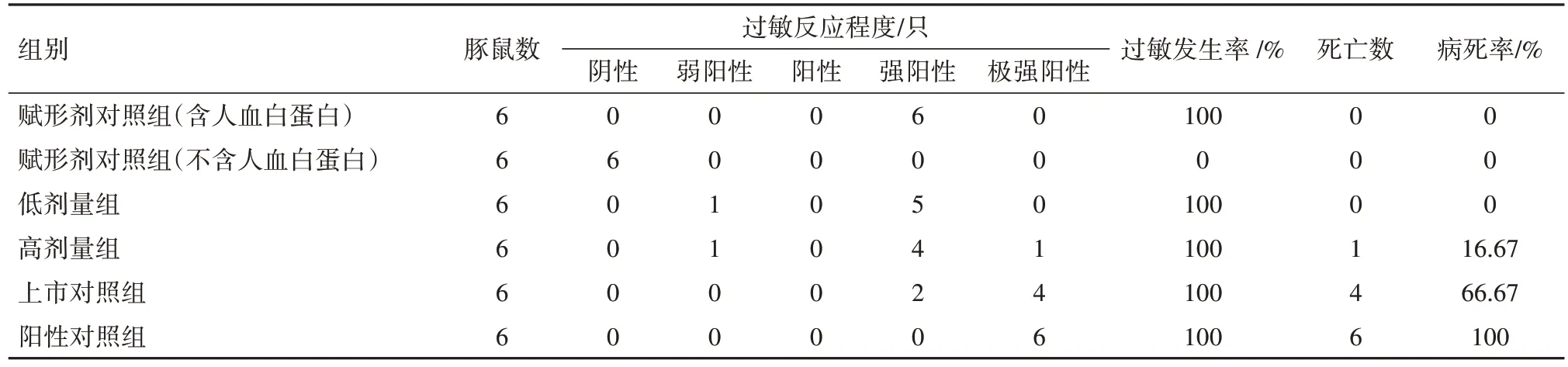
表1 豚鼠全身主動過敏試驗結果(第14天激發)
2.2 單次給藥肌肉刺激試驗結果賦形劑對照組和給藥組動物注射部位在實驗期間均未見異常,刺激反應評分為0分(無明顯變化)。局部組織病理學檢查結果如表3 所示,給藥后96 h(d4),給藥組可見1 只家兔給藥部位(左側股四頭肌)小灶輕微單核細胞浸潤;恢復末期(給藥后d17),動物左右側股四頭肌均正常。
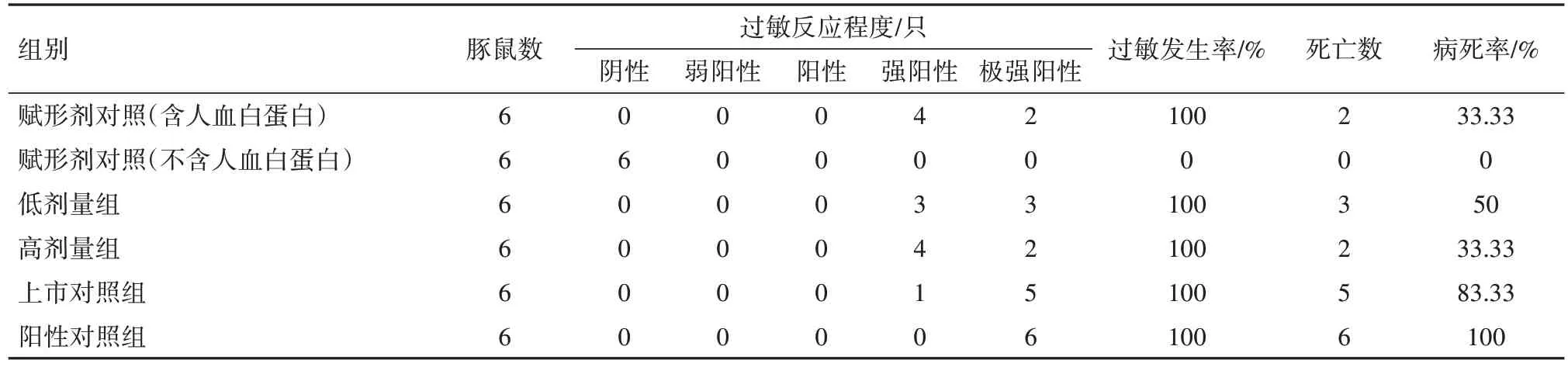
表2 豚鼠全身主動過敏試驗結果(第21天激發)
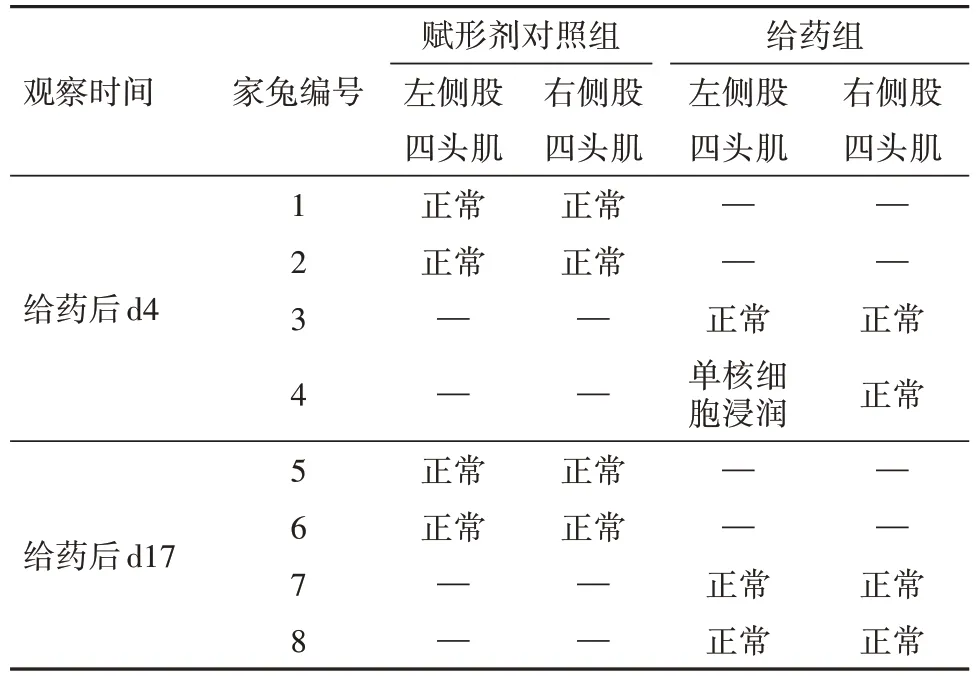
表3 單次給藥兔肌肉刺激試驗局部組織病理學檢查結果
2.3 多次給藥肌肉刺激實驗結果賦形劑對照組和給藥組注射部位肉眼觀察未見異常,刺激反應評分為0分(無明顯變化)。局部組織病理學檢查結果如表4 所示,末次給藥后96 h(d4),賦形劑對照組和給藥組各有2只家兔給藥部位出現輕度至中度單個核細胞浸潤;恢復末期(末次給藥后d17),給藥組可見1只家兔給藥部位輕度單核細胞浸潤。所有動物右側股四頭肌(未給藥)正常。

表4 多次給藥兔肌肉刺激實驗局部組織病理學檢查結果
2.4 單次給藥毒性實驗結果實驗中未見動物死亡或瀕死,適應期及觀察期均未見異常。給藥前、給藥當日、給藥后1周和2周小鼠體質量結果見表5,給藥前后小鼠體質量增加;且高劑量組、低劑量組和賦形劑對照組之間,無論雌性或雄性小鼠的體質量差異均無統計學意義(P>0.05),顯示疫苗未對體質量增長產生影響;耗食量、大體解剖、臟器重量、臟器重量與體質量比以及臟器重量與腦重比,均未見與給予疫苗相關的異常變化。由此可見,兩個劑量水平的凍干人用狂犬病疫苗(MRC-5細胞)均沒有明顯的毒性反應,疫苗最大耐受量(MTD)>50 IU/kg。
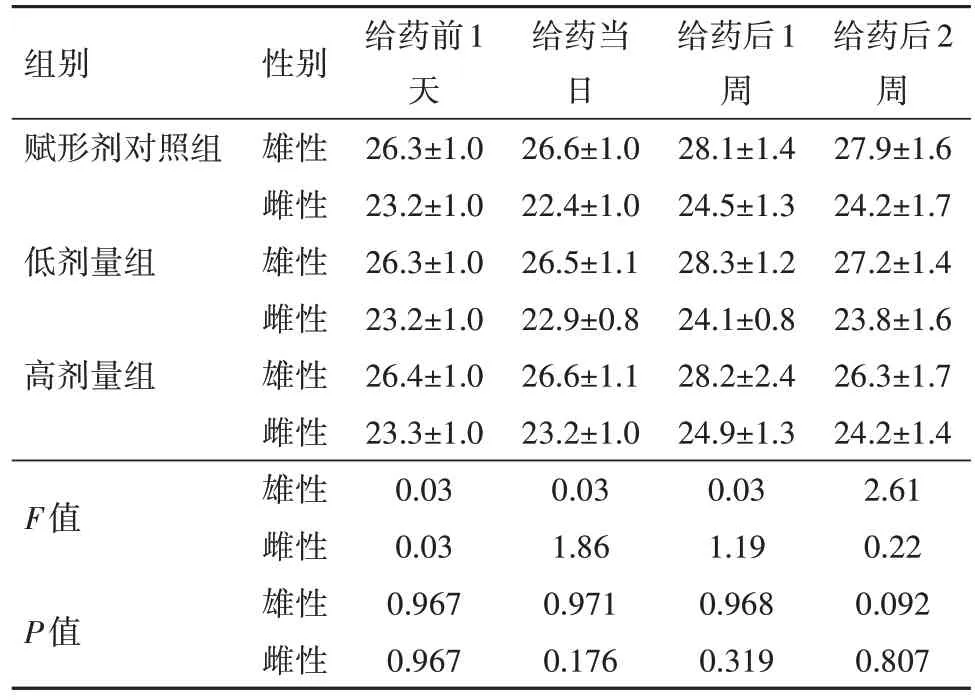
表5 單次給藥毒性實驗小鼠體質量變化(n=10)/(g,xˉ±s)
2.5 溶血性實驗結果孵育前,除陽性對照組顏色較紅有溶血現象外,其余各組試管內紅細胞分布均勻;孵育期間,供試品、賦形劑對照和陰性對照組肉眼觀察可見紅細胞緩慢下沉,上清液體無色澄明;陽性對照組溶液顏色較紅,呈澄明紅色。孵育3 h 后,手動顛倒搖勻各組試管,未見棕紅色或紅棕色絮狀沉淀,無凝聚現象發生。
3 討論
臨床使用時,疫苗中由于含外源蛋白、明膠和抗生素等,或可導致嚴重過敏反應[14-15]。狂犬病疫苗因為殘留有經過滅活處理的人血白蛋白,以及宿主細胞蛋白質和DNA 以及殘留的牛血清白蛋白等常常引起嚴重的過敏反應和局部刺激反應[14-17]。
疫苗保護劑中添加的人血白蛋白,因為種屬關系常會引起豚鼠過敏反應,豚鼠主動過敏實驗常常無法完全排除狂犬病疫苗抗原和保護劑成分潛在的過敏風險[18]。通過設立不含抗原成分的對照組,比較過敏反應程度和發生率,可以研究抗原成分是否會引起或加重過敏[19]。為此,本研究分別設置了兩種賦形劑對照組。研究結果顯示,疫苗組和上市對照組因在凍干保護劑中添加了人血白蛋白,從而引起豚鼠出現過敏反應。不含人血白蛋白的賦形劑組過敏反應呈現陰性,確認該疫苗過敏反應與賦形劑其他組分無關。含有人血白蛋白的賦形劑組、低劑量組、高劑量組疫苗三者相較,過敏反應程度相似、過敏發生率均為100%;三組動物病死率差異無統計學意義,因此可以判斷過敏反應與疫苗抗原成分無關。人血白蛋白不會引起人體過敏反應,且疫苗中添加的人血白蛋白為市售的批簽發制品,效期滿足疫苗有效期,能夠保證人體內使用時安全性。
考慮到現有“五針法”免疫程序可能在同一部位給藥5 針[20],本研究同時設計了單次和多次給藥肌肉刺激實驗。多次給藥肌肉刺激后,賦形劑組和給藥組均出現給藥側股四頭肌輕度至中度單核細胞浸潤,該現象為常見的注射針穿刺造成的損傷以及機體對損傷的修復或反應性變化。對照組和給藥組注射部位觀察以及局部組織病理學檢查均未見與疫苗相關的異常。
在本研究條件下,凍干人用狂犬病疫苗(MRC-5細胞)在豚鼠中引起的過敏癥狀,與疫苗抗原成分無關;單次和多次肌內注射均不會引起家兔肌肉刺激性反應;給藥最高劑量50 IU/kg 時,未見明顯的毒性反應;疫苗自身也不會引起紅細胞溶血和凝聚。
綜上所述,動物體內實驗表明,采用MRC-5 細胞制備的凍干人用狂犬病疫苗具有良好的安全性。

