精子DFI、HDS 與精子濃度及活力的相關性分析
丁旭鋒,湯姣,孫大林,史卿菁,黃園
1.宜興市婦幼保健院生殖健康科,江蘇無錫 214200;2.宜興市婦幼保健院檢驗科,江蘇無錫 214200;3.東南大學附屬中大醫院中西醫結合男科,江蘇南京 210029
隨著國家生育政策的調整,男性的生育力評估進一步受到家庭和社會的重視,男性不育癥的發病率也有上升趨勢,夫妻不孕不育的原因中男方的因素占30%~50%。男性生育力的評估重點是精子的檢測。常規檢查精子的濃度和活力及精子形態學檢查對生育的評估并不全面,精子DNA 損傷程度的評價是有效的補充。精子DNA 損傷程度主要用精子DNA 碎片指數(DNA-fragmetation-index,DFI)和高DNA 染色性精子比率(high dyeable sperm index,HDS)兩個指標來評價,精子DFI、HDS 與精子濃度及活力的相關性研究有各種報道[1]。本文選擇2020年1 月—2021 年11 月在宜興市婦幼保健院生殖健康科進行精液檢查的325 份精液標本數據,對數據進行了統計和分析,初步研究了精子DFI、HDS 與精子常見指標的相關性,發現了部分指標新的相關性依據,并進行了分析和探討,現報道如下。
1 資料與方法
1.1 一般資料
本研究對于325 份精液標本數據按照相關指標進行分組,有不育癥患者也有孕前優生檢查的男性,年齡20~51 歲,平均(30.13±4.93)歲。分析主要參數的相關性。具體分組方式如下。①按照精子濃度分組,低濃度組:精子濃度低于20×106/mL,23份,平均年齡(29.65±4.07)歲;中濃度組:精子濃度(20~60)×106/mL,118 份,平均年齡(30.22±4.87)歲;高濃度組:精子濃度60×106/mL 以上,184 份,平均年齡(30.07±5.10)歲。3 組年齡對比,差異無統計學意義(P>0.05),具有可比性。②按照精子的活力分組,低活力組:PR<32%,101 份,平均年齡(30.42±5.07)歲;中活力組:PR:32%~50%,105 份,平均年齡(30.34±4.72)歲;高活力組:PR>50%,119 份,平均年齡(29.61±5.01)歲。3 組年齡差異無統計學意義(P>0.05),具有可比性。③按照DFI 分組,低DFI 組:DFI<15%,169 份,平均年齡(29.47±3.94)歲;中DFI組:15%<DFI<30%,106 份,平均年齡(30.50±5.76)歲;高DFI 組:DFI>30%,50 份,平均年齡(31.36±5.82)歲。3 組年齡對比,差異無統計學意義(P>0.05),具有可比性。
1.2 納入與排除標準
納入標準:身體基本健康的男性;男性體征明顯;無生殖系統疾病史;無局部外傷史;無腮腺炎病史;備孕前主動要求檢查精液或有不育病史門診檢查精液。
排除標準:無精子癥患者,精子濃度低于2×106/mL,前向運動精子比率(PR)低于5%的檢查者,死精子癥患者,精液量小于0.8 mL 的檢查者;禁欲天數不在2~7 d 內的檢測者。
1.3 方法
1.3.1 精液標本處理 所有檢查對象均要求禁欲2~7 d,平均禁欲天數為(3.86±1.28)d,在本單位專門的取精室手淫取精,采用專門的取精管儲存精液標本,取精后標本送到檢驗科37℃水浴恒溫箱保存精液30~60 min,然后分成兩份標本,送檢DFI 及HDS的標本為0.6~0.7 mL,剩余部分進行精液常規及形態學檢查,進行DFI 及HDS 檢測的標本在-20℃冰箱中冷凍保存,每天通過南京金域醫學檢驗所有限公司專門冷鏈外送到該實驗室。
1.3.2 檢測方法 精液體積、濃度、活力、及液化時間由本院檢測,實驗室采用半自動精液分析儀,由上海北昂醫療技術有限公司提供,檢驗科從事精液檢測的工作人員固定在2~3 名經過培訓的檢驗師之中。精子DFI、HDS 檢測由南京金域醫學檢驗所有限公司負責檢測,主要流程:首先用37℃恒溫水浴箱孵育冷凍的精液標本,精液完全溶解后,檢測精子濃度,用專門的稀釋液按比例稀釋至(1~2)×106/mL,加入酸化液后再加入專門的染色劑,再將標本用Sparrow 流式細胞儀進行檢測,軟件進行分析,形成精子DFI 和HDS 值。
1.4 觀察指標
本研究主要觀察指標為:精子濃度(單位:106/mL);精子活力即前向運動精子比率(progressive rate, PR)(單位:%);DFI(單位:%);HDS(單位:%)。
1.5 統計方法
使用SPSS 17.0 統計學軟件對數據進行分析,符合正態分布的計量資料以(±s)表示,組間差異比較以t檢驗,P<0.05 為差異有統計學意義。精子濃度及活力與DFI 及HDS 的相關性均采用Pearson 相關分析。
2 結果
2.1 精子濃度與精子DFI 及HDS 的相關性分析
精子濃度逐步升高,精子的DFI 及HDS 逐步降低,呈負相關(r=-0.180、-0.137)。低濃度組DFI、HDS 均大于高濃度組,差異有統計學意義(P<0.05),中濃度組的DFI 也大于高濃度組,差異有統計學意義(P<0.05),而3 組HDS 比較,差異無統計學意義(P>0.05)。本組研究中低濃度組和中濃度的組DFI 及HDS 比較,差異無統計學意義(P<0.05)。見表1。
表1 不同濃度精子的DFI 及HDS 比較[(±s),%]

表1 不同濃度精子的DFI 及HDS 比較[(±s),%]
組別低濃度組(A)中濃度組(B)高濃度組(C)t/P 值(A-B)t/P 值(B-C)t/P 值(A-C)精子濃度(×106/mL)<20 20~60>60樣本數23 118 184 DFI 22.42±12.35 20.12±13.26 15.23±10.10-0.769/0.443-3.625/<0.001-3.137/0.002 HDS 8.96±5.05 6.99±4.67 6.20±3.22-1.826/0.069-1.739/0.083-3.604/<0.001
2.2 精子活力與精子DFI 及HDS 的相關性分析
隨著精子活力的提高,精子的DFI 及HDS 逐步降低,呈負相關(r=-0.135、-0.225)。低活力組的HDS 高于中活力組及高活力組,差異有統計學意義(P<0.05),3 組DFI 對比,差異無統計學意義(P>0.05)。中活力組的DFI 及HDS 與高活力組對比,差異無統計學意義(P>0.05)。見表2。
表2 不同活力精子的DFI 及HDS 比較[(±s),%]
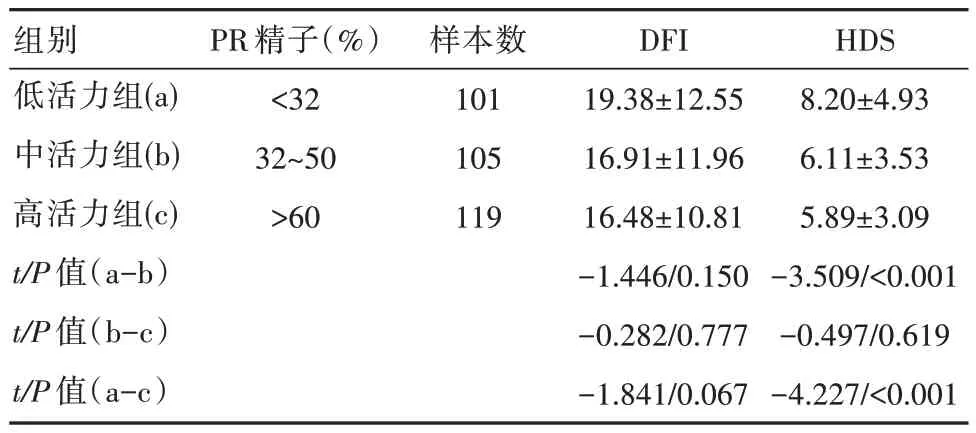
表2 不同活力精子的DFI 及HDS 比較[(±s),%]
組別低活力組(a)中活力組(b)高活力組(c)t/P 值(a-b)t/P 值(b-c)t/P 值(a-c)PR 精子(%)<32 32~50>60樣本數101 105 119 DFI 19.38±12.55 16.91±11.96 16.48±10.81-1.446/0.150-0.282/0.777-1.841/0.067 HDS 8.20±4.93 6.11±3.53 5.89±3.09-3.509/<0.001-0.497/0.619-4.227/<0.001
2.3 不同DFI 精子的HDS 比較
隨著精子DFI 的變化,HDS 的變化很不明顯,DFI 不同組別中的DHS 對比,差異無統計學意義(P>0.05),變化幅度很小,每組的HDS 均數接近總體樣本均數。見表3。
表3 不同DFI 精子的HDS 比較[(±s),%]
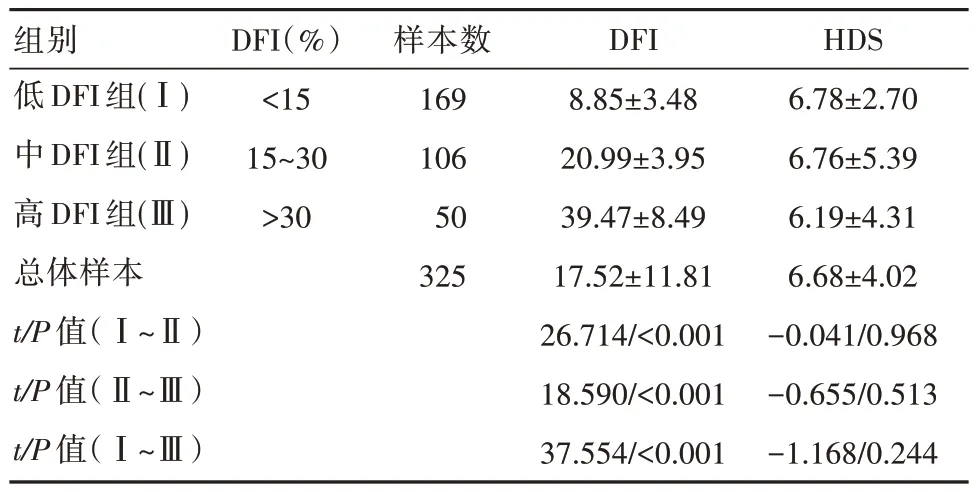
表3 不同DFI 精子的HDS 比較[(±s),%]
組別低DFI 組(Ⅰ)中DFI 組(Ⅱ)高DFI 組(Ⅲ)總體樣本t/P 值(Ⅰ~Ⅱ)t/P 值(Ⅱ~Ⅲ)t/P 值(Ⅰ~Ⅲ)DFI(%)<15 15~30>30樣本數169 106 50 325 DFI 8.85±3.48 20.99±3.95 39.47±8.49 17.52±11.81 26.714/<0.001 18.590/<0.001 37.554/<0.001 HDS 6.78±2.70 6.76±5.39 6.19±4.31 6.68±4.02-0.041/0.968-0.655/0.513-1.168/0.244
3 討論
精子在受精卵的形成過程中主要的作用是提供男方的DNA,精子的DNA 是男性將遺傳信息傳給下一代的主要物質[2],精子DNA 的完整性對胚胎的形成和發育有重要的意義,影響受孕率和流產率[3],由于各種原因如生活環境的污染,生殖系統的疾病,甚至精神壓力等都可能導致精子DNA 的損傷[4],精子DNA 的損傷檢測是近年來評價精子DNA的主要方式[5]。DFI 是指精子細胞核中斷裂的DNA的比率。HDS 也叫高DNA 著色性[6]或精子成熟度,精子的細胞核未完全縮合即未成熟的情況下可表現為高染色的特點,HDS 是指不成熟的精子即高可染性精子占總精子的比率[7]。多數研究認為,DFI和HDS 的評價對男性生育能力有一定的價值[8]。絕大多數研究認為DFI 是獨立于精液常規參數的指標,對于男性生育力評估,DFI 比精液常規參數更有預測作用[9-10],DFI 具有更加客觀、穩定的優點,不易受其他檢測因素的影響[11]。研究認為精子DFI升高可能導致精子的受精能力下降,可能會抑制胚胎的生長發育,易導致女方胚胎丟失,給妊娠過程帶來不良的影響[12-13]。
精子的濃度和活力與DFI 的相關性分析研究報道較多,但是與HDS 的相關性研究文獻報道相對較少。本研究顯示精子的濃度與精子DFI 及HDS 均呈負相關性(r=-0.180、-0.137),劉鵬等[13]研究認為DFI 與精子濃度存在負相關關系(r=-0.087)和本研究相一致,但也有研究認為DFI 和精子濃度無相關性[14]。本研究也顯示隨著精子濃度變化DFI 的變化較HDS 的變化更明顯,提示精子DNA 碎片的形成因素和生精功能可能有較大相關性。本研究顯示精子活力與精子DFI 及HDS 呈負相關性(r=-0.135、-0.225),馮玲等[15]研究認為精子活力與DFI 呈負相關關系(r=-0.402),庾偉堅等[16]研究也發現DFI 與精子活力成負相關關系(r=-0.450),與本研究結果基本相一致。本研究發現,隨著精子活力的提高,HDS 的變化較敏感,而DFI 的變化相對較小,可見影響精子活力變化的因素可能和影響精子細胞核成熟程度的因素有較大的相關性。本研究同時發現對于正常活力精子的男性(即中活力組和高活力組),隨著精子活力提升,其DFI 及HDS 下降幅度較小,差異無統計學意義(P>0.05)。
對于HDS 的臨床價值存在部分爭議,目前臨床認為精子HDS 小于15%更有利于生育。但是,據陸金春[17]認為,HDS 參數的臨床意義并不明確。據譚志國等[18]研究認為隨著精索靜脈曲張程度的加重,精子DFI 逐漸升高,而HDS 則不受影響。有研究報道男性的年齡變化和精子HDS 并無相關性[7],而戎春浩等[19]研究認為隨著禁欲天數的延長,精子的活力下降,DFI 升高,但是HDS 在下降。帥俊等[20]研究認為和HDS 與DFI 成正相關(r=0.150),而本研究發現精子HDS 與精子濃度及活力呈現不同程度的負相關性(r=-0.135、-0.225),但是單純以精子DFI 分組中各組的HDS 變化很小,差異無統計學意義(P>0.05),可見精子DFI 與HDS 基本沒有直接的相關性,即精子DNA 的損傷程度和精子細胞核的成熟程度無明顯的直接相關性。
綜上所述,男性精液檢查是評價生育力的主要途徑,但是精液常規波動性較大,精子DFI 及HDS 的檢測是生育能力的重要補充,精子DFI 及HDS 與精子濃度及活力存在負相關性,但是DFI 與HDS 直接的相關性很小。精子DFI 對生育的影響意義較明確,對于HDS的臨床價值有必要進一步研究。

