薯蕷皂苷的抗抑郁作用及其機制
譚雪梅,許麗娜,彭金詠,尹連紅
(大連醫科大學藥學院,遼寧 大連 116044)
抑郁癥是當今世界最嚴重的精神疾病之一,也是初級衛生保健中最常見的精神疾病,其特點之一就是顯著持久的心情壓抑、情緒低落。據世界衛生組織相關數據顯示,目前全球抑郁癥患者高達4.8%,并且患病人數還在不斷上升。已有文獻證明,心血管疾病、二型糖尿病、乳腺癌、帕金森病、焦慮癥等疾病的發生都伴隨著抑郁癥的產生[1-3]。因此,深入研究抑郁癥的發病機制及治療對策是生命科學領域的研究熱點之一。
氧化應激通過自由基、非自由基分子、活性氧等多種物質參與抑郁癥的發生發展[4]。抑郁癥常伴有氧化應激失調,如總抗氧化能力異常、氧化損傷和自身免疫反應產物等[5]。此外,研究發現抑郁癥患者皮質線粒體能量產生減少,葡萄糖類似物攝取減少,提示抑郁癥的發生與能量缺陷和糖代謝異常密切相關[6]。解偶聯蛋白家族新成員-解偶聯蛋白2(uncoupling protein 2,UCP2)普遍存在于心臟、大腦等多種組織中,可通過抑制氧化應激發揮細胞保護作用[7]。UCP2是一種線粒體負離子載體蛋白,具有調節能量代謝的作用[8]。因此,UCP2有可能是一個有效預防和治療抑郁癥的藥物作用靶點。
目前,臨床上常用的抗抑郁癥藥物均能增加突觸間單胺類神經遞質作用,如丙咪嗪、氟西汀等。但是,這些藥物或多或少存在一些不良反應,并且部分重性抑郁癥患者在一定劑量和時間內對抗抑郁癥藥物沒有反應。因此,尋找起效快、副作用小的抗抑郁癥活性先導物是非常必需的。薯蕷皂苷(dioscin,DIO)是一種天然甾體皂苷類化合物,存在于穿龍薯蕷、山藥等多種藥用植物中。近年來研究表明,薯蕷皂苷通過調控炎癥、氧化應激、細胞凋亡等保護器官損傷,對糖尿病、肥胖等代謝性疾病也有調節作用[9-10]。但是,目前未見薯蕷皂苷抗抑郁作用的相關報道。因此,本研究通過構建慢性不可預知溫和應激(chronic unpredictable mild stress,CUMS)小鼠抑郁模型來探討薯蕷皂苷抗抑郁的藥理學作用及可能的分子機制。
1 材料
1.1 實驗動物♂ SPF級C57BL/6J小鼠,體質量(20±2)g,購自遼寧長生生物技術股份有限公司,合格證號:SCXK(遼)2015-0001。所有動物實驗程序均按照相關實驗動物使用與護理條例進行,經大連醫科大學動物倫理與使用委員會批準。
1.2 藥物與試劑薯蕷皂苷純度≥98%(實驗室自制);氟西汀(fluoxetine, FLU)(上海阿拉丁生化科技股份有限公司,批號:D1823052);皮質酮(corticosterone, CORT)(批號:201903)、腦源性神經營養因子(brain-derived neurotrophic factor, BDNF)(批號:201904)和5-羥色胺(5-hydroxytryptamin, 5-HT)(批號:201903)ELISA試劑盒(江蘇酶免實業有限公司);丙二醛(malondialdehyde, MDA)(批號:20190616)、超氧化物歧化酶(superoxide dismutase, SOD)(批號:20190713)和過氧化氫酶(catalase, CAT)(批號:20190612)試劑盒(南京建成生物技術公司);組織蛋白提取試劑盒(南京凱基生物科技發展有限公司,批號:20180906);一抗UCP2、GLUT1、G6Pase、Nrf2、SOD2及二抗(HRP-GOAT anti-Rabbit)(武漢三鷹生物技術有限公司);一抗β-actin(北京博奧森生物科技有限公司)。
1.3 實驗儀器曠場實驗裝置、強迫游泳實驗裝置、懸尾實驗裝置(上海欣軟信息科技有限公司);PMOD 3.4軟件(PMOD Technology,Switzerland);酶標儀(Thermo,USA);U-3010紫外可見分光光度計(HITACHI,Japan);TE2000-U顯微鏡(Nikon, Japan);DYCZ-40D轉印電泳儀(北京市六一儀器廠);UVP凝膠成像系統(BioSpectrum系列,USA)。
2 方法
2.1 造模CUMS法造模參照文獻方法[11]并根據實驗條件進行改良:禁食24 h、禁水24 h、晝夜顛倒24 h、潮濕墊料24 h(100 g墊料加200 mL水)、抽離墊料24 h、鼠籠45°傾斜24 h、水平振蕩5 min、冰水浴4 ℃游泳5 min、溫水浴45 ℃游泳5 min、夾尾1 min、束縛(50 mL 塑料離心管中)2 h。每周隨機選擇7種刺激方式,同一種刺激不得連續出現,連續造模4周。正常組(Control)和DIO對照組(DIO Control)常規飼養,不給予任何刺激。
2.2 分組與給藥將造模成功的小鼠隨機均分為模型(Model)組、薯蕷皂苷低、中、高劑量組(20、40、80 mg·kg-1DIO)以及陽性藥組(20 mg·kg-1FLU),灌胃給藥4周,同時進行CUMS操作。正常組和模型組給予等量的羧甲基纖維素鈉(sodium carboxymethyl cellulose,CMC-Na)溶液,DIO對照組給予高劑量薯蕷皂苷(80 mg·kg-1DIO)。
2.3 行為學測試實驗開始前小鼠先進行48 h糖水適應過程,計算糖水偏好/%=蔗糖用量/(蔗糖用量+普通水用量)×100%。將小鼠置于裝有25 ℃普通水的透明圓柱體內(高20 cm、直徑12 cm)6 min,記錄最后4 min小鼠靜止時間。將小鼠尾巴用膠帶固定,頭部朝下6 min,記錄最后4 min小鼠靜止時間。將小鼠隨機置于底部分為5×5方格的黑筆白底敞箱內,記錄小鼠5 min的行動軌跡,并進行數據分析。
2.4 ELISA檢測小鼠眼球取血,血液放置30 min后離心(3 500 r·min-1) 10 min后取其上清,-80 ℃儲存,備用。小鼠斷頭取腦置于冰盒上,快速分離出完整的腦組織,并將位于腦組織皮層下方的八字形白色組織即海馬組織分離,海馬組織和剩余腦組織分別儲存在-80 ℃(每組隨機保留兩顆完整腦組織用于組織病理學檢測)備用。血清CORT、海馬組織BDNF和5-HT含量經ELISA法檢測。
2.5 氧化應激指標檢測取“2.4”所得血清和剩余腦組織,按照試劑盒說明書檢測血清MDA、SOD和剩余腦組織CAT含量。
2.6 組織病理學檢查將完整的腦組織置于10%甲醛溶液中浸泡固定,制成蠟塊并切成5 μm的薄片,按照HE和Nissl方法染色,最后置光學顯微鏡下觀察。
2.7 正電子發射計算機斷層顯像(PET)實驗小鼠禁食12 h,通過鼻錐吸入含1.5%異氟醚和98.5%氧氣的混合氣體(流速1 L·min-1)麻醉。尾靜脈1次性注射14.8~18.5 MBq 18F-fluorodeoxyglucose(18F-FDG)示蹤劑200 μL,室溫45 min后進行掃描[12],并對其結果進行數據分析。
2.8 Western blot分析取適量剩余腦組織,按照組織蛋白提取試劑盒說明書提取總蛋白;總蛋白濃度經BCA蛋白濃度測定試劑盒測定后,PBS溶液拉平濃度,2×loading buffer(100 μL+4 μL β-巰基乙醇)進行變性;配制適當比例的SDS-PAGE凝膠進行電泳后,采用濕轉轉膜法進行轉膜,5%的脫脂牛奶封閉,室溫2 h,然后放入一抗中孵育,4 ℃過夜;次日,PVDF膜用TTBS洗滌后放入對應的二抗中孵育,室溫2 h,然后按照ECL發光試劑盒的操作說明,觀察并拍照。圖像分析采用Gel-Pro Analyzer專業圖像分析軟件。
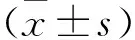
3 結果
3.1 薯蕷皂苷對抑郁小鼠行為的影響如Fig 1A所示,與模型組相比,薯蕷皂苷或氟西汀給藥后明顯提高抑郁小鼠的糖水偏好(P<0.05),改善抑郁小鼠的快感缺失狀態,其中80 mg·kg-1薯蕷皂苷效果最為明顯(P<0.01)。如Fig 1B-C所示,與模型組相比,薯蕷皂苷給藥后抑郁小鼠在強迫游泳實驗和懸尾實驗中的不動時間分別由(173.2±8.326) s、(162.6±6.575) s降低至(101.9±11.25) s、(97.38±11.13) s,顯著改善抑郁小鼠的絕望行為(P<0.01)。在曠場試驗中,薯蕷皂苷給藥后明顯增加抑郁小鼠在中心區域的活動距離(P<0.05),改善抑郁小鼠的焦慮行為(Fig 1D-E)。
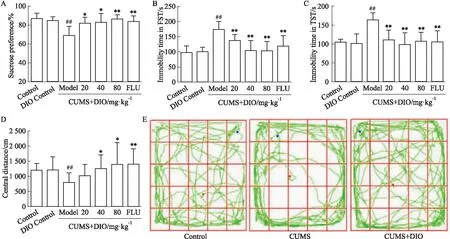
Fig 1 Effects of DIO on behavior of depressed mice
3.2 薯蕷皂苷對抑郁小鼠海馬組織CORT、BDNF和5-HT含量的影響如Fig 2A所示,與對照組相比,模型組小鼠血清CORT含量由(110.9±4.959) μg·L-1增加至(152.2±12.28) μg·L-1,薯蕷皂苷給藥后降至(123.3±5.543) μg·L-1。與對照組相比,模型組小鼠海馬組織內BDNF和5-HT含量分別由(5.777±0.176) ng·鮮重(g)-1、(1.591±0.053) μg·鮮重(g)-1降至(4.963±0.092) ng·鮮重(g)-1、(1.215±0.043) μg·鮮重(g)-1;與模型組相比,薯蕷皂苷給藥后小鼠海馬組織內BDNF和5-HT含量分別增加至(5.404±0.184) ng·鮮重(g)-1、(1.429±0.062) μg·鮮重(g)-1(Fig 2B-C)。
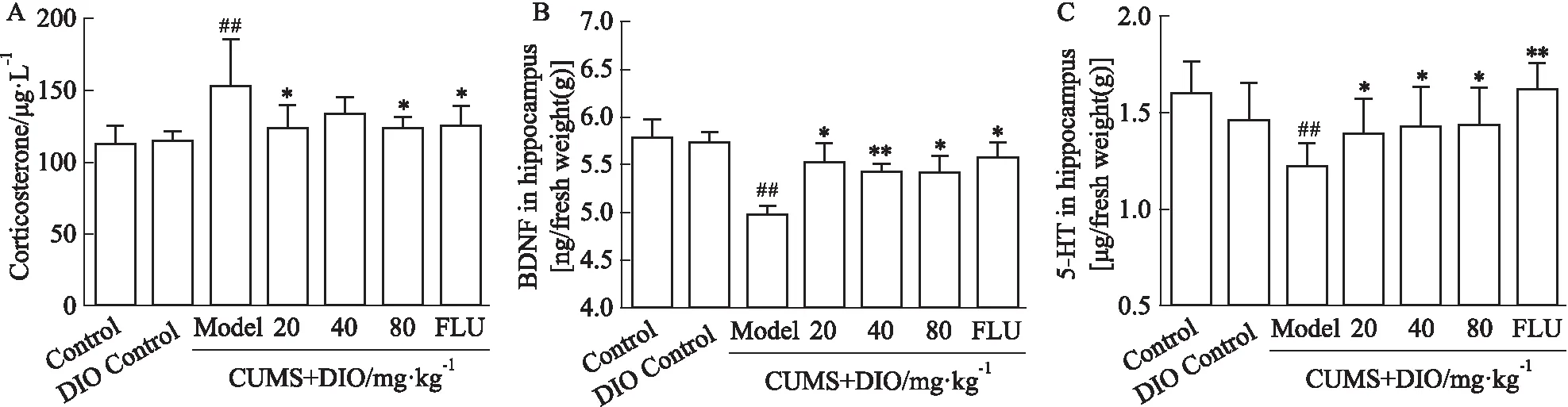
Fig 2 DIO improved levels of CORT, BDNF and 5-HT of depressed mice
3.3 薯蕷皂苷對抑郁小鼠MDA、SOD和CAT水平的影響Fig 3A表明,與對照組相比,模型組小鼠血清中MDA含量由(4.810±0.519 5) μmol·L-1升高至(17.49±1.569) μmol·L-1;與模型組相比,薯蕷皂苷或氟西汀給藥后明顯降低MDA含量。如Fig 3B-C所示,模型組小鼠血清中SOD和腦組織中CAT的含量相對于對照組明顯降低(P<0.01),薯蕷皂苷給藥后SOD和CAT的含量分別增加至對照組水平。
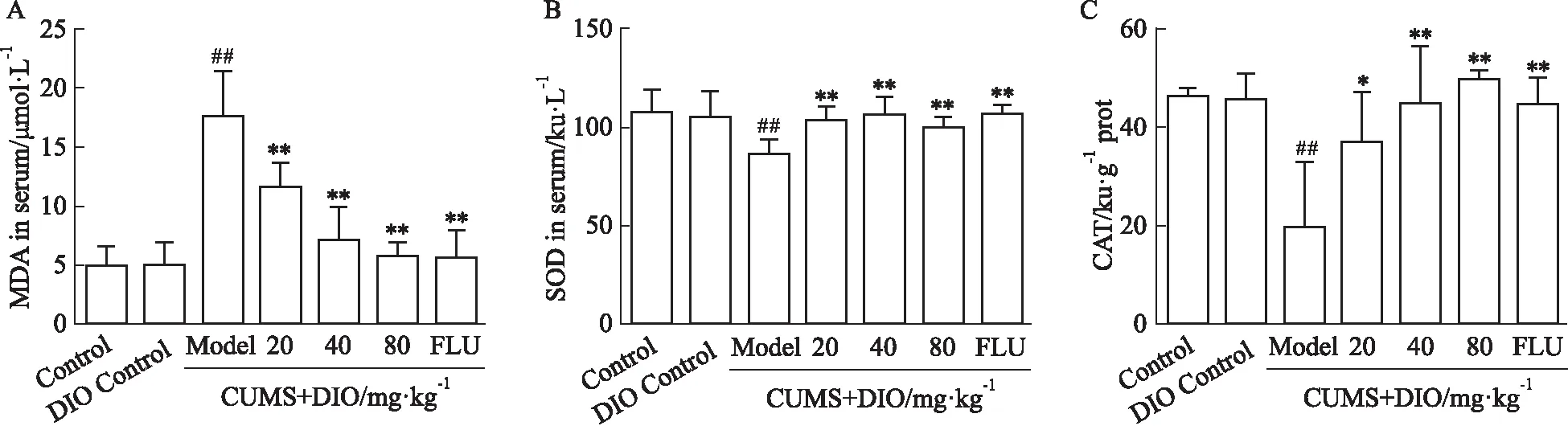
Fig 3 Effects of DIO on levels of MDA, SOD and CAT of depressed mice
3.4 薯蕷皂苷對抑郁小鼠腦組織病理的影響由HE染色結果可知,模型組小鼠腦組織海馬CA1區出現部分脂肪變性,而薯蕷皂苷或氟西汀給藥能改善此癥狀(Fig 4A)。Nissl染色結果如Fig 4B所示,模型組小鼠大腦皮層(Cortex)神經元胞質染色淺,海馬CA1區神經元排列紊亂、松散;不同劑量薯蕷皂苷或氟西汀給藥后,小鼠大腦皮層神經元胞質染色變深,海馬CA1神經元排列相對有序。
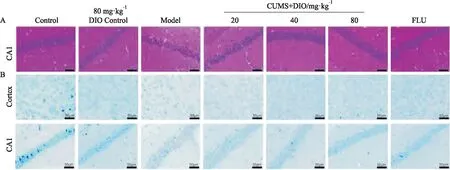
Fig 4 Effects of DIO on histopathology of brain tissues of depressed mice
3.5 薯蕷皂苷對抑郁小鼠大腦各區域18F-FDG的標準攝取值的影響對小鼠大腦各區域18F-FDG的標準攝取值(SUV)進行統計,與對照組相比,抑郁小鼠海馬、杏仁體、紋狀體、下丘腦和中腦區域SUV值明顯降低(P<0.05),薯蕷皂苷給藥后這些區域的SUV值明顯上升(P<0.05) (Fig 5)。
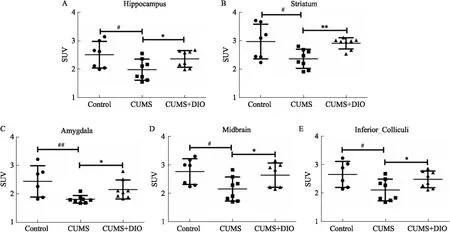
Fig 5 Changes of SUV values (B) in various brain regions of depressed mice
3.6 薯蕷皂苷對抑郁小鼠UCP2信號通路相關蛋白表達的影響如Fig 6A所示,與對照組相比,模型組小鼠腦組織內UCP2蛋白表達水平降低了6.2倍;薯蕷皂苷給藥后UCP2蛋白表達水平增加至模型組的3.8倍。Fig 6B結果顯示,與模型組相比,薯蕷皂苷給藥后Nrf2和SOD2蛋白表達水平分別增加9.0倍和1.3倍。Fig 6C結果顯示,與對照組相比,模型組小鼠腦組織內GLUT1和G6Pase蛋白表達水平分別增加1.5倍和2.7倍;薯蕷皂苷給藥后GLUT1和G6Pase蛋白表達水平分別降低下調至模型組的0.17倍和0.14倍。
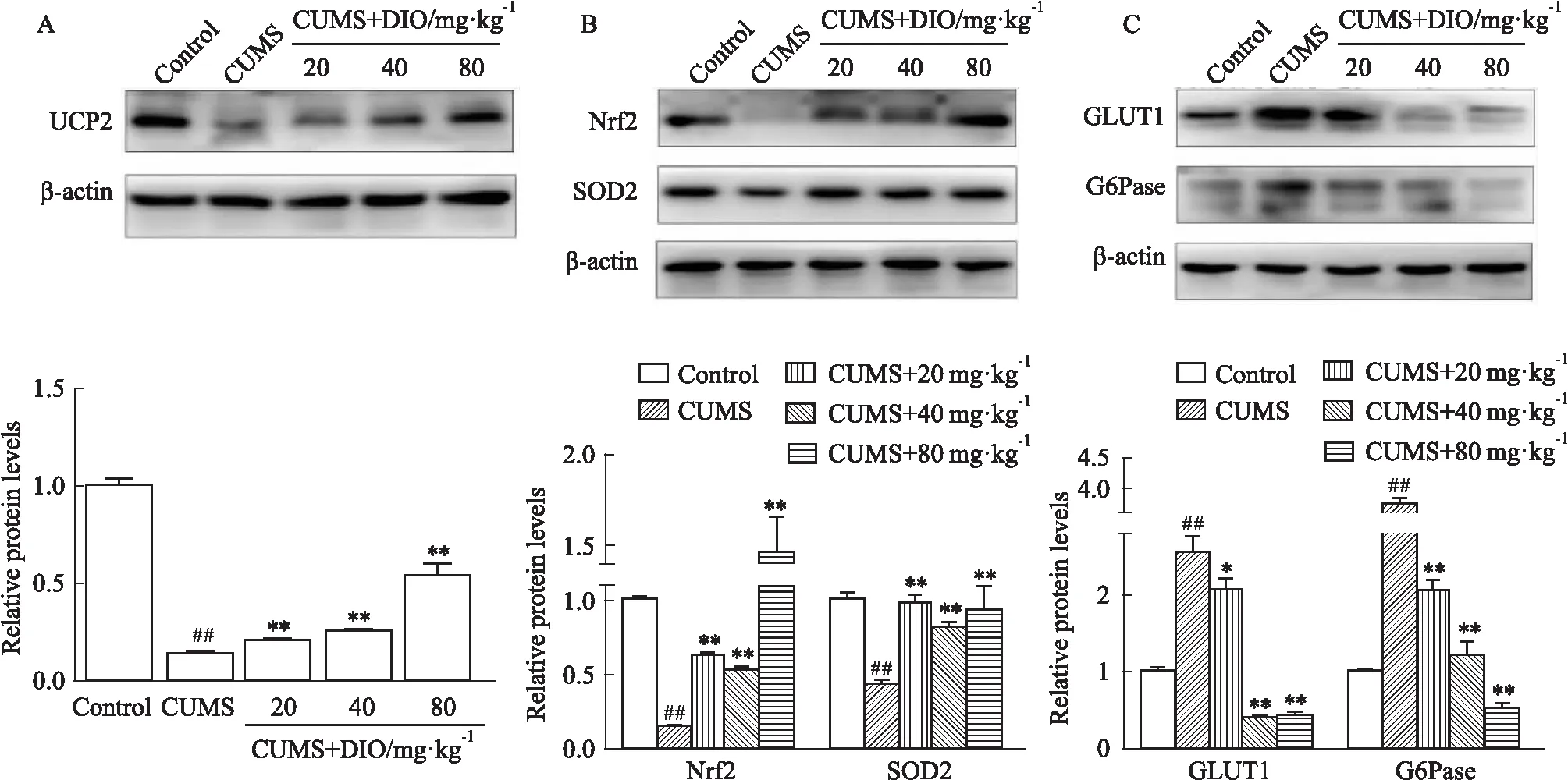
Fig 6 Effects of DIO on UCP2 signaling pathway in brain tissues of depressed mice
4 討論
抑郁癥的患病率和死亡率伴隨著人們的心理壓力和精神壓力的增加而增加。CUMS模型模擬了人們在日常生活所遭遇的不良環境,具有重復性、有效性、連續性等特點[13]。臨床上對于抑郁癥的治療方法多樣,但藥物治療一直是最主要手段。因此,尋找新的抗抑郁活性先導物是必不可缺的。
薯蕷皂苷通過提高海馬區5-HT水平,增強血清素能系統產生抗抑郁作用[14]。研究證明百合地黃湯有抗抑郁作用,其有效成分之一就是薯蕷皂苷[15]。本研究發現,薯蕷皂苷可以顯著改善抑郁小鼠的抑郁樣行為,也能提高抑郁小鼠海馬組織內BDNF和5-HT含量,降低血清CORT含量,對抑郁小鼠大腦的病理狀態也有改善作用。
細胞內活性氧(reactive oxygen species, ROS)的主要來源是線粒體,而在線粒體內膜發現的解偶聯蛋白(UCP)中,UCP2表達最為廣泛,并在控制細胞ROS的產生中發揮關鍵作用[16]。研究發現UCP2的缺失可能促進ROS的積累,從而誘導氧化損傷[17]。除此之外,UCP2及其控制產生的ROS與下丘腦神經元群的活動有關,這些神經元群參與能量和葡萄糖穩態的控制[8]。研究發現,氧化應激和能量代謝在抑郁癥的發生發展中占據著舉足輕重的作用[17-18]。本課題組前期已有研究證明,薯蕷皂苷能通過氧化應激和能量代謝過程調整多種疾病,如心血管疾病、非酒精性脂肪肝、二型糖尿病等。本研究發現,薯蕷皂苷明顯降低抑郁小鼠血清中MDA含量,顯著升高抑郁小鼠血清中SOD含量和腦組織中CAT含量。同時,薯蕷皂苷能改善抑郁小鼠大腦能量代謝,明顯增加抑郁小鼠腦組織UCP2、Nrf2、SOD2和G6Pase蛋白的表達,降低GLUT1蛋白的表達。因此,薯蕷皂苷發揮抗抑郁作用可能與其參與氧化應激和能量代謝的過程有關。
綜上,薯蕷皂苷能改善由CUMS誘導的小鼠抑郁樣行為,發揮抗抑郁作用,此過程可能是通過UCP2介導的氧化應激和能量代謝過程進行的。