濃度對數圖的精確繪制與應用解析
李海斌,謝發之,馮紹杰,王穎,陳欣怡,王亞琴
濃度對數圖的精確繪制與應用解析
李海斌1,2,謝發之1,2,馮紹杰1,2,王穎1,2,陳欣怡2,王亞琴1,2
(安徽建筑大學 1. 功能分子設計與界面過程重點實驗室,2. 材料與化學工程學院,安徽 合肥 230601)
為準確繪制濃度對數圖,利用分布分數獲取酸堿溶液理論數據,以Excel與Origin軟件為工具繪制濃度對數圖,并應用其判斷酸堿組分組成,求算溶液平衡濃度,計算溶液pH,確定酸堿滴定終點誤差.結果表明,酸性條件下對溶液中酸性分子產生促進作用,但堿性條件下會產生抑制作用.采用濃度對數圖計算平衡濃度具有直觀、準確的特點,其不僅可以計算純酸堿溶液與兩性物質溶液pH,而且可以計算混合酸堿溶液pH.在確定酸堿滴定終點誤差方面,應用濃度對數圖為理論計算提供了簡捷途徑.
圖解法;濃度對數圖;平衡濃度;pH;酸堿滴定
濃度對數圖是以pH為橫坐標,不同組分lg為縱坐標的關系圖.采用濃度對數圖解決實際問題的方法稱為對數圖解法.對數圖解法可以判斷溶液中存在的主次要組分,求算溶液平衡濃度,計算溶液pH,確定酸堿滴定終點誤差等.處理酸堿平衡問題時,采用代數法求解需解高次方程,其數學處理過程十分復雜[1].若采用對數圖解法解決酸堿平衡問題,則具有簡便、直觀等優點.由于現階段繪制的濃度對數圖是根據允許誤差的大小,忽略次要酸堿組分繪制的,其繪圖的準確性、美觀性與系統性仍有待商榷,并且濃度對數圖的應用均是基于近似關系解決實際問題[2].因此,研究濃度對數圖的精確繪制與應用具有重要理論價值.
為準確繪制濃度對數曲線的彎曲部分,龍文清[3]提出了繪制濃度對數圖中任意2條直線與加合線的統一依據,但其繪制的方法仍缺乏理論系統性.為提高濃度對數圖繪制準確性,徐斌[4]等系統討論了濃度對數圖解法中校正線的繪制方法與校正原則,并提供了濃度對數圖解法校正值表,但是校正因素判斷與準確繪圖依然不易操作.鐘國輝[5]采用濃度對數圖計算兩性物質的pH,盡管避免了采用代數法解高次方程難題,但是其準確性是否滿足要求則需要系統論證.陳中勝[6]等根據pH對檸檬酸離子形態的百分率分布圖,繪制了Y3+-Ti4+-檸檬酸-H2O體系溶解度等溫線,為制備燒綠石Y2Ti2O7納米晶提供了適宜的理論pH條件.隨著計算機技術的發展,濃度對數圖方面需要解決2個主要問題,繪制準確與美觀的濃度對數圖,以及采用準確的濃度對數圖系統解決化學方面的基礎理論問題.因此,現階段研究濃度對數圖仍具有重要意義.
利用分布分數計算濃度對數數據,以Excel,Origin軟件為工具繪制濃度對數圖,并應用其判斷酸堿組分組成,判斷溶液中存在的主次要組分,求算溶液平衡濃度,計算溶液pH,確定酸堿滴定終點誤差,以期提高濃度對數圖繪制的準確性,為濃度對數圖的應用研究奠定理論基礎.
1 研究方法
以Excel,Origin軟件為工具,繪制濃度對數圖的步驟見圖1.其主要包含3個步驟,分別是根據pH計算氫離子濃度,根據解離常數與氫離子濃度計算分布分數,根據分布分數與濃度的乘積取對數繪制濃度對數圖.其中,解離常數根據文獻[7]查表獲取,且解離常數數據獲取條件為25 ℃,=0.分布分數公式參照文獻[8]進行計算,再根據繪制的濃度對數圖解析其應用.
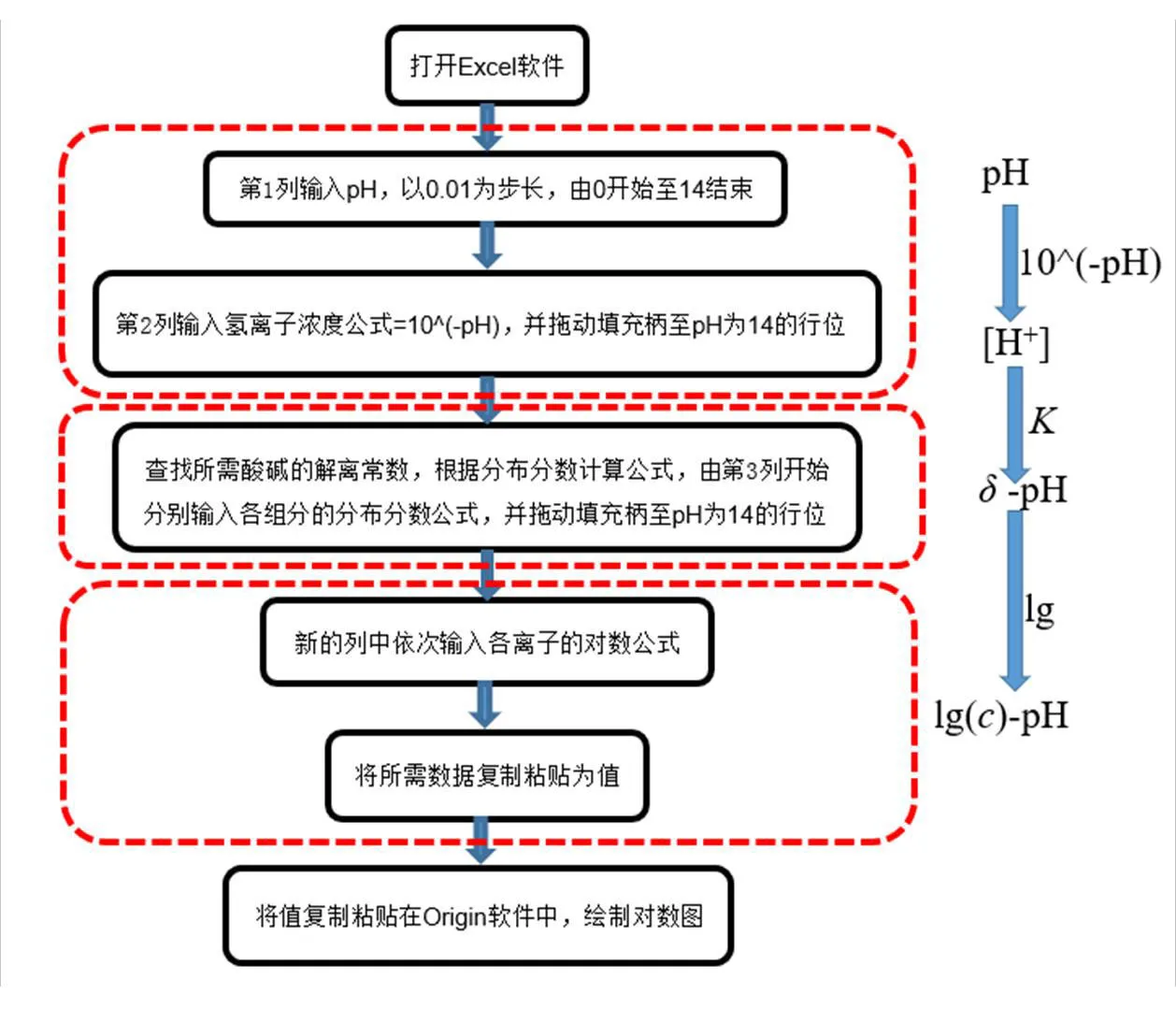
圖1 繪制濃度對數圖的步驟
2 結果與討論
2.1 判斷酸堿組分組成
為判斷HCl(aq)中和滴定Na2CO3(aq)過程中溶液酸堿組分變化,通過繪制H2CO3的濃度對數圖(見圖2)予以解決.0.01 mol/L的H2CO3(aq)濃度對數圖見圖2a.由圖2a可見,當溶液滴定至pH為12.00時,溶液中含H2CO3,HCO3-,CO32-,主要為CO32-;當溶液滴定至pH為8.00時,溶液中含H2CO3,HCO3-,CO32-,主要為HCO3-;當溶液滴定至pH<4.00時,溶液中含H2CO3,HCO3-,主要為H2CO3.圖示結果顯示,H2CO3的pa1,pa2分別為6.38,10.25,當pH
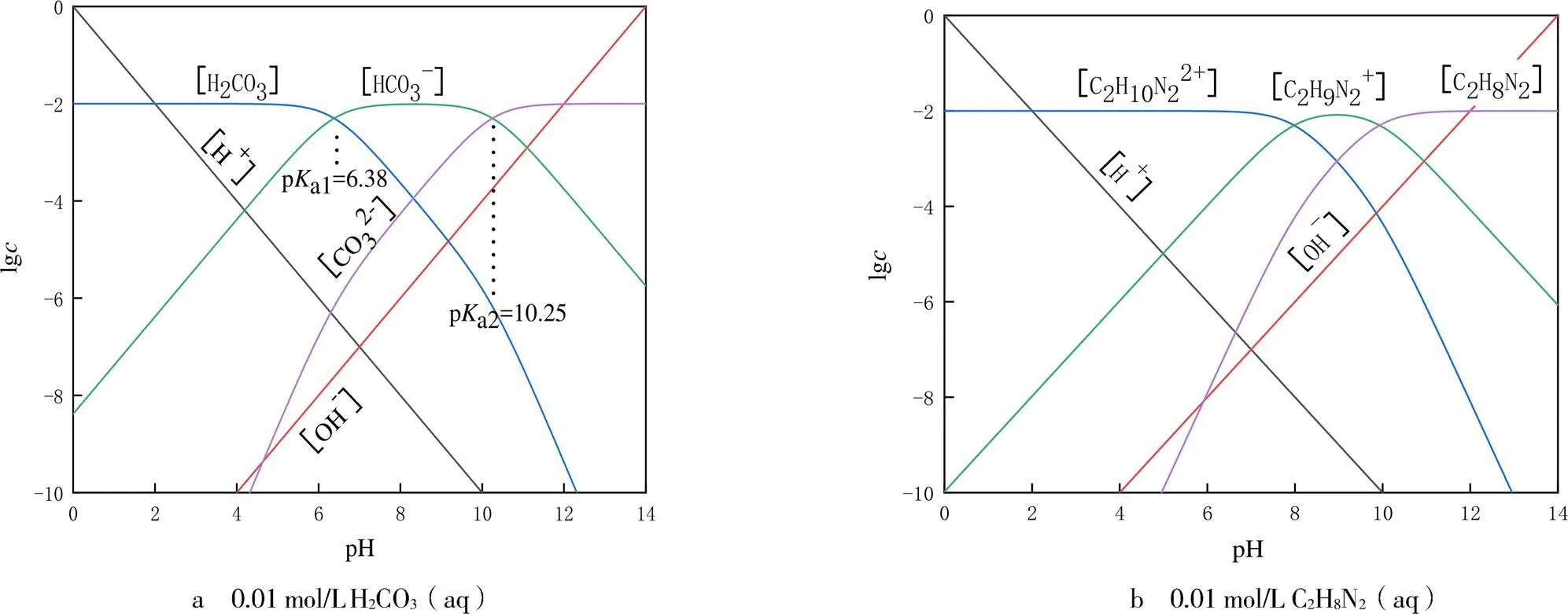
圖2 判斷酸堿組分組成的濃度對數圖
2.2 計算平衡濃度
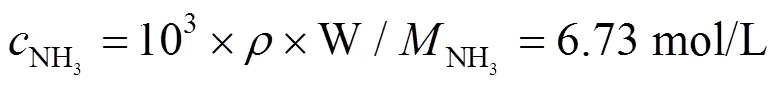
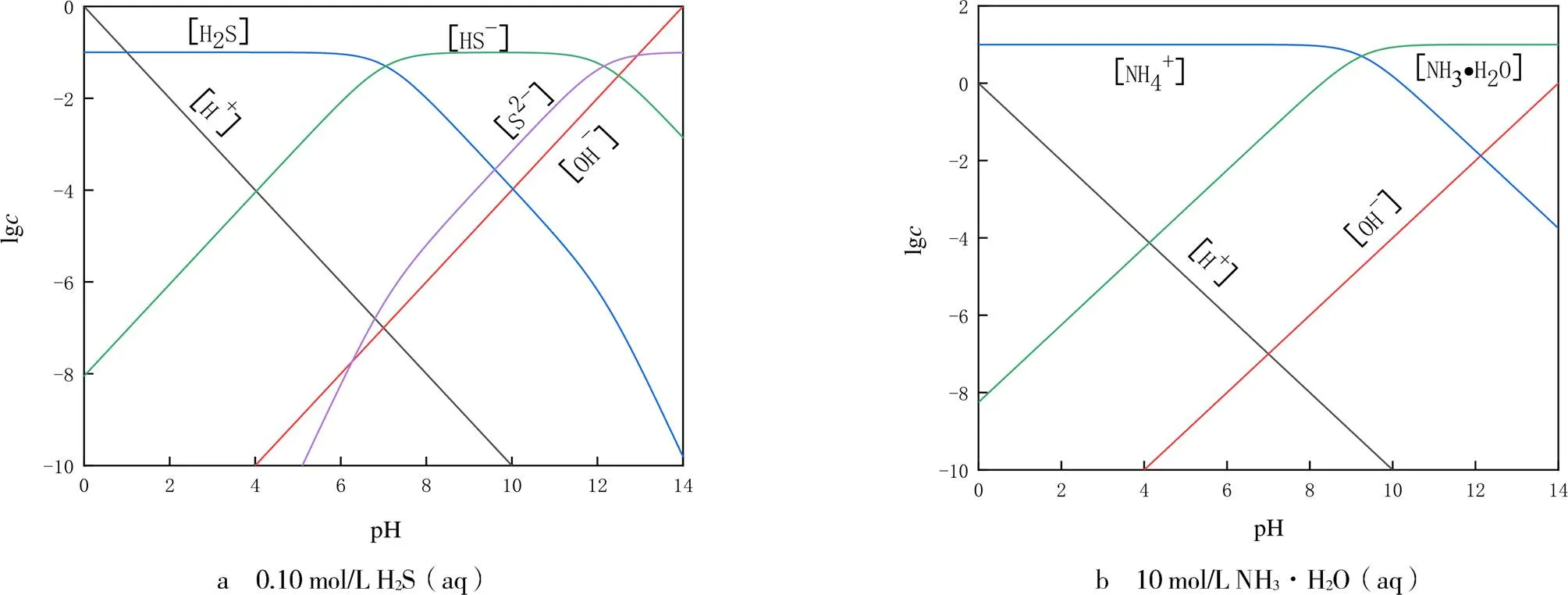
圖3 計算平衡濃度的濃度對數圖
2.3 計算pH
0.01 mol/L一元弱酸至多元弱酸的濃度對數圖見圖4.由圖4可見,濃度相同時,4種酸的酸度由強到弱依次為EDTA、草酸、砷酸、甲酸,且不同酸溶液隨濃度增大而酸性逐漸增強.原因是電解質的解離常數越大,其在水溶液中酸性越強.根據圖示計算方法,計算不同濃度條件下4種酸溶液的pH(見表1).不同濃度的同種酸性溶液,濃度越高則pH越小.相同濃度的不同酸性溶液,一級解離常數越大則pH越小,相比柳青[10]等采用簡易通用計算方法計算多元弱酸堿溶液pH,采用濃度對數圖來計算pH可以提高計算的準確性.
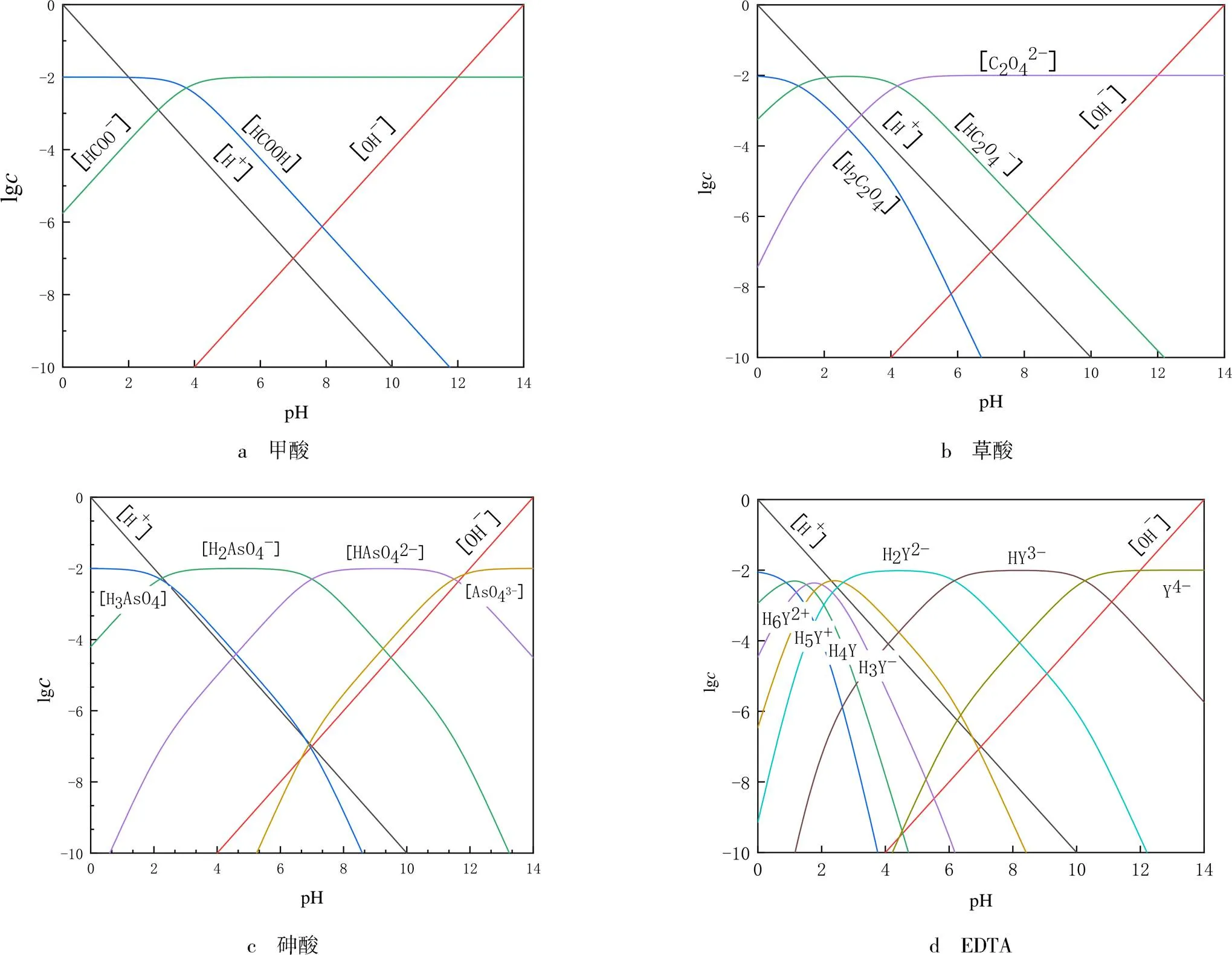
圖4 0.01 mol/L酸溶液濃度對數圖

表1 不同濃度條件下弱酸溶液pH計算結果
2.4 確定酸堿滴定終點誤差
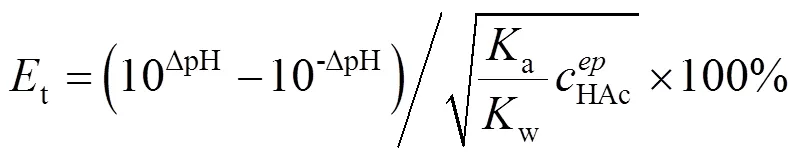
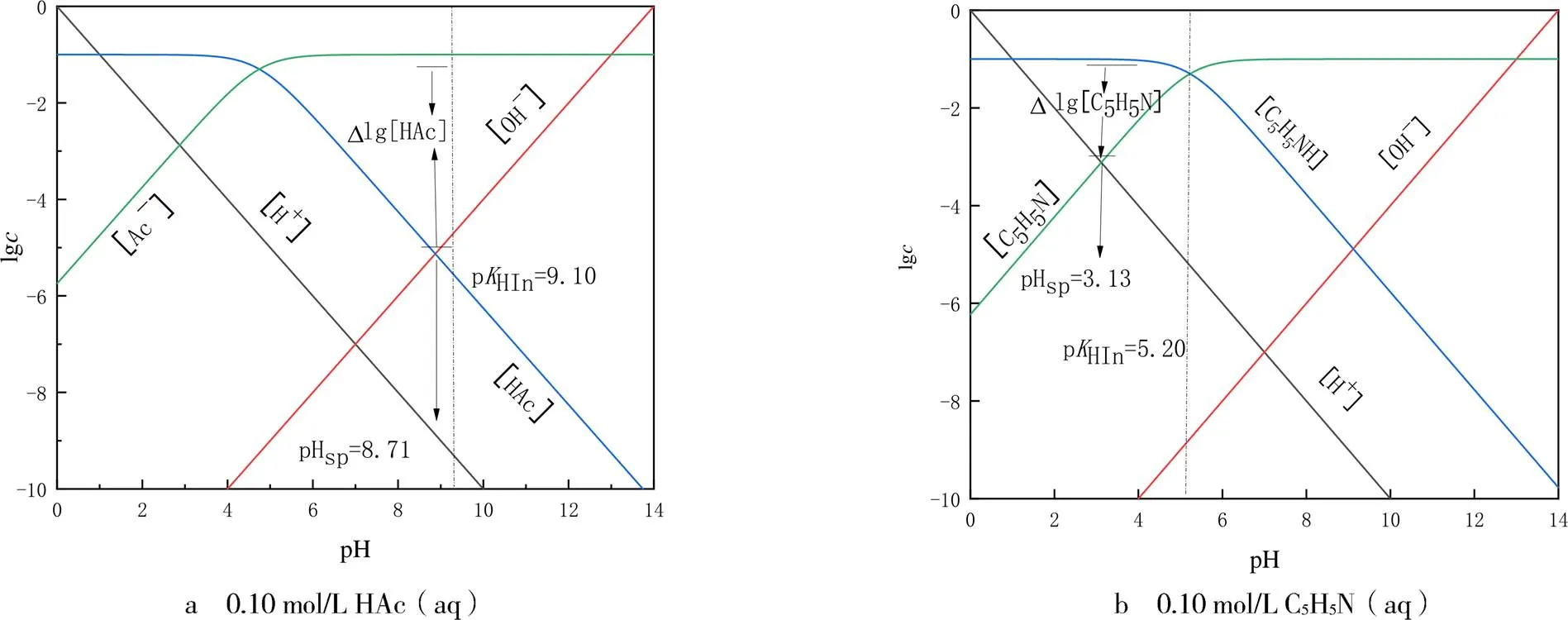
圖5 確定酸堿滴定終點誤差的濃度對數圖
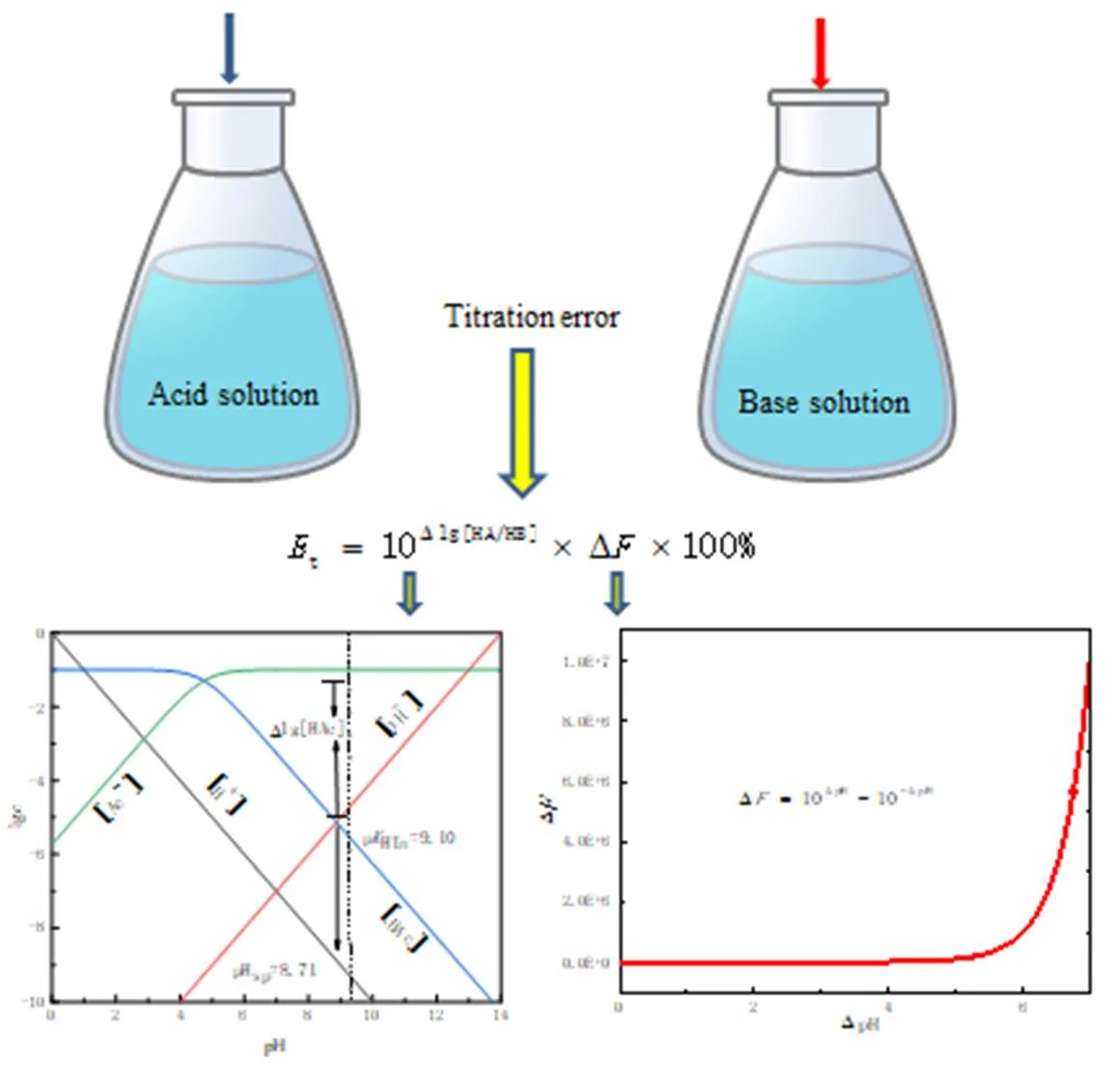
圖6 計算滴定誤差的步驟
3 結論
濃度對數圖可以判斷酸堿溶液組成,不僅是定性分析其組成,而且可以定量分析其所存在的含量.根據濃度對數圖可以獲取不同pH條件下各組分的變化規律,且濃度對數圖計算平衡濃度具有直觀、準確的特點,克服了平衡分析法過程繁瑣的缺點.濃度對數圖不僅可以計算純酸堿溶液與兩性物質溶液的pH,而且可以計算酸堿溶液混合后的pH.采用濃度對數圖可以計算強(酸)堿滴定弱(堿)酸的誤差,也可以計算強(酸)堿滴定多元弱(堿)酸與混合液的終點誤差,為計算酸堿滴定終點誤差提供了簡捷途徑.
[1] 李海斌,謝發之,馮紹杰,等.精確計算弱酸溶液中氫離子濃度[J].高師理科學刊,2021,41(5):61-65.
[2] 陳玲然,張懋森.在濃度對數圖上確定酸堿體系狀態的新方法[J].中國科學技術大學學報,1988,18(3):116-118.
[3] 龍文清.濃度對數圖中直線加合線繪制的新方法[J].井岡山師范學院學報,1994(6):8-12.
[4] 徐斌,劉莉.濃度對數圖解法中的校正值[J].大學化學,2000,15(5):22-25.
[5] 鐘國輝.利用濃度對數圖解法計算兩性物質溶液的pH值[J].西北農業大學學報,1996,24(5):103.
[6] 陳中勝,肖雙喜,許劍平,等.溶膠-凝膠法制Y2Ti2O7的前驅體溶液pH范圍的計算[J].東華理工大學學報(自然科學版),2017,40(2):185-190.
[7] 武漢大學.分析化學[M].6版.北京:高等教育出版社,2016:392-393.
[8] 李海斌,謝發之,王穎,等.-pH曲線的繪制及其在環境分析中的應用[J].高師理科學刊,2020,40(3):77-82.
[9] 商少明,劉瑛,汪云,等.無機及分析化學[M].3版.北京:化學工業出版社,2017:59-60.
[10] 柳青,王海水.多元弱酸(堿)溶液pH的簡易通用計算方法[J].大學化學,2016,31(11):89-92.
[11] 喬成立.一元強堿滴定二元弱酸的林邦滴定曲線方程及pHsp計算[J].大學化學,2016,31(2):29-33.
[12] 周權.利用濃度對數圖確定酸堿滴定的終點誤差[J].安徽師大學報(自然科學版),1998,21(2):88-92.
Accurate drawing and application of the logarithm graphic of concentration
LI Haibin1,2,XIE Fazhi1,2,FENG Shaojie1,2,WANG Ying1,2,CHEN Xinyi2,WANG Yaqin1,2
(1. Key Laboratory of Functional Molecule Design and Interface Process,2. School of Materials and Chemical Engineering,Anhui Jianzhu University,Hefei 230601,China)
In order to accurate drawing of the logarithm graphic of concentration,the theoretical data of acid-base solution was calculated by distribution fraction.A mathematical method of the logarithm graphic of concentration was established by excel and origin software,and it was used to judge the composition of acid-base components,calculate the equilibrium concentration of the solution,calculate the pH of the solution,and determine the end-point error of acid-base titration.The results show that at acidic conditions it can have a positive effect on acidic molecules in solution,but a negative effect at alkaline conditions.This method has intuitionistic and credible characteristic with calculate the equilibrium concentration.It can calculate not only the pH of pure acid-base solution and amphoteric material solution,but also consider the mixed acid-base solution.However,the logarithm graphic of concentration provides a simple and reliable method for determining the end-point error of acid-base titration.
graphical method;logarithm graphic of concentration;equilibrium concentration;pH;acid-base titration
1007-9831(2022)03-0052-06
O65
A
10.3969/j.issn.1007-9831.2022.03.011
2021-12-09
安徽省省級質量工程一般項目(2020jyxm0356);安徽省重大質量工程項目(2019rcsfjd061) ;安徽省省級線下課程項目(2020kfkc159);安徽建筑大學校級質量工程項目(2020jy46)
李海斌(1989-),男,安徽安慶人,講師,碩士,從事實驗教學與實驗室管理研究.E-mial:lihb@ahjzu.edu.cn

