白堅(jiān)木堿類二聚體在Caco-2細(xì)胞模型中的吸收機(jī)制研究
王重陽,李 潔,王夢文,陶福林,朱文濤,汪電雷
(1.安徽中醫(yī)藥大學(xué)藥學(xué)院,安徽 合肥 230012;2.肇慶學(xué)院,廣東 肇慶 526061)
白堅(jiān)木堿類生物堿是單萜吲哚生物堿家族中最為龐大的生物堿,因其潛在的細(xì)胞毒性,可以用來開發(fā)其抗腫瘤的作用[1-2]。白堅(jiān)木堿類及其白堅(jiān)木堿類二聚體,是活性的吲哚生物堿中抗腫瘤活性的基本骨架之一。最近有研究[3]從薄葉山橙中再次發(fā)現(xiàn)了新的白堅(jiān)木堿類二聚體(10-dehydroxyl-12-demethoxy-conophylline)成分,代碼命名為“wtdr-11”(見圖1),其對體外的腫瘤細(xì)胞株(HL-60,SMMC-7721、A-549、MCF-7、SW480)具有顯著的抑制作用。進(jìn)一步的研究表明,wtdr-11活性成分通過抑制Wnt信號通路(IC50=0.21、0.45 μmol/L)發(fā)揮其抗腫瘤活性[4],與微管蛋白抑制劑長春堿類成分的結(jié)構(gòu)、機(jī)制完全不同[5],這提示wtdr-11對腫瘤細(xì)胞的選擇性更好、對正常細(xì)胞的毒性更低。課題組前期采用超高效液相色譜-熒光法(ultra-high performance liquid chromatography-fluorescence,UPLC-FLR)測定wtdr-11在大鼠體內(nèi)的藥物代謝動力學(xué)[6],wtdr-11在大鼠體內(nèi)分布廣泛,主要分布在腎、肺和肝這些血流量較大的器官組織內(nèi),大鼠灌胃給藥的絕對生物利用度為11.55%,然而wtdr-11在人類結(jié)腸癌細(xì)胞系Caco-2細(xì)胞中吸收特性仍不清楚。為探究該生物堿在腸道的低生物利用度和吸收機(jī)制,本實(shí)驗(yàn)選用體外Caco-2細(xì)胞模型[7-8]模擬藥物的口服給藥途徑,考察wtdr-11在Caco-2細(xì)胞中的吸收和轉(zhuǎn)運(yùn)機(jī)制。

圖1 新的白堅(jiān)木堿類二聚體(wtdr-11)
1 材料
1.1 試藥 wtdr-11(純度>99.0%)由中國科學(xué)院昆明植物研究所提供;胰酶、二甲基亞砜、熒光黃和青霉素-鏈霉素(100 IU/mL青霉素,100 μg/mL鏈霉素):北京索萊寶科技有限公司;DMEM培養(yǎng)基(高糖):美國HyClone公司;胎牛血清(fetal bovine serum,F(xiàn)BS):德國Serana公司;漢克平衡鹽溶液(Hank’s balanced salt solution,HBSS):中國上海興科生物公司;磷酸鹽緩沖溶液(phosphate buffer solution,PBS):北京中商金橋生物公司;Transwell板:美國Corning公司;堿性磷酸酶(alkaline phosphatase,ALP)活性檢測試劑盒:上海生物科技有限公司;甲醇色譜純:德國Merck公司;實(shí)驗(yàn)水是Milli-Q超純水,其他試劑均為分析純。
1.2 儀器 5% CO2細(xì)胞培養(yǎng)箱:美國賽默飛世爾公司;倒置顯微鏡XSP-15CE:上海立光精密儀器有限公司;TDL-5低速離心機(jī):中國上海飛鴿公司;高壓蒸汽滅菌鍋LDZX-50KAS:上海三申醫(yī)療器械有限公司;電熱恒溫鼓風(fēng)干燥:上海博訊實(shí)業(yè)有限公司;熒光分光光度計(jì):日本日立公司;-20 ℃冰箱:中科美菱低溫技術(shù)有限公司;超高效液相色譜儀:美國Waters公司;Kinetex C18色譜柱(100 mm×2.1 mm,1.7 μm):美國菲羅門公司。
1.3 細(xì)胞株 人結(jié)腸癌細(xì)胞系Caco-2:賽齊上海生物工程有限公司,本實(shí)驗(yàn)所用細(xì)胞代數(shù)為10~15代。
2 方法
2.1 Caco-2細(xì)胞模型液wtdr-11定量分析方法的建立
2.1.1 色譜條件及其專屬性 UPLC色譜條件:Kinetex C18色譜柱(100 mm×2.1 mm,1.7 μm);流動相:甲醇-水(75∶25);流速:0.2 mL/min;檢測器:FLU檢測器;熒光激發(fā)波長:330 nm; 熒光發(fā)射波長:439 nm; 柱溫:25 ℃;靈敏度:0.001 AUFS,進(jìn)樣量:2 μL。在該條件下wtdr-11的色譜峰與相鄰基線分離度較好,峰形對稱。
2.1.2 wtdr-11標(biāo)準(zhǔn)曲線建立 將wtdr-11儲備液用HBSS液分別稀釋成 0.1、1、2、5、10、20 μg/mL的質(zhì)量濃度標(biāo)準(zhǔn)溶液,渦旋混合后,取上清液進(jìn)樣測定,記錄峰面積。以峰面積(Y)與質(zhì)量濃度(X)作線性回歸,計(jì)算回歸方程。
2.1.3 wtdr-11穩(wěn)定性實(shí)驗(yàn) 精密稱取wtdr-11標(biāo)準(zhǔn)品,用HBSS液稀釋成10 μg/mL,置于37 ℃恒溫水浴槽中保溫,分別于0、0.5、1、1.5、2、3 h取樣渦旋混合后,取上清液進(jìn)樣測定,記錄峰面積。
2.1.4 wtdr-11精密度實(shí)驗(yàn) 取wtdr-11線性范圍內(nèi)1、5、10 μg/mL低、中、高3個(gè)濃度的樣品,按“2.1.1”項(xiàng)下操作,每個(gè)濃度樣品制備5份,于1 d內(nèi)連續(xù)進(jìn)樣測定5次考察日內(nèi)精密度,于1 d內(nèi)進(jìn)樣測定1次,連續(xù)5 d進(jìn)樣測定考察日間精密度。
2.1.5 wtdr-11回收率實(shí)驗(yàn) 取wtdr-11線性范圍內(nèi)1、5、10 μg/mL低、中、高3個(gè)濃度的樣品,按“2.1.1”項(xiàng)下操作并記錄相應(yīng)峰面積。將wtdr-11峰面積代入標(biāo)準(zhǔn)曲線中,即得wtdr-11的實(shí)際加入的濃度,以檢測濃度與配制濃度之間的比例,計(jì)算回收率。
2.2 Caco-2細(xì)胞的培養(yǎng) Caco-2細(xì)胞在含10%(V/V)FBS、100 IU/mL青霉素和100 μg/mL鏈霉素的DMEM培養(yǎng)基中于37 ℃、5% CO2、相對濕度90%下培養(yǎng)。每隔2 d用PBS(37 ℃,pH 7.4)沖洗細(xì)胞1次,去除未貼壁細(xì)胞,加入新鮮的完全培養(yǎng)液維持細(xì)胞生長。當(dāng)培養(yǎng)瓶中細(xì)胞生長至80%~90%對數(shù)生長期時(shí),用胰酶消化液處理,按1∶3的比例傳代,本實(shí)驗(yàn)所用細(xì)胞代數(shù)為10~15代。
2.3 MTT法測定wtdr-11對Caco-2細(xì)胞毒性作用[9]用胰酶消化對數(shù)生長期的Caco-2細(xì)胞,加入完全培養(yǎng)液制成細(xì)胞懸液,以每孔5×104個(gè)細(xì)胞密度均勻接種于96孔板中,于5% CO2、37 ℃下培養(yǎng)24 h。wtdr-11預(yù)溶于DMSO中,再用DMEM稀釋成系列濃度(0.1、1、5、10、20、30 μg/mL)溶液。每個(gè)濃度設(shè)置5個(gè)復(fù)孔。細(xì)胞與wtdr-11孵育24 h后,每孔加入20 μL MTT溶液(5 mg/mL),37 ℃再孵育3.5 h。棄去上清液,每孔加入150 μL DMSO。將板低速輕輕搖動10 min,使甲瓚充分溶解,使用酶標(biāo)儀在490 nm處測量各孔的吸光度(A)值。未接種細(xì)胞的孔作為空白對照,含有細(xì)胞但無樣品溶液的孔作為陰性對照。
2.4 wtdr-11在Caco-2細(xì)胞中的攝取[10-11]
2.4.1 樣品處理方法 將細(xì)胞裂解液加入等容積的甲醇中,渦旋30 s,14 000 r/min離心10 min,取上清液進(jìn)樣分析。
2.4.2 攝取細(xì)胞模型的建立 用胰酶消化對數(shù)生長期細(xì)胞,加入完全培養(yǎng)液制成細(xì)胞懸液,以3×105個(gè)細(xì)胞密度接種在12 孔板上,于5% CO2、37 ℃下培養(yǎng)7 d。
2.4.3 時(shí)間依賴性攝取實(shí)驗(yàn) 給藥前,將各孔加入1 mL 37 ℃的HBSS溶液蕩洗細(xì)胞表面培養(yǎng)基,棄去清洗液,37 ℃孵育不同時(shí)間間隔(15、30、60、90、120、180 min)后,吸出藥液,HBSS蕩洗3次后加入500 μL Triton X-100細(xì)胞裂解液,-80 ℃反復(fù)凍融3次,得細(xì)胞裂解液,按“2.4.1”項(xiàng)處理。
2.4.4 濃度依賴性攝取實(shí)驗(yàn) 將wtdr-11溶解于HBSS中,配制濃度為2.5、5、10、15、20 μg/mL的藥物溶液。給藥前,37 ℃ HBSS溶液蕩洗細(xì)胞表面培養(yǎng)基,棄去清洗液。各孔加入1 mL不同濃度的藥物溶液37 ℃孵育60 min,HBSS蕩洗3次后加入500 μL Triton X-100細(xì)胞裂解液,-80 ℃反復(fù)凍融3次,得細(xì)胞裂解液,按“2.4.1”項(xiàng)處理。
2.4.5 pH值依賴性攝取實(shí)驗(yàn) 將wtdr-11溶于不同pH值(5,6,7.4,8)的HBSS溶液。給藥前,37 ℃ HBSS溶液蕩洗細(xì)胞表面培養(yǎng)基,棄去清洗液。各孔加入1 mL不同pH值的藥物溶液,37 ℃孵育60 min,HBSS蕩洗3次后加入500 μL Triton X-100細(xì)胞裂解液,-80 ℃反復(fù)凍融3次,得細(xì)胞裂解液,按“2.4.1”項(xiàng)處理。
2.4.6 溫度依賴性攝取實(shí)驗(yàn) 將wtdr-11溶解于HBSS中,配制濃度為20 μg/mL的藥物溶液。給藥前,37 ℃ HBSS溶液蕩洗細(xì)胞表面培養(yǎng)基,棄去清洗液。各孔加入1 mL pH為7.4濃度為20 μg/mL的藥物溶液,分別于不同溫度(4、25、37 ℃)下孵育60 min,HBSS蕩洗3次后加入500 μL Triton X-100細(xì)胞裂解液,-80 ℃反復(fù)凍融3次,得細(xì)胞裂解液,按“2.4.1”項(xiàng)處理。
2.4.7 P-糖蛋白(P-glycoprotein,P-gp)抑制劑對Caco-2細(xì)胞吸收wtdr-11的影響 給藥前,37 ℃的HBSS溶液蕩洗細(xì)胞表面培養(yǎng)基,棄去清洗液。在孔內(nèi)加入wtdr-11 (20 μg/mL)、維拉帕米(25 μg/mL)和環(huán)孢素A(10 μg/mL)藥液,并與細(xì)胞共同孵育60 min(pH為7.4,溫度為37 ℃),HBSS蕩洗3次后加入500 μL Triton X-100細(xì)胞裂解液,-80 ℃反復(fù)凍融3次,得細(xì)胞裂解液,按“2.4.1”項(xiàng)處理。
2.5 wtdr-11在Caco-2細(xì)胞中的轉(zhuǎn)運(yùn)
2.5.1 Caco-2細(xì)胞模型的建立 用胰酶消化對數(shù)生長期的Caco-2 細(xì)胞,加入完全培養(yǎng)液制成細(xì)胞懸液,以3×105個(gè)細(xì)胞密度接種在12孔Transwell板中,細(xì)胞刷狀緣側(cè)(apical,AP)加入0.5 mL細(xì)胞懸液,細(xì)胞基底側(cè)(basolateral,BL)加1.5 mL完全培養(yǎng)液,放入培養(yǎng)箱中培養(yǎng),隔天換液,重復(fù)1周,第8天開始,每天換液,培養(yǎng)至21 d。
2.5.2 Caco-2細(xì)胞模型單層膜完整性評價(jià)[12]通過檢測膜兩側(cè)ALP活性和熒光黃的透過率判斷模型是否符合轉(zhuǎn)運(yùn)實(shí)驗(yàn)要求。
Caco-2細(xì)胞膜兩側(cè)ALP活性的測定:當(dāng)Caco-2細(xì)胞培養(yǎng)至21 d時(shí),測定AP和BL側(cè)ALP的活性。用空白HBSS液小心沖洗Transwell小室的上層和下層,并37 ℃孵育20 min。收集兩側(cè)的樣品溶液,依照ALP試劑盒說明書測定Caco-2細(xì)胞兩側(cè)的ALP酶活性。
Caco-2細(xì)胞膜熒光黃透過量的測定:當(dāng)Caco-2細(xì)胞培養(yǎng)至21 d時(shí),測定Caco-2細(xì)胞中熒光黃透過量。Caco-2細(xì)胞單層用預(yù)熱37 ℃的HBSS清洗3次后,AP側(cè)加入0.5 mL 20 μg/mL熒光黃,BL側(cè)加入1.5 mL HBSS溶液,置于37 ℃,5% CO2培養(yǎng)箱培養(yǎng)2 h后,取BL側(cè)溶液0.5 mL,用熒光分光光度計(jì)檢測熒光強(qiáng)度(激發(fā)波長427 nm,發(fā)射波長536 nm),計(jì)算熒光透過率,并由公式計(jì)算熒光黃的細(xì)胞模型的表觀滲透系數(shù)(apparent permeability coefficient,Papp)。
2.5.3 wtdr-11在Caco-2單層細(xì)胞膜的雙向轉(zhuǎn)運(yùn)實(shí)驗(yàn) 實(shí)驗(yàn)前用37 ℃ HBSS液浸泡接種AP側(cè)孔30 min,吸去孔內(nèi)液體。AP→BL方向:在AP側(cè)加入含wtdr-11(20 μg/mL)的HBSS液0.5 mL,BL側(cè)加入空白HBSS液1.5 mL。置于37 ℃,以50 r/min振搖,并分別于60、90、120、180 min于下層采樣200 μL,并補(bǔ)充同容積空白HBSS液,將所取樣品按“2.4.1”項(xiàng)處理。BL→AP方向:將藥物加入BL側(cè),AP側(cè)加入HBSS液,其余步驟同“AP→BL方向”實(shí)驗(yàn)操作。

3 結(jié)果
3.1 HPLC圖譜專屬性 結(jié)果表明wtdr-11的保留時(shí)間為4.5 min,空白HBSS液和內(nèi)源物質(zhì)在當(dāng)前色譜條件下無干擾,符合樣品分析方法的檢查要求。見圖2。

注:A.Caco細(xì)胞模型HBSS液;B.wtdr-11對照品;C.含有wtdr-11的Caco-2細(xì)胞轉(zhuǎn)運(yùn)液
3.2 HPLC方法學(xué)小結(jié) HPLC測定Caco-2細(xì)胞模型中wtdr-11標(biāo)準(zhǔn)曲線為y=83 543.4x-173.28(r=0.997 3),線性范圍為0.1~20 μg/mL,在此范圍內(nèi)線性關(guān)系良好,相對回收率均>90%,日內(nèi)和日間精密度RSD<5%,且在實(shí)驗(yàn)條件下37 ℃穩(wěn)定,符合樣品分析要求。
3.3 wtdr-11對Caco-2單細(xì)胞層的毒性作用 wtdr-11對Caco-2單細(xì)胞層的毒性結(jié)果如圖3所示,在0.1~20.0 μg/mL范圍內(nèi)時(shí),細(xì)胞存活率在80%以上,后續(xù)實(shí)驗(yàn)選擇此濃度范圍進(jìn)行實(shí)驗(yàn)。

圖3 wtdr-11對培養(yǎng)24 h的Caco-2 細(xì)胞活力的影響(n=5)
3.4 wtdr-11在Caco-2細(xì)胞中的攝取
3.4.1 不同時(shí)間對Caco-2細(xì)胞攝取wtdr-11的影響 藥物以時(shí)間依賴性方式積累,wtdr-11的吸收隨時(shí)間的增加攝取率緩慢降低。因此,選擇60 min作為后續(xù)實(shí)驗(yàn)的攝取時(shí)間。見圖4。

圖4 不同時(shí)間對Caco-2細(xì)胞攝取wtdr-11的影響(n=3)
3.4.2 不同濃度對Caco-2細(xì)胞攝取wtdr-11的影響 藥物的細(xì)胞攝取隨藥物濃度線性增加,在整個(gè)研究濃度范圍內(nèi)未觀察到飽和,表明藥物攝取可能是被動擴(kuò)散[15-16]。因此,選擇20 μg/mL作為后續(xù)實(shí)驗(yàn)的劑量濃度。見圖5。

圖5 不同濃度對Caco-2細(xì)胞攝取wtdr-11的影響(n=3)
3.4.3 不同pH值對Caco-2細(xì)胞攝取wtdr-11的影響 藥物的細(xì)胞攝取量隨pH值的增加逐漸增加。經(jīng)方差分析,pH值為5時(shí),細(xì)胞對藥物的攝取與其他組比較,差異有統(tǒng)計(jì)學(xué)意義(P<0.05),其他組組間比較,差異均無統(tǒng)計(jì)學(xué)意義(P>0.05),表明弱堿性環(huán)境有利于藥物的吸收。根據(jù)人體小腸pH值的環(huán)境,選擇pH值為7.4作為后續(xù)實(shí)驗(yàn)的條件。見圖6。

注:與其他組別比較,*P<0.05
3.4.4 不同溫度對Caco-2細(xì)胞攝取wtdr-11的影響 藥物的細(xì)胞攝取量隨溫度的升高略有增加,但差異無統(tǒng)計(jì)學(xué)意義(P>0.05),表明藥物攝取與溫度無關(guān)。因此選擇37 ℃作為后續(xù)實(shí)驗(yàn)的溫度條件。見圖7。

圖7 不同溫度對細(xì)胞攝取wtdr-11的影響(n=3)
3.4.5 不同P-gp抑制劑對Caco-2細(xì)胞攝取wtdr-11的影響 環(huán)孢菌素A和維拉帕米都是選擇性P-gp抑制劑。在維拉帕米和環(huán)孢素A存在的情況下,藥物的細(xì)胞攝取沒有顯著性差異,結(jié)果表明wtdr-11可能不是P-gp底物。見表1。
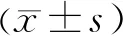
表1 環(huán)孢菌素A和維拉帕米對Caco-2細(xì)胞攝取wtdr-11的影響
3.5 wtdr-11在Caco-2細(xì)胞中的轉(zhuǎn)運(yùn)
3.5.1 Caco-2細(xì)胞模型單層膜完整性評價(jià) 使用ALP試劑盒測定Caco-2細(xì)胞兩側(cè)的ALP酶活性,AP側(cè)ALP活性比BL側(cè)ALP酶活性高約6.3倍。熒光黃透過量實(shí)驗(yàn)中,熒光黃的Papp為(6.365±0.81)×10-7cm/s,小于10-6cm/s,說明細(xì)胞膜完整性良好。
3.5.2 wtdr-11在Caco-2細(xì)胞模型中跨膜轉(zhuǎn)運(yùn)實(shí)驗(yàn) 藥物的雙向轉(zhuǎn)運(yùn)量都隨著時(shí)間的增加而增加。根據(jù)細(xì)胞模型Papp的計(jì)算公式,藥物從AP側(cè)到BL側(cè)的Papp值為58.4×10-6cm/s,從BL側(cè)到AP側(cè)的Papp值為82.8×10-6cm/s,推測藥物在小腸吸收良好[17]。隨著時(shí)間的延長,藥物總體轉(zhuǎn)運(yùn)隨時(shí)間增加,且BL側(cè)到AP側(cè)轉(zhuǎn)運(yùn)速度大于AP側(cè)到BL側(cè)。ER為1.42,表示轉(zhuǎn)運(yùn)有方向性,且小于1.5,主要屬于被動擴(kuò)散。見圖8。

注:與BL→AP 60 min組比較,*P<0.05;與AP→BL 60 min組比較,#P<0.05
4 討論
癌癥是嚴(yán)重威脅人類健康的復(fù)雜疾病,是世界科學(xué)領(lǐng)域的重要研究課題之一。作為一種新型抗腫瘤候選藥物,wtdr-11具有很強(qiáng)的抗腫瘤活性,但其口服生物利用度差(低于20%)阻礙了其臨床應(yīng)用。體內(nèi)實(shí)驗(yàn)?zāi)軠?zhǔn)確地反映藥物給藥后的吸收過程,但很難從細(xì)胞或分子水平上研究藥物的吸收機(jī)制。Caco-2細(xì)胞模型具有細(xì)胞極性,緊密連接,與小腸上皮細(xì)胞非常相似,可以研究藥物從小腸的AP側(cè)到BL側(cè)和從BL側(cè)到AP側(cè)的轉(zhuǎn)運(yùn)特征,用來表達(dá)藥物的轉(zhuǎn)運(yùn)方式,建模后需經(jīng)過細(xì)胞單層完整性評價(jià)才能進(jìn)行轉(zhuǎn)運(yùn)研究。為驗(yàn)證Caco-2細(xì)胞單層的分化程度,對ALP活性進(jìn)行檢測,結(jié)果顯示,培養(yǎng)21 d的細(xì)胞模型AP側(cè)磷酸酶活性是BL側(cè)的6.3倍,表明細(xì)胞極性分化已經(jīng)形成。此外,本研究對細(xì)胞模型的完整性進(jìn)行了評價(jià),實(shí)驗(yàn)中選用熒光黃作為滲透實(shí)驗(yàn)藥物測定了培養(yǎng)21 d的Caco-2細(xì)胞模型。從數(shù)據(jù)可知,熒光黃的Papp為6.37×10-7cm/s,小于10-6cm/s,說明此細(xì)胞完整性良好[18-20],適合進(jìn)行藥物轉(zhuǎn)運(yùn)實(shí)驗(yàn)。本實(shí)驗(yàn)以Caco-2細(xì)胞模型研究wtdr-11的吸收與轉(zhuǎn)運(yùn)機(jī)制,在攝取試驗(yàn)中,攝取時(shí)間盡量選擇攝取速度大的時(shí)間段,因此選擇60 min作為攝取時(shí)間。細(xì)胞對藥物攝取量在2.5~20.0 μg/mL范圍內(nèi)隨著濃度增加而增加,并且在實(shí)驗(yàn)范圍并未有飽和現(xiàn)象,提示攝取方式很可能是被動擴(kuò)散,因此選取20 μg/mL為后續(xù)實(shí)驗(yàn)的濃度。在溫度的影響因素中,攝取量無顯著影響,因此選擇37 ℃的人體溫度為實(shí)驗(yàn)條件進(jìn)行實(shí)驗(yàn)。在不同pH值影響的實(shí)驗(yàn)結(jié)果中,隨著pH值的升高,藥物的攝取量也逐漸增加,表明在堿性環(huán)境下可能有利于wtdr-11的細(xì)胞攝取。但考慮到人小腸實(shí)際pH值為6.8左右,因此實(shí)驗(yàn)選擇接近此pH值的pH 7.4作為后續(xù)的實(shí)驗(yàn)條件。在P-gp抑制劑實(shí)驗(yàn)中,發(fā)現(xiàn)抑制劑對細(xì)胞攝取藥物量并沒有顯著影響。
口服制劑的腸道吸收可能涉及多種轉(zhuǎn)運(yùn)機(jī)制,包括被動擴(kuò)散、外排和攝取轉(zhuǎn)運(yùn)蛋白,以及細(xì)胞旁通路。研究表明,藥物Papp跨越Caco-2細(xì)胞單層與其在腸上皮細(xì)胞中的吸收有關(guān)。當(dāng)Papp>1×10-6時(shí),表明藥物在腸上皮細(xì)胞中吸收良好;Papp值在1×10-7~1×10-6之間,為中度吸收。然而,Papp<1×10-7表示藥物在腸道中的吸收較差。在本實(shí)驗(yàn)中,藥物的雙向轉(zhuǎn)運(yùn)量均隨時(shí)間的增加而增加,Papp(AP→BL)為58.4×10-6cm/s,Papp(BL→AP)為82.8×10-6cm/s,均大于1×10-6,表明wtdr-11在腸道內(nèi)有著較好的吸收。通常,ER值大于2的藥物的轉(zhuǎn)運(yùn)特征被認(rèn)為是轉(zhuǎn)運(yùn)蛋白介導(dǎo)的藥物轉(zhuǎn)運(yùn)的指標(biāo)。wtdr-11在Caco-2細(xì)胞間雙向轉(zhuǎn)運(yùn)的ER值小于1.5,表明該藥物的主要轉(zhuǎn)運(yùn)機(jī)制可能為被動轉(zhuǎn)運(yùn),不涉及主動外排。因此,可以推測,wtdr-11的低口服生物利用度不是由其較差的腸道吸收和轉(zhuǎn)運(yùn)蛋白P-gp的外排作用引起的。這可能與該藥物的半衰期有關(guān),藥物在體內(nèi)消除過快,或在進(jìn)入體循環(huán)前被胃腸道代謝,使藥物絕對生物利用度也隨之降低。為進(jìn)一步闡明該生物堿在腸道處置過程,可以考慮采用體內(nèi)腸灌流法和體外外翻腸囊法[21]等模型進(jìn)一步探討。本研究觀察了細(xì)胞膜屏障功能對wtdr-11的影響,進(jìn)一步闡述藥物的腸道吸收機(jī)制,為抗癌候選藥物的藥理研究提供藥物代謝動力學(xué)數(shù)據(jù)支持。

