3株具有抑菌活性的Lactobacillus plantarum在玉米青貯中的應用研究
霍瑞,周亭亭,趙景娜,王昊乾,陳永福
(內蒙古農業大學乳品生物技術與工程教育部重點實驗室農業農村部奶制品加工重點實驗室呼和浩特010018)
0 引言
為了提高青貯的發酵品質,減少有害菌生長,通常會在其發酵過程添加青貯發酵劑[1]。乳酸菌種屬、數量和活性都對飼料的品質起到至關重要的作用[2]。同型發酵乳酸菌可產大量的乳酸,降低pH,抑制細菌增殖;而異型發酵乳酸菌能產生乙酸等有機酸來抑制真菌的生長[3]。L.plantarum是同型乳酸菌,具有生長迅速和產酸能力強的特性,然而關于玉米青貯中添加L.plantarum的報道鮮少:Contreras-Govea等[4]研究發現,L.plantarum能提高全株玉米青貯蛋白質含量;L.plantarum與L.buchneri混合添加提高牧草有氧暴露穩定性[5];對玉米[6]和高粱[7]青貯也有積極作用。
本實驗室以L.plantarum IMAU80162、IMAU10585和IMAU20013為研究對象,評價單菌和復合發酵對全株玉米青貯發酵期、有氧暴露期的活菌數和發酵品質的影響,為菌株在青貯應用提供重要研究基礎。
1 材料與方法
1.1 菌種和青貯來源
供試乳酸菌包括L.plantarum IMAU80162、IMAU10585和IMAU20013均由內蒙古農業大學乳品生物技術與工程教育部重點實驗室保藏和提供。
全株玉米于秋季在呼和浩特市郊區收割,其水分含量為65%~75%,并剪成1.5×1.5×1.5 cm的小塊備用。
1.2 試劑與儀器
MRS固體培養基、孟加拉紅培養基(酵母菌和霉菌),廣東環凱微生物科技有限公司;結晶紫中性紅膽鹽瓊脂培養基,上海致化化學科技有限公司;活性炭,國藥集團化學試劑科技有限公司;葡萄糖,天津風船;硫酸銅,天津市永大化學試劑有限公司;硫酸鉀,天津市北方天醫化學試劑廠;色譜柱BEHC18(2.1×100 mm,1.7μm),waters Waters公司;可變波長檢測器(VWD);UV-1700分光光度計;自動化凱氏定氮儀,上海晟聲自動化分析儀器有限公司。
1.3 玉米青貯的調制
試驗設置5組分別為:①空白對照組;②添加IMAU80162組;③添加IMAU10585組;④添加IMAU20013組;⑤IMAU80162、IMAU10585和IMAU20013等比例添加組。將L.plantarum以1×105cfu/g的接種總量噴灑至全株玉米小塊,混合均勻后以每袋200 g分裝在錫箔紙袋并進行真空塑封,25℃發酵貯藏。貯藏0、3、42天時隨機取3袋樣品測定相應指標,第42d將剩余樣品進行有氧暴露,并置于25℃培養箱,檢測青貯溫度變化,升高2℃時取樣測定相應指標。
1.4 微生物指標的測定
將20 g玉米青貯加到含有80 g無菌生理鹽水的三角瓶中,搖床150 rmp/min搖動30 min,取0.5 mL上清液,稀釋到適合的梯度對乳酸菌、酵母菌,霉菌和大腸桿菌活菌計數,對應的培養基分別為MRS固體培養基、孟加拉紅培養基(酵母菌和霉菌)和結晶紫中性紅膽鹽瓊脂培養基。之后將樣品放置到攪拌機中,高速攪拌30 s,然后4層紗布過濾得勻漿,留樣備用。
1.5 發酵品質的測定方法
1.5.1 干物質
本實驗采用的是微波爐法[9]。稱取10 g玉米青貯放置于微波爐的塑料盤中,在高功率(600 W)條件下加熱1.5 min,稱重,重復上述操作直至前后兩次稱重相差小于0.01 g。
1.5.2 pH值及有機酸
取1.3中青貯勻漿10 mL,測定其pH值。之后將勻漿12 000 g離心15 min取上清液,過0.22μ濾膜,上機測試。
標準溶液的配制:準確稱取乳酸、乙酸對照品各3.0000 g,先在燒杯中溶解后,轉移到100 mL棕色容量瓶中,加超純水定量至刻度,分別得到30 mg/mL的儲備液。根據需要稀釋成系列標準溶液。
HPLC分析條件[10]:色譜柱:BEH C18(2.1×100 mm,1.7μm.;檢測器:可變波長檢測器(VWD);流速:0.4 mL/min;柱溫:45℃;進樣量:4μL;流動相A:水(millipore)+0.1%甲酸,流動相B:乙腈(fisher,optimicalLCMS級別,Fisher公司)+0.1%甲酸;梯度洗脫(B%):0 min(20%)-2 min(50%)-2.1 min(95%)-3 min(95%)-3.1 min(20%)-5 min(20%)。
1.5.3 可溶性碳水化合物
本實驗采用的是蒽酮硫酸法[11]。取含有4 mL的蒽酮溶液的試管(15×2.5 cm),冰上預冷10 min,將經活性炭脫色后的提取液1 mL快速加到上述試管中,振蕩10 s,再放置到冰上;所有反應液加完后,將反應試管置于沸水浴10 min,隨后在冰上靜置5 min;分光光度計(UV-1700)測定分光光度值,配制濃度分別為0.1、0.075、0.05、0.025和0 mg/mL的葡萄糖溶液重復上述操作,做標準曲線。
1.5.4 粗蛋白含量及氨態氮
準確稱取玉米青貯1±0.0002 g,送至蒸餾瓶底部,加入0.2 g硫酸銅,3.5 g硫酸鉀,10 mL濃硫酸和2顆玻璃珠,放入消化爐,240℃加熱60 min之后,升溫到400℃繼續加熱至液體呈透明藍綠色,最后用自動化凱氏定氮儀進行蒸餾、滴定[12]。
1.6 統計分析
采用SPSS18.0和Excel軟件對試驗數據進行統計分析。
2 結果與分析
2.1 全株玉米原料微生物及品質檢測
青貯前檢測原料中的乳酸菌、酵母菌、霉菌、大腸桿菌、干物質、粗蛋白、氨態氮、可溶性碳水化合物、pH值和有機酸。結果見表1,玉米原料微生物菌群豐富,可溶性碳水化合物和粗蛋白的含量適中,pH值為4.85,適合各種有益、有害菌的生長。
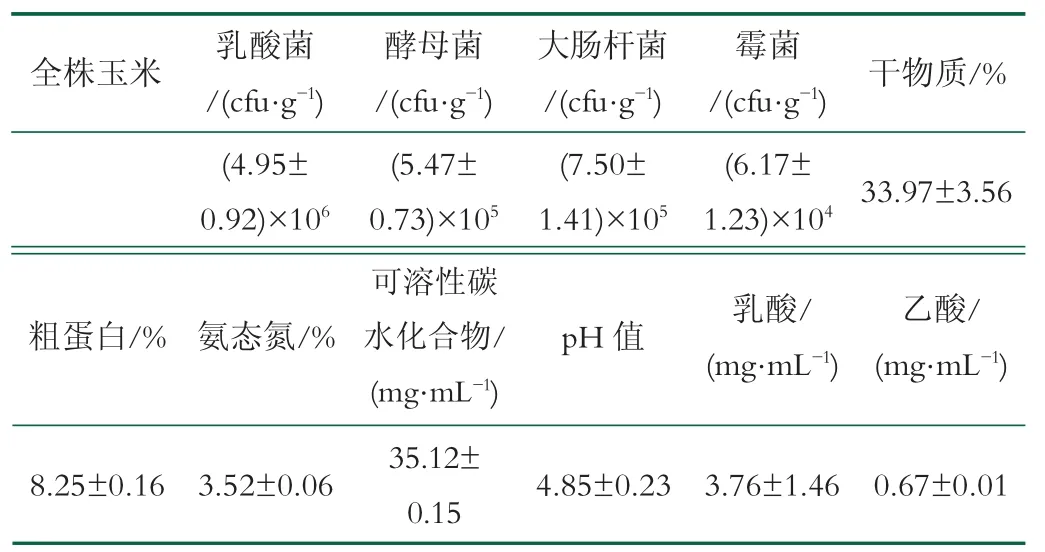
表1 青貯前全株玉米的化學成分
2.2 添加乳酸菌對青貯發酵期的影響
由表2可以看出,青貯第3天,乳酸菌的數量急劇增長。其中,IMAU10585和混菌處理組的乳酸菌活菌數達到(4.05±0.31)×108cfu/g和(3.98±0.86)×108cfu/g,明顯高于對照組(P<0.05)。此后,乳酸菌數量逐漸減少。酵母菌、大腸桿菌的數量在此時未檢出,而所有處理組的霉菌數明顯低于對照組(P<0.05)。
乳酸菌生長繁殖,代謝旺盛,產生了大量的乳酸,所有處理組乳酸含量均顯著大于對照組(P<0.05)。隨著青貯的發酵,乳酸含量逐漸積累增多。IMAU80162與對照組乙酸含量差異不顯著(P>0.05),顯著高于其他實驗組(P<0.05)。青貯飼料pH值的變化主要與有機酸的變化相關。青貯第3天時所有組的pH值均降到4.0以下,除IMAU80162外,其他組的pH值均顯著低于對照組(P<0.05)。3 d之后pH值一直保持相對穩定,IMAU10585組pH值下降最快、最低。
第42天,對照組、IMAU80162組、混菌處理組的乳酸菌活菌數比IMAU10585和IMAU20013組高,達到105數量級,如表2所示。IMAU10585、IMAU20013和混菌組的酵母菌活菌數顯著高于(P<0.05)對照組,這可能是由于耐酸酵母菌在低pH和高酸度的情況下生長繁殖造成的。發酵后期仍未檢出大腸桿菌和霉菌,證明乳酸菌的生長代謝形成的高酸環境及其產物能長時間抑制有害菌的生長。

表2 添加乳酸菌對玉米青貯發酵參數及微生物組成的影響
整個青貯期間,干物質的變化都不大,可能是由于整個發酵過程在密封的鋁箔袋中進行,水分不散失或散失較少。類似地,粗蛋白的變化在各組間不存在顯著性差異(P>0.05),整體含量略有增長,但反應蛋白質質量水平的氨態氮指標數值出現了差異性(P<0.05),說明L.plantarum的添加對蛋白質起到了一定的保護作用。可溶性碳水化合物作為乳酸菌產乳酸的原料,其含量到青貯第3天已經迅速下降,之后緩慢較少,其消耗的程度與乳酸菌活菌數的變化是一致的。
2.3 添加乳酸菌對青貯有氧暴露期的影響
如表3所示,有氧暴露期間,乳酸菌數減少,混菌處理組,IMAU800162組的活菌數明顯高于對照組(P<0.05)。接觸空氣后,各實驗組酵母菌急劇增長,對照組、IMAU800162組、混菌處理組差異不顯著(P>0.05),未檢測出大腸桿菌和霉菌。

表3 添加乳酸菌對有氧暴露期的玉米青貯發酵參數及微生物組成的影響
各組pH值均有所升高,但各組間無顯著性差異(P>0.05)。乳酸含量相較于發酵前期出現了一定程度的下降,但對照組的乳酸含量、乙酸含量顯著高于其他實驗組(P<0.05)。干物質、可溶性碳水化合物、粗蛋白的含量呈不同水平地降低,但IMAU20013組干物質和可溶性碳水化合物含量明顯高于其它組(P<0.05),分別達到32.95%和4.23 mg/mL。各組氨態氮比例增加,其中,除IMAU10585組外,其他處理組氨態氮比例明顯低于對照組(P<0.05)。
3 討論
在作物表面附生著大量的微生物,一部分是對青貯有利的,比如乳酸菌;另外一部分是有害的,比如腐敗菌、酵母菌和霉菌等[13]。實驗中的全株玉米干物質、粗蛋白含量、可溶性碳水化合物適中,pH值適合各類微生物生長繁殖,這些可能與玉米的收割季節以及種類有關[14]。
全株玉米是包括玉米果實的完整株玉米,是青貯的主要原材料,含糖量較高,有利于發酵的進行。在青貯初期,添加乳酸菌的各處理組乳酸菌總數顯著高于對照組,而酵母菌、霉菌和大腸桿菌的數量均顯著地降低了,各處理組的乳酸含量均顯著高于對照組,pH值也迅速降低至4.00以下,說明添加的各乳酸菌均能很好的定植和繁殖,并抑制有害菌的增殖。
在青貯后期,對照組和實驗組的所有樣品仍保持著低pH值環境,未檢出大腸桿菌和霉菌。但在乳酸菌、酵母菌總數方面,對照組與某些處理組差異不顯著。Hu[15]和Pedroso[16]的實驗中同樣出現了類似情況。這可能因為添加乳酸菌的總數為105cfu/g,僅為青貯前全株玉米乳酸菌數的1/50,隨著青貯原有乳酸菌的生長繁殖,添加的乳酸菌在后期并不占優勢。有學者指出,添加乳酸菌達到原料乳酸菌的2~10倍才能使添加的菌群在青貯中占據優勢地位[17-18]。
青貯研究中,乳酸與乙酸含量的比值間接反映了青貯中同型和異型發酵乳酸菌的比重[1]。如圖1所示,5組青貯飼料中,對照組和IMAU80162的比值相對較小,也就是能產生乙酸的乙酸菌、異型發酵乳酸菌相對較多。乙酸能對酵母菌產生一定抑制作用[19],這與本實驗酵母數變化是一致的。雖然酵母菌活動強烈不利于青貯飼料的發酵,但有研究[20]表明酵母菌能夠提高奶牛干物質采食量、產奶量以及消化粗蛋白和酸性洗滌纖維的能力,同時生成乙醇等,使青貯飼料具有酒香味。

圖1 乳酸與乙酸在青貯期間的含量比值變化
青貯過程中青貯飼料營養成分的變化情況,是指包括干物質、可溶性碳水化合物和粗蛋白等的變化。干物質代表著飼料的潛在可利用潛能,研究指出要獲得較好的青貯品質需要干物質濃度大于200 g/kg,干物質含量高(300~350 g/kg)的青貯玉米可以在一定程度上控制發酵造成的損失,另外牛對干物質含量低于300 g/kg的青貯玉米的消化吸收率會大量減少[21]。本實驗的各組間干物質含量變化并不顯著,且隨青貯時間的變化規律也不明顯。
可溶性碳水化合物和粗蛋白含量也是衡量谷物類青貯品質的兩大重要指標[22]。可溶性碳水化合物是乳酸菌形成乳酸的原料,只有足夠數量的可溶性碳水化合物,才有可能使乳酸菌生成足夠的乳酸,造成低pH環境,抑制或殺死有害微生物,達到形成和保存青貯飼料的目的[13]。本實驗中,雖然IMAU100585和IMAU20013組相較于其他組可溶性碳水化合物含量明顯高,但可能與這兩組乳酸菌總數偏少有關如圖2所示,而混菌處理組在保證乳酸菌數量的基礎上,可溶性碳水化合物含量仍然高于對照組和IMAU80162處理組,說明乳酸菌的添加一定程度上可以提高青貯飼料的品質。

圖2 青貯期間飼料中葡萄糖含量變化
另外,評價玉米飼料的營養品質還需看其蛋白質含量和蛋白質品質。在青貯過程中蛋白質會降解成非蛋白氮,造成氨態氮的比例增加[23]。該實驗中的蛋白質含量和氨態氮比例在青貯期并沒有顯著變化,在有氧暴露期,由圖3可見,IMAU80162組、混菌組的氨態氮明顯低于其他組,說明乳酸菌的添加可以在一定程度上保護蛋白質不被消耗。

圖3 玉米青貯中氨態氮的變化情況
4 結論
本研究中L.plantarum的添加有助于增加飼料厭氧發酵和有氧暴露后乳酸菌的數量,降低pH,減少大腸桿菌、酵母菌和霉菌等有害菌的數量,提高青貯飼料品質和有氧穩定性。其中單株IMAU80162抑制霉菌和酵母菌的效果最為顯著,它與IMAU100585,IMAU20013混合使用能有效維持青貯飼料的營養品質。但是,不同的L.plantarum及配比能否改善青貯飼料的微生物菌群及營養成分,還需要進一步的探究。

