小米綠豆醋的糖化工藝研究
文明,王毛毛,王雪婷,王如福
(山西農(nóng)業(yè)大學(xué) 食品科學(xué)與工程學(xué)院,山西 晉中 030801)
綠豆(PhaseolusradiatusL.),屬于豆科、蝶形花科(Papilionoideae)、菜豆族(Phaseoleae)、豇豆屬(Vigna)中的一個種,是溫帶地區(qū)廣泛種植的豆類之一[1]。綠豆?fàn)I養(yǎng)豐富,籽粒中蛋白質(zhì)含量高達(dá)19.5%~33.1%,明顯高于禾谷類作物,到目前為止已從綠豆中鑒定出多種化合物,如黃酮類、花青素、皂苷、植物甾醇等[2]。
小米(Setariaitalica),又稱粟米,是禾本科(Gramineae)、狗尾草屬(Setaria)植物,直徑約1 mm,屬雜糧作物,是世界上最古老的雜糧作物之一[3]。小米營養(yǎng)豐富,主要含有多酚、蛋白質(zhì)、不飽和脂肪酸和各種礦物質(zhì)等,營養(yǎng)素搭配合理,人體利用消化率高[4-5]。
食醋是一種酸性調(diào)味品,采用傳統(tǒng)發(fā)酵工藝釀造,不僅具有獨(dú)特的風(fēng)味,而且富含營養(yǎng)及多種功能因子。傳統(tǒng)食醋中的抗氧化活性成分有多酚、黃酮、蛋白黑素和川芎嗪等,可以抵抗機(jī)體的氧化應(yīng)激,具有預(yù)防心血管疾病、抗癌、抗衰老和保護(hù)肝臟的作用。隨著人們生活水平及對食醋營養(yǎng)價值、保健功能認(rèn)識的提高,單一的食醋品種已不能滿足不同層次、不同消費(fèi)者的需求。小米和綠豆除了具有豐富的蛋白質(zhì)以外還有大量的淀粉,所以其能夠作為食醋釀造的原料,由于人體在消化和吸收蛋白質(zhì)過程中,蛋白中的各種氨基酸需要合適的比例才能夠充分地被吸收和利用,而當(dāng)某種蛋白中的氨基酸不能達(dá)到這一比例時,即使食物中蛋白質(zhì)含量再高,也不能被人體充分利用[6-7]。因為賴氨酸為小米的第一限制性氨基酸[8],而綠豆的賴氨酸含量較高,基于上述理論,可以選擇綠豆作為小米蛋白利用價值的互補(bǔ)原料。
目前國內(nèi)外,對于小米和綠豆的研究大多集中在功能成分上或是某一種原料的產(chǎn)品加工上,朱文學(xué)等[9]通過超聲波輔助水提工藝提取綠豆皮中的黃酮類物質(zhì),最佳提取工藝為超聲功率419 W、超聲溫度70 ℃、超聲時間75 min、料液比1∶45(g/mL);Sharma等[10]研究發(fā)現(xiàn),小米多酚對金黃色葡萄球菌、糞腸球菌、蠟狀芽孢桿菌和腸膜明串珠菌的生長均具有抑制作用;潘潔瓊等[11]通過正交試驗對固態(tài)法小米醋釀造工藝進(jìn)行了優(yōu)化,最終釀造出的小米醋小米香味突出、酸味柔和。但是對于小米和綠豆發(fā)酵產(chǎn)品的研究還有所缺失,所以對于小米綠豆糖化液的研究顯得意義重大。在小米綠豆發(fā)酵產(chǎn)品的釀造過程中,糖化階段是一個保留功能成分和進(jìn)一步發(fā)酵的重要階段,因為在加熱蒸煮的過程中會導(dǎo)致許多功能成分的損失以及影響到微生物的生長代謝,從而直接影響后續(xù)發(fā)酵產(chǎn)品的品質(zhì),所以本試驗將對小米綠豆糖化液的制備進(jìn)行工藝優(yōu)化。
本試驗以小米、綠豆和高粱為原料,以氨基酸態(tài)氮、還原糖和總黃酮為評價指標(biāo)。通過對單因素的分析、Plackett-Burman試驗及響應(yīng)面法優(yōu)化小米綠豆的糖化工藝,旨在確定小米綠豆糖化的最佳工藝,為進(jìn)一步研究小米綠豆醋提供了理論依據(jù)。
1 材料與方法
1.1 材料與試劑
小米:產(chǎn)自山西省長治市沁縣;綠豆:產(chǎn)自山西省大同市云州區(qū);α-淀粉酶(1×105U/g);糖化酶(4×105U/g);酸性蛋白酶(1×105U/g);蘆丁標(biāo)準(zhǔn)品(純度≥98%):北京索萊寶科技有限公司。
1.2 儀器與設(shè)備
DS-1組織搗碎機(jī) 上海昂尼儀器儀表有限公司;電熱恒溫水浴鍋 上海博迅實(shí)業(yè)有限公司醫(yī)療設(shè)備廠;Starter 2C pH計 奧豪斯儀器(上海)有限公司;722型可見光分光光度計 上海舜宇恒平科學(xué)儀器有限公司。
1.3 試驗方法
1.3.1 工藝流程

1.3.2 單因素試驗
以氨基酸態(tài)氮、還原糖和總黃酮含量為指標(biāo),固定因素水平為α-淀粉酶添加量為200 U/g,液化時間為40 min,液化溫度為70 ℃,糖化酶添加量為1500 U/g,糖化時間為50 min,糖化溫度為70 ℃,加水量為300%,蛋白酶添加量為1000 U/g,高粱添加量為10%。設(shè)置單因素試驗:α-淀粉酶添加量(0,100,200,300,400 U/g)、液化時間(10,20,30,40,50 min)、液化溫度(60,70,80,90,100 ℃)、糖化酶添加量(500,1000,1500,2000,2500 U/g)、糖化時間(30,40,50,60,70 min)、糖化溫度(55,60,65,70,75 ℃)、加水量(200%、300%、400%、500%、600%)、蛋白酶添加量(100,200,300,400,500 U/g)、高粱添加量(0%、5%、10%、15%、20%)9個因素對小米綠豆糖化醪的氨基酸態(tài)氮、還原糖和總黃酮含量的影響。
1.3.3 Plackett-Burman試驗
在單因素試驗結(jié)果的基礎(chǔ)上確定各個因素的范圍,以小米綠豆糖化醪還原糖和總黃酮的綜合評分為響應(yīng)值,通過Plackett-Burman試驗從9個因素中選出對小米綠豆糖化醪有顯著影響的因素。
1.3.4 響應(yīng)面試驗設(shè)計
基于PB試驗的結(jié)果,選取α-淀粉酶添加量、液化時間、糖化酶添加量、糖化時間4個影響顯著的因素,以小米綠豆糖化醪還原糖和總黃酮含量的綜合評分為響應(yīng)值,試驗設(shè)計見表1。
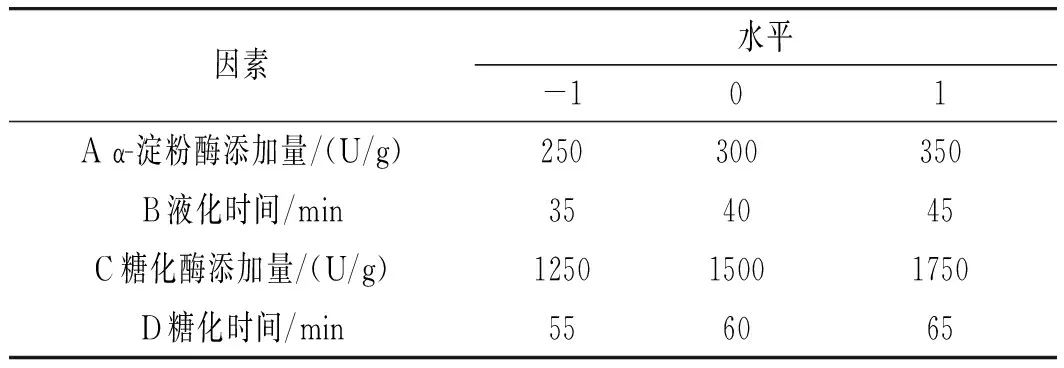
表1 響應(yīng)面試驗因素及水平Table 1 The factors and levels of response surface test
1.3.5 測定方法
還原糖含量的測定:通過3,5-二硝基水楊酸(DNS)比色法進(jìn)行測定[12]。葡萄糖標(biāo)準(zhǔn)曲線的回歸方程為:y=1.4165x-0.0386,R2=0.9966。
總黃酮含量的測定:參考GB/T 19777-2013,建立標(biāo)準(zhǔn)曲線回歸方程y=0.431x-0.0082,R2=0.9974,其中y為吸光值,x為蘆丁質(zhì)量。
氨基酸態(tài)氮含量的測定:參考GB/T 13662-2018。
1.3.6 綜合評分
小米綠豆糖化醪還原糖和總黃酮含量的綜合評分標(biāo)準(zhǔn)見表2。

表2 綜合評分標(biāo)準(zhǔn)Table 2 The comprehensive scoring standards
1.3.7 數(shù)據(jù)處理
采用Design-Expert 10以及Origin 9處理數(shù)據(jù)。
2 結(jié)果與分析
2.1 小米綠豆糖化單因素試驗結(jié)果
2.1.1 α-淀粉酶添加量、液化時間及液化溫度的確定
由圖1中a可知,隨著α-淀粉酶添加量的增加,氨基酸態(tài)氮的含量無明顯變化,還原糖與總黃酮含量逐漸增加最終趨于平緩,這是因為黃酮類物質(zhì)與α-淀粉酶可通過疏水作用、氫鍵或范德華力產(chǎn)生結(jié)合作用,其結(jié)合到酶的非活性中心部位,對α-淀粉酶表現(xiàn)出非競爭性抑制[13],隨著黃酮含量的增加,導(dǎo)致對α-淀粉酶的抑制性增強(qiáng),使得還原糖含量的增長趨于平緩。
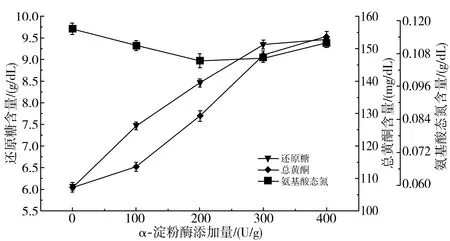
a
由圖1中b可知,液化時間對小米綠豆糖化醪的影響顯著(P≤0.05),氨基酸態(tài)氮含量則變化不明顯,總黃酮含量先升高后降低,還原糖含量在10~40 min時增長迅速,在40 min后增長平緩,主要是因為淀粉的液化過程大致分為兩個階段:最初α-淀粉酶作用于直鏈淀粉使其迅速分解,黏度快速降低;其次,再作用于支鏈淀粉產(chǎn)生葡萄糖和糊精等,同時促進(jìn)寡糖緩慢地分解為葡萄糖,從而促進(jìn)支鏈淀粉的液化,后一反應(yīng)比第一階段要慢[14],所以在40 min后還原糖含量增長逐漸平緩。
由圖1中c可知,隨著溫度的上升,氨基酸態(tài)氮含量略微下降,總黃酮含量逐漸升高而后趨于平緩,受氧化影響導(dǎo)致總黃酮含量有所下降[15]。在80 ℃時還原糖含量達(dá)到最大值,但其隨后逐漸降低,其原因是還原糖與氨基酸發(fā)生了美拉德反應(yīng)。
2.1.2 糖化酶添加量、糖化時間及糖化溫度的確定
由圖2中a可知,氨基酸態(tài)氮幾乎不受糖化酶添加量的影響。在糖化酶添加量為1500 U/g時總黃酮含量開始逐漸下降,其原因是隨著糖化酶含量的增加,逐漸將總黃酮水解為異黃酮苷[16]。在糖化酶添加量為500~1500 U/g時,還原糖含量增長迅速,在1500~2500 U/g范圍內(nèi)還原糖含量增長緩慢,原因是在糖化酶添加量低于1500 U/g時,糖化酶與底物充分反應(yīng)導(dǎo)致糖化反應(yīng)受酶添加量的影響較大,當(dāng)糖化酶含量大于1500 U/g時,糖化酶的添加量已過量,所以還原糖含量增長緩慢。

a
由圖2中b可知,在糖化前期,氨基酸態(tài)氮的含量基本不受影響,然而總黃酮含量與還原糖含量逐漸增加,但隨著時間的增加,糖化酶作用的底物濃度逐漸降低,使得還原糖含量在60 min后增長變緩,這時糖化酶則對總黃酮進(jìn)行水解,導(dǎo)致總黃酮含量下降。
由圖2中c可知,隨著溫度的逐漸升高,氨基酸態(tài)氮含量略微下降,總黃酮和還原糖含量先升高后下降,其主要原因是溫度過高導(dǎo)致糖化酶活性降低使得還原糖含量下降,受氧化影響導(dǎo)致總黃酮含量下降。
2.1.3 高粱添加量、蛋白酶添加量及加水量的確定
由圖3中a可知,隨著高粱添加量的增加,氨基酸態(tài)氮的含量逐漸減小,而總黃酮和還原糖的含量隨著高粱添加量的增加逐漸增大,原因是高粱的支鏈淀粉含量高于小米和綠豆,所以隨著其添加量的增加還原糖的含量也隨之增加,并且高粱淀粉的加入使得糊化穩(wěn)定性增強(qiáng)[17]。
由圖3中b可知,隨著蛋白酶添加量的增加,還原糖和氨基酸態(tài)氮的含量逐漸上升,總黃酮的含量先上升后趨于平緩,其作用機(jī)理是蛋白酶作用于原料中的蛋白質(zhì),使得與蛋白質(zhì)相結(jié)合的黃酮類物質(zhì)析出,導(dǎo)致氨基酸態(tài)氮和黃酮類物質(zhì)含量上升[18]。

a
由圖3中c可知,隨著加水量的增加,還原糖、總黃酮含量都先增加后減少,其作用機(jī)理是蛋白質(zhì)含有-COOH、-NH3、-OH等親水性基團(tuán),所以加水量少時導(dǎo)致小米綠豆醪液黏稠使得還原糖、總黃酮含量不易析出[19],而加水量過多會導(dǎo)致還原糖、總黃酮和氨基酸態(tài)氮濃度過低。
2.1.4 參數(shù)確定
通過對單因素結(jié)果的分析確定α-淀粉酶添加量為300 U/g,液化時間為40 min,液化溫度為80 ℃,糖化酶添加量為1500 U/g,糖化時間為60 min,糖化溫度為60 ℃,高粱添加量為15%,蛋白酶添加量為300 U/g以及加水量為原料的400%,由于氨基酸態(tài)氮在糖化階段相對穩(wěn)定,所以在后續(xù)的試驗中不再將其設(shè)置為考察指標(biāo)。
2.2 Plackett-Burman試驗確定關(guān)鍵影響因素
以小米綠豆糖化醪還原糖含量和總黃酮含量為響應(yīng)值,試驗設(shè)計及結(jié)果見表3。
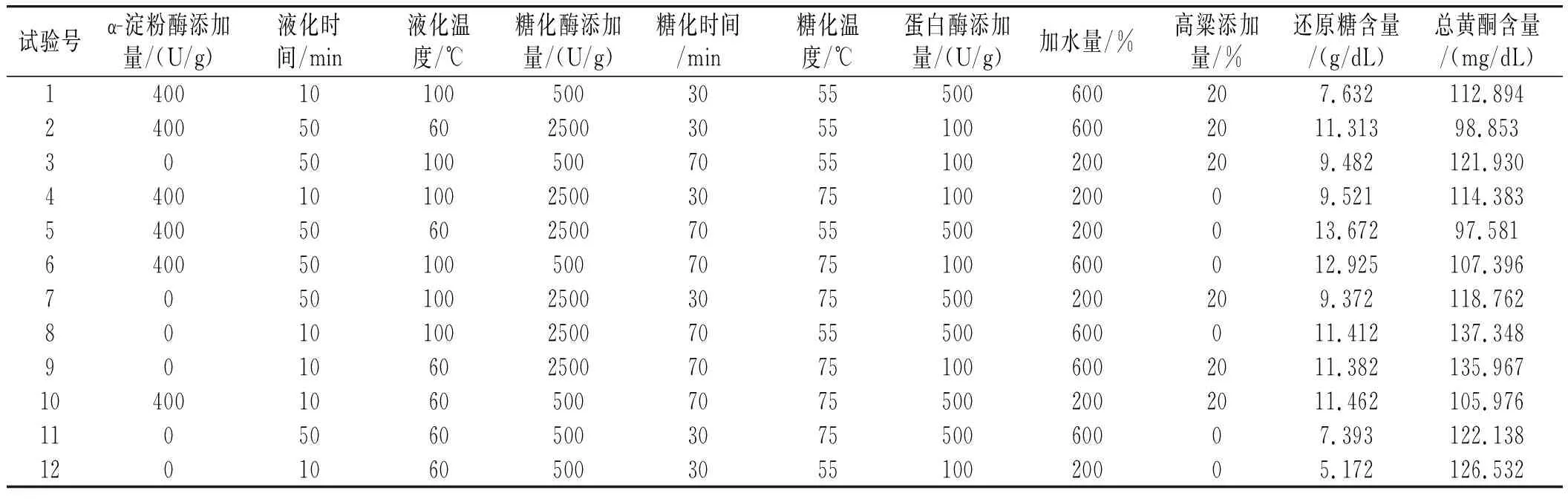
表3 Plackett-Burman試驗設(shè)計及結(jié)果Table 3 Plackett-Burman test design and results
由表3可知,分別以還原糖、總黃酮為響應(yīng)值建立回歸模型顯著。回歸模型方程為:還原糖含量=-0.20+0.005130A+0.03157B-0.00021C+0.001051D+0.08305E+0.0281F+0.000478G+0.001407H+0.0046I;總黃酮含量=115.65-0.05233A-0.2768B+0.1069C+0.000502D+0.0527E+0.0790F-0.00432G+0.01226H-0.0916I;兩模型的R2分別為0.9915,0.9954,表明模型具有統(tǒng)計學(xué)意義。
由表4可知,α-淀粉酶添加量對還原糖含量的影響顯著,對總黃酮含量的影響極顯著,液化時間對總黃酮含量的影響顯著,糖化酶添加量對還原糖含量的影響顯著,糖化時間對還原糖含量的影響極顯著。所以PB試驗篩選出主要影響因素為A α-淀粉酶添加量、B 液化時間、D糖化酶添加量和E糖化時間。
2.3 響應(yīng)面試驗結(jié)果
以小米綠豆糖化醪還原糖和總黃酮含量的綜合評分指標(biāo)為響應(yīng)值,采用Box-Behnken試驗和響應(yīng)面分析,對試驗結(jié)果進(jìn)行處理和分析,結(jié)果見表5。

表5 Box-Behnken試驗設(shè)計及結(jié)果Table 5 Box-Behnken test design and results

續(xù) 表
經(jīng)過回歸擬合后得到小米綠豆糖化醪以綜合評分為響應(yīng)值的回歸方程為:綜合評分=+88.42+2.45A+1.31B+4.69C+9.17D-0.89AB-2.62AC-2.41AD-2BC-2.09BD-0.66CD-10.02A2-9.9B2-5.45C2-6.84D2,其中R2為0.9904,表明其因變量與其他自變量之間的多元關(guān)系顯著,RAdj2和 RPred2分別為0.9807和0.9460,兩者之間的差距小于0.2,所以該模型可信,則上述回歸方程可以預(yù)測4個因素對小米綠豆糖化工藝的影響。

表6 小米綠豆糖化醪綜合評分方差分析表Table 6 Analysis of variance of the comprehensive scores of millet and mung bean saccharifying mash

續(xù) 表
由表6方差分析結(jié)果可知,該模型回歸關(guān)系顯著,各因素對其綜合評分的影響大小為:糖化時間>糖化酶添加量>α-淀粉酶添加量>液化時間。
各因素及其交互作用對小米綠豆糖化醪綜合評分的影響結(jié)果可以通過響應(yīng)面圖直觀地反映出來,其中圖像底部的等高線可以反映兩因素相互作用的強(qiáng)弱,若是橢圓形則表示相互作用較強(qiáng),圓形則表示較弱[20]。由圖4可知AB和CD的等高線為圓形,說明其交互作用對小米綠豆糖化醪綜合評分的影響不顯著,而AC、AD、BC以及BD為橢圓形,則說明其交互作用顯著,這與表6中的結(jié)果相符合。
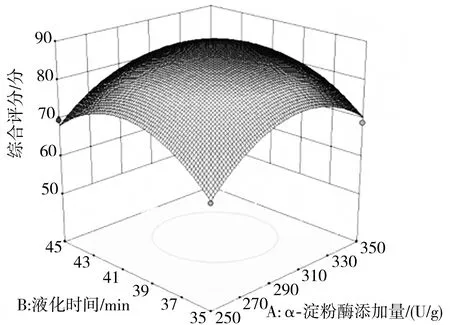
由回歸方程擬合得到的小米綠豆糖化的最優(yōu)工藝條件為:α-淀粉酶添加量為306.927 U/g,液化時間為39.174 min,糖化酶添加量為1700.517 U/g,糖化時間為61.347 min,在此條件下小米綠豆糖化醪的綜合評分理論值為90.16分,還原糖含量為13.423 g/dL,總黃酮含量為163.745 mg/dL。結(jié)合實(shí)際生產(chǎn)需要將工藝調(diào)整為α-淀粉酶添加量307 U/g、液化時間39 min、糖化酶添加量1700 U/g、糖化時間61.5 min。在此條件下進(jìn)行3次驗證,得到糖化醪還原糖含量為12.85 g/dL,總黃酮含量為156.14 mg/dL,綜合評分為87.32分,與預(yù)測值相比誤差為3.15%,由此說明該模型的擬合程度良好,得到的小米綠豆糖化工藝參數(shù)可靠。
3 結(jié)論
該試驗對小米綠豆糖化工藝進(jìn)行了優(yōu)化,在單因素試驗的基礎(chǔ)上進(jìn)行Plackett-Burman試驗,篩選出α-淀粉酶添加量、液化時間、糖化酶添加量及糖化時間這4個顯著影響因素,采用響應(yīng)面分析法優(yōu)化了小米綠豆的糖化工藝,最優(yōu)條件為α-淀粉酶添加量307 U/g、液化溫度80 ℃、液化時間39 min、糖化酶添加量1700 U/g、糖化溫度60 ℃、糖化時間61.5 min、加水量為原料的400%、蛋白酶添加量300 U/g以及高粱添加量15%。在此條件下,得到的小米綠豆糖化醪氨基酸態(tài)氮含量為0.127 g/dL,還原糖含量為12.85 g/dL,總黃酮含量為156.14 mg/dL,綜合評分為87.32分。

