鎘在南美蟛蜞菊、蟛蜞菊及其雜交種中的遷移和分布特征
黃駿東,柯偉倩,陳廣欣,古曉倩,張啟雷,2*,彭長連*
鎘在南美蟛蜞菊、蟛蜞菊及其雜交種中的遷移和分布特征
黃駿東1,柯偉倩1,陳廣欣1,古曉倩1,張啟雷1,2*,彭長連1*
(1. 廣東省植物發育生物工程重點實驗室, 華南師范大學生命科學學院, 廣州 510631; 2. 中國林業科學研究院熱帶林業研究所, 廣州 510520)
為了解植物對鎘的吸收和遷移特性,用200mol/L鎘處理蟛蜞菊()、南美蟛蜞菊()及其雜交種,研究了其對鎘的吸收、遷移與分布的差異。結果表明,隨著鎘處理時間的延長,3種植物莖和葉中的鎘含量逐漸上升,葉片的鎘含量逐漸與莖相當,而根部的鎘含量一直是最高的;整株水平上,雜交種的鎘含量一直是最高的。恢復生長后,3種植物根中鎘含量均呈下降趨勢,雜交種(50.4%)>蟛蜞菊(35.8%)>南美蟛蜞菊(33.7%)。鎘在3種植物的葉位分布模式在去鎘前后沒有明顯的變化,雜交種更偏向將重金屬鎘積累于幼葉和成熟葉中。3種植物從葉脈、葉脈間隙到葉片邊緣的鎘含量逐漸下降,南美蟛蜞菊葉脈的鎘含量(2 766.3g/kg)最高。可見,雜交種對鎘的吸收和轉運轉移能力高于雙親, 預示其在未來應用于植物修復中具有更大的潛力。
鎘;蟛蜞菊;雜交種;植物修復;重金屬
隨著我國經濟的發展,工農業生產活動對大氣、水體和土壤的重金屬污染程度越來越嚴重。我國國土資源部和環境保護部在2014年發布的報告中指出,鎘在重金屬土壤污染中排第一位,在過去30 a間呈逐年上升的趨勢,并預計農業用地的鎘濃度未來以較高的速率逐年提高[1]。鎘作為一種非必需元素,對于生物體是一種危害性較大的有毒重金屬[2],鎘的物理化學性質決定了其在水、土壤和空氣中的高移動性[3–4],并且鎘在食物鏈中轉移性高,威脅人類健康[5]。鎘在生態系統中移動的一個重要環節是“土壤-植物”,即從土壤中富集于植物體的過程。鎘從土壤進入植物體的第一步是根部的吸收,主要通過共質體與質外體途徑進入到根的維管系統,而后通過木質部和韌皮部往地上部分運輸并發生再分配[6]。鎘對植物生長發育產生不利的影響, 如影響植物對其他營養元素的吸收、轉移和利用,抑制植物的光合作用等代謝過程,打破植物體內活性氧代謝平衡,使活性氧不斷積累造成氧化脅迫, 最終導致葉片黃化、卷曲、萎蔫等[7–9]。
目前國內外已經有多種治理方法來有效降低重金屬含量,其中植物和微生物修復法具有良好的生態效益和經濟效益[10],植物修復技術包括植物提取、植物穩定和植物揮發。植物提取是植物從土壤中吸收重金屬元素,并在莖和葉中存留,這涉及植物對重金屬的吸收、轉移并富集至地上部分的可收集部位,從而進行收割處理[10–11]。植物對重金屬的吸收、轉移和在地上部再分配能力在植物修復重金屬土壤效率中起著關鍵作用[12–13]。
種間雜交是植物界普遍現象,本地種與外來種的雜交已有許多報道[14]。入侵種與本地種的雜交被認為是促進植物入侵力和適應性的主要推動力之一,其主要機制是通過雜交形成新的物種、引起遺傳變異、固定雜種優勢、降低遺傳負荷等多個途徑,促進入侵力和適應性的進化,所形成的雜交種相較于雙親具有更高的適應性與更寬的生態位[15],因此,雜交種通常對環境脅迫具有更高的耐受力。南美蟛蜞菊(),又稱三裂葉蟛蜞菊,菊科(Compositae)蟛蜞菊屬多年生草本植物, 是世界最有害的100種入侵物種之一[16],原產于南美洲及中美洲熱帶地區,起初以地被綠化植物引入, 而后逃逸成為入侵種,在華南地區對社會經濟和生態系統造成嚴重的損失和破壞[17]。蟛蜞菊()為同屬多年生草本植物,廣泛分布于我國華南地區。2013年,Wu等[18]在野外發現并鑒定了1種表型介于南美蟛蜞菊和蟛蜞菊之間的雜交種,前期研究表明,雜交種的競爭力與南美蟛蜞菊相似,且對氮沉降更為敏感[19],但對低溫低光環境的適應性沒有出現超親優勢[20]。
前期研究結果表明,南美蟛蜞菊[21–23]和蟛蜞菊[24–25]能夠富集鎘并對其具有一定的耐受性。但是,2種蟛蜞菊及其雜交種對鎘的吸收、轉運轉移能力的比較研究尚未見報道。因此,本研究在營養液中添加氯化鎘培養蟛蜞菊、南美蟛蜞菊及其雜交種,探討鎘在植物體內的遷移和分布情況,以了解雜交種對鎘的遷移能力是否具有超親優勢及其未來在植物修復上的應用潛力。
1 材料和方法
1.1 材料
蟛蜞菊()、南美蟛蜞菊()及其雜交種采自廣州市中國科學院華南植物園園區(23o10′ N, 113o21′ E)。在夏季5—6月份,3種植物以扦插苗的方式在培養箱中室溫培養,待莖條長出2~3 cm的根和嫩芽后,轉移至Hoagland營養液中培養,每隔7 d換1次營養液, 待長出3~ 4對葉子時,選取生長狀態一致的幼苗進行后續試驗。前期試驗表明,植物經200mol/L的鎘處理能存活且較快出現重金屬脅迫相關癥狀,因此采用200mol/L鎘處理。幼苗分為處理組和對照組,每種5株,共15株,置于育苗盆中。對照組使用Hoag- land營養液培養,處理組在Hoagland營養液中添加200mol/L氯化鎘。鎘脅迫21 d后3種植物轉移至無鎘營養液中繼續恢復培養7 d,比較植株不同部位葉片中鎘含量的變化,以考察鎘的移動性。
1.2 方法
鎘和其他金屬元素含量的測定 3種植物分別進行鎘處理7、21和28 d后,收集植株,5次生物學重復(下同)。先用蒸餾水沖洗根系,重復3次,而后置于20 mmol/L EDTA-Na2溶液中浸泡15 min,重復浸泡2次后再用蒸餾水沖洗3次,以除去根系表面附著的重金屬離子。將根系、葉片、莖分開放入樣品袋,于100 ℃下殺青30 min,然后在60 ℃下烘干,用研磨器粉碎,保存備用。準確稱取根、莖、葉粉末各0.20 g,移至消解罐中,加入濃硝酸5 mL,使用微波消解儀(COOLPEX, 上海屹堯)進行消解。消解過后,定容至50 mL。使用電感耦合等離子體質譜儀(Agilent7800, USA)測定樣品的Cd2+含量及其他金屬(Na、K、Ca、Mn、Fe、Zn和Cu)離子含量。
葉片各部位鎘含量的測定 為檢測葉片中鎘的分布情況,取鎘脅迫處理21 d后的從莖頂端往下第3片葉片(也是發黃癥狀最為明顯的葉片),將葉片分為葉脈、葉片邊緣和葉脈間隙3個部分(圖1),分別消解并測定其鎘含量。
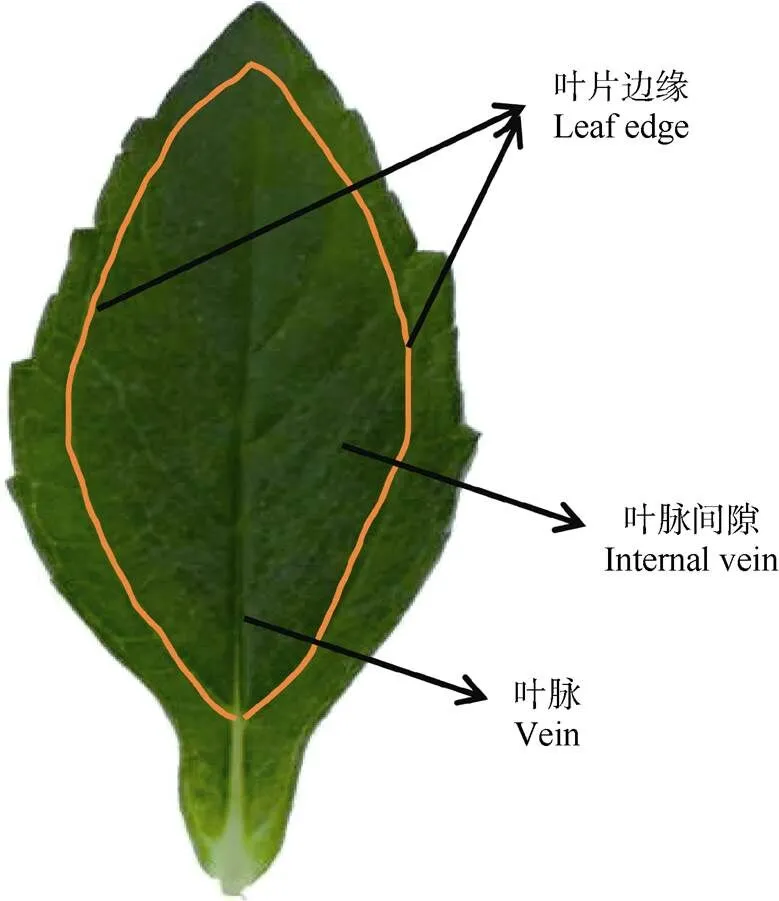
圖1 葉片部位
1.3 數據統計分析
實驗數據通過IBM SPSS Statistics 19.0 (IBM, Armonk, NY, USA)進行統計分析。對3種植物根、莖、葉中的鎘含量進行單因素方差分析, 采用Duncan’s法進行多重比較(<0.05)。采用Sigmaplot 14.0 (Systat Software Inc., USA)進行繪圖。
2 結果和分析
2.1 鎘脅迫下表型變化
從圖2可見, 3種植物在200mol/L鎘脅迫下,葉片均出現了黃化現象,南美蟛蜞菊葉片的黃化最為嚴重,葉片基部葉脈處甚至出現了褐色壞死斑,而在蟛蜞菊和雜交種的葉片中沒有出現明顯的壞死斑。
2.2 根、莖、葉中鎘含量的變化
從表1可見,隨鎘脅迫時間的延長,葉片的鎘含量呈逐漸上升的趨勢,脅迫7 d雜交種葉片中鎘含量最高,南美蟛蜞菊和蟛蜞菊的沒有顯著差異; 脅迫28 d,南美蟛蜞菊葉片中鎘含量最高。與葉片的變化趨勢相似,3種植物莖的鎘含量也逐漸升高,雜交種莖部鎘含量最高。根的鎘含量呈現先升后降的變化趨勢,脅迫28 d后,南美蟛蜞菊根的鎘含量最高。從整株植物來看,3種植物的鎘含量均呈現上升的趨勢,以雜交種的最高。
從圖3可見,鎘主要分布于葉片和莖中,隨著脅迫處理時間的延長,鎘在南美蟛蜞菊和雜交種根中所占比例逐漸下降,而蟛蜞菊則呈先升后降的變化趨勢;鎘在蟛蜞菊和南美蟛蜞菊莖中所占比例逐漸下降,雜交種呈先降后升的變化趨勢;鎘在蟛蜞菊和南美蟛蜞菊的葉片中所占比例呈上升趨勢,雜交種呈先升后降的趨勢。脅迫28 d后,鎘在莖中所占比例依次為雜交種(55%)、蟛蜞菊(53%)和南美蟛蜞菊(42%);葉中依次為南美蟛蜞菊(54%)、蟛蜞菊(42%)和雜交種(38%);根中依次為雜交種(7%)、蟛蜞菊(5%)和南美蟛蜞菊(4%)。可見,南美蟛蜞菊吸收的鎘主要集中在光合器官(葉)中,而蟛蜞菊和雜交種集中在莖中。

圖2 3種植物在200 μmol/L鎘脅迫下的表型
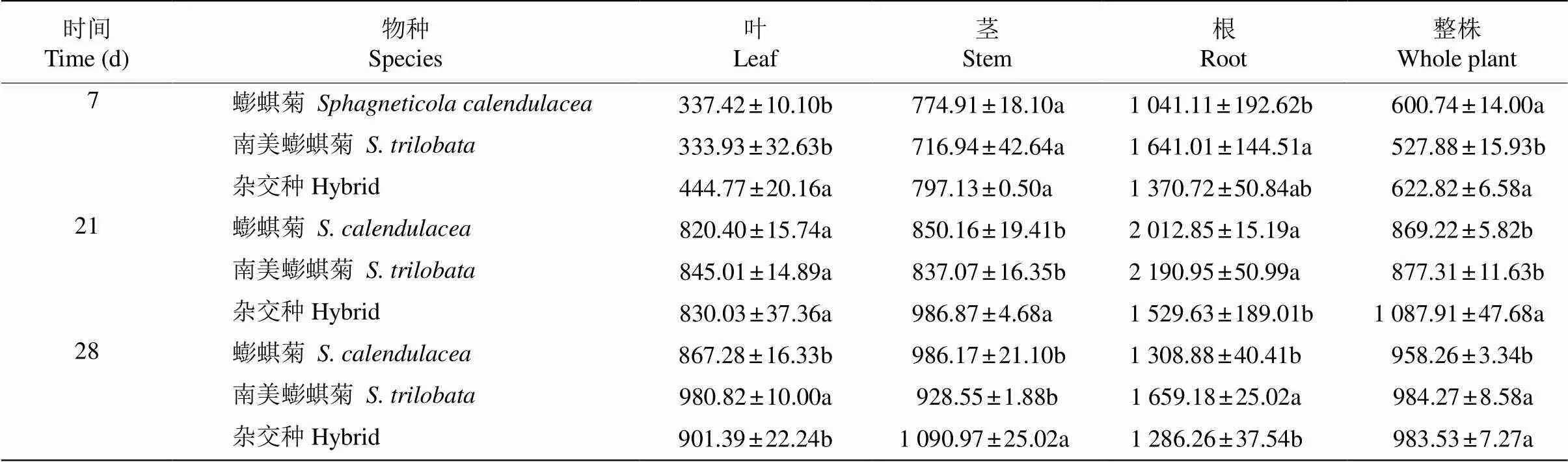
表1 脅迫下根、莖、葉鎘含量的變化(μg/kg DW)
=5。同列數據后不同字母表示差異顯著(<0.05, Duncan’s檢驗)。
=5. Data followed different letters indicate significant differences at 0.05 level by Duncan’s test.
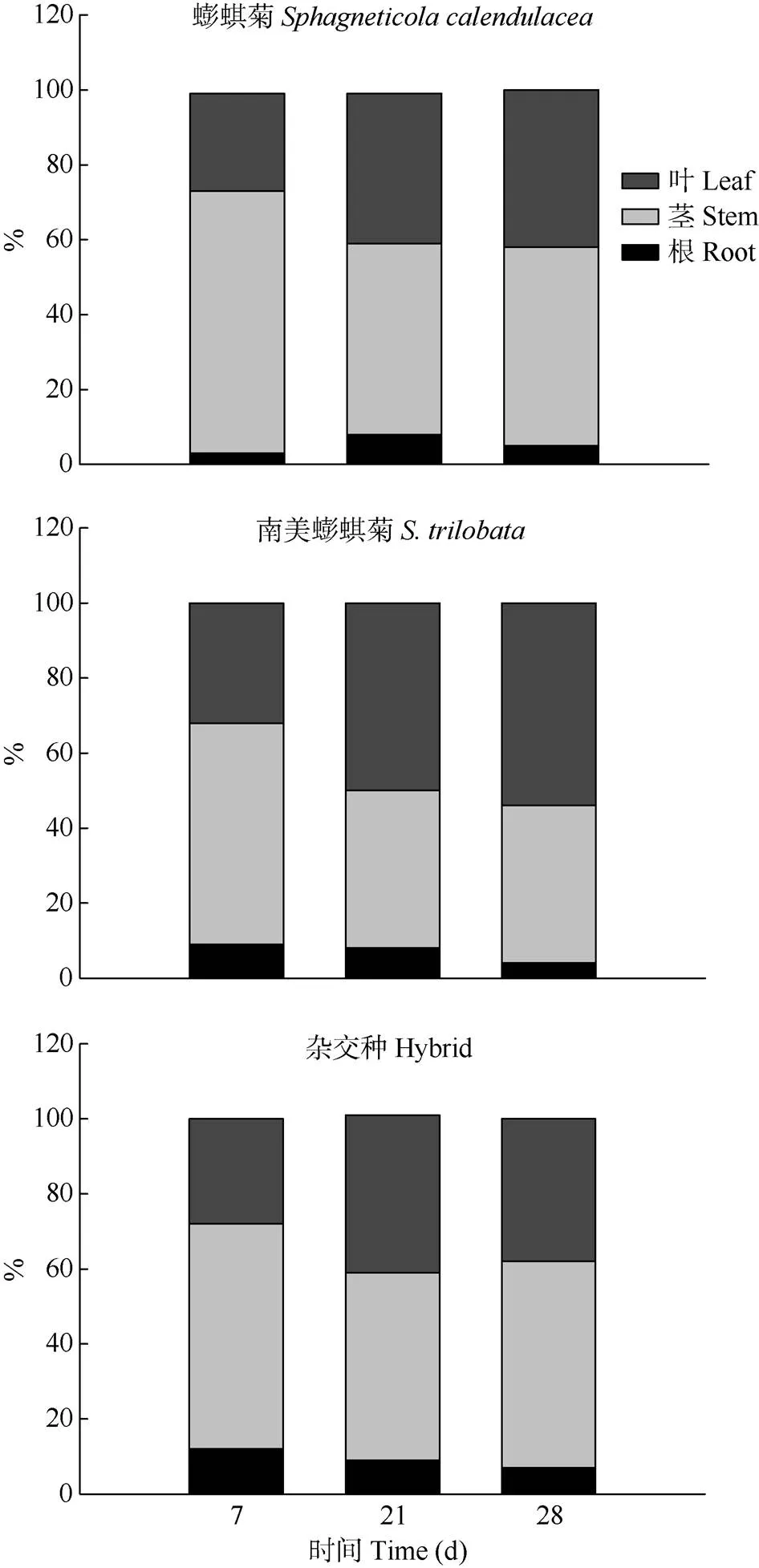
圖3 根、莖、葉中鎘含量所占比例
2.3 鎘在蟛蜞菊體內的移動性
總體來看,鎘在葉中的分布模式沒有發生顯著改變(圖4)。鎘含量越大的葉位,黃化現象越明顯,鎘在葉中的分布模式與表型相符合(圖2)。恢復培養后,3種植物新葉片(第6片葉)中鎘含量均極低,蟛蜞菊老葉(第1片葉)和幼葉(第5片葉)中鎘含量顯著提高,而成熟葉(第2~4片葉)中鎘含量無顯著變化;南美蟛蜞菊各葉位的葉片中鎘含量沒有顯著變化;而雜交種第4和5片葉中鎘含量顯著提高,且第4片(成熟葉)比第5片葉(幼葉)增加幅度更大, 這說明3種植物從脅迫生長到恢復生長,根部所積累的鎘不斷地往地上部分轉移(圖5)。恢復生長后,蟛蜞菊的幼葉和老葉中的鎘含量高于成熟葉,南美蟛蜞菊所有葉位的葉片鎘含量沒有顯著變化,雜交種則是除新展開的葉片,葉齡越小,鎘含量就越大。
恢復培養7 d后,3種植物根中的鎘含量均顯著下降(圖5),說明根部積累的鎘可能由根部運輸至地上部分, 其中,雜交種根中鎘含量下降幅度最大(50.4%),蟛蜞菊和南美蟛蜞菊分別下降了35.8%和33.7%。由此可見,雜交種將鎘往地上部分轉運的能力更強,從而可以較大限度降低鎘對根部的損傷。
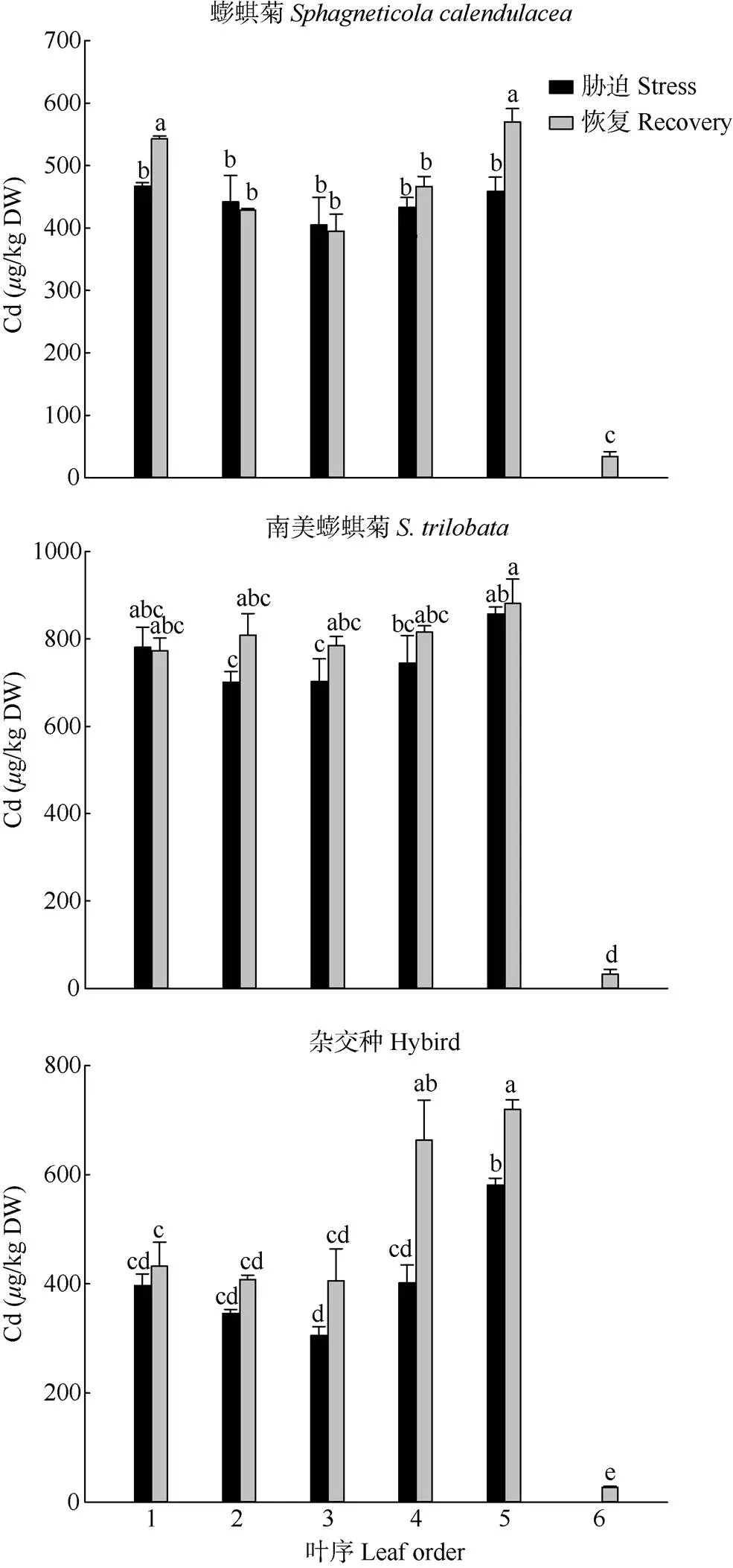
圖4 恢復生長后不同葉位鎘含量的變化。n=5。柱上不同字母表示差異顯著(P<0.05, Duncan’s檢驗)。
2.4 鎘在葉片中的分布
鎘脅迫21 d時3種植物葉片中鎘含量沒有顯著差異(表2),因此選擇此時的葉片研究鎘的分布特性。結果表明,3種植物葉片鎘分布具有相同的變化趨勢,從葉脈、葉脈間隙到葉片邊緣鎘含量逐漸減少。蟛蜞菊的鎘含量從葉脈到葉脈間隙和從葉脈間隙到葉片邊緣分別下降了26%和79%,南美蟛蜞菊下降了79%和59%,雜交種下降了2%和62%。鎘在葉片中的移動性越強,其含量下降就越小。因此,鎘在葉中的移動性依次為雜交種>蟛蜞菊>南美蟛蜞菊。南美蟛蜞菊葉脈的鎘含量最高,分別比蟛蜞菊和雜交種高2和2.5倍,蟛蜞菊和雜交種之間沒有顯著差異。這與鎘脅迫下南美蟛蜞菊葉脈處受損最嚴重的表型相吻合,說明南美蟛蜞菊受到鎘的毒害作用最強,出現了褐色的壞死斑(圖2)。
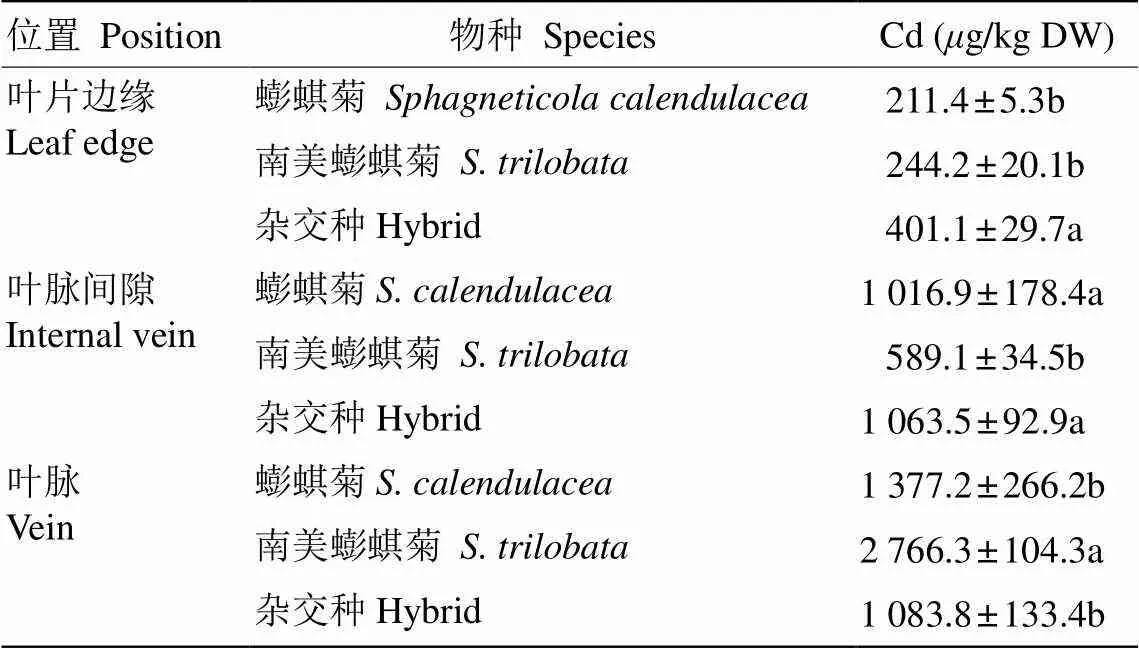
表2 葉片不同部位的鎘含量
=5。同列數據后不同字母表示差異顯著(<0.05, Duncan’s 檢驗)。
=5. Data followed different letters indicate significant differences at 0.05 level by Duncan’s test.
2.5 鎘脅迫對其他金屬元素吸收的影響
從表3可見,鎘脅迫下Na、K、Ca、Mn、Fe、Zn、Cu等礦質元素含量在3種植物中均出現不同程度的波動,其中,Ca2+含量在脅迫后均出現下降。
3 結論和討論
對于植物來說,鎘是一種非必需重金屬元素, 具有較高的毒性與移動性[7]。根是植物吸收水分和營養物質的器官,直接與土壤接觸,植物通過根部吸收外界營養元素,同時也會吸收共存的重金屬元素[26]。根部所吸收的重金屬元素,通過共質體或質外體途徑轉移至木質部,而后通過維管柱轉移至地上部分,通過韌皮部在莖、葉、籽實中進行分配[6]。本文研究了重金屬鎘在同科同屬的3種植物中的分布和移動特征,鎘脅迫過程中3種植物根部的鎘含量始終高于莖和葉,脅迫第28天葉片中的鎘含量與莖相近,說明重金屬鎘首先被根部吸收,通過莖向上運輸并向葉片積累。鎘在植物不同器官中的積累情況因植物種類、品種而異,一般來說,大部分的鎘積累在根中,少部分被轉移至地上部分,呈現根>莖>葉>籽實,而超富集植物地上部分的重金屬含量通常高于地下部分[27]。水培條件下的大豆()吸收的92%鎘滯留在根部,葉片中的鎘含量是莖的1/10[28]。用同樣方法處理蓖麻()的2個品種、菜豆()和玉米(),根、莖、葉中的鎘含量依次下降[29–30]。鎘滯留根部可能是鎘離子與根部皮層細胞的蛋白質和多糖類等物質結合形成穩定的大分子化合物,進而減少鎘離子對地上部分的毒害作用[31]。隨脅迫時間的延長,莖和葉的鎘含量都呈上升的趨勢,其中雜交種莖部鎘含量相對較高,根部則呈先升后降的趨勢,這可能與根長時間受鎘脅迫出現爛根有關,其中雜交種的變化幅度較小,這說明雜交種在28 d的鎘脅迫中,根部能保持較為良好的生長狀況,具有較高的向地上運輸鎘的能力。從根、莖、葉鎘含量所占比例來看,3種植物受到鎘脅迫時, 根部能將吸收的外界鎘離子向地上部分轉移。
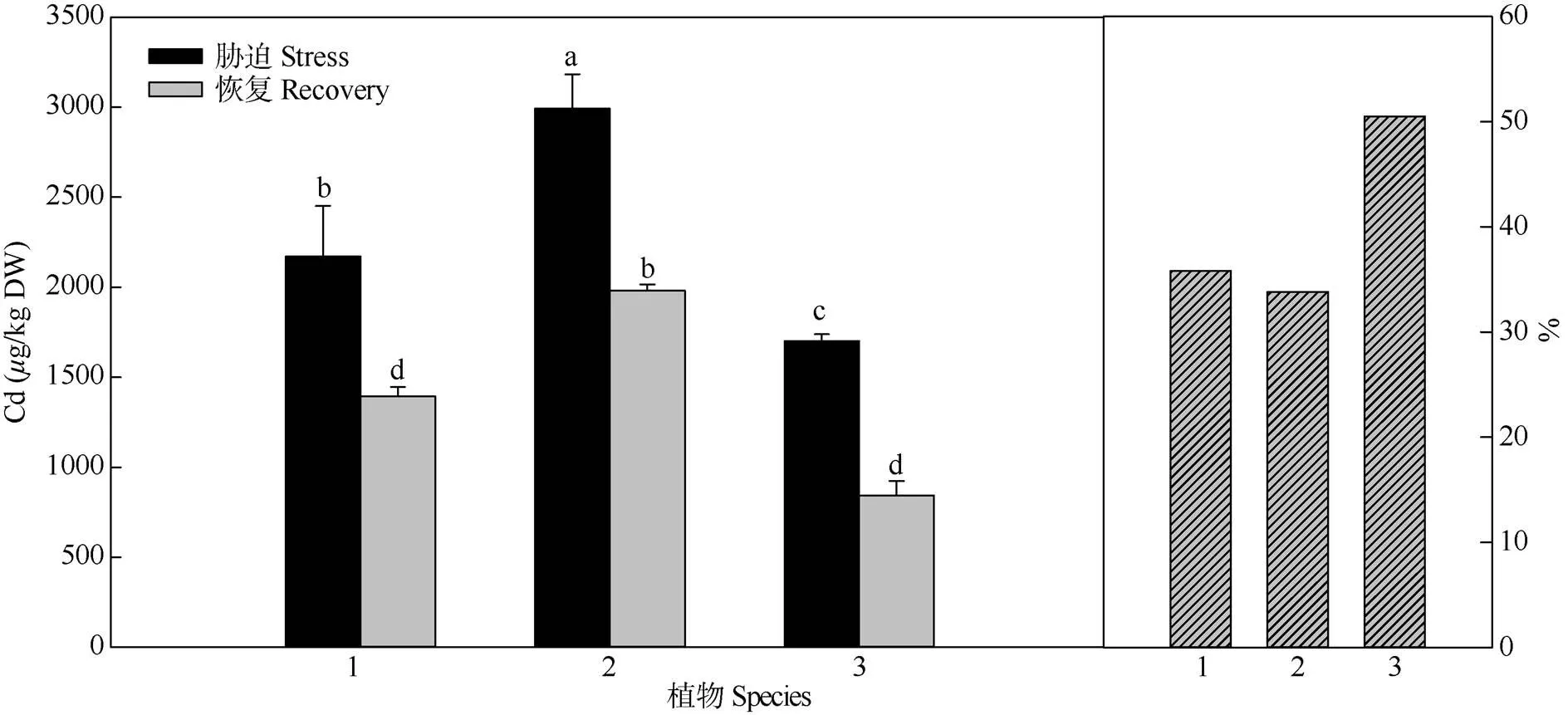
圖5 根部的鎘含量變化。n=5。1: 蟛蜞菊; 2: 南美蟛蜞菊; 3: 雜交種。柱上不同字母表示差異顯著(P<0.05, Duncan’s檢驗)。
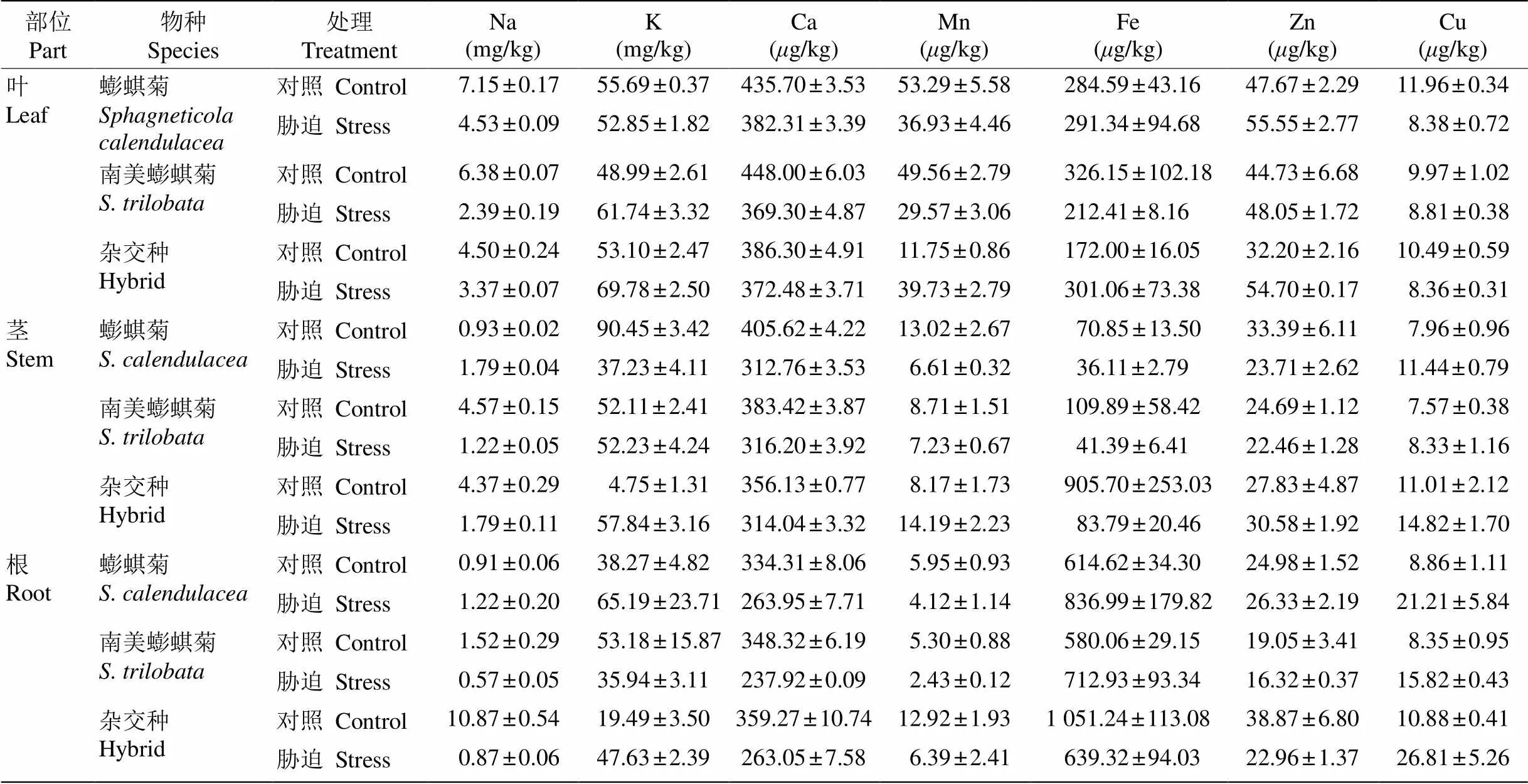
表3 鎘脅迫對金屬元素含量的影響
恢復培養7 d后,3種植物的根部鎘含量出現下降,以雜交種的下降幅度最大,進一步說明雜交種向上運輸鎘的能力較強。恢復培養7 d,蟛蜞菊和雜交種各葉位的鎘含量均有上升,這可能與脅迫時儲存在根部和莖部中的鎘轉移至葉片有關。蟛蜞菊偏向于將鎘積累在老葉和幼葉中,南美蟛蜞菊偏向于各個葉位均勻積累,而雜交種更偏向積累于幼葉和成熟葉中。鎘在不同植物中有不同的分布模式,與木質部的向上運輸和韌皮部的再分配2個過程密切相關。鎘超富集植物龍葵()具有較強的地上部運輸能力并積累在老葉和子葉中,鎘在地上部分進行再分配的能力較弱[32],而鎘在非超富集植物體中的分布情況與其有所不同,如白羽扇豆()將絕大部分的鎘滯留在根部,地上部分較少積累[26]。在非超富集植物小麥()中鎘通過木質部往地上部運輸以及通過韌皮部在不同葉位進行再分配的能力較其它重金屬元素弱[33]。植物將重金屬元素積累在老葉中會大大降低植物提取效率,因為重金屬會隨著老葉的脫落重新回歸土壤[13]。鎘在3種植物中具有不同的分布模式,且3種植物對鎘具有不同的運輸能力,表明他們之間存在不同的轉運機制,這有待于今后進一步研究。南美蟛蜞菊將大量的鎘積累在葉脈處,有利于減少鎘對代謝活躍部位的抑制,這與南美蟛蜞菊葉脈處有褐色壞死斑的表型一致。鎘在葉片中的分布模式對其代謝過程如光合作用有密切聯系,在葉片特定部位的鎘含量與該部位的光合能力呈負相關。Pietrini等報道鎘主要積累在葉脈,可以減少鎘對葉片其余部位光合能力的抑制[34],而在超富集植物天藍遏藍菜()中, 鎘主要積累在葉片的邊緣[35]。
植物正常的生長發育需要各種礦質元素,是植物體的組成成分且具有調節生理功能的作用,主要是通過根部吸收,進而通過木質部和韌皮部在地上部分分布與再分配[36]。鎘對于植物來說是一種非必需元素,但在化學性質上與Zn、Fe、Ca、Mn等礦質元素相似,通過與這些礦質元素競爭轉運蛋白進入到植物體中[37–39]。不僅礦質元素間在植物中的吸收、分布等過程具有競爭作用,許多重金屬元素與礦質元素同樣也存在類似的競爭作用,表現在植物對重金屬元素的吸收會抑制其他礦質元素的吸收與利用[40]。本研究表明,重金屬鎘顯著影響了植物對Na、K、Ca、Mn、Fe、Zn和Cu等的吸收和積累,其中Ca含量在3種植物的根、莖、葉中都下降。有研究表明,植物對Cd和Ca的吸收與積累存在競爭關系[37,39],也有一些研究表明兩者存在協同關系[41], 這可能與植物種類和器官不同有關。本研究表明, Cd和Ca在3種植物的根、莖、葉中具有競爭關系,這可能與鎘進入植物體利用了鈣的通道有關。鎘脅迫下Ca2+通道抑制劑(LaCl3)使空心菜()和紫莧菜()對鎘的吸收受到顯著抑制[42–43]。
目前,修復受到重金屬污染的土壤已有較多實用技術方法,其中植物修復技術因其成本低、修復效率較高而受到廣泛關注。植物提取技術(植物修復中的一種)是利用植物對重金屬的吸收,并將其轉運至可收割部位的一種原地生物修復技術[11]。重金屬積累在植物的具體部位與植物修復效率以及實際修復過程中方案的制定(例如收割植物體哪個部位以及收割時間)密切相關[12–13]。結合我們前期的研究,雜交種對重金屬鎘脅迫(200mol/L)的抗性上具有超親優勢[44],以及對鎘具有較強的吸收和向上轉運能力,偏向于將鎘積累于第2~3葉位的葉片中,這說明雜交種在未來的植物修復中具有較高的應用潛力。將雜交種應用于修復受到重金屬污染的土壤,仍需要進一步在野外實地調查與研究。
[1] ZHAO F J, MA Y B, ZHU Y G, et al. Soil contamination in China: Current status and mitigation strategies [J]. Environ Sci Technol, 2015, 49(2): 750–759. doi: 10.1021/es5047099.
[2] YUAN M, HE H D, XIAO L, et al. Enhancement of Cd phyto- extraction by twospecies with endophyticsp. JN27 [J]. Chemosphere, 2014, 103: 99–104. doi: 10.1016/j.chemosphere. 2013.11.040.
[3] YANG Y, GE Y C, ZENG H Y, et al. Phytoextraction of cadmium- contaminated soil and potential of regenerated tobacco biomass for recovery of cadmium [J]. Sci Rep, 2017, 7(1): 7210. doi: 10.1038/ s41598-017-05834-8.
[4] HASAN S A, FARIDUDDIN Q, ALI B, et al. Cadmium: Toxicity and tolerance in plants [J]. J Environ Biol, 2009, 30(2): 165–174. doi: 10. 1016/C2017-0-02050-5.
[5] TANG Y T, DENG T H B, WU Q H, et al. Designing cropping systems for metal-contaminated sites: A review [J]. Pedosphere, 2012, 22(4): 470–488. doi: 10.1016/S1002-0160(12)60032-0.
[6] SONG Y, JIN L, WANG X J. Cadmium absorption and transportation pathways in plants [J]. Int J Phytoremed, 2017, 19(2): 133–141. doi: 10. 1080/15226514.2016.1207598.
[7] DAS P, SAMANTARAY S, ROUT G R. Studies on cadmium toxicity in plants: A review [J]. Environ Pollut, 1997, 98(1): 29–36. doi: 10. 1016/S0269-7491(97)00110-3.
[8] DALCORSO G, FARINATI S, MAISTRI S, et al. How plants cope with cadmium: Staking all on metabolism and gene expression [J]. J Integr Plant Biol, 2008, 50(10): 1268–1280. doi: 10.1111/j.1744-7909. 2008.00737.x.
[9] BENAVIDES M P, GALLEGO S M, TOMARO M L. Cadmium toxi- city in plants [J]. Braz J Plant Physiol, 2005, 17(1): 21–34. doi: 10.1590/ S1677-04202005000100003.
[10] GARBISU C, ALKORTA I. Phytoextraction: A cost-effective plant- based technology for the removal of metals from the environment [J]. Bioresour Technol, 2001, 77(3): 229–236. doi: 10.1016/S0960-8524 (00)00108-5.
[11] MARQUES A P G C, RANGEL A O S S, CASTRO P M L. Reme- diation of heavy metal contaminated soils: Phytoremediation as a potentially promising clean-up technology [J]. Crit Rev Environ Sci Technol, 2009, 39(8): 622–654. doi: 10.1080/10643380701798272.
[12] HU Y, TIAN S K, FOYER C H, et al. Efficient phloem transport signi- ficantly remobilizes cadmium from old to young organs in a hyper- accumulator[J]. J Hazard Mater, 2019, 365: 421–429. doi: 10.1016/j.jhazmat.2018.11.034.
[13] FELLER U, ANDERS I, WEI S H. Distribution and redistribution of109Cd and65Zn in the heavy metal hyperaccumulatorL.: Influence of cadmium and zinc concentrations in the root medium [J]. Plants, 2019, 8(9): 340. doi: 10.3390/plants8090340.
[14] ELLSTRAND N C. Evolution of invasiveness in plants following hybridization [J]. Biol Invasions, 2009, 11(5): 1089–1091. doi: 10.1007/ s10530-008-9389-9.
[15] ELLSTRAND N C, SCHIERENBECK K A. Hybridization as a stimulusfor the evolution of invasiveness in plants? [J]. Proc Natl Acad Sci USA, 2000, 97(13): 7043–7050. doi: 10.1073/pnas.97.13.7043.
[16] LOWE S, BROWNE M, BOUDJELAS S, et al. 100 of the world’s worst invasive alien species: A selection from the global invasive species database [R]. Auckland: Invasive Species Specialist Group, 2000.
[17] WU Y Q, HU Y J, LIAO F L.: A species from introduced to potential invasive [J]. Guihaia, 2005(5): 413–418.
吳彥瓊, 胡玉佳, 廖富林. 從引進到潛在入侵的植物——南美蟛蜞菊 [J]. 廣西植物, 2005(5): 413–418.
[18] WU W, ZHOU R C, NI G Y, et al. Is a new invasive herb emerging? Molecular confirmation and preliminary evaluation of natural hybridi- zation between the invasive(Asteraceae) and its native congenerin South China [J]. Biol Invasions, 2013, 15(1): 75–88. doi: 10.1007/s10530-012-0269-y.
[19] NI G Y, ZHAO P, WU W, et al. A hybrid of the invasive planthas similar competitive ability but different response to nitrogen deposition compared to parent [J]. Ecol Res, 2014, 29(2): 331–339. doi: 10.1007/s11284-014-1130-9.
[20] SUN Z Y, CHEN Y Q, SCHAEFER V, et al. Responses of the hybrid betweenandto low temperature and weak light characteristic in south China [J]. Sci Rep, 2015, 5(1): 16906. doi: 10.1038/srep16906.
[21] PERNIA B, CALABOKIS M, NORIS K, et al. Effects of cadmium in plants of(L.) Pruski [J]. Bioagro, 2019, 31(2): 133–142.
[22] ZHU J L, XU Z F, CAO H L, et al. Effect of cadmium on photo- synthetic traits in[J]. Ecol Environ, 2008, 17(2): 657–660. doi: 10.16258/j.cnki.1674-5906.2008.02.039.
朱建玲, 徐志防, 曹洪麟, 等. 鎘對南美蟛蜞菊光合特性的影響[J]. 生態環境, 2008, 17(2): 657–660. doi: 10.16258/j.cnki.1674-5906.2008. 02.039.
[23] LIN M Z, LIN N W, QIU X F, et al. Wedelia trilobata’s response to heavy metals and heavy metal absorption and enrichment in its body with sludge as a part of growth substrate [J]. J Anhui Agric Univ, 2012, 39(2): 286–291. doi: 10.13610/j.cnki.1672-352x.2012.02.002.
林茂茲, 林能文, 邱雪芬, 等. 蟛蜞菊對污泥重金屬的響應、吸收與富集作用[J]. 安徽農業大學學報, 2012, 39(2): 286–291. doi: 10. 13610/j.cnki.1672-352x.2012.02.002.
[24] XIAO N C, ZHANG Y X, SONG B, et al. Enrichment characteristics and application potential of dominant plants for heavy metals in typical cadmium-rich lead-zinc mining areas of Guangdong [J]. Environ Pollut Control, 2021, 43(3): 343–347. doi: 10.15985/j.cnki.1001-3865.2021. 03.014.
肖乃川, 張云霞, 宋波, 等. 廣東省典型富鎘鉛鋅礦區中優勢植物重金屬富集特性與應用潛力[J]. 環境污染與防治, 2021, 43(3): 343–347. doi: 10.15985/j.cnki.1001-3865.2021.03.014.
[25] LU R R, HU Z H, ZHANG Q L, et al. The effect ofon the plant growth, Cd translocation and accumulation in the new Cd-hyperaccumulator[J]. Ecotox Environ Safe, 2020, 203: 110988. doi: 10.1016/j.ecoenv.2020.110988.
[26] PAGE V, WEISSKOPF L, FELLER U. Heavy metals in white lupin: Uptake, root-to-shoot transfer and redistribution within the plant [J]. New Phytol, 2006, 171(2): 329–341. doi: 10.1111/j.1469-8137.2006. 01756.x.
[27] ZHANG Y X, YU F, ZHANG Y Y, et al. Uptake, translocation and accumulation of cadmium in plant [J]. Chin J Ecol Agric, 2008, 16(5): 1317–1321.
張玉秀, 于飛, 張媛雅, 等. 植物對重金屬鎘的吸收轉運和累積機制[J]. 中國生態農業學報, 2008, 16(5): 1317–1321.
[28] CATALDO D A, GARLAND T R, WILDUNG R E. Cadmium distri- bution and chemical fate in soybean plants [J]. Plant Physiol, 1981, 68 (4): 835–839. doi: 10.1104/pp.68.4.835.
[29] YE W L, GUO G F, WU F, et al. Absorption, translocation, and detoxification of Cd in two different castor bean (L.) cultivars [J]. Environ Sci Pollut Res, 2018, 25(29): 28899–28906. doi: 10.1007/s11356-018-2915-0.
[30] GUO Y, MARSCHNER H. Uptake, distribution, and binding of cadmium and nickel in different plant species [J]. J Plant Nutri, 1995, 18(12): 2691–2706. doi: 10.1080/01904169509365094.
[31] ZHANG J B, HUANG W N. Advances on physiological and ecological effects of cadmium on plants [J]. Acta Ecol Sin, 2000, 20(3): 514–523. doi: 10.3321/j.issn:1000-0933.2000.03.030.
張金彪, 黃維南. 鎘對植物的生理生態效應的研究進展 [J]. 生態學報, 2000, 20(3): 514–523. doi: 10.3321/j.issn:1000-0933.2000.03.030.
[32] WEI S H, ANDERS I, FELLER U. Selective uptake, distribution, and redistribution of109Cd,57Co,65Zn,63Ni, and134Csxylem and phloem in the heavy metal hyperaccumulatorL. [J]. Environ Sci Pollut Res, 2014, 21(12): 7624–7630. doi: 10.1007/s11356- 014-2636-y.
[33] PAGE V, FELLER U. Selective transport of zinc, manganese, nickel, cobalt and cadmium in the root system and transfer to the leaves in young wheat plants [J]. Ann Bot, 2005, 96(3): 425–434. doi: 10.1093/ aob/mci189.
[34] PIETRINI F, ZACCHINI M, IORI V, et al. Spatial distribution of cadmium in leaves and its impact on photosynthesis: Examples of different strategies in willow and poplar clones [J]. Plant Biol, 2010, 12 (2): 355–363. doi: 10.1111/j.1438-8677.2009.00258.x.
[35] COSIO C, DESANTIS L, FREY B, et al. Distribution of cadmium in leaves of[J]. J Exp Bot, 2005, 56(412): 765–775. doi: 10.1093/jxb/eri062.
[36] PAN R C. Plant Physiology [M]. 7th ed. Beijing: Higher Education Press, 2012: 32–64.
潘瑞熾. 植物生理學[M]. 第7版. 北京: 高等教育出版社, 2012: 32–64.
[37] PERFUS-BARBEOCH L, LEONHARDT N, VAVASSEUR A, et al. Heavy metal toxicity: Cadmium permeates through calcium channels and disturbs the plant water status [J]. Plant J, 2002, 32(4): 539–548. doi: 10.1046/j.1365-313X.2002.01442.x.
[38] LLAMAS A, ULLRICH C I, SANZ A. Cd2+effects on transmembrane electrical potential difference, respiration and membrane permeability of rice (L) roots [J]. Plant Soil, 2000, 219(1–2): 21–28. doi: 10.1023/A:1004753521646.
[39] TIAN S K, XIE R H, WANG H X, et al. Calcium deficiency triggers phloem remobilization of cadmium in a hyperaccumulating species [J]. Plant Physiol, 2016, 172(4): 2300–2313. doi: 10.1104/pp.16.01348.
[40] KRUPA Z, SIEDLECKA A, SKORZYNSKA-POLIT E, et al. Heavy metal interactions with plant nutrients [M]// PRASAD M N V, STRZA?KA K. Physiology and Biochemistry of Metal Toxicity and Tolerance in Plants. Dordrecht: Springer, 2002: 287–301. doi: 10.1007/ 978-94-017-2660-3_11.
[41] DECHAMPS C, ROOSENS N H, HOTTE C, et al. Growth and mineral element composition in two ecotypes ofon Cd contaminated soil [J]. Plant Soil, 2005, 273(1): 327–335. doi: 10.1007/s11104-005-0099-0.
[42] HE B Y, YU D P, CHEN Y, et al. Use of low-calcium cultivars to reduce cadmium uptake and accumulation in edible amaranth (L.) [J]. Chemosphere, 2017, 171: 588–594. doi: 10.1016/j.chemosphere.2016.12.085.
[43] HE B Y, LING L, ZHANG L Y, et al. Cultivar-specific differences in heavy metal (Cd, Cr, Cu, Pb, and Zn) concentrations in water spinach (‘Forsk’) grown on metal-contaminated soil [J]. Plant Soil, 2015, 386(1): 251–262. doi: 10.1007/s11104-014-2257-8.
[44] ZHANG Q L, CHEN G X, SHAO L, et al. The hybridization between(L.) Pruski and(L.) Pruski improved the tolerance of hybrid to cadmium stress [J]. Chemosphere, 2020, 249: 126540. doi: 10.1016/j.chemosphere.2020. 126540.
Migration and Distribution Characteristics of Cadmium in,and Their Hybrid
HUANG Jundong1, KE Weiqian1, CHEN Guangxin1, GU Xiaoqian1, ZHANG Qilei1,2*, PENG Changlian1*
(1. Guangdong Key Laboratory of Biotechnology for Plant Development, School of Life Science,South China Normal University,Guangzhou 510631, China; 2. Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guangzhou 510520, China)
In order to understand themigration and absorption characteristics of cadmium,the differences in absorption, migration and distribution of cadmium were studied in(indigenous congener),(alien invasive species) and their hybrid treated with Hoagland solution containing 200mol/L CdCl2. The results showed that the cadmium concentrations in stems and leaves of three species gradually increased with the time extension of cadmium treatment, and the cadmium concentrations in leaves gradually matched that in stems, while that in roots of three species was always the highest. For the whole plant, cadmium concentration of the hybrid was also the highest under stress. After recovery growth, the cadmium concentrations in roots of hybrid,, anddeclined by 50.4%, 35.8%, and 33.7%, respectively. Distribution pattern of cadmium in leaves of three species had not significant change treated with/without CdCl2. The hybrid tended to accumulate cadmium in young and mature leaves. The cadmium concentrations gradually decreased from vein, internal vein and leaf edge of three species, which in internal vein ofwas the highest (2 766.3g/kg). Therefore, the hybrid displayed stronger ability to absorb, transport and transfer cadmium than its parents, suggesting that it had greater potential in phytoremediation in the future.
Cadmium;; Hybrid; Phytoremediation; Heavy metal
10.11926/jtsb.4448
2021-05-14
2021-07-28
國家自然科學基金項目(32171493, 31870374)資助
This work was supported by the National Natural Science Foundation of China (Grant No. 32171493, 31870374).
黃駿東,男,碩士,主要從事植物生理生態研究。E-mail: hjd201909ecology@126.com
. E-mail: dalei45666@163.com, pengchl@scib.ac.cn

