菠蘿蜜白化突變體葉片表皮形態研究
王紫璇, 徐芷蕙, 黃曉薇, 于旭東, 蔡澤坪*, 羅佳佳, 李世東
菠蘿蜜白化突變體葉片表皮形態研究
王紫璇1, 徐芷蕙1, 黃曉薇1, 于旭東1, 蔡澤坪1*, 羅佳佳2,3, 李世東1
(1. 海南大學林學院,熱帶特色林木花卉遺傳與種質創新教育部重點實驗室,海口 570228; 2. 中國熱帶農業科學院熱帶作物品種資源研究所,海口 571101; 3. 海南大學熱帶作物學院,海口 570228)
為探究木本植物白化突變體葉片表皮形態的變化,在掃描電鏡下觀測了菠蘿蜜()白化突變體(AAS)和正常(CK)幼苗葉片的表皮細胞和氣孔器,對MAP65家族蛋白構建了進化樹,并分析了基因的表達模式。結果表明,AAS表皮細胞和氣孔器的大小、形態均發生較大變化。與CK相比,AAS表皮細胞的周長、面積較小,密度較大,凸出數量和長度均減少,氣孔器較小且大小不一。下表皮小細胞和異常氣孔器的數量在AAS中大幅增加。MAP65家族成員大部分基因在AAS中下調表達。因此,推測菠蘿蜜白化突變體的發生可能與基因表達有關。
菠蘿蜜;白化突變體;葉;表皮細胞;氣孔器;基因表達
葉片表皮是調控蒸騰作用的重要組成成分,同時也是植物抵御生物和非生物入侵的第一道防線。表皮細胞和氣孔器在保護植株、調節光合和呼吸作用等多種生理過程中發揮著重要的作用[1]。大多數雙子葉植物表皮細胞的細胞壁會形成凸出(lobe),從而使表皮細胞相互嵌合,緊密排列[2]。雙子葉植物氣孔器一般由2個保衛細胞構成,通過控制氣孔器的開閉來調控與外界氣體的交換[3]。已對很多植物的表皮形態進行了研究[4–7],如擬南芥()、水稻()、玉米()、小麥()、野丁香()等,而菠蘿蜜()的表皮形態研究還較少。
植物葉片是進行光合作用的主要器官,光對葉表皮形態具有一定的調控作用。有研究表明,強光環境下葉表皮細胞的體積會減小[8]。Thomas等[9]報道氣孔的密度隨光照強度的增加而增加。Kang等[10]的研究表明,在藍光和紅光下隱花色素(cryptochrome, CRY)和光敏色素B (phytochrome B, phyB)功能缺失突變體中氣孔的發育受到抑制;在遠紅光下光敏色素A (phyA)缺失突變體中氣孔器幾乎不發育。
MAPs (microtubule associated proteins)是一類與微管結合的蛋白。MAP65s對維持微管穩定以及微管成束起關鍵作用。MAP65-1可通過抑制與微管切斷酶KTN1 (katanin)的結合,保護微管免受切斷[11]。微管排布會影響細胞的生長過程。當微管平行聚集成束并橫向排列時,局部表皮細胞的生長會受到抑制,從而使表皮細胞形成凹陷[12]。同時,微管還可通過調節纖維絲的長度影響細胞生長,當微管正常排布時,纖維絲較長,抑制細胞向纖維絲平行的方向生長[13]。
菠蘿蜜是一種常綠木本植物,具有較高食用、觀賞和經濟價值[14]。白化突變植株光合色素缺失, 從而使得葉片發育異常[15]。同時葉色白化突變體也是一類難得的材料,可發掘其觀賞價值[16]。目前有關白化現象對表皮形態影響方面的研究較少,對白化葉片表皮形態及其形成機制進行研究,可為植物細胞形態建成、分子調控機制和植株園藝性狀改良提供重要依據[17]。
本文在掃描電鏡下觀察了菠蘿蜜白化突變體(AAS)和正常(CK)幼苗葉片的表皮細胞和氣孔器變化,基于MAP65家族蛋白構建進化樹,并對MAP65家族基因的表達模式進行分析,為探究木本植物白化突變體葉片表皮形態變化機制提供參考依據。
1 材料和方法
1.1 材料
試驗材料種植于海南大學儋州校區。菠蘿蜜()白化突變體(albino mutant, AAS)和作為對照(CK)的正常幼苗均為實生苗,來源于同一棵帶有隱性白化基因的菠蘿蜜成年母株,取幼苗成熟葉片為材料(圖1)。
1.2 方法
種子萌發與幼苗的栽種 采用謝柳青等[18]的方法,選取發育良好的種子,點播于經滅菌處理的基質(營養土∶蛭石=3∶1)中,在(32±3) ℃、光照強度約1 440mol/(m2·s)的環境下栽種,每天定時澆水和管理。
掃描電鏡觀察 幼苗萌發第15天用鑷子取莖尖向下第3枚葉片, 觀測面向上置于電鏡載物臺,并用液氮速凍約3 min。在掃描電子顯微鏡下對葉片上下表皮進行觀察并拍照。
表皮細胞形態 表皮細胞測量周長、面積和密度。周長為單個細胞的細胞壁長度,面積為細胞壁圍成的面積。此外,為反映AAS與CK表皮細胞的嵌合程度,參照Armour等[19]的方法對相鄰2個表皮細胞交界點的直線距離和細胞壁長度進行測量,并統計凸出數量,重復大于100次; 表皮細胞的密度為單位面積的表皮細胞個數,重復3次。小細胞是指小于平均面積60%的細胞,小細胞密度為單位面積內小細胞的個數,重復3次。
氣孔器形態 氣孔器測量長度、寬度、面積、周長、密度和氣孔指數。長度和寬度分別為氣孔器的長軸和短軸長;周長為2個保衛細胞外圍細胞壁圍成的曲線長;面積為2個保衛細胞外圍曲邊圍成的面積,重復大于100次。氣孔指數=氣孔器個數/ (氣孔器個數+表皮細胞個數),重復3次。形態異常的氣孔器為面積不足平均面積60%的氣孔器,計算異常氣孔器占全部氣孔器的比例,重復3次。
保衛細胞形態 保衛細胞測量長度、寬度、周長和面積。寬度為氣孔器橫向邊緣切點到氣孔中軸線的距離;長度為保衛細胞縱向展平時兩端點的距離;周長為保衛細胞外圍曲邊與氣孔中軸線圍成的曲線長;面積為保衛細胞外圍曲邊與氣孔中軸線圍成的面積,重復大于100次。
1.3 數據的統計和分析
采用Image J軟件對葉片表皮細胞和氣孔器進行測量。采用Excel 2010軟件對數據進行單因素方差分析和多重比較,以<0.05表示差異顯著,< 0.01表示差異極顯著,所有數據用平均值±標準誤差表示。
1.4 MAP65家族基因的表達分析
本研究前期已完成菠蘿蜜轉錄組測序(PRJNA 579273),從擬南芥數據庫(https://www.arabidopsis. org/)中獲得AtMAP65家族成員的氨基酸序列,使用BioEdit軟件,通過本地Blast篩選出與擬南芥AtMAP65-1 (AT5G55230)同源的蛋白,并在擬南芥數據庫中進行BLAST驗證。從AAS葉轉錄組數據中獲取菠蘿蜜MAP65家族基因表達量。并通過在線網站Expression Heatmapper (http://www2.heatmapper.ca/ expression/)進行可視化,標準化方法為Row Z-score標準化。
1.5 系統進化樹的構建
用Clustal W將菠蘿蜜和擬南芥MAP65的氨基酸序列進行多重比對,采用MEGA 6.05軟件以鄰接法(neighbor-joining, NJ)構建進化樹,設置步長為1 000,模式為Poisson model,缺口設為Pairwise deletion進行檢驗。
2 結果和分析
2.1 表皮細胞形態結構
CK幼苗的葉片顏色為綠色,而AAS為白色(圖1)。AAS和CK的上表皮細胞周長分別是347.25和923.67m,AAS是CK的37.59%,差異極顯著;AAS和CK下表皮細胞周長分別是146.18和524.09m, AAS是CK的27.89%,差異極顯著(圖2, 圖3)。AAS和CK上表皮細胞面積分別是85.03和202.73m2, AAS是CK的41.94%,差異極顯著;AAS和CK下表皮細胞面積分別是54.44和128.00m2,AAS是CK的42.53%,差異極顯著(圖3),這表明光合色素缺失嚴重抑制葉表皮細胞的大小。
AAS和CK上表皮細胞密度分別是2 816.98和1 077.77 num./mm2,AAS是CK的2.61倍,差異極顯著;AAS和CK下表皮細胞密度分別是6 458.43和2 008.03 num./mm2,AAS是CK的3.22倍,差異極顯著(圖3),這表明光合色素缺失使葉表皮細胞的密度成倍增加。

圖1 菠蘿蜜正常幼苗(A)和白化突變體(B)植株形態
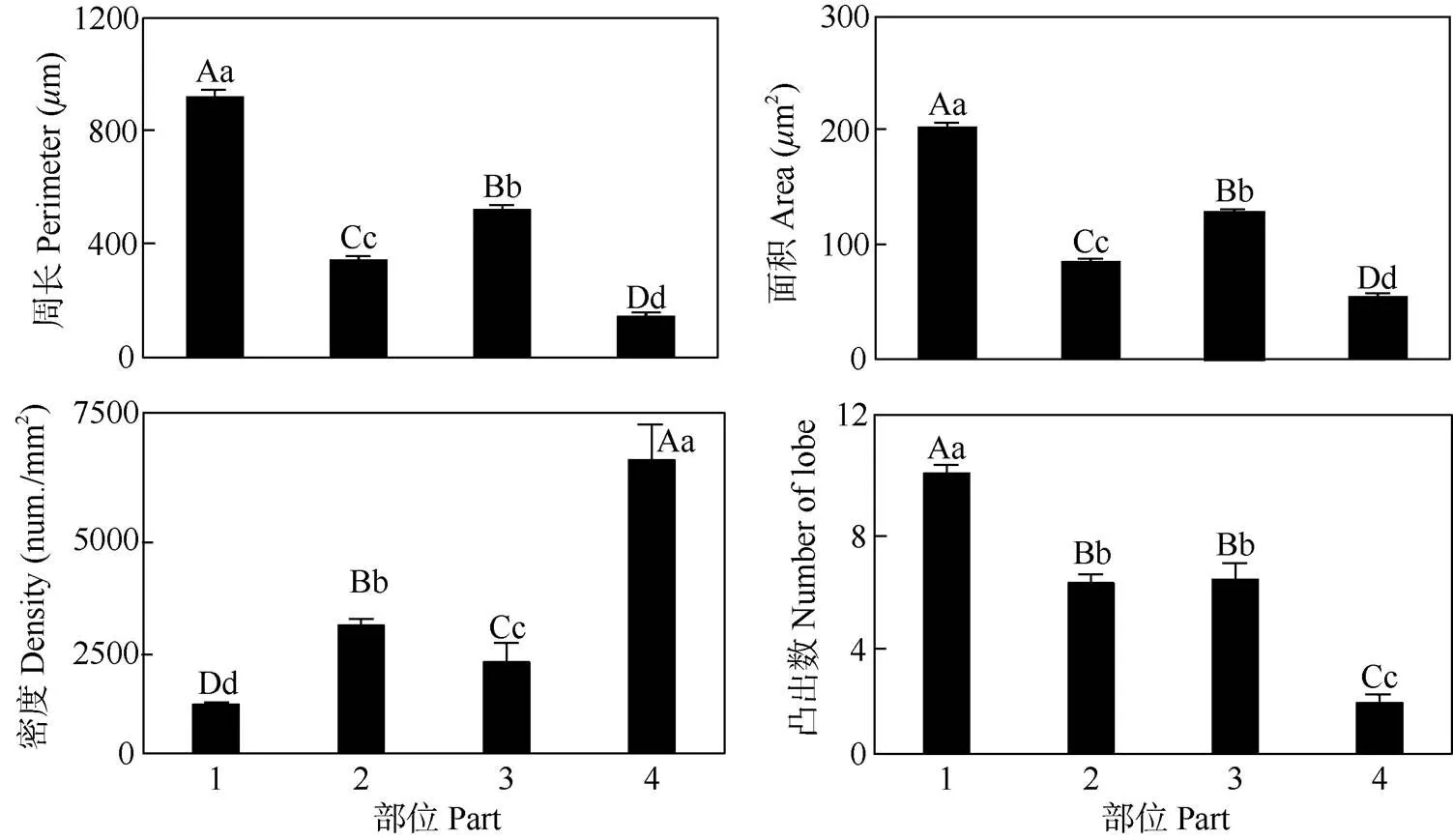
圖3 葉片表皮細胞的形態特性。1: CK上表皮細胞; 2: AAS上表皮細胞; 3: CK下表皮細胞; 4: AAS下表皮細胞。柱上不同大小寫字母分別表示差異極顯著(P<0.01)和顯著(P<0.05)。
氣孔器僅分布于葉片的下表皮(圖2)。與CK相比,AAS上、下表皮細胞的凸出較少,分別是CK的60.82%和29.50%,差異極顯著(圖3)。AAS的上、下表皮相鄰2個細胞交界點直線距離的中位數分別是11.55和6.62m,是CK的57.43%和46.95%; 相鄰2個細胞交界點的細胞壁長度分別是14.22和7.40m,是CK的39.38%和52.48% (圖4: A, B)。這表明光合色素缺失使AAS的上、下表皮細胞凸出減少。
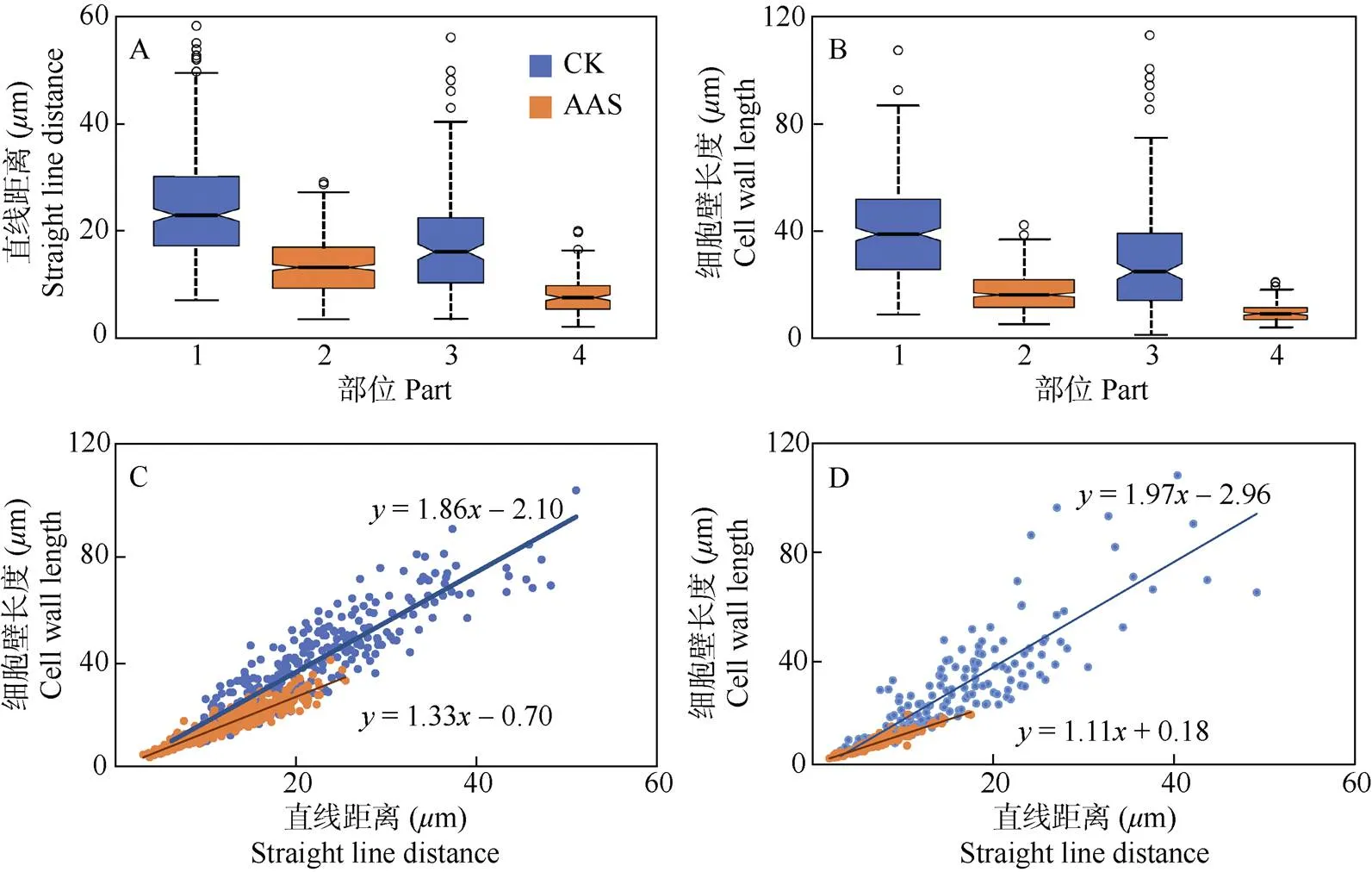
圖4 相鄰2個細胞交界點間直線距離(A)和細胞壁長度(B)及其線性關系(C: 上表皮, D:下表皮)。1: CK上表皮細胞; 2: AAS上表皮細胞; 3: CK下表皮細胞; 4: AAS下表皮細胞。
在葉片的上、下表皮中,AAS和CK的相鄰2個細胞交界點間的直線距離與細胞長度都呈正相關。線性回歸分析表明,CK上表皮的回歸系數是1.86, AAS為1.33,是CK的71.50%;而CK下表皮的回歸系數是1.97,AAS為1.11,是CK的56.35% (圖4: C, D),這表明受光合色素缺失的影響,AAS上、下表皮細胞間的嵌合程度降低。
AAS下表皮的小細胞較多,CK小細胞的密度為19.15 num./mm2,AAS為279.38 num./mm2,是CK的14.59倍,差異極顯著。
2.2 氣孔器形態
AAS和CK的氣孔器均分布于葉片下表皮。CK氣孔器的長度、寬度、周長和面積分別為23.22、18.48、64.90m和333.67m2,而AAS分別為20.16、17.50、58.81m和292.67m2,分別是CK的86.82%、94.70%、90.62%和87.71%,差異達極顯著或顯著水平。此外,AAS周長和面積的變異系數分別為15.18%和29.78%,是CK的2.60和3.09倍。CK的氣孔密度為390.58 num./mm2, AAS為1 044.92 num./mm2,是CK的2.68倍,達極顯著差異。CK的氣孔指數為21.58%,AAS的為20.63%, 無顯著差異(表1)。
CK保衛細胞的長度、寬度、周長和面積分別是23.31、8.95、52.88m和160.35m2,AAS分別為20.46、8.60、48.28m和144.00m2,分別是CK的87.77%、96.09%、91.30%和89.80%,差異均達極顯著或顯著水平。AAS保衛細胞周長和面積的變異系數分別為15.76%和29.93%,是CK的2.89和2.87倍(表2)。這表明光合色素缺失會使AAS的氣孔器和保衛細胞發育異常,導致氣孔器和保衛細胞大小懸殊,分布不均。
AAS形態異常氣孔器的比例為6.19%;而CK則沒有(表1),表明光合色素缺失使部分氣孔器的形態異常。
2.3 MAP65家族基因分析
為探究基因表達對AAS表皮細胞的影響,選擇與微管蛋白相關的MAP65家族進行分析。本研究與MAP65家族相關基因在菠蘿蜜中共有20個,其編碼的蛋白中CL1677.C5、CL1677.C14、CL1677.C13、CL1677.C4、CL1677.C2、CL1677.C12、CL1677.C7、CL1677.C10與AtMAP65-8、AtMAP65-5聚于一支,基因在AAS中下調表達(圖5)。CL1465.C1、CL1465.C3、CL1465.C4與AtMAP65-2為直系同源蛋白。在AAS中下調表達,而和上調表達。CL205.C4、CL205.C3、CL205.C5、CL205.C6、CL205.C8、CL205.C7、CL205.C1與AtMAP65-6、AtMAP65-7聚于一大支。除、和在AAS中上調表達,其余均下調表達。與為直系同源基因,UG41335與AtMAP65-4的親緣關系較近, 且其基因均在AAS中上調表達。這表明菠蘿蜜MAP65家族成員大部分基因在AAS中下調表達。

表1 氣孔器的形態
*:<0.05; **:<0.01。

表2 保衛細胞比較
*:<0.05; **:<0.01.
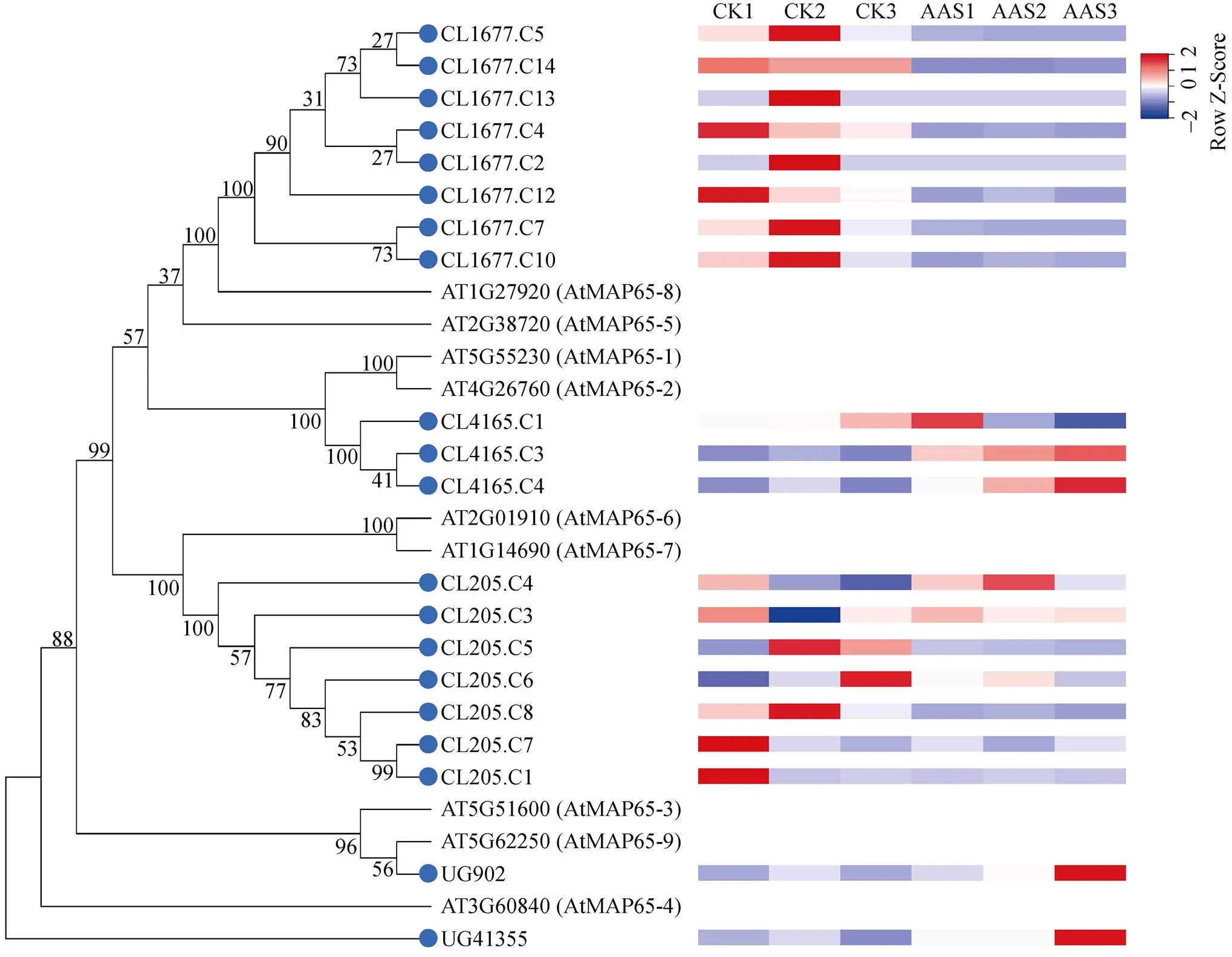
圖5 MAP65家族蛋白的系統進化樹(左)及基因表達分析(右)。數值表示分支的置信度,藍色圓點為菠蘿蜜蛋白。
3 結論和討論
對于雙子葉植物而言,表皮細胞的發育經歷了3個階段,即多邊形細胞的產生、細胞壁的延伸以及凸出的形成[20]。在這個過程中,細胞面積的增大依賴于細胞的膨脹和凸出的延伸[19]。本研究中, AAS的上下表皮細胞在大小、形態上均與CK有顯著差異,表現為細胞的周長和面積減小,細胞密度增大,細胞壁的凸出數減少,相鄰2個細胞交界點的直線距離和細胞壁長度較短,表明AAS的上、下表皮細胞間的嵌合程度降低。由此可見,AAS表皮細胞的生長和發育受到了抑制。韓冰等[21]研究的擬南芥突變體表皮細胞形態與本研究結果相似。其認為植物免疫反應可以調節表皮細胞的形態建成,因此可進一步研究AAS和CK免疫反應的異同。
無論是單子葉還是雙子葉植物,通常氣孔排布時兩個氣孔器間至少間隔1個表皮細胞,稱為“單細胞間距規則”[22]。排布異常的氣孔器會出現2個或多個氣孔直接接觸的情況,中間無表皮細胞間隔,稱為氣孔簇[23]。付影等[24]使用光學顯微鏡對白化菠蘿蜜的葉表皮細胞及氣孔器臨時裝片進行觀察,由于圖像解析度的限制,2個氣孔器直接接觸被誤認為氣孔簇,但本研究在電子顯微鏡下觀察2個氣孔器并未直接接觸,并不構成氣孔簇。
植物的細胞形態建成需要微管微絲的參與[25–26], 其中微絲與凸出的延伸有關,微管與細胞生長點的構建有關,微絲形成受阻會導致細胞壁變得平滑, 凸出減少;微管的異常則會導致細胞不正常膨脹, 趨近于圓形[21],由此推測,葉色白化植株微管微絲的結構可能發生了改變。MAP65對維持微管穩定起關鍵作用[27],有研究表明AtMAP65-1和AtMAP65- 5蛋白能促進微管捆綁成束[28]。微管聚集成束會抑制表皮細胞局部生長,形成細胞凹陷[12]。菠蘿蜜中與AtMAP65-1聚于同一分支的3個蛋白,對應的有2個基因在AAS中上調表達,1個下調表達;與AtMAP65-5聚于同一分支的8個蛋白,其基因在AAS中下調表達,由此推測,AAS中這些基因的表達變化可能是造成菠蘿蜜葉上、下表皮細胞凸出數量降低的原因。
AAS的氣孔器和保衛細胞形態與CK有較大差異,AAS氣孔器和保衛細胞的長、寬、周長和面積均較小,氣孔器密度增大,且AAS的氣孔器大小不一,而CK相對均一。Kim等[29]首次報道油菜素甾醇(brassinosteroid, BR)突變體中植物的氣孔密度增加,而用BR處理發育葉片后氣孔密度降低,由此推測,可能是由于AAS的BR合成異常導致氣孔的密度增加。同時,AAS中小細胞密度和形態異常氣孔器比例均與CK呈極顯著差異。有研究表明, 甾醇合成異常會導致表皮細胞及氣孔器的發育改變[30],因此,對甾醇相關合成酶基因的表達情況還有待于深入研究。
[1] ZHOU Y Q, MENG S Y, ZHOU W Q. Molecular mechanism for regulating epidermal morphogenesis in plants [J]. Acta Agric Boreali- Occid Sin, 2018, 27(5): 609–616. doi: 10.7606/j.issn.1004-1389.2018. 05.001.
周玉乾, 孟思遠, 周文期. 植物表皮形態建成的分子調控機制 [J]. 西北農業學報, 2018, 27(5): 609–616. doi: 10.7606/j.issn.1004-1389. 2018.05.001.
[2] LIANG S Q, SU T, HU J J, et al. Pattern of leaf epidermal characters inand its significance of taxonomy and paleoecology [J]. Acta Palaeontol Sin, 2019, 58(4): 526–542. doi: 10.19800/j.cnki.aps.2019. 04.010.
梁水清, 蘇濤, 胡瑾瑾, 等. 蘇鐵屬植物葉表皮特征及其分類學和古生態學意義 [J]. 古生物學報, 2019, 58(4): 526–542. doi: 10.19800/ j.cnki.aps.2019.04.010.
[3] YANG Y, MA S M, WANG Y F. Classification, distribution, deve- lopment of plant stomata [J]. Life Sci Res, 2011, 15(6): 550–555.
楊洋, 馬三梅, 王永飛. 植物氣孔的類型、分布特點和發育 [J].生命科學研究, 2011, 15(6): 550–555.
[4] YIN Q Q. The preliminary biological function ofstomatal index regulation gene[D]. Tianjin: Tianjin Agri- cultural University, 2016: 1–60.
尹倩倩. 擬南芥氣孔指數調控基因生物學功能的初步研究 [D]. 天津: 天津農學院, 2016: 1–60.
[5] ZHOU W Q, KOU S R, LIAN X R, et al. Screening and identification of leaf epidermal mutants in rice and maize [J]. Plant Physiol J, 2020, 56(2): 189–199. doi: 10.13592/j.cnki.ppj.2019.0402.
周文期, 寇思榮, 連曉榮, 等. 水稻和玉米葉表皮突變體的篩選和鑒定 [J]. 植物生理學報, 2020, 56(2): 189–199. doi: 10.13592/j.cnki. ppj.2019.0402.
[6] CHENG Q L. Distribution of specialized epidermal cells and stomatal development in wheat [D]. Tianjin: Tianjin Agricultural University, 2015: 1–42.
程喬林. 小麥葉片下表皮特化細胞分布及氣孔發育的研究[D]. 天津: 天津農學院, 2015: 1–42.
[7] YANG P, LUO Y Y, WANG R J. Leaf epidermal morphology ofWall. (Rubiaceae) [J]. J Trop Subtrop Bot, 2011, 19(4): 291–302. doi: 10.3969/j.issn.1005-3395.2011.04.001.
楊萍, 羅燕燕, 王瑞江. 野丁香屬植物葉表皮形態特征研究[J]. 熱帶亞熱帶植物學報, 2011, 19(4): 291–302. doi: 10.3969/j.issn.1005- 3395.2011.04.001.
[8] SUN M, TIAN K, ZHANG Y, et al. Research on leaf functional traits and their environmental adaptation [J]. Plant Sci J, 2017, 35(6): 940– 949. doi: 10.11913/PSJ.2095-0837.2017.60940.
孫梅, 田昆, 張贇, 等. 植物葉片功能性狀及其環境適應研究 [J]. 植物科學學報, 2017, 35(6): 940–949. doi: 10.11913/PSJ.2095-0837. 2017.60940.
[9] THOMAS P W, WOODWARD F I, QUICK W P. Systemic irradiance signalling in tobacco [J]. New Phytol, 2004, 161(1): 193–198. doi: 10. 1046/j.1469-8137.2003.00954.x.
[10] KANG C Y, LIAN H L, WANG F F, et al. Cryptochromes, phyto- chromes, and COP1 regulate light-controlled stomatal development in[J]. Plant Cell, 2009, 21(9): 2624–2641. doi: 10.1105/tpc. 109.069765.
[11] BURKART G M, DIXIT R. Microtubule bundling by MAP65-1 protects against severing by inhibiting the binding of katanin [J]. Mol Biol Cell, 2019, 30(13): 1587–1597.
[12] LLOYD C, CHAN J. Microtubules and the shape of plants to come [J]. Nat Rev Mol Cell Biol, 2004, 5(1): 13–22. doi: 10.1038/nrm1277.
[13] BURGERT I, FRATZL P. Actuation systems in plants as prototypes for bioinspired devices [J]. Philos Trans Roy Soc A Math Phys Eng Sci, 2009, 367(1893): 1541–1557. doi: 10.1098/rsta.2009.0003.
[14] YANG X R, YU X D, WU F H, et al. Bioinformatics prediction and comparison ofBRI1 family members [J]. Mol Plant Breed, 2021, 19(1): 100–110. doi: 10.13271/j.mpb.019.000 100.
楊欣蓉, 于旭東, 吳繁花, 等. 菠蘿蜜BRI1家族成員生物信息學的預測與對比 [J]. 分子植物育種, 2021, 19(1): 100–110. doi: 10. 13271/j.mpb.019.000100.
[15] CAO L, YU X D, CAI Z P, et al. Research progress of plant leaf albino [J]. Mol Plant Breed, 2019, 17(16): 5390–5397. doi: 10.13271/j.mpb. 017.005390.
曹璐, 于旭東, 蔡澤坪, 等. 植物葉色白化的研究進展 [J]. 分子植物育種, 2019, 17(16): 5390–5397. doi: 10.13271/j.mpb.017.005390.
[16] LI X Y. Studies on albinism of[D]. Taiyuan: Shanxi University, 2015: 1–34.
李小玉. 玉樹白化機理研究 [D]. 太原: 山西大學, 2015: 1–34.
[17] WU L Q, YOU C C, KE J, et al. Chloroplast development and physio- logical characteristics of green-revertible albino leaf color mutants in rice [J]. Chin J Trop Crop, 2013, 34(6): 1115–1120. doi: 10.3969/j.issn. 1000-2561.2013.06.021.
武立權, 尤翠翠, 柯建, 等. 葉色白化水稻突變體轉綠中若干生理與葉綠體發育特型的研究 [J]. 熱帶作物學報, 2013, 34(6): 1115– 1120. doi: 10.3969/j.issn.1000-2561.2013.06.021.
[18] XIE L Q, DONG J N, YU X D, et al. Transcriptome analysis of stem secondary growth in chlorophyll deficient mutant of[J]. Mol Plant Breed, 2020, 18(18): 5958–5969. doi: 10. 13271/j.mpb.018.005958.
謝柳青, 董俊娜, 于旭東, 等. 菠蘿蜜葉綠素缺失突變體莖次生生長轉錄組分析 [J]. 分子植物育種, 2020, 18(18): 5958–5969. doi: 10.13271/j.mpb.018.005958.
[19] Armour W J, Barton D A, Law A M K, et al. Differential growth in periclinal and anticlinal walls during lobe formation incotyledon pavement cells [J]. Plant Cell, 2015, 27(9): 2484–2500. doi: 10.1105/tpc.114.126664.
[20] ZHENG J. Research on a pavement cell mutantof[D]. Lanzhou: Lanzhou University, 2013: 1–46.
鄭婕. 一個擬南芥扁平細胞突變體的研究[D]. 蘭州: 蘭州大學, 2013: 1–46.
[21] HAN B. CPR1 is involved in the pavement cell morphogenesis inand the preliminary study on the functions of PP1 family [D]. Lanzhou: Lanzhou University, 2015: 1–111.
韓冰. CPR1參與擬南芥扁平細胞的形態建成和PP1家族功能初探[D]. 蘭州: 蘭州大學, 2015: 1–111.
[22] Akita K, Hasezawa S, Higaki T. Breaking of plant stomatal one-cell-spacing rule by sugar solution immersion [J]. PLoS One, 2013, 8(9): e72456. doi: 10.1371/journal.pone.0072456.
[23] Bergmann D C, LUKOWITZ W, SOMERVILLE C R. Stomatal development and pattern controlled by a MAPKK kinase [J]. Science, 2004, 304(5676): 1494–1497. doi: 10.1126/science.1096014.
[24] FU Y, YU X D, CAI Z P, et al. Characters of albino mutant ofLam. [J]. Chin J Trop Crop, 2018, 39(6): 1081– 1086. doi: 10.3969/j.issn.1000-2561.2018.06.007.
付影, 于旭東, 蔡澤坪, 等. 菠蘿蜜白化突變體的性狀研究 [J]. 熱帶作物學報, 2018, 39(6): 1081–1086. doi: 10.3969/j.issn.1000-2561. 2018.06.007.
[25] WANG Z F, KONG Z S. Research advancements in plant cell micro- tubules [J]. Chin J Cell Biol, 2019, 41(3): 372–380. doi: 10.11844/ cjcb.2019.03.0006.
王朝鳳, 孔照勝. 植物細胞微管研究進展 [J]. 中國細胞生物學學報, 2019, 41(3): 372–380. doi: 10.11844/cjcb.2019.03.0006.
[26] QIAN D, LI P P, XIANG Y. Research advances on actin cytoskeleton in the novel physiological process of plants [J]. Chin J Cell Biol, 2019, 41(3): 399–405. doi: 10.11844/cjcb.2019.03.0009.
錢東, 李盼盼, 向云. 微絲骨架調控植物特有生理活動的研究進展 [J]. 中國細胞生物學學報, 2019, 41(3): 399–405. doi: 10.11844/cjcb. 2019.03.0009.
[27] LLOYD C W, HUSSEY P J. Microtubule-associated proteins in plants: Why we need a MAP [J]. Nat Rev Mol Cell Biol, 2001, 2(1): 40–47. doi: 10.1038/35048005.
[28] Gaillard J, Neumann E, VAN Damme D, et al. Two micro- tubule-associated proteins ofMAP65s promote antiparallel microtubule bundling [J]. Mol Biol Cell, 2008, 19(10): 4534–4544. doi: 10.1091/mbc.e08-04-0341.
[29] Kim T W, Michniewicz M, Bergmann D C, et al. Brassino- steroid regulates stomatal development by GSK3-mediated inhibition of a MAPK pathway [J]. Nature, 2012, 482(7385): 419–422. doi: 10. 1038/nature10794.
[30] QIAN P P. Study on sterols regulating stomatal development and flowering in[D]. Lanzhou: Lanzhou University, 2013: 1–80.
錢平平. 擬南芥甾醇調控氣孔發育和開花的研究[D]. 蘭州: 蘭州大學, 2013: 1–80.
Leaf Epidermal Morphology of Albino Mutant of
WANG Zixuan1, XU Zhihui1, HUANG Xiaowei1, YU Xudong1, CAI Zeping1*, LUO Jiajia2,3, LI Shidong1
(1.Key Laboratory of Genetics and Germplasm Innovation of Tropical Special Forest Trees and Ornamental Plants, Ministry of Education, College of Forestry, Hainan University,Haikou 570228, China; 2. Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences,Haikou 571101, China; 3. College of Tropical Crops, Hainan University,Haikou 570228, China)
To investigate the changes of leaf epidermal morphology in albino mutants of woody plants, the epidermis cells and stomatal apparatus on leaves of albino mutant (AAS) and normal (CK)seedlings were observed under scanning electron microscopy. The phylogenetic tree was constructed based on MAP65 family proteins, and the expression ofwas analyzed. The results showed that the size and morphology of epidermal cells and stomatal apparatus of AAS were changed greatly. Compared with CK, epidermal cells of AAS had smaller perimeter and area, higher density, less lobe number, shorter lobe length and smaller stomatal apparatus. The number of small cells and abnormal stomatal apparatus in lower epidermis increased significantly in AAS. Most genes of MAP65 family members were down regulated in AAS. Therefore, it was speculated that the occurrence of AAS might be related to the expression ofgene.
; Albino mutant; Leaf; Epidermal cell; Stomatal apparatus; Gene expression
10.11926/jtsb.4447
2021-05-12
2021-06-12
海南省自然科學基金項目(319MS017); 海南大學科研啟動基金項目(kyqd1620); 海南大學國家級大學生創新創業訓練計劃項目(SA2000008501, SA2100001230)資助
This work was supported by the Project for Natural Science in Hainan (Grant No. 319MS017); the Project for Scientific Research Startup of Hainan University (Grant No. kyqd1620), and the Project for National Innovation and Entrepreneurship Training of Hainan University (Grant No. SA2000008501, SA2100001230).
王紫璇(2000~ ),女,本科,研究方向為林學、森林培育。E-mail: 18005505432@126.com
. E-mail: 992995@hainanu.edu.cn

