酚酸類化感物質種類、提取、分離和檢測研究進展
程佳 王發(fā)啟 李小雙 杜亞東 謝越
摘要:酚酸類物質是導致作物產生連作障礙問題的重要原因之一。對連作土壤中酚酸類物質進行有效提取和快速檢測,是酚酸類物質研究的重要前提,也是農業(yè)行業(yè)和產業(yè)的技術需求。對酚酸類化感物質的種類結構、提取工藝、分離純化和檢測手段4個方面進行梳理總結,并對酚酸類物質的研究進行展望,以期為土壤中酚酸類物質的科學研究提供理論和技術參考,為緩解因酚酸類化感物質產生的土壤連作障礙問題提供新的思路。
關鍵詞:化感作用;酚酸類物質;提取;分離純化;定性定量分析
中圖分類號: S184;S344.4? 文獻標志碼: A
文章編號:1002-1302(2022)06-0008-08
收稿日期:2021-05-14
基金項目:安徽省自然科學基金(編號:2008085MC81);安徽省重點研發(fā)計劃面上項目(編號:201904a06020042);企業(yè)橫向委托項目(編號:2020QX001)。
作者簡介:程 佳(1997—),女,安徽歙縣人,碩士研究生,主要從事農業(yè)資源高效利用研究。E-mail:chengj8067@163.com。
通信作者:謝 越,博士,教授,碩士生導師,主要從事環(huán)境污染控制研究。E-mail:yorke@126.com。
化感作用是由Molish在1937年首次提出[1],后來國際化感作用學會將其定義為植物在生長發(fā)育過程中,將自身次生代謝的化學物質釋放到周圍環(huán)境,改變周圍微生態(tài)環(huán)境,影響自身或周圍其他植物的生長發(fā)育,導致植物間相互排斥或促進的現(xiàn)象[2-3]。眾多研究表明,酚酸類物質為植物微生態(tài)環(huán)境中被鑒定最多、活性最強的一類化感物質[4-5]。國內外研究發(fā)現(xiàn)酚酸類化感物質釋放到環(huán)境中有4種途徑,即植物被雨水淋洗、植物殘體分解(如凋落物)、根系滲出和揮發(fā)[6-7]。研究發(fā)現(xiàn),這類化感物質是導致植物連作障礙的一個重要原因,在連作土壤中檢測出的酚酸類物質含量明顯增加。例如:在連作綏陽小米辣根際土壤中發(fā)現(xiàn)酚酸類物質數(shù)量從最初的1種增長到10種,其質量分數(shù)增加44.8%[8]。連作3年的甜瓜土壤與未連作的土壤比較,土壤中7種酚酸總含量顯著增加,連作3年后干土中7種酚酸的總量較未連作土壤增加了96.80%[9]。
目前,酚酸類物質能夠通過多種檢測手段進行定性定量研究[10-13],但是這些方法均較為繁瑣且檢測條件有限,檢測靈敏度較低,不適合連作田間土壤中酚酸物質的快速分析,因此,探究土壤樣品中酚酸的前處理和酚酸類物質高靈敏、簡便、快捷的檢測方法已成為農業(yè)行業(yè)和產業(yè)普遍亟待解決的問題。本文綜合國內外相關文獻,從酚酸類物質的種類結構、提取分離純化、檢測方法及定性定量檢測方面進行了歸納總結,以期為酚酸類物質引起的連作障礙問題的緩解提供技術參考。
1 酚酸類物質種類及結構特征
酚酸類化合物是一類結構簡單、含有芳香酚環(huán)、酚羥基和羧基的有機酸。具有化感作用的酚酸類物質主要是苯甲酸為母核的C6-C1型酚酸和以苯丙烯酸為母核的C6-C3型酚酸。
1.1 以苯甲酸為母核的C6-C1型酚酸
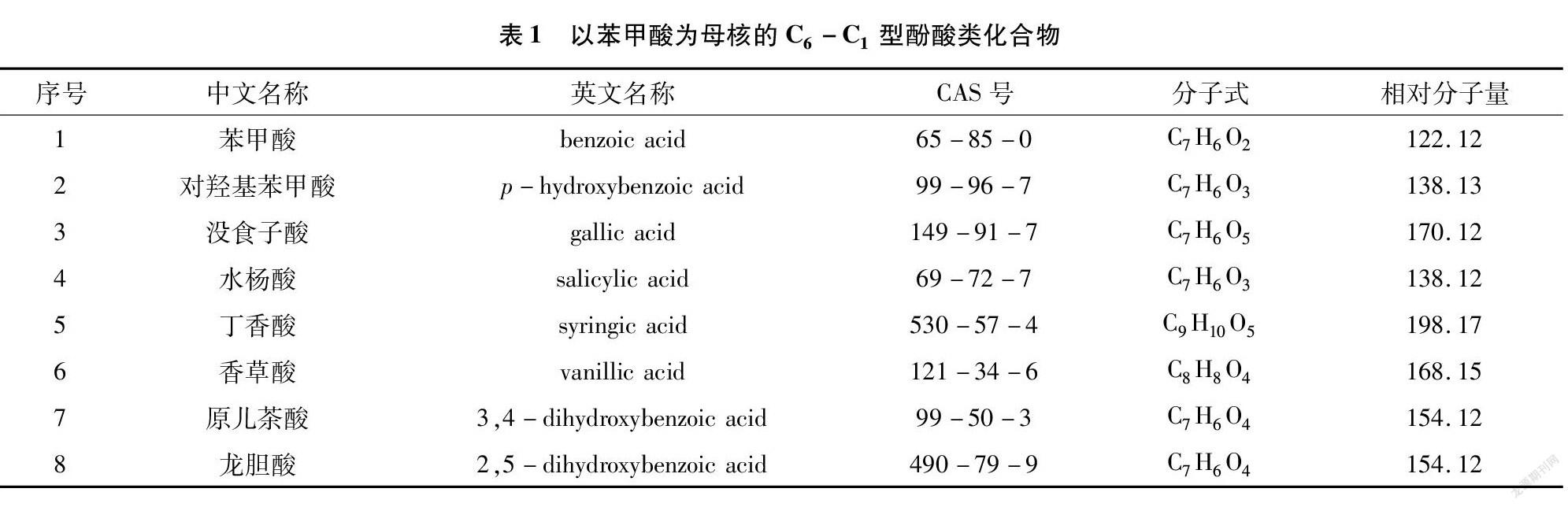
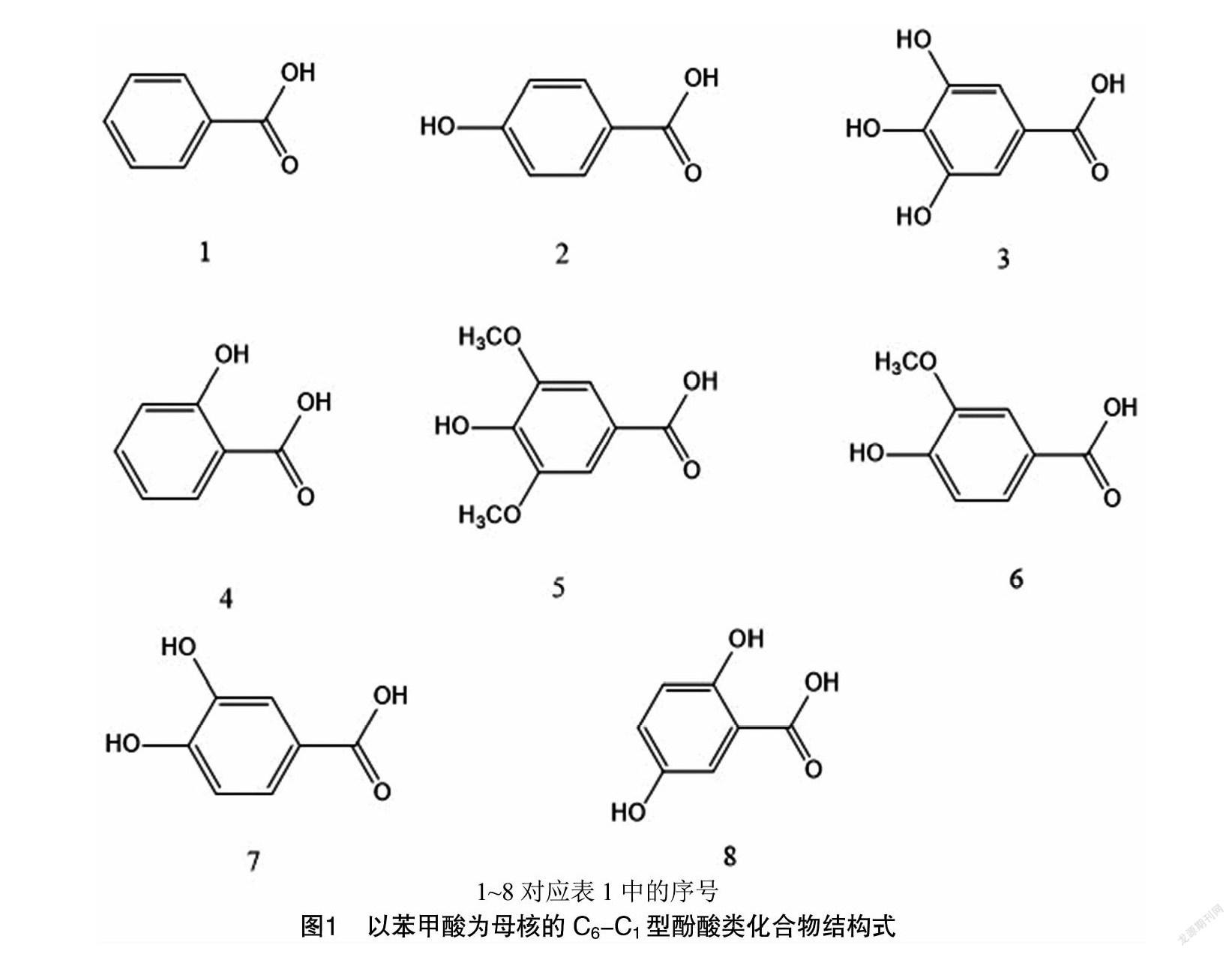
具有化感作用的酚酸類化合物中,大部分屬于母核為C6-C1型的苯甲酸類酚酸。目前研究顯示,具有化感作用的物質主要有苯甲酸、對羥基苯甲酸、沒食子酸、水楊酸、丁香酸、香草酸、原兒茶酸、龍膽酸等[10,14-15],其分子式和化學結構式詳見表1、圖1。
在藥用植物連作障礙的研究中發(fā)現(xiàn),沒食子酸、水楊酸、丁香酸、香草酸、原兒茶酸等是導致三七、地黃、西洋參、人參、太子參、丹參、半夏等這些常用大宗道地藥材產生化感作用的主要酚酸物質[16]。梁薇薇等通過室內模擬試驗,闡明了苯甲酸、丁香酸及香草酸對紅松種子萌發(fā)存在抑制作用,且對種子萌發(fā)的抑制作用強于對胚軸及胚根長的影響[14]。謝越等在研究5種酚酸對滁菊扦插幼苗的生長影響時,發(fā)現(xiàn)對羥基苯甲酸、水楊酸等苯甲酸類外源酚酸對根長度、可溶性糖含量、可溶性蛋白含量、葉綠素a含量、葉綠素b含量均有顯著抑制作用,其中對羥基苯甲酸的抑制作用最強[17]。魯曉峰等研究發(fā)現(xiàn),對羥基苯甲酸與鄰苯二甲酸2種酚酸能顯著影響植株根系H+-ATPase、K+/Na+-ATPase及Ca2+/Mg2+-ATPase活性,阻礙細胞內外各離子的運轉能力[18]。
1.2 以苯丙烯酸為母核的C6-C3型酚酸
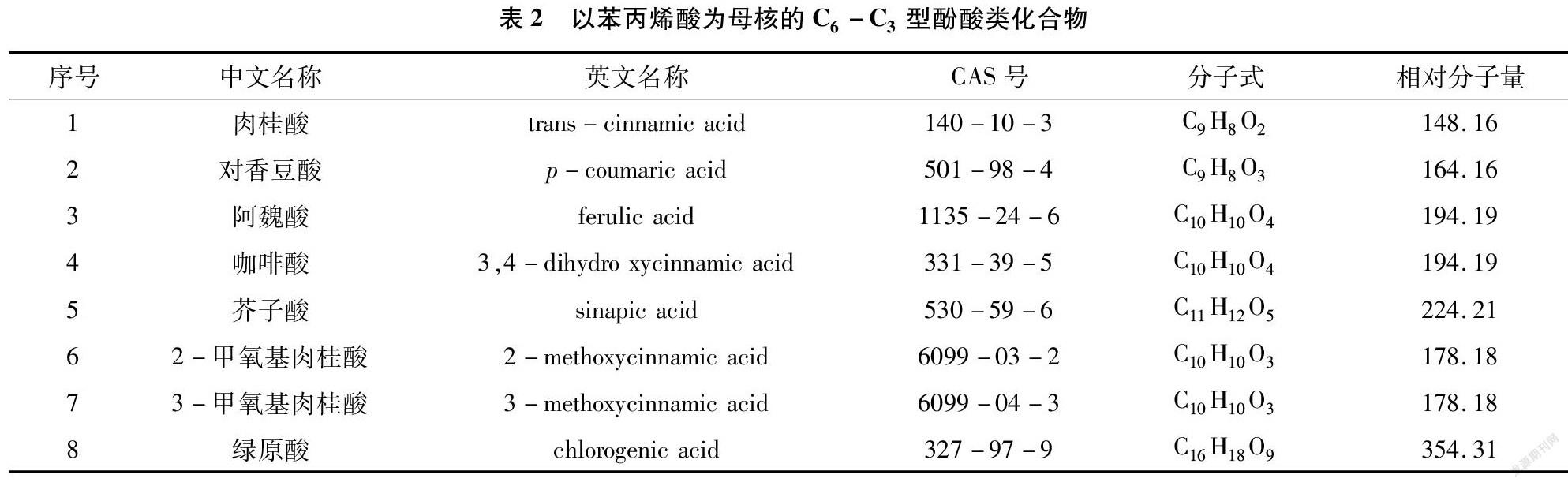
以苯丙烯酸為母核的C6-C3型酚酸是具有化感作用的酚酸類化合物另一類主要構型,主要以肉桂酸及其衍生物的形式存在。目前研究表明,具有化感作用的的苯丙烯酸類化合物包括肉桂酸、對香豆酸、阿魏酸、咖啡酸、芥子酸、2-甲氧基肉桂酸、3-甲氧基肉桂酸、綠原酸等[10,15,19],其分子式和化學結構式詳見表2、圖2。
研究發(fā)現(xiàn),低濃度的香豆素會對種子的萌發(fā)與生長產生很強的抑制作用,綠原酸對植物細胞壁的建立與根的生成則具有脅迫作用 [20]。Abenavoli等研究表明,反式肉桂酸、對香豆酸、阿魏酸不同程度地抑制了玉米幼苗對硝酸鹽的吸收,影響了植物體內氮素營養(yǎng)情況,其抑制程度與酚酸濃度和其芳香環(huán)中取代基的結構有關[21]。
2 酚酸類物質提取
酚酸類物質酚羥基是其主要活性基團,但該基團容易受到光照、溫度等外界因素的影響,大多易被氧化成羰基而失去活性[22]。因此,在酚酸的提取中須要注意光照、試驗溫度、試驗時間等試驗條件的影響。
2.1 溶劑提取法
酚酸類物質在植物中通常以氫鍵和疏水鍵形式與其他大分子物質形成穩(wěn)定的分子復合物,所以對提取溶劑要求是對酚酸具有很好的溶解性,但不應與酚酸發(fā)生化學反應;有氫鍵斷裂的作用,但浸出雜質少[23-24]。
常規(guī)溶劑提取法操作簡單、成本低廉,不需要昂貴精密的儀器就能達到提取效果,被實驗室作為最為常用的提取方法。楊澤良等通過應用不同提取溶劑提取細葉旱芹地上部化感物質,用其提取液處理蔬菜種子,發(fā)現(xiàn)乙醇提取液對蔬菜種子的萌發(fā)抑制效果最強,其次是甲醇提取物[25]。
除了常規(guī)的溶劑提取法,研究者還發(fā)現(xiàn)了新型綠色溶劑,在保證化合物高提取率的前提下,增加了環(huán)保、可持續(xù)性等功能。Alaón等提出了以氯化膽堿衍生物為基礎的深共晶溶劑作為橄欖葉中酚類化合物的新型綠色替代溶劑,其提取率與傳統(tǒng)溶劑相似[26]。深共晶溶劑具有熱穩(wěn)定性好、毒性低、可持續(xù)性、減少有機溶劑的使用和制備廉價等優(yōu)點,被稱為“21世紀的新型綠色溶劑”[27-28]。
2.2 超聲波輔助提取法
超聲輔助提取法提取樣品中的有效成分是利用超聲波具有的機械效應、空化效應和熱效應作用,增大孔徑從而加速化合物的擴散[29],超聲波輔助提取條件有溫度、溶劑、提取時間及料液比例等[30]。
超聲波輔助提取法作為一種快速提取技術,能在短時間內提取高酚類、黃酮類和糖苷類化合物,減少溶劑消耗[31]。薛宏坤等提取萬壽菊花多酚成分,采用二階速率模型評價熱回流提取法、超聲波輔助提取法和微波輔助提取法3種提取方法,結果得出超聲波輔助提取的總酚含量高于其他2種提取方法[32]。有學者研究超聲輔助提取枸杞中綠原酸、咖啡酸、丁香酸、對香豆酸和阿魏酸等5種酚酸,采用4因素3水平Box-Behnken設計探討出最優(yōu)提取方法,即在33%的乙醇溶液 ∶樣品體積比為 40 ∶1 的比例下,采用100 W超聲功率,提取30 min,有利于酚類化合物的提取、分離和藥物分析,為枸杞作為保健食品和藥物的進一步研究奠定了基礎[33]。
2.3 微波輔助提取法
微波輔助提取是采用非接觸式熱源,能量傳遞更快,可選擇性加熱減少熱梯度,快速達到反應過程,使提取時間縮短、減少溶劑消耗[34]。
微波輔助提取法與超聲波輔助提取法和溶劑提取法相比,該方法可以避免酚酸類物質的降解,同時在較短的時間內獲得了所有組分的最高回收率,消耗的溶劑和能量更少[35]。Chiremba等用微波輔助提取不同硬度高粱和玉米麩皮和面粉中的結合酚酸,避免了咖啡酸隨pH值的增加發(fā)生的不可逆的化學轉化,同時也減少了羥基肉桂酸和羥基苯甲酸衍生物因高溫產生的降解[36]。Pellati等在提取蜂膠原料中的酚酸類物質時,其回收率為95.3%~98.1%,并且沒有降解產物生成[37]。Molina等比較不同方法提取酚酸和黃酮類化合物,結果表明,微波輔助提取的含量分別比索氏提取法和超聲波提取法高34.54%、31.95%。利用微波提取的方法比其他方法提取時間短得多,是一種不需要有機溶劑就能獲得酚酸類化合物的有效方法[38]。
3 酚酸類物質分離純化
3.1 大孔樹脂分離純化
大孔吸附樹脂的吸附性能與其表面性能、孔結構以及吸附劑的溶解度有關[39]。鐘方麗等研究 D-101、LX-28、LX-1、LSA-21、LX-36、AB-8這6種不同類型大孔樹脂對覆盆子總酚酸的靜態(tài)吸附及解吸附效率,結果得出,AB-8型大孔樹脂效果最好,吸附率達到89.56%,解吸率為90.69%,通過正交試驗調整最佳純化條件,其提取干浸膏中總酚酸含量提高為原來的3.5倍[40];這與劉興賦等得出的結果[41]類似,AB-8分離蜘蛛香中總酚酸的效果最好,吸附率為92.93%,解吸率為84.24%。謝越等利用D-101大孔樹脂柱富集純化連作5年滁菊土壤樣品中的阿魏酸,得到的100份校正樣品經(jīng)過近紅外光譜法測定,其校正相關系數(shù)達到 0.991 4[11]。
3.2 萃取分離純化
土壤中酚酸含量低,須要進行富集純化,與其他物質分離,常用于富集酚酸的技術有液-液萃取[30]、固相萃取[42]、膜萃取[43]等。
有研究表明,在液-液萃取過程中進行強烈的振動,將極性相似的化合物轉移到有機相中進行分離,正己烷和三氯甲烷餾分可以提取相對非極性的化合物,乙酸乙酯和丙酮可以提取相對極性的化合物,其余高極性的化合物則作為殘留物留在水相中[30]。固相萃取的效果由固相萃取柱的組成以及吸附、解吸原理決定,張曉華等用HLB、PSD和MAX這3種不同的固相萃取柱對模擬蜂蜜中酚酸類物質檢測進行前處理,結果表明,經(jīng)HLB柱處理的10種酚酸類物質的平均回收率為70.9%~102.2%;經(jīng)PSD柱處理的平均回收率為55.7%~85.5%;經(jīng)MAX柱處理的平均回收率為1.8%~102.1%,表明不同的萃取柱組成導致的萃取效果不同[42]。
含極性或者極性較強的酸性有機物在高效氣相色譜或高效氣相色譜-質譜聯(lián)用檢測前須要進行衍生化才能實現(xiàn),張莉等檢測水中酚酸采用聚苯乙烯-二乙烯苯膜萃取,萃取完成后,將膜片移入衍生瓶中,采用超聲技術對酸性有機物進行洗脫和衍生,可以有效節(jié)省溶劑的使用和預處理時間[44]。Asadi等采用凝膠電膜法利用電輔助有效提取蘋果、橘子和獼猴桃汁中酚酸類化合物,以最佳參數(shù)對提取方法進行了驗證,得出較高的線性及回收率[43],具有操作簡便、成本低、環(huán)境友好等優(yōu)點。
4 酚酸類物質的檢測方法
4.1 福林酚(Folin-Ciocalteu)比色法
福林酚比色法多酚含量測定的原理為在堿性條件下,酚類化合物的酚羥基與Folin-Ciocalteu試劑中鎢鉬酸的W6+反應,將其還原成W5+,生成藍色絡合物[45],在一定波長范圍內可測定其吸收度。
福林酚比色法適合較為簡單的總酚測定,可以準確穩(wěn)定測出總酚含量,林倩等采用響應面法優(yōu)化福林酚法測定冬棗中總酚含量,優(yōu)化后Folin-Ciocalteu試劑濃度為0.8 mol/L、20%碳酸鈉溶液取0.6 mL、反應溫度為40 ℃,測得的總酚含量與預估值吻合度達98.4%[46]。但是福林酚比色法會受到其他氧化物質的干擾,對酚類物質不具有特異性,在較復雜的植物樣品的測定前需要注意其他易氧化物質的干擾[47]。Padda等測定甘薯總酚時比較Folin-Denis、Folin-Ciocalteu 2種試劑測出的總酚含量,發(fā)現(xiàn)Folin-Ciocalteu試劑受還原糖及抗壞血酸等其他易氧化物質的干擾更大,導致Folin-Ciocalteu試劑測出的總酚含量偏高[48]。這與Showkat等在研究菊芋酚酸時的結論一致,福林酚比色法測出的總酚含量偏高[49]。
4.2 高效液相色譜(HPLC)法
利用高效液相色譜研究土壤中的化感自毒物質酚酸類物質文獻報道很多。大部分文獻報道中色譜柱采用十八烷基鍵合硅膠色譜柱,流動相體系均為有機相——水,調節(jié)pH值使流動相體系成弱酸性,減少了苯酚、酚羥基和羧基的電離[50],有利于酚酸物質的分離。謝越等選用Symmetry C18色譜柱同時測定滁菊樣品中的9種酚酸,色譜條件為流動相A為乙腈,流動相B為以冰醋酸調節(jié)至pH值為2.8的0.02 mol/L磷酸鹽緩沖溶液,柱溫設為 25 ℃,在280 nm檢測波長下運行30 min,結果表明,其檢出限介于0.01~0.08 mg/L,達到痕量檢測要求[10]。González-González等建立了高選擇性、高靈敏度、高精確度的高效液相色譜-二極管陣列檢測器同時測定龍葵水提物及其水解產物中6種酚酸的含量,該方法在濃度范圍內呈良好的線性關系(r>0.999),回收率為88.07%~109.17%,基質效應均小于5%,可作為藥用植物提取液的檢測[51]。Nian等則利用HPLC快速、高準確度等特點在 30 min 內檢測出茶葉中20種化合物,其中包括酚酸類化合物[52]。
現(xiàn)在對高效液相色譜法檢測酚酸物質的方法越來越成熟,越來越多研究者們結合其他方法或條件,使檢測結果更加準確。比如,超高壓液相色譜法與小粒徑色譜柱結合,可以達到高效、快速的分離目的,中藥虎杖中的34種化合物可以在10 min內分析完成[53]。還有結合數(shù)學方法,利用數(shù)字色譜結合普通色譜或質譜的方法將重疊難區(qū)分的譜圖分辨為純物質的譜圖,從而實現(xiàn)化合物的快速檢測,比如利用高效液相色譜法結合交替三線性分解算法(ATLD),可實現(xiàn)蜂蜜中10種酚酸類物質快速定性和定量分析[42]。
4.3 毛細管電泳法
毛細管電泳法具有分辨率高、模式多、分析時間短、操作成本低、污染物去除容易等優(yōu)點,可以高效地進行提取物的分離與測定[54]。Martí 等通過響應面法優(yōu)化在20 min內實現(xiàn)了番茄中9種多酚的分離,經(jīng)過方法驗證,該方法回收率為77%~106%,日內、日間的峰面積相對標準偏差分別<3.1%、<3.7%,保留時間的相對標準偏差分別<0.2%、<1.4%,檢出限濃度為0.8~3.8 mg/kg,滿足了毛細管電泳法分析番茄中多酚類物質的要求[12]。
電動增壓毛細管電泳是瞬間等速電泳和場放大進樣結合的在線富集方法,可同時分析植物中常見的10種酚酸,該方法驗證結果表明,回歸曲線的相關系數(shù)大于0.997,相對標準偏差和相對誤差分別小于9.63%、4.70%,檢出限(LOD)為0.01~2.5 ng/mL,與傳統(tǒng)的毛細管區(qū)帶電泳方法相比,該方法對酚酸的靈敏度可提高2.5萬倍[55]。毛細管電泳-化學發(fā)光法可以快速分離并定量檢測出中藥中阿魏酸、綠原酸、水楊酸這3種酚酸類物質,在優(yōu)化條件下,可在7 min內達到化合物的分離并快速檢測[56]。毛細管電泳法是一種比HPLC法樣品消耗量和溶劑消耗量低的綠色方法,符合環(huán)境友好的環(huán)保要求。
4.4 紅外吸收光譜法
近年來,紅外吸收光譜法作為一種快速檢測分析的方法,而且可以對化合物基團進行準確鑒別,逐漸進入研究者的視野。紅外吸收光譜法測出各物質的數(shù)據(jù)較復雜,可能出現(xiàn)非線性關系且含量差異大,因此需要結合化學計量學對復雜的數(shù)據(jù)進行統(tǒng)計分析,偏最小二乘法就是常用的與紅外吸收光譜結合的常用方法[57]。偏最小二乘傅里葉變換紅外光譜法測定藥用植物提取物中酚酸含量,測得的酚酸含量與Folin-Ciocalteu比色法測得的酚酸含量在相同范圍內,通過不同波段比較,其中紅外法測得的結果最為準確[58]。謝越等快速檢測連作土壤中阿魏酸含量,測出數(shù)據(jù)采用偏最小二乘法分析,結果表明,模型校正集和驗證集與高效液相色譜法測定的參考值之間均呈現(xiàn)良好的相關關系,校正相關系數(shù)與交叉驗證相關系數(shù)均大于0.99[11]。Vivar-Quintana等利用近紅外光譜法測定蜂膠中的酚酸物質,得出結果[59]也與高效液相色譜法一致。
也有學者認為近紅外光譜法需要通過數(shù)學模型進行二次擬合,才能得到被測化合物的含量,其準確度不足以取代傳統(tǒng)的高效液相色譜法,且建立近紅外光譜的識別和定量模型需要大量的時間、成本和精力,但模型建立后,近紅外光譜具有非破壞性和測量時間短(約5 min)的巨大優(yōu)勢[60]。近紅外光譜作為一種快速、無損的方法,在不使用試劑的情況下,制備樣品較少或不需要制備樣品,是未來酚酸類檢測的可行性方法。
4.5 超高效液相色譜-串聯(lián)質譜聯(lián)用法(UPLC-MS/MS)
超高效液相色譜在高效液相色譜的基礎上對分離效果和靈敏度進一步提高[61-62],但是對分離化學分子質量、結構相近的化合物以及含量較低的游離酚酸分離效果和靈敏度還存在不足[63]。Fang等采用UPLC-MS對全國各地的金蓮花湯劑中化學成分進行鑒定,共鑒定出89種化合物,除個別化合物外,其他化合物的精密度、重復性、穩(wěn)定性和回收率均符合測定要求,定量限低至0.05~4.67 ng/mL[64],可用于中藥制劑痕量成分的相關研究。
優(yōu)化色譜柱、流動相組成和流速等色譜條件,使相鄰峰得到最佳分離,避免了峰拖尾,可以得到更好的檢測結果。Wabaidur等優(yōu)化UPLC-MS建立了一種簡便、靈敏、準確的UPLC-MS方法,用于蜂蜜中9種酚酸類、9種黃酮類、4種酚類物質的同時分離、鑒定和定量[13]。對于復雜的樣品,UPLC與MS聯(lián)用可以同時對多種酚酸類物質在較短的時間里進行定性與定量分析,具有高選擇性與高靈敏度,可節(jié)約試驗時間以及試驗能源,UPLC-MS越來越被科研工作者青睞。
5 展望
酚酸類物質已經(jīng)被證明是單一體系連作的重要化感物質。然而,其產生機制尚不完全明確,與植物生長的相互作用還需要深入研究,進行這些科學研究工作的前提是酚酸類物質從土壤環(huán)境中有效分離和快速分析,這對于快速發(fā)展的現(xiàn)代農業(yè)行業(yè)和產業(yè)來說,是急迫的技術需求。
另外,有研究發(fā)現(xiàn)酚酸物質在田間土壤中的濃度,明顯低于實驗室試驗抑制種子發(fā)芽和幼苗生長的濃度,田間條件下酚酸自毒的作用是如何發(fā)揮的?各種酚酸結構中的不同官能團,是否在化感自毒過程中扮演不同作用?酚酸類物質性質不穩(wěn)定,其酚羥基在光照、溫度等自然環(huán)境下會造成氧化失活,發(fā)生降解等反應,因此,溫室效應下氣溫升高與二氧化碳濃度升高是否會對酚酸類物質產生和降解產生影響?在農田自然條件下可以采取哪些措施,促進酚酸類物質降解?這些科學問題關系到田間土壤體系中酚酸物質自毒機理,以及能否通過改變環(huán)境因素,改變酚酸形態(tài),降低酚酸濃度,甚至在田間土壤環(huán)境中,原位降解酚酸,減少酚酸類物質的自毒效應,從而緩解作物的連作障礙問題。上述這些問題關系到農業(yè)的綠色高質量發(fā)展,都值得進一步深入研究。
參考文獻:
[1]Molish H B. Der einfluss einer pflanze auf die andere,allelopathie[J]. Nature,1938,141(3568):493.
[2]Macías F A,Mejías F J,Molinillo J M.Recent advances in allelopathy for weed control:from knowledge to applications[J]. Pest Management Science,2019,75(9):2413-2436.
[3]Bais H P,Vepachedu R,Gilroy S,et al. Allelopathy and exotic plant invasion:from molecules and genes to species interactions[J]. Science,2003,301(5638):1377-1380.
[4]Li Q A,Wu Y H,Wang J Y,et al. Linking short-chain N-acyl homoserine lactone-mediated quorum sensing and replant disease:a case study of Rehmannia glutinosa[J]. Frontiers in Plant Science,2020,11:787.
[5]Li J Y,Lin S X,Zhang Q,et al. Phenolic acids and terpenoids in the soils of different weed-suppressive circles of allelopathic rice[J]. Archives of Agronomy and Soil Science,2020,66(2):266-278.
[6]Zhang Z J,Liu Y J,Yuan L,et al. Effect of allelopathy on plant performance:a meta-analysis[J]. Ecology Letters,2021,24(2):348-362.
[7]謝星光,陳 晏,卜元卿,等. 酚酸類物質的化感作用研究進展[J]. 生態(tài)學報,2014,34(22):6417-6428.
[8]袁 圓,張愛民,王永平,等. 連作辣椒根圍化學成分鑒定與動態(tài)分析[J]. 江蘇農業(yè)科學,2018,46(21):139-144.
[9]張 璐,楊瑞秀,王 瑩,等. 甜瓜連作土壤中酚酸類物質測定及降解研究[J]. 北方園藝,2017(9):18-23.
[10]謝 越,俞 浩,汪建飛,等. 高效液相色譜法同時測定滁菊樣品中的9種酚酸[J]. 分析化學,2013,41(3):383-388.
[11]謝 越,周 成,涂 從,等. 近紅外光譜技術定量分析連作滁菊土壤中的阿魏酸含量[J]. 分析化學,2017,45(3):363-368.
[12]Martí R,Valcárcel M,Herrero-Martínez J M,et al. Simultaneous determination of main phenolic acids and flavonoids in tomato by micellar electrokinetic capillary electrophoresis[J]. Food Chemistry,2017,221:439-446.
[13]Wabaidur S M,Ahmed Y B H,Alothman Z A,et al. Ultra high performance liquid chromatography with mass spectrometry method for the simultaneous determination of phenolic constituents in honey from various floral sources using multiwalled carbon nanotubes as extraction sorbents[J]. Journal of Separation Science,2015,38(15):2597-2606.
[14]梁薇薇,陳立新,段文標,等. 酚酸物質對紅松種子萌發(fā)及苗木生長和生理特性的影響[J]. 生態(tài)學報,2021,41(4):1583-1592.
[15]Gulzar A,Siddiqui M B,Bi S.Phenolic acid allelochemicals induced morphological,ultrastructural,and cytological modification on Cassia sophera L. and Allium cepa L.[J]. Protoplasma,2016,253(5):1211-1221.
[16]吳紅淼,林文雄.藥用植物連作障礙研究評述和發(fā)展透視[J]. 中國生態(tài)農業(yè)學報(中英文),2020,28(6):775-793.
[17]謝 越,肖 新,周 毅,等. 5種酚酸物質對滁菊扦插幼苗生長及酶活性的影響[J]. 南京農業(yè)大學學報,2012,35(6):19-24.
[18]魯曉峰,杜國棟,邵 靜,等. 草莓根系線粒體對外源酚酸脅迫的生理響應[J]. 中國農業(yè)科學,2021,54(5):1029-1042.
[19]鄢邵斌,王 朋. 化感物質對植物根系形態(tài)屬性影響的meta分析[J]. 應用生態(tài)學報,2020,31(7):2168-2174.
[20]Wojtania A,Dziurka M,Skrzypek E. In vitro rooting response of yellow-flowered magnolia in relation to the phenolic acids content[J]. Agronomy,2020,10(12):1880.
[21]Abenavoli M R,Lupini A,Oliva S,et al. Allelochemical effects on net nitrate uptake and plasma membrane H+-ATPase activity in maize seedlings[J]. Biologia Plantarum,2010,54(1):149-153.
[22]Rocchetti G,Blasi F,Montesano D,et al. Impact of conventional/non-conventional extraction methods on the untargeted phenolic profile of Moringa oleifera leaves[J]. Food Research International,2019,115:319-327.
[23]張東明. 酚酸化學[M]. 北京:化學工業(yè)出版社,2009.
[24]Roselló-Soto E,Martí-Quijal F J,Cilla A,et al. Influence of temperature,solvent and pH on the selective extraction of phenolic compounds from tiger nuts by-products:triple-TOF-LC-MS-MS characterization[J]. Molecules,2019,24(4):797.
[25]楊澤良,黃良偉,向書琴,等. 細葉旱芹地上部不同溶劑浸提液對3種蔬菜種子萌發(fā)及幼苗生長的影響[J]. 中國瓜菜,2020,33(9):57-62,78.
[26]Alaón M E,Ivanovic' M,Gómez-Caravaca A M,et al. Choline chloride derivative-based deep eutectic liquids as novel green alternative solvents for extraction of phenolic compounds from olive leaf[J]. Arabian Journal of Chemistry,2020,13(1):1685-1701.
[27]Huang J,Guo X Y,Xu T Y,et al. Ionic deep eutectic solvents for the extraction and separation of natural products[J]. Journal of Chromatography A,2019,1598:1-19.
[28]Yang L L,Li L,Hu H,et al. Natural deep eutectic solvents for simultaneous extraction of multi-bioactive components from Jinqi Jiangtang preparations[J]. Pharmaceutics,2019,11(1):18.
[29]夏 婷,趙超亞,杜 鵬,等. 食品中多酚類化合物種類、提取方法和檢測技術研究進展[J]. 食品與發(fā)酵工業(yè),2019,45(5):231-238.
[30]Chan H P,Chua L S,Abdullah F I.Ultrasound assisted extraction and solvent partition for polyhydroxylated and polymethoxylated flavones and phenolic acids from Orthosiphon aristatus[J]. Separation Science Plus,2021,4(2):60-67.
[31]Pezeshkpour V,Khosravani S A,Ghaedi M,et al. Ultrasound assisted extraction of phenolic acids from broccoli vegetable and using sonochemistry for preparation of MOF-5 nanocubes:Comparative study based on micro-dilution broth and plate count method for synergism antibacterial effect[J]. Ultrasonics Sonochemistry,2018,40:1031-1038.
[32]薛宏坤,戴 寧,譚佳琪,等. 不同提取方法對萬壽菊花中總多酚和總花色苷動力學模型對比研究[J]. 食品研究與開發(fā),2020,41(3):6-13.
[33]Chen S S,Zeng Z,Hu N,et al. Simultaneous optimization of the ultrasound-assisted extraction for phenolic compounds content and antioxidant activity of Lycium ruthenicum Murr. fruit using response surface methodology[J]. Food Chemistry,2018,242:1-8.
[34]Vladic' J,Jankovic' T,Zˇivkovic' J,et al. Comparative study of subcritical water and microwave-assisted extraction techniques impact on the phenolic compounds and 5-hydroxymethylfurfural content in pomegranate peel[J]. Plant Foods for Human Nutrition,2020,75(4):553-560.
[35]Fang X S,Wang J H,Hao J F,et al. Simultaneous extraction,identification and quantification of phenolic compounds in Eclipta prostrata using microwave-assisted extraction combined with HPLC-DAD-ESI-MS/MS[J]. Food Chemistry,2015,188:527-536.
[36]Chiremba C,Rooney L W,Beta T . Microwave-assisted extraction of bound phenolic acids in bran and flour fractions from sorghum and maize cultivars varying in hardness[J]. Journal of Agricultural and Food Chemistry,2012,60(18):4735-4742.
[37]Pellati F,Prencipe F P,Bertelli D,et al. An efficient chemical analysis of phenolic acids and flavonoids in raw propolis by microwave-assisted extraction combined with high-performance liquid chromatography using the fused-core technology[J]. Journal of Pharmaceutical & Biomedical Analysis,2013,81/82:126-132.
[38]Molina G A,González-Fuentes F,Loske A M,et al. Shock wave-assisted extraction of phenolic acids and flavonoids from Eysenhardtia polystachya heartwood:a novel method and its comparison with conventional methodologies[J]. Ultrasonics Sonochemistry,2020,61:104809.
[39]Wang X Y,Wang S S,Huang S S,et al. Purification of polyphenols from distillers grains by macroporous resin and analysis of the polyphenolic components[J]. Molecules,2019,24(7):1284.
[40]鐘方麗,徐秀杰,王曉林. 覆盆子總酚酸純化工藝研究[J]. 食品工業(yè),2015,36(11):155-159.
[41]劉興賦,程盛勇,陳 慧,等. 大孔樹脂對蜘蛛香總酚酸的吸附熱力學和動力學研究[J]. 離子交換與吸附,2020,36(5):443-450.
[42]張曉華,呂敏明,鄭晶晶,等. 化學計量學二階校正方法結合高效液相色譜用于蜂蜜中10種酚酸類物質的快速定量分析[J]. 色譜,2020,38(5):572-580.
[43]Asadi S,Nojavan S,Behpour M,et al. Electromembrane extraction based on agarose gel for the extraction of phenolic acids from fruit juices[J]. Journal of Chromatography B,2020,1159:122401.
[44]張 莉,張辰凌,桂建業(yè),等. 固相膜萃取-膜上超聲衍生法測定水中酸性有機物[J]. 分析化學,2013,41(11):1709-1713.
[45]劉玉明,李珂嫻,何 穎,等. 枇杷花水提液總酚含量的Folin-Ciocalteu法測定[J]. 時珍國醫(yī)國藥,2017,28(4):838-840.
[46]林 倩,吳 昊,劉芊辰,等. 響應面法優(yōu)化福林酚法測定冬棗中總酚含量[J]. 食品工業(yè),2020,41(4):86-90.
[47]Ainsworth E A,Gillespie K M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent[J]. Nature Protocols,2007,2(4):875-877.
[48]Padda M S,Picha D H. Methodology optimization for quantification of total phenolics and individual phenolic acids in sweetpotato (Ipomoea batatas L.) roots[J]. Journal of Food Science,2007,72(7):412-416.
[49]Showkat M M,F(xiàn)alck-Ytter A B,Strtkvern K O.Phenolic acids in Jerusalem artichoke (Helianthus tuberosus L.):plant organ dependent antioxidant activity and optimized extraction from leaves[J]. Molecules,2019,24(18):3296.
[50]Liu A H,Li L E,Xu M,et al. Simultaneous quantification of six major phenolic acids in the roots of Salvia miltiorrhiza and four related traditional Chinese medicinal preparations by HPLC-DAD method[J]. Journal of Pharmaceutical and Biomedical Analysis,2006,41(1):48-56.
[51]González-González R M,Barragán-Mendoza L,Peraza-Campos A L,et al. Validation of an HPLC-DAD method for the determination of plant phenolics[J]. Revista Brasileira de Farmacognosia,2019,29(5):689-693.
[52]Nian B,Chen L J,Yi C,et al. A high performance liquid chromatography method for simultaneous detection of 20 bioactive components in tea extracts[J]. Electrophoresis,2019,40(21):2837-2844.
[53]潘智然,梁海龍,梁朝暉,等. 基于診斷離子策略的超高壓液相色譜-線性離子阱-軌道離子阱質譜聯(lián)用技術解析中藥虎杖的化學成分[J]. 色譜,2015,33(1):22-28.
[54]Xu L Y,Chang R M,Chen M,et al. Quality evaluation of Guan-Xin-Ning injection based on fingerprint analysis and simultaneous separation and determination of seven bioactive constituents by capillary electrophoresis[J]. Electrophoresis,2017,38(24):3168-3176.
[55]Lin Y H,Huang H C,Hsu W L.Application of capillary electrophoresis with electrokinetic supercharging and sweeping for the on-line preconcentration of phenolic acids[J]. Analytical and Bioanalytical Chemistry,2015,407(23):7093-7100.
[56]Chen X,Mao J X,Wen F Y,et al. Determination of phenolic acids in botanical pharmaceutical products by capillary electrophoresis with chemiluminescence detection[J]. Analytical Letters,2021,54(5):817-829.
[57]范林宏,范文翔,韋志強,等. 近紅外光譜技術結合化學計量學在中藥分析中的應用現(xiàn)狀[J]. 中國實驗方劑學雜志,2019,25(24):205-210.
[58]Bensemmane N,Bouzidi N,Daghbouche Y,et al. Quantification of phenolic acids by partial least squares Fourier-transform infrared (PLS-FTIR) in extracts of medicinal plants[J]. Phytochemical Analysis,2021,32(2):206-221.
[59]Vivar-Quintana A M,González-Martín M I,Revilla I,et al. Determination and quantification of phenolic acids in raw propolis by reversed phase high performance liquid chromatography.Feasibility study for the use of near infrared spectroscopy[J]. Journal of Apicultural Research,2018,57(5):648-656.
[60]Li W L,Qu H B.Rapid quantification of phenolic acids in Radix salvia Miltrorrhiza extract solutions by FT-NIR spectroscopy in transflective mode[J]. Journal of Pharmaceutical and Biomedical Analysis,2010,52(4):425-431.
[61]張 帥,叢海林,于 冰. 超高效液相色譜的發(fā)展及在分析領域的應用[J]. 分析儀器,2017(6):16-27.
[62]吳 哲,李趙嘉,馮 薇,等. 蒲公英酚酸綜合提取技術優(yōu)化及質量評價[J]. 江蘇農業(yè)科學,2020,48(23):190-195.
[63]Zhao X Q,Guo S,Yan H,et al. Analysis of phenolic acids and flavonoids in leaves of Lycium barbarum from different habitats by ultra-high-performance liquid chromatography coupled with triple quadrupole tandem mass spectrometry[J]. Biomedical Chromatography,2019,33(8):e4552.
[64]Fang M Y,Liu S Y,Wang Q Q,et al. Qualitative and quantitative analysis of 24 components in Jinlianhua decoction by UPLC-MS/MS[J]. Chromatographia,2019,82(12):1801-1825.

