化學感受蛋白直系同源基因CSP8在茶尺蠖及近緣種灰茶尺蠖中的表達分析
嚴玉婷,李玉杰,王倩,唐美君,郭華偉,李紅亮,孫亮*
化學感受蛋白直系同源基因在茶尺蠖及近緣種灰茶尺蠖中的表達分析
嚴玉婷1,2,李玉杰2,3,王倩4,唐美君2,郭華偉2,李紅亮1*,孫亮2*
1.中國計量大學生命科學學院/浙江省生物計量及檢驗檢疫技術重點實驗室,浙江 杭州 310018;2.中國農業科學院茶葉研究所/農業農村部茶葉質量安全控制實驗室,浙江 杭州 310008;3.河南科技學院植物保護系,河南 新鄉 453003;4.浙江農林大學農業與食品科學學院,浙江 杭州 311300
化學感受蛋白(Chemosensory proteins,CSPs)在昆蟲化學通訊及其他生理過程中發揮重要功能。茶尺蠖與其近緣種灰茶尺蠖是茶園重要鱗翅目害蟲,對我國茶葉的安全生產造成嚴重危害。研究化學感受蛋白直系同源基因在茶尺蠖兩近緣種間的表達,有助于研發同時針對該兩種害蟲的綠色防控技術。通過熒光定量qRT-PCR分析了直系同源基因在灰茶尺蠖中的表達分布。結果表明,與具有保守的幼蟲期高表達模式,主要表達于灰茶尺蠖3齡幼蟲頭部。進一步比較在茶尺蠖兩近緣種間的表達發現在茶尺蠖中的表達量顯著高于在灰茶尺蠖中的表達量。此外,還分析了沃爾巴克氏體菌()及揮發物誘導對表達的影響,發現顯著影響在灰茶尺蠖中的表達。該結果證實參與調控昆蟲CSPs基因的表達,為后續揭示介導CSPs表達,參與調控茶尺蠖兩近緣種化學感受及與茶樹的協同進化提供了新的研究思路。
茶尺蠖;灰茶尺蠖;化學感受蛋白;;表達分析
高度靈敏的嗅覺系統對昆蟲寄主定位、取食選擇、交配繁衍及躲避天敵等行為活動至關重要。觸角是昆蟲最重要的感受器官,其表面分布有多種類型的化學感受器感知外界化學信號[1]。外界信號分子主要通過感器表面的微孔進入嗅覺感器淋巴液。脂溶性的氣味分子無法直接穿過水溶性的感器淋巴液激活氣味受體(Odorant receptors,ORs),載體蛋白如氣味結合蛋白(Odorant binding protein,OBPs)、化學感受蛋白(Chemosensory protein,CSPs)在昆蟲感器淋巴液中大量表達,能夠選擇性的識別、結合運輸氣味分子穿過親水性的感器淋巴液至感覺神經元樹突,激活氣味受體,最終引發昆蟲相應的行為反應[2]。
CSPs被發現可在沙漠蝗()的接觸感器中表達,推測其具有化學感受功能,因而被命名為化學感受蛋白[3]。CSPs是一類水溶性小分子蛋白,分子量一般為10~15?kDa,具有4個半胱氨酸,可形成兩個二硫鍵。CSPs可以在昆蟲的各個組織廣泛表達,涉及調控昆蟲的多種生理過程[4]。例如NlugCSP10在褐飛虱(St?l)的多個發育時期表達,體外結合試驗與基因干擾證實NlugCSP10參與褐飛虱的感受識別順-3-己烯乙酸酯等寄主植物揮發物[5]。苜蓿盲蝽(Goeze)CSPs被證實能夠表達于多種化學感器的淋巴液,結合盲蝽性信息素及植物揮發物,推測其具有化學感受功能[6]。家蠶()CSPs可在殺蟲劑誘導下顯著上調,可能具有除化學通訊以外的其他功能[7-8]。此外,CSPs還被證實可參與東亞飛蝗()的行為相變[9]、蜚蠊()足的再生[10-11],以及紅火蟻(ta)的脫皮代謝等[12]。
茶尺蠖(Prout)與灰茶尺蠖(Warren)是茶園鱗翅目尺蛾科的一對近緣種害蟲,二者形態相似,均以幼蟲取食葉片危害茶樹[13]。近年來兩近緣種在我國局部茶區頻繁暴發,對茶葉安全生產和品質造成嚴重威脅。研究表明茶尺蠖兩近緣種在地理分布、生長發育歷期、求偶交配等方面存在明顯差異。茶尺蠖主要分布在浙江、江蘇和安徽等地茶園,灰茶尺蠖分布范圍更廣,二者存在混合發生區域[14-15]。灰茶尺蠖世代發育歷期比茶尺蠖短,發育速率也較茶尺蠖快,繁殖能力更強[16]。此外,二者存在明顯的生殖隔離和生殖競爭[17-18],兩種尺蠖雌蛾合成釋放的性信息素在組分和比例上存在差異[19]。共生菌尤其是沃爾巴克氏體菌()在兩近緣種間的攜帶率也顯著不同;利用快速進化基因外膜蛋白基因wsp分子檢測發現,主要在灰茶尺蠖中,茶尺蠖幾乎不攜帶[20]。四環素等抗生素處理茶樹葉片飼喂幼蟲,可以去除灰茶尺蠖體內的,建立不攜帶的灰茶尺蠖突變體種群[21]。
本實驗室前期研究鑒定了14個茶尺蠖化學感受蛋白基因,并明確了其在茶尺蠖中的發育時期及組織表達分布,其中被證明能夠表達于茶尺蠖的3齡幼蟲[22]。為鑒定兩近緣種幼蟲表達的化學感受蛋白,篩選重要的靶標功能基因調控幼蟲與茶樹互作行為,本研究繼續聚焦,采用實時熒光定量PCR技術著重研究直系同源基因在灰茶尺蠖中的表達分布及其在兩近緣種間的表達差異,旨在為后續揭示茶尺蠖兩近緣種與茶樹互作的化學通訊機制,研發針對兩近緣種幼蟲的綠色防控技術提供科學依據。
1 材料與方法
1.1 供試昆蟲
茶尺蠖幼蟲采于浙江省安吉縣(119.31°E,30.27°N),野外采集的茶尺蠖幼蟲根據前期研究報道進行分子鑒定確定種屬關系[18]。在實驗室建立茶尺蠖種群,溫度為(25±1)℃、光周期為L∶D=13∶11、相對濕度75%~80%。幼蟲用新鮮的茶樹葉片飼喂,化蛹后在顯微鏡下按雌雄分開。將新羽化的雌雄蛾配對交配,待雌蛾產卵后,收集試蟲卵條保存于4℃冰箱備用。灰茶尺蠖以及利用四環素處理去除共生菌的突變體(以下簡稱灰茶尺蠖突變體)種群已在實驗室繁殖飼養多代,飼養方法與上述茶尺蠖相同。
為研究共生菌對靶標基因表達量的影響,本研究試樣收集前,根據前期研究報道,對灰茶尺蠖及灰茶尺蠖突變體種群進行攜帶檢測驗證,確保灰茶尺蠖突變體種群中共生菌被去除[23]。
1.2 組織樣品收集
1.2.1 灰茶尺蠖各個發育時期樣品收集
為研究直系同源基因在灰茶尺蠖的各個發育時期的表達分布,分別取灰茶尺蠖卵(200粒)、3齡幼蟲(15頭)、雌雄蟲蛹(0~1?d)各30頭、未交配雌雄蛾(羽化0~1?d)各15頭。每個樣品收集3個生物學重復,樣品經液氮冷凍后迅速轉移至–80℃冰箱備用。
1.2.2 灰茶尺蠖3齡幼蟲各組織樣品收集
為研究在灰茶尺蠖3齡幼蟲各組織的表達情況,取20頭灰茶尺蠖3齡幼蟲進行解剖,分別收集幼蟲頭部、中腸、表皮及脂肪體,每個組織樣品至少收集3個生物學重復。收集樣品于液氮中冷凍后迅速轉移至–80℃冰箱備用。
1.2.3 茶尺蠖、灰茶尺蠖及灰茶尺蠖突變體3齡幼蟲樣品收集
為研究直系同源基因在茶尺蠖兩近緣種間是否存在表達量的差異,并分析其與的相關性,分別收集茶尺蠖、灰茶尺蠖及灰茶尺蠖突變體3齡幼蟲。收集30頭幼蟲頭部作為1個生物學重復,重復3次,樣品于液氮冷凍后迅速轉移至–80℃冰箱備用。
1.2.4 揮發物誘導試蟲樣品收集
有研究指出,茶樹揮發物順-3-己烯-1-醇參與茶尺蠖與茶樹互作調控[24-25],本研究選擇順-3-己烯-1-醇(純度>97%)作為誘導揮發物,分析茶尺蠖兩近緣種被誘導后體內的表達量變化。
取20頭3齡茶尺蠖幼蟲置于500?mL玻璃養蟲瓶中,瓶內放置2~3片茶樹葉片。取10?μL溶于石蠟的1?μg·μL-1順-3-己烯-1-醇加到3?cm×4?cm的濾紙條內,將濾紙條置于茶樹葉片中。玻璃瓶口用正方形的梨酸紙封口,再用直徑9?cm的培養皿蓋在瓶口,減少空氣流通。對照組將揮發物換成石蠟,其他條件與處理組相同。處理4、8、12?h后分別從處理組和對照組取5頭幼蟲作為1個樣品重復,共收集3個生物學重復。試蟲樣品經液氮速凍后轉移至–80℃冰箱保存備用。灰茶尺蠖試蟲處理方法與茶尺蠖相同。
1.3 總RNA提取及第一鏈cDNA合成
將樣品在滅菌的研缽中用液氮充分研磨,加入Trizol(Invitrogen),按照Trizol法提取樣品總RNA。通過1%的瓊脂糖凝膠電泳檢測總RNA完整性。利用NanoDrop 2000分光光度計(Thermo,美國)測定總RNA的濃度。經檢測驗證的各組織總RNA于–80℃冰箱保存備用。
利用PrimeScriptTMRT reagent Kit with gDNA Eraser試劑盒[寶日醫生物技術(北京)有限公司]進行第一鏈cDNA的合成。第一步10?μL反應體系:2.0?μL 5×gDNA Eraser buffer,1.0?μL gDNA Eraser,6.0?μL ddH2O,1.0?μL RNA,42℃反應2?min,4℃保存備用。第二步10?μL反應體系:4.0?μL 5×PrimeScript Buffer,1.0?μL PrimeScript RT Enzyme Mix I,1.0?μL RT Primer Mix,4.0?μL ddH2O,與第一步反應體系充分混勻,37℃反應15?min,85℃5?s,4℃保存備用。利用NanoDrop 2000分光光度計測定cDNA模板的濃度,稀釋至200~300?ng·μL-1存于–20℃冰箱備用。
通過內參基因進行反轉錄cDNA模板的驗證,20?μL PCR反應體系包括rTaq酶反應混合物10.0?μL,上下游引物(表1)各0.8?μL,cDNA模板1.0?μL,ddH2O 7.4?μL。反應程序:94℃預變性3?min;94℃變性30?s,56℃退火30?s,72℃延伸1?min,40個循環;72℃ 10?min,4℃保存。用1%的瓊脂糖凝膠電泳檢測PCR產物條帶。
1.4 實時熒光定量PCR(qRT-PCR)
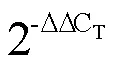
2 結果與分析
2.1 EgriCSP8在灰茶尺蠖不同發育時期的表達分析
前期研究發現,在茶尺蠖3齡幼蟲期高表達[22]。為了明確其直系同源基因是否在灰茶尺蠖幼蟲期大量表達,本研究收集了灰茶尺蠖不同發育時期,包括卵、幼蟲期(3齡)、雌雄蛹期和雌雄成蟲期,通過qRT-PCR分析在各發育時期的表達動態。結果表明,在灰茶尺蠖各個發育階段都有表達,但相對表達豐度存在差異。在灰茶尺蠖卵期表達水平很低,在3齡幼蟲期表達量最高,進入蛹期后雌雄兩性的表達量均迅速下降,直至成蟲期都維持相對較低的表達水平(圖1)。表達量在3齡幼蟲期與其他發育時期存在顯著差異;卵、雌雄蛹期及雌雄成蟲期之間差異不顯著。

表1 實時熒光定量PCR引物
2.2 EgriCSP8在灰茶尺蠖幼蟲不同組織的表達分布
解剖灰茶尺蠖3齡幼蟲,利用qRT-PCR比較在灰茶尺蠖幼蟲頭部、中腸、表皮和脂肪體中的相對表達量。結果表明,主要表達于幼蟲頭部和表皮,其他部位的相對表達量很低,其中幼蟲頭部表達量較其他組織差異顯著(圖2)。
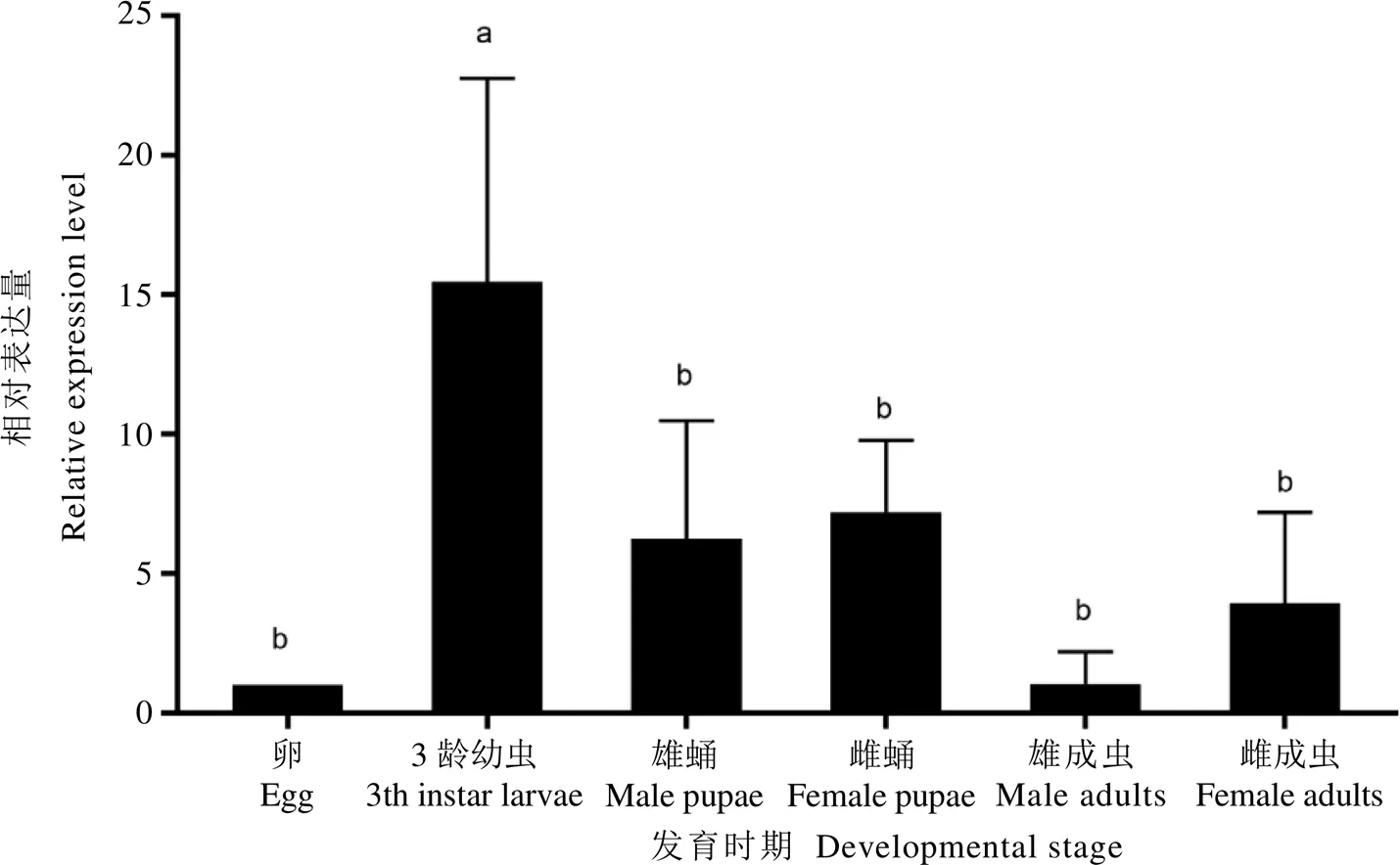
注:不同字母表示樣品之間存在顯著差異(P<0.05),下同

圖2 EgriCSP8在灰茶尺蠖3齡幼蟲不同組織的表達
2.3 Eobl-EgriCSP8在茶尺蠖兩近緣種間的表達分析
利用qRT-PCR比較分析了在茶尺蠖兩近緣種3齡幼蟲間的表達量,結果表明,在茶尺蠖與灰茶尺蠖間的表達量存在顯著差異,在茶尺蠖3齡幼蟲中的表達量顯著高于其直系同源基因在灰茶尺蠖3齡幼蟲中的表達(圖3)。
2.4 Wolbachia對Eobl-EgriCSP8表達的影響
為分析共生菌是否與在茶尺蠖兩近緣種間表達差異有關。本研究利用qRT-PCR比較分析了灰茶尺蠖3齡幼蟲在去除前后表達量的變化。結果表明,的去除對的表達量存在顯著影響,與未處理組相比,去除的灰茶尺蠖3齡幼蟲中的表達量顯著降低(圖4)。
進一步分析比較在去除的灰茶尺蠖中表達量與在茶尺蠖3齡幼蟲中的表達量發現,在茶尺蠖中的表達量顯著高于在灰茶尺蠖突變體中的表達量(圖5)。

圖3 Eobl-EgriCSP8在茶尺蠖兩近緣種3齡幼蟲間的表達量

圖4 EgriCSP8在灰茶尺蠖與灰茶尺蠖Wolbachia突變體3齡幼蟲間的表達量
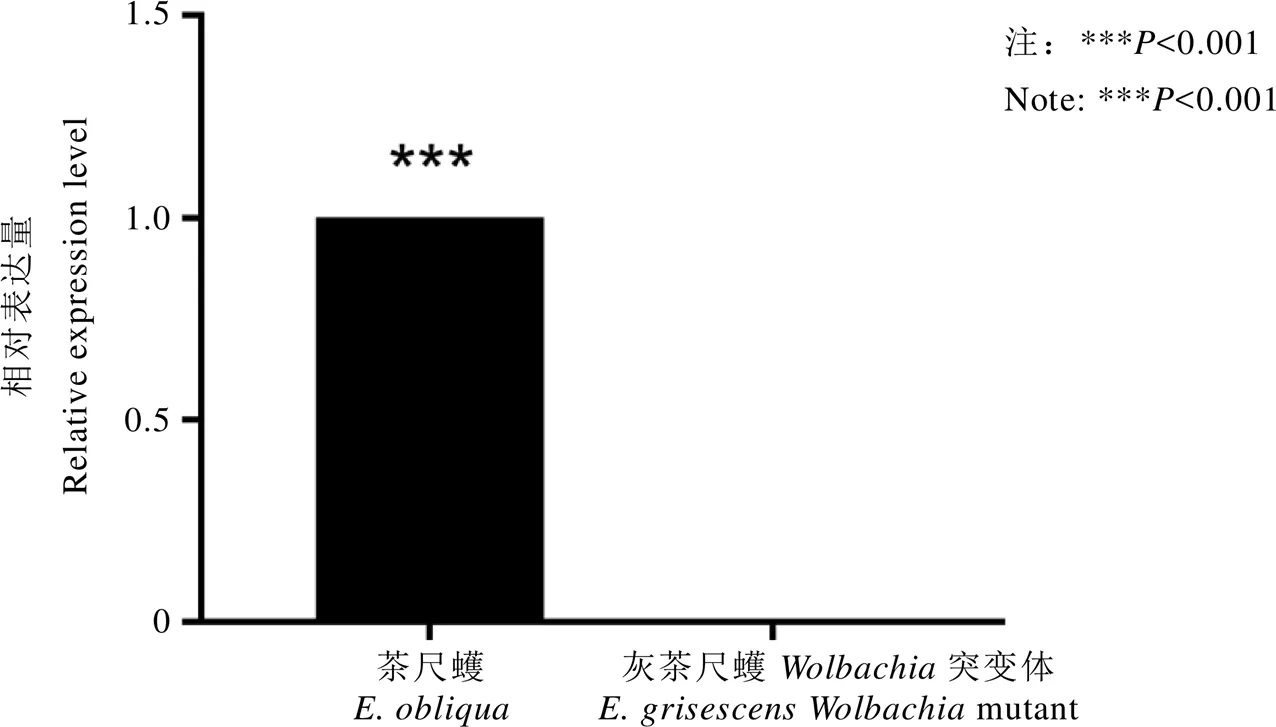
圖5 EoblCSP8在茶尺蠖與其直系同源EgriCSP8在灰茶尺蠖Wolbachia突變體3齡幼蟲間的表達量
2.5 順-3-己烯-1-醇對Eobl-EgriCSP8表達的影響
由圖6可知,茶尺蠖3齡幼蟲在順-3-己烯-1-醇誘導處理后,轉錄表達水平均略高于對照組,但統計分析表明誘導處理前后的表達均無顯著差異。
灰茶尺蠖3齡幼蟲在順-3-己烯-1-醇誘導處理4?h和8?h時,轉錄表達水平沒有顯著變化,誘導12?h處理后表達量有所上升但差異不顯著(圖7)。
3 討論
鱗翅目蛾類幼蟲是害蟲危害農作物主要蟲期,研究幼蟲中高表達的靶標功能基因有助于研發幼蟲的綠色防控技術。本研究比較分析了化學感受蛋白基因在茶尺蠖兩近緣種幼蟲間的轉錄表達,有助于解析CSPs在調控茶尺蠖兩近緣種識別定位茶樹中的生理功能。
CSPs被報道表達于昆蟲的化學感受器官,參與調控昆蟲的化學通訊行為[27]。大螟()被證實表達于雄蛾觸角,并且強烈結合雌蛾合成釋放的性信息素[28]。CSPs在半翅目盲蝽類昆蟲中也被廣泛研究,通過免疫組織定位研究發現苜蓿盲蝽的CSP1-6均可在成蟲觸角化學感器中表達,體外熒光競爭性結合試驗證實CSP1-6可以結合大多數寄主植物揮發物[6,29]。本實驗室前期研究鑒定了14個茶尺蠖化學感受蛋白基因,表達譜分析發現在茶尺蠖3齡幼蟲期表達水平較高[22]。實驗室前期研究發現灰茶尺蠖中存在的直系同源基因,明確的發育時期及組織表達分布,有助于分析其潛在的生理功能。
本研究首先利用qRT-PCR分析了在灰茶尺蠖不同發育時期的表達動態,結果表明,與其直系同源基因具有保守的發育表達模式,和都在茶尺蠖兩近緣種幼蟲期大量表達。組織表達譜分析發現,與相似,均表達于幼蟲頭部與表皮,統計分析結果顯示在灰茶尺蠖幼蟲頭部表達量顯著高于表皮和其他組織。鱗翅目蛾類幼蟲頭部是其主要的化學感受器官[30-32]。灰茶尺蠖幼蟲頭部感器結構研究表明,頭部觸角上著生有栓錐形感器、錐形感器、刺形感器,上下唇與上下顎等也分布有化學感器[33]。與在茶尺蠖兩近緣種幼蟲頭部高表達暗示其可能涉及幼蟲化學通訊行為,然而該推論還需進一步提供在茶尺蠖兩近緣種幼蟲頭部化學感器表達的證據。此外,均可表達于茶尺蠖兩近緣種3齡幼蟲表皮,尤其是在茶尺蠖3齡幼蟲表皮中表達量較高[22],據此推測,在茶尺蠖與灰茶尺蠖兩近緣種間可能還涉及調控其他生理過程。

圖6 順-3-己烯-1-醇誘導對EoblCSP8在茶尺蠖中表達的影響

圖7 順-3-己烯-1-醇誘導對EgriCSP8在灰茶尺蠖中表達的影響
昆蟲CSPs可以被農藥等外源性化合物誘導表達例如被證實在煙粉虱()B生物型和Q生物型中的表達量不同,新煙堿類農藥噻蟲嗪誘導處理后的表達量提高了5~10倍[34];阿維菌素處理家蠶也可以顯著改變基因的轉錄表達[8];體外表達的中華蜜蜂()CSP1重組蛋白可以與新煙堿類農藥吡蟲啉發生互作[35]。本研究分析了茶樹揮發物順-3-己烯-1-醇對的誘導表達情況,結果顯示,揮發物順-3-己烯-1-醇誘導處理后,與的表達量在不同處理時間略有變化,但與相同時間下的對照組差異不顯著。功能基因的誘導表達可能受處理時間、誘導底物、組織樣品間的變異等多種因素影響,是否是誘導底物選擇、處理劑量或樣品間的變異等導致該結果仍然需要后續更為詳細的研究分析。
CSPs在蛾類昆蟲近緣種幼蟲間的比較分析報道較少。本研究比較分析了在茶尺蠖兩近緣種幼蟲間的表達量,結果顯示,在茶尺蠖3齡幼蟲中的表達量顯著高于在灰茶尺蠖3齡幼蟲中的表達。進一步研究比較灰茶尺蠖與灰茶尺蠖突變體、茶尺蠖與灰茶尺蠖突變體間的表達量發現,共生菌的去除顯著降低了在灰茶尺蠖3齡幼蟲中的表達量,導致灰茶尺蠖突變體中的表達量顯著低于茶尺蠖3齡幼蟲。亞致死劑量吡蟲啉處理褐飛虱可增加褐飛虱體內的,同時誘導提高了細胞色素P450基因的表達,當利用四環素清除后基因的誘導表達被明顯減弱[36]。本研究中,在灰茶尺蠖中的去除同樣顯著降低了在灰茶尺蠖中的轉錄表達,證實共生菌可能參與調控昆蟲化學感受相關基因在近緣種間的轉錄表達。
致謝:感謝中國農業科學院茶葉研究所孫曉玲研究員提供本研究中茶樹揮發物順-3-己烯-1-醇。
[1] Elgar M A, Zhang D, Wang Q, et al.Insect antennal morphology: the evolution of diverse solutions to odorant perception [J].The Yale Journal of Biology and Medicine, 2018, 91: 457-469.
[2] Leal W S.Odorant reception in insects: roles of receptors, binding proteins, and degrading enzymes [J].Annual Review of Entomology, 2013, 58: 373-391.
[3] Angeli S, Ceron F, Scaloni A, et al.Purification, structural characterization, cloning and immunocytochemical localization of chemoreception proteins from[J].European Journal of Biochemistry, 1999, 262: 745-754.
[4] Pelosi P, Iovinella I, Zhu J, et al.Beyond chemoreception: diverse tasks of soluble olfactory proteins in insects [J].Biological Reviews Cambridge Philosophical Society, 2018, 93: 184-200.
[5] Waris M I, Younas A, Adeel M M, et al.The role of chemosensory protein 10 in the detection of behaviorally active compounds in brown planthopper,[J].Insect Science, 2020, 27(3): 531-544.
[6] Sun L, Zhou J J, Gu S H, et al.Chemosensillum immunolocalization and ligand specificity of chemosensory proteins in the alfalfa plant bug(Goeze) [J].Scientific Reports, 2015, 5: 8073.doi: 10.1038/srep08073.
[7] Qiao H L, Deng P Y, Li D D, et al.Expression analysis and binding experiments of chemosensory proteins indicate multiple roles in[J].Journal of Insect Physiology, 2013, 59: 667-675.
[8] Xuan N, Guo X, Xie H Y, et al.Increased expression of CSP and CYP genes in adult silkworm females exposed to avermectins [J].Insect Science, 2015, 22(2): 203-219.
[9] Guo W, Wang X H, Ma Z Y, et al.andgenes modulate the switch between attraction and repulsion during behavioral phase change in the migratory locust [J].PLoS Genetics, 2011, 7: e1001291.doi: 10.1371/journal.pgen.1001291.
[10] Kitabayashi A N, Arai T, Kubo T, et al.Molecular cloning of cDNA for p10, a novel protein that increases in the regenerating legs of(American cockroach) [J].Insect Biochemistry and Molecular Biology, 1998, 28(10): 785-790.
[11] Nomura A, Kawasaki K, Kubo T, et al.Purification and localization of p10, a novel protein that increases in nymphal regenerating legs of(American cockroach) [J].International Journal of Developmental Biology, 1992, 36(3): 391-398.
[12] Cheng D, Lu Y, Zeng L, et al.Si-CSP9 regulates the integument and moulting process of larvae in the red imported fire ant,[J].Scientific Reports, 2015, 5: 9245.
[13] 唐美君, 王志博, 郭華偉, 等.茶尺蠖和灰茶尺蠖幼蟲及成蟲的鑒別方法[J].植物保護, 2019, 45(4): 172-175.
Tang M J, Wang Z B, Guo H W, et al.An identification method for the adult and larva between the two sibling speciesand[J].Plant Protection, 2019, 45(4): 172-175.
[14] Li Z Q, Cai X M, Luo Z X, et al.Geographical distribution of(Lepidoptera: Geometridae) andin China and description of an efficient identification method [J].Journal of Economic Entomology, 2019, 11(1): 277-283.
[15] 白家赫, 王志博, 肖強.浙江茶區茶尺蠖兩近緣種的遺傳分化及分布[J].昆蟲學報, 2018, 61(6): 741-748.
Bai J H, Wang Z B, Xiao Q.Genetic differentiation and distribution of two sibling species of tea geometrids in tea-growing areas in Zhejiang, eastern China [J].Acta Entomological Sinica, 2018, 61(6): 741-748.
[16] 白家赫, 唐美君, 殷坤山, 等.灰茶尺蛾和小茶尺蠖兩近緣種的生物學特性差異[J].浙江農業學報, 2018, 30(5): 797-803.
Bai J H, Tang M J, Yin K S, et al.Differential biological characteristics between closely related tea geometrid species,and[J].Acta Agriculture Zhejiangensis, 2018, 30(5): 797-803.
[17] Zhang G H, Yuan Z J, Yin K S, et al.Asymmetrical reproductive interference between two sibling species of tea looper:and[J].Bulletin of Entomological Research, 2016: 1-8.doi: 10.1017/s0007485316000602.
[18] Zhang G H, Yuan Z J, Zhang C, et al.Detecting deep divergence in seventeen populations of tea geometrid (Prout) in China by COI mtDNA and cross-breeding [J].PLoS One, 2014, 9: e99373.doi: 10.1371/journal.pone.0099373.
[19] Luo Z X, Li Z Q, Cai X M, et al.Evidence of premating isolation between two sibling moths:and(Lepidoptera: Geometridae) [J].Journal of Economic Entomology, 2017, 110(6): 2364-2370.
[20] Wang Z B, Li H, Zhou X G, et al.Comparative characterization of microbiota between the sibling species of tea geometrid mothProut andWarren [J].Bulletin of Entomological Research, 2020,110(6): 684-693.
[21] 王志博, 白家赫, 周孝貴, 等.3種抗生素處理對灰茶尺蛾內生菌群的影響[J].茶葉科學, 2021, 41(1): 90-100.
Wang Z B, Bai J H, Zhou X G, et al.Effect of three antibiotic treatments on bacterial endosymbiont community ofWarren [J].Journal of Tea Science, 2021, 41(1): 90-100.
[22] Sun L, Mao T F, Zhang Y X, et al.Characterization of candidate odorant-binding proteins and chemosensory proteins in the tea geometridProut (Lepidoptera: Geometridae) [J].Archives of Insect Biochemistry and Physiology, 2017, 94(4): e21383.doi: 10.1002/arch.21383.
[23] 周孝貴, 付建玉, 劉守安, 等.茶尺蠖和灰茶尺蠖內共生菌Wolbachia的分子檢測及序列分析[J].應用昆蟲學報, 2016, 53(4): 782-792.
Zhou X G, Fu J Y, Liu S A, et al.Molecular detection and sequence analysis of Wolbachia strains inand(Lepidoptera: Geometridae) [J].Chinese Journal of Applied Entomology, 2016, 53(4): 782-792.
[24] Jing T T, Zhang N, Gao T, et al.Glucosylation of ()-3-hexenol informs intraspecies interactions in plants: a case study in[J].Plant Cell and Environment, 2019, 42(4): 1352-1367.
[25] Sun X L, Wang G C, Gao Y, et al.Volatiles emitted from tea plants infested bylarvae are attractive to conspecific moths [J].Journal of Chemical Ecology, 2014, 40: 1080-1089.
[26] Sun L, Wang Q, Zhang Y, et al.Expression patterns and colocalization of two sensory neurone membrane proteins inProut, a geometrid moth pest that uses Type-II sex pheromones [J].Insect Molecular Biology, 2019, 28: 342-354.
[27] Pelosi P, Zhou J J, Ban L P, et al.Soluble proteins in insect chemical communication [J].Cellular and Molecular Life Sciences, 2006, 63: 1658-1676.
[28] Zhang Y N, Ye Z F, Yang K, et al.Antenna-predominant and male-biased CSP19 ofis able to bind the female sex pheromones and host plant volatiles [J].Gene, 2014, 536: 279-286.
[29] Gu S H, Wang S Y, Zhang X Y, et al.Functional characterizations of chemosensory proteins of the alfalfa plant bugindicate their involvement in host recognition [J].PLoS One, 2012, 7: e42871.doi: 10.1371/journal.pone.0042871.
[30] Albert P J.Electrophysiological responses to sucrose from a gustatory sensillum on the larval maxillary palp of the spruce budworm,(Clem.) (Lepidoptera: Tortricidae) [J].Journal of Insect Physiology, 2003, 49(8): 733-738.
[31] del Campo M L, Miles C I.Chemosensory tuning to a host recognition cue in the facultative specialist larvae of the moth[J].Journal of Experimental Biology, 2003, 206: 3979-3990.
[32] Zacharuk R Y, Shields, V D.Sensilla of immature insects [J].Annual Review of Entomology, 1991, 36: 331-354.
[33] 張方梅, 金銀利, 張麗麗, 等.灰茶尺蠖成蟲觸角及幼蟲頭部感器超微結構[J].昆蟲學報, 2019, 62(6): 743-755.
Zhang F M, Jin Y L, Zhang L L, et al.Ultrastructure of the sensilla on adult antenna and larval head of(Lepidoptera: Geometridae) [J].Acta Entomological Sinica, 2019, 62(6): 743-755.
[34] Liu G X, Xuan N, Chu D, et al.Biotype expression and insecticide response ofchemosensory protein-1 [J].Archives of Insect Biochemistry and Physiology, 2014, 85(3): 137-151.
[35] Li H L, Tan J, Song X M, et al.Sublethal doses of neonicotinoid imidacloprid can interact with honey bee chemosensory protein 1 (CSP1) and inhibit its function [J].Biochemical and Biophysical Research Communications, 2017, 486(2): 391-397.
[36] Cai T W, Zhang Y H, Liu Y, et al.enhances expression ofinin response to imidacloprid stress [J].Insect Science, 2021, 28: 355-362.
The Expression Profiles of Chemosensory Protein 8 Orthologs in Two Closely Related Tea Geometrid Species,Prout andWarren
YAN Yuting1,2, LI Yujie2,3, WANG Qian4, TANG Meijun2, GUO Huawei2, LI Hongliang1*, SUN Liang2*
1.College of Life Science, China Jiliang University/Zhejiang Provincial Key Laboratory of Biometrology and Inspection and Quarantine, Hangzhou 310018, China; 2.Key Laboratory of Tea Quality and Safety Control, Ministry of Agriculture, Tea Research Institute, Chinese Academy of Agricultural Sciences, Hangzhou 310008, China; 3.Department of Plant Protection, Henan Institute of Science and Technology, Xinxiang 453003, China; 4.College of Agriculture and Food Science, Zhejiang A & F University, Hangzhou 311300, China
Chemosensory proteins (CSPs) play crucial roles in insect chemosensory and non-chemosensory processes.Prout and its sibling species,Warren are serious lepidopteran moth pests in tea gardens and they cause destructive damages to tea plants.The development of greener and environmentally friendly pest managements would benefit from orthologous CSPs’ investigation on the interaction between twospecies and tea plants.This study mainly examined the expression profiles of, the orthologs ofinby using the real-time quantitative PCR experiment.The qRT-PCR results show thatandhad a conserved larvae-enriched expression pattern.was mainly expressed in the heads of the third instar oflarvae.Next, the expression levels ofwere compared betweenand.The results show that the expression level ofinwas higher than that ofin.In addition, the effects ofand tea plant volatiles onexpression levels inandwere also estimated.The results show that theexpression level declined significantly whenwas removed in, which provided the first evidence that the insect CSPs’ expression is associated with.These findings laid a foundation for the future studies on the molecular mechanisms of chemosensory and coevolution between the geometrid sibling species and tea plants.
Prout,Warren, chemosensory protein,, expression analysis
S571.1,S435.711
A
1000-369X(2022)02-200-11
2021-03-19
2021-04-14
中國科協青年人才托舉工程項目(2018QNRC001)、中央級公益性科研院所基本科研業務費專項(1610212020001,1610212018010)、國家自然科學基金(31501652,31871977)
嚴玉婷,女,碩士研究生,主要從事昆蟲生化與分子生物學方面的研究。*通信作者:hlli@cjlu.edu.cn;liangsun@tricaas.com
(責任編輯:黃晨)

