形變配準法與直接疊加法用于宮頸癌內外照射累積劑量的研究
劉子成,崔相利,劉苓苓,王金云,費振樂,3
1. 安徽醫科大學 生物醫學工程學院,安徽 合肥 230032;2. 中國科學院合肥腫瘤醫院 放療中心,安徽 合肥 230031;3. 中國人民解放軍聯勤保障部隊第901醫院 腫瘤診療中心,安徽 合肥 230031
引言
宮頸癌是婦科常見的惡性腫瘤,發病率和死亡率均居世界第四位[1]。目前,宮頸癌治療有手術、放療和化療三種方式,對于Ⅱ~Ⅳ期宮頸癌,體外放療聯合后裝的根治性放療是首選治療方式[2]。在宮頸癌根治性放療中,體外放療后再進行近距離放療既可提高腫瘤局部控制率,又可更好地保護周圍正常組織[3]。由于宮頸癌患者內照射采用截石位且置入施源器,容易造成內照射分次間、內照射與外照射體位間較大差異,從而造成劑量評估的差異。目前,臨床上普遍使用的劑量疊加方法是基于生物學效應的線性二次方程模型的直接疊加法,該方法簡潔、方便,可快速給出劑量疊加的結果[4],但忽略了體位差異,無法確保劑量疊加的準確性。形變配準是一種可較大程度地削弱體位差異,提高劑量疊加精度的方法[5-6]。目前,可進行形變配準的軟件有多模態圖像合并(Multi-modality Image Merger,MIM)軟件和Velocity軟件,前人驗證了MIM軟件在彈性模體形變配準中的可靠性和精度[7-8]。勞崢等[9]對比分析MIM和Velocity軟件之間的形變配準精度,發現兩者均能滿足臨床應用,而MIM操作更加簡便。由于MIM軟件屬于商業化軟件,很多醫院暫未配備。本研究借助MIM軟件和宮頸癌患者的內外放療計劃,運用直接疊加法和形變配準法對內照射劑量和內外照射劑量進行疊加,對比分析兩種疊加法的差異,評估直接疊加法評估的準確性。
1 材料與方法
1.1 病例資料
隨機選取2020年1月至2020年12月在中國科學院合肥腫瘤醫院行根治性放療的10例宮頸癌患者的CT影像資料,年齡53~81歲(中位年齡為66.5歲)。根據國際婦產科聯合會制定的標準[10],10例患者臨床分期為宮頸癌ⅡA期3例、宮頸癌ⅡB期1例、宮頸癌ⅢB期2例、宮頸癌ⅢC期4例。所有患者均先進行體外放療后再進行三維腔內近距離治療。
1.2 定位CT掃描及靶區、危及器官勾畫
患者掃描外照射定位CT前1 h排空膀胱,口服泛影葡胺溶液500 mL(配比為泛影葡胺40 mL:水1000 mL)。仰臥位,雙手互握肘置于頭頂,并攏雙腿,熱塑膜固定,在患者體表和體膜上做好標記。使用飛利浦公司的大孔徑CT模擬定位機對患者進行CT掃描。掃描參數為:電壓120 kV,曝光325 mAs,層厚5 mm。發送CT圖像至Monaco 5.11計劃系統。根據放射治療腫瘤協作組指南[11],逐層勾畫臨床靶區(Clinical Target Volume,CTV)。CTV定義為腫瘤組織及可能浸潤的亞臨床病灶,包括子宮、宮頸、部分陰道、盆腔及部分腹主動脈旁淋巴結引流區。CTV邊緣外放0.5 cm形成計劃靶區(Plan Target Volume,PTV),并勾畫出膀胱、直腸、小腸等危及器官(Organ At Risk,OAR)。
患者每次內照射定位前1 h口服泛影葡胺溶液500 mL(配比為泛影葡胺40 mL:水1000 mL),排空膀胱,截石位,在后裝治療床上使用真空墊固定體位。插入Foley導尿管,并于氣囊內注入20%泛影葡胺7 mL。掃描定位CT時、治療前膀胱中分別注入100 mL的生理鹽水,其他時間排空膀胱。宮腔和陰道內同時放置施源器,同一患者均使用同一款施源器進行分次治療。每次治療前,使用大孔徑CT模擬定位機掃描CT圖像。掃描參數:電壓120 kV,曝光325 mAs,層厚3 mm。發送CT圖像到Varian BrachyVision后裝治療計劃系統。根據歐洲放射治療協會指南[12],放療醫師逐層勾畫CTV及OAR。臨床靶區定義為放化療后殘存腫瘤最大的區域,包括整個子宮頸和明顯殘留的宮頸和宮頸以外的腫塊,OAR包括膀胱、直腸和乙狀結腸。
1.3 放療計劃設計
宮頸癌患者外照射計劃均采用VMAT共面雙弧技術,且在Monaco 5.11計劃系統中實現。處方劑量為50 Gy/25次,95%以上體積的PTV均達到處方劑量;OAR限量要求參照RTOG0418[13]。計劃評估參數包括PTV的適形度(Coverage Index,CI)、劑量不均勻性指數(Heterogeneity Index,HI)、小腸、直腸、膀胱、乙狀結腸、雙側股骨頭接受30、40和50 Gy照射的體積占總體積的百分比(V30、V40、V50)和脊髓所受的最大劑量(Dmax)。
宮頸癌患者內照射計劃均采用三維腔內近距離放療,在Varian BrachyVision計劃系統中設計放療計劃。每位患者均行5次三維腔內治療,處方劑量為6 Gy/次,90%以上體積的CTV達到處方劑量;OAR限量要求參照Report 89號報告[14]。計劃評估參數包括接受最大劑量的膀胱、直腸和乙狀結腸的0.1 cm3和2 cm3體積所接受的最小劑量(D0.1cc、D2cc)。
1.4 內照射和外照射劑量疊加方法
1.4.1 直接疊加法
根據GEC-ESTRO婦科協作組推薦指南Ⅰ~Ⅳ[12,15-16]中OAR累積劑量的計算方法是假設一個“最壞情況”,即假設每次放療的最高劑量都落在同一位置上。內、外照射累積劑量直接疊加的前提是需要將內照射中OAR的D2cc、D0.1cc利用公式(1)[15]計算為等效成2 Gy時的吸收劑量(Equivalent Dose,EQD2Gy)。因外照射為單次劑量2 Gy的分次治療(假設外照射的腫瘤及危及器官均接受了100%的處方劑量且受照劑量均勻[14]),OAR劑量數值可與內照射計算的EQD2Gy直接相加。
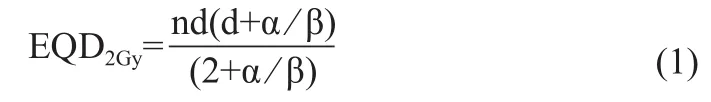
其中,n為治療次數;d為分次劑量;α/β值中腫瘤取10,OAR取3。列舉2例如下。
(1)例1:計算某例患者的三維腔內近距離放療計劃6 Gy×5次的腫瘤靶區EQD2Gy。按照公式(1)和放療計劃劑量體積直方圖(Dose-Volume Histogram,DVH)中的數值,n1×d1=6.09;n2×d2=6.25;n3×d3=6.19;n4×d4=6.00;n5×d5=6.13,n1、n2、n3、n4、n5 均為 1,腫瘤 α/β 值為 10,則
(2)例2:計算某例患者的三維腔內近距離放療計劃 6 Gy×5次的膀胱D2cc的EQD2Gy。按照公式(1)和DVH中的值,n1×d1=4.84;n2×d2=4.92;n3×d3=4.97;n4×d4=4.83;n5×d5=4.69,n1、n2、n3、n4、n5均 為 1, 膀 胱 值 為 3,則
以EQD2Gy作為標準等效劑量,解決了不同分割放療的等效劑量計算問題。直接疊加法就是將外照射劑量轉換為常規2 Gy分次放射的等效劑量,再與計算后的內照射總EQD2Gy直接相加。
1.4.2 形變配準法
本研究借助MIM 6.8.4軟件中的形變配準工作流對宮頸癌內照射劑量、內外照射劑量進行疊加。MIM軟件中形變配準算法是利用圖像灰度進行變形,通過空間變換來尋找CT圖像像素之間的空間對應關系,引入多個自由度測量像素對其間的相似度使全局達到最優,從而實現較高配準度[17]。
(1)內照射分次間劑量疊加。將CT圖像導入MIM 6.8.4軟件中,將第一次治療CT圖像作為參考圖像,第二次治療CT圖像作為目標圖像。先基于盆腔骨標志進行剛性配準,再以灰度為基礎進行密度形變配準,最后形成融合CT和疊加劑量參數。按照治療順序將內照射5次治療的CT圖像進行形變配準。
(2)內外照射劑量疊加。如圖1所示,在MIM中將外照射治療CT圖像作為參考圖像,5次內照射治療配準融合新CT圖像作為目標圖像,同樣先進行盆腔骨解剖結構的剛性配準,減少圖像像素之間的位置差,提高配準速度和精度,再進行形變配準形成融合CT和疊加劑量參數。
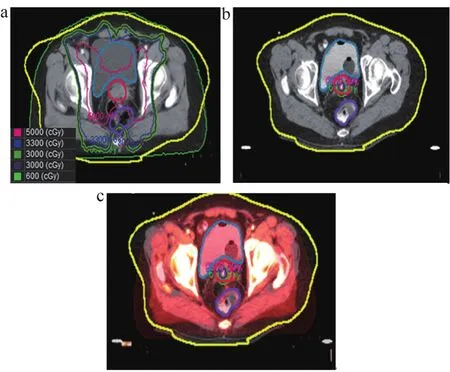
圖1 MIM軟件中宮頸癌內外照射劑量疊加示意圖
配準過程中用Reg Refine功能檢查形變結果,配準結果運用計算融合度中的歸一化互信息和平均絕對值評價[18]。
1.5 統計學分析
采用SPSS 25.0軟件進行數據處理,數據用±s表示。將兩種方法獲得的劑量參數進行成組設計資料的t檢驗,當P<0.05時,差異具有統計學意義。
2 結果
2.1 內照射分次間劑量疊加
本研究應用直接疊加法和MIM軟件中的形變配準法分別對每例患者5次后裝放療計劃進行劑量疊加,分析結果表明:直接疊加法所得腫瘤臨床靶區D90%、膀胱D2cc、直腸D2cc、直腸D0.1cc分別為6.54、1.66、4.05和9.66 Gy,且均有明顯差異(P<0.05)。直接疊加法所得膀胱D0.1cc、乙狀結腸D2cc和D0.1cc的平均值比形變配準法的結果分別低6.51、0.31和31.19 Gy,膀胱D0.1cc差異有統計學意義(P<0.05),但乙狀結腸D2cc和D0.1cc均無明顯差異(P>0.05)(表1)。
表1 內照射分次劑量疊加劑量學比較(Gy,±s)

表1 內照射分次劑量疊加劑量學比較(Gy,±s)
參數 直接疊加法 形變配準法 t值 P值臨床靶區D90%40.01±5.97 33.47±7.07 -4.129 0.003膀胱D2cc 33.08±5.06 31.42±4.87 -3.236 0.010膀胱D0.1cc 38.61±6.98 45.12±10.24 4.376 0.002直腸D2cc 27.43±6.66 23.38±4.20 -4.168 0.002直腸D0.1cc 47.56±9.25 37.90±4.32 -3.405 0.008乙狀結腸D2cc15.54±4.49 15.85±8.94 0.130 0.899乙狀結腸D0.1cc30.43±10.27 61.62±93.74 1.038 0.326
2.2 內外照射劑量疊加
采用兩種疊加方法對內、外照射劑量進行疊加,可得宮頸癌患者總照射劑量。其中,直接疊加法所得腫瘤臨床靶區D90%、膀胱D2cc、直腸D2cc、直腸D0.1cc、乙狀結腸D2cc的平均值比形變配準法的結果分別高5.35、0.78、6.72、10.6和1.57 Gy,臨床靶區D90%、直腸D2cc、直腸D0.1cc有明顯差異(P<0.05),而乙狀結腸D2cc、膀胱D2cc均無統計學意義(P>0.05)。直接疊加法所得膀胱D0.1cc和乙狀結腸D0.1cc的平均值比形變配準法的結果分別低7.7、31.36 Gy,膀胱D0.1cc差異有統計學意義(P<0.05),但乙狀結腸D0.1cc無明顯差異(P>0.05)(表2)。
表2 內外照射劑量疊加劑量學比較(Gy,±s)
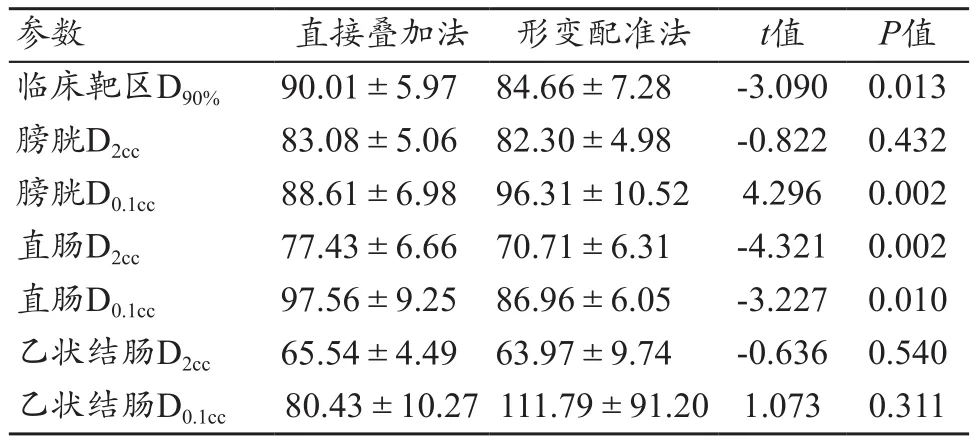
表2 內外照射劑量疊加劑量學比較(Gy,±s)
參數 直接疊加法 形變配準法 t值 P值臨床靶區D90% 90.01±5.97 84.66±7.28 -3.090 0.013膀胱D2cc 83.08±5.06 82.30±4.98 -0.822 0.432膀胱D0.1cc 88.61±6.98 96.31±10.52 4.296 0.002直腸D2cc 77.43±6.66 70.71±6.31 -4.321 0.002直腸D0.1cc 97.56±9.25 86.96±6.05 -3.227 0.010乙狀結腸D2cc 65.54±4.49 63.97±9.74 -0.636 0.540乙狀結腸D0.1cc 80.43±10.27 111.79±91.20 1.073 0.311
3 討論
目前,外照射聯合后裝是宮頸癌根治性放療的首選方式。在不超過OAR的耐受劑量前提下,提高靶區腫瘤劑量可達到根治效果[19-20]。臨床上使用直接疊加法計算宮頸癌內外照射后靶區和OAR總劑量,該方法忽略了兩種放療方式的體位差異、劑量不均勻等因素[21]。梁有騰等[22]采用三種配準方法(B樣條彈性配準、仿射配準和剛性配準)探討了宮頸癌自適應外照射累積劑量及其差異,研究結果表明采用彈性配準方法能獲得較準確的照射總劑量。為了探究直接疊加法應用于宮頸癌分次間內照射和內外照射劑量累積的準確性,本研究利用MIM軟件中形變配準法對宮頸癌分次間內照射劑量和內外照射累積劑量進行疊加,所得結果與直接疊加法結果進行對比分析。
本研究發現宮頸癌分次間內照射劑量和內外照射劑量疊加時,直接疊加法所得臨床靶區D90%比形變配準法結果高出5 Gy以上且均有明顯差異(P<0.05)。直接疊加法所得OAR值比形變配準法結果高出2 Gy以上且均有明顯差異(P<0.05)。導致這一結果的原因可能是直接疊加法是假設每次治療的最高劑量都落在同一位置上,且認為內外照射時OAR所受劑量均勻且解剖位置不發生改變。直接疊加法易夸大OAR所受照劑量,不利于靶區劑量的保證,導致靶區劑量不足,降低療效。
Brock等[23]根據AAPM-132號報告中指出形變配準過程中產生較大劑量誤差的原因是將靠近OAR的腫瘤靶區劑量形變到了OAR上,導致OAR劑量增加。本研究結果中膀胱D0.1cc的形變疊加結果大于直接疊加結果,可能是MIM軟件進行形變配準時將靠近膀胱的腫瘤靶區劑量形變到了膀胱壁上,造成較大劑量誤差。Latifi等[24]對圖像配準精度實際量化后發現在形變配準過程中引入大量自由度會導致密度矢量場產生模糊,穩定性較差,易使D0.1cc評價指標容易產生較大誤差,本研究中部分OAR的D0.1cc數值不穩定。Flower等[25]研究宮頸癌近距離放療劑量累積的形變圖像配準中OAR解剖位置穩定性時發現器官運動也會導致形變配準結果產生誤差,因此本研究中不同患者間乙狀結腸D0.1cc的形變疊加結果差異較大。本研究發現在內外照射圖像采集前保持膀胱充盈度一致,且患者分次內照射時置入同一款施源器,可以幫助提高形變配準和劑量疊加的準確性,與Abe等[26]研究結果一致。有研究發現MIM軟件中Reg Refine功能可以很好地檢查形變配準精度和結果,保證配準精度[27]。本研究過程中通過Reg Refine功能不斷檢查形變結果以確保配準精度。
4 結論
直接疊加法和形變配準法均可適用于疊加宮頸癌內外照射總劑量。直接疊加法快速簡便,但可能會造成評估OAR劑量偏高,靶區劑量不足,影響治療效果。MIM軟件中的形變配準法可以相對準確地反映宮頸癌內外照射累積劑量,可為沒有配備形變配準軟件的醫院的臨床醫生和物理師提供一定的參考依據。但本文也存在不足之處,研究病例數較少,之后將收集更多的病例,進一步充實本文的實驗結果。

