柏木人工林林窗位置對香椿細根分解及土壤真菌群落多樣性的影響
李德會,李相君,吳慶貴,尹海峰,李賢偉,*
1 綿陽師范學院生態安全與保護四川省重點實驗室,綿陽 621000
2 四川農業大學林學院,成都 611030
土壤真菌是森林生態系統中凋落物的主要分解者,作為植物-土壤互作效應的媒介之一[1],在有機碳降解、N/P轉換等過程中發揮著重要作用[2—3]。真菌生態功能的實現取決于其群落多樣性和功能動態,這一過程既與真菌自身相關,也受環境干擾的影響[1—3]。在大尺度空間背景下,土壤真菌群落主要受溫度和海拔梯度影響[4—5];土壤理化性質等因子決定著真菌物種生存環境,亦對群落組成和多樣性產生具體影響,使群落呈現出小空間尺度異質性[6—8]。
細根是植物水養吸收的主要器官,其生命周期短,周轉速率快[9—10]。細根分解是植物與土壤進行養分物質循環和能量流動的重要進程[2]。在凋落物底物分解過程中真菌群落經歷了一系列類群或種群變化[11—12],其群落結構和多樣性在有機質分解[13]、植物生長[1]、促進養分循環和能量流動等生態過程中均發揮著重要作用[3,11,14—15]。
林窗是森林群落中由于自然災害和群落演替導致優勢樹種死亡后在林冠層形成的空隙[16—17]。林窗(包括人工林窗)形成后會導致微地形、光環境、溫濕度、土壤養分和水分狀況等生態因子發生改變,其對土壤生態過程的調控機制較為復雜[18—20]。林窗內不同位置亦對土壤真菌群落特征和功能產生影響[3,6]。Yang等[21]采用磷酸脂肪酸方法發現土壤微生物活性從林窗中心到郁閉林下逐漸增強,相同尺度林窗內邊緣位置微生物量在碳氮含量上顯著高于內部[22],土壤微生物量和功能多樣性[23]、土壤真菌類群聚集和網絡關系也存在位置梯度效應[6]。較多研究證實林窗形成后土壤理化性質異質性對土壤真菌群落產生影響,但對于參與細根分解的土壤真菌如何響應林窗內不同位置差異的研究鮮見報導。
本文研究區現存柏木(Cupressusfunebris)人工林系20世紀80年代在川中丘陵區營造的“長江防護林一期”工程,成林后缺乏管理措施,樹種單一,生態系統功能低下,呈現出退化趨勢,嚴重影響了森林綜合效益的發揮[24—25]。在我國生態文明發展的整體框架下,采用科學措施對柏木人工林開展林分結構調控與功能提升,已成為當下重要的科學議題。香椿(Toonasinensis),蕓香目楝科香椿屬落葉喬木,對環境條件耐受性好,兼具食用藥用價值,是柏木人工林林分結構調整引入的主要鄉土樹種。本文以川中丘陵區30a生柏木人工林中2014年開設的200 m2林窗為研究對象,探討林窗內位置異質性對香椿細根分解2a時土壤真菌群落多樣性變化的影響,了解土壤地下生態進程對林窗位置異質性的響應,探索林窗式干擾對柏木人工林養分物質循環的微生物影響機制,為實現森林質量精準提升提供理論依據。
1 材料與方法
1.1 研究區概況及試驗樣地設置
研究區位于四川省德陽市旌陽區和新鎮,地處川中丘陵區北部邊緣,屬四川盆地中亞熱帶濕潤季風氣候區,現存柏木人工林平均樹高6.8 m、平均胸徑8.2 cm、郁閉度>0.8,單位蓄積量不足50 m3/hm2,遠低于全國平均水平(83.63 m3/hm2),屬于典型的低產低效林[17]。
試驗樣地位于和新鎮永興村(104°25′30″—104° 25′45″E,31°04′08″—31°04′15″N),海拔510—530m,土壤類型為紫色土。2014年3月在研究區內選擇位于山體中坡位、坡向西南向、坡度20°—25°、立地條件相同、屬同一造林批次、生長狀況及經營管理水平基本一致的柏木林進行林窗式疏伐改造后植入3a生香椿(供試樣地香椿現存狀況見表1),各林窗間隔一個樹高(6 m)以上[25]。林窗為南北向長、東西向短的近似橢圓形,兩軸相交點為中心,沿中心點向外拓展3/4區域為邊緣區(圖1)。林窗面積計算A=πLW/4,分別設定為200 m2(20 m×14 m)、150 m2(18 m×11 m)、100 m2(15 m×9 m)、50 m2(12 m×6 m)。為探索香椿細根分解2a時土壤真菌群落多樣性對林窗內位置異質性的響應,以研究區內最大尺度林窗(200 m2)對象,設置重復樣地3個,每個樣地內設定中心位置(Gap center, GC)、邊緣位置(Gap boarder, GB)3個,以未開窗的柏木郁閉林(Closed canopy, CC)為對照。

表1 200 m2林窗內不同位置上香椿現狀表
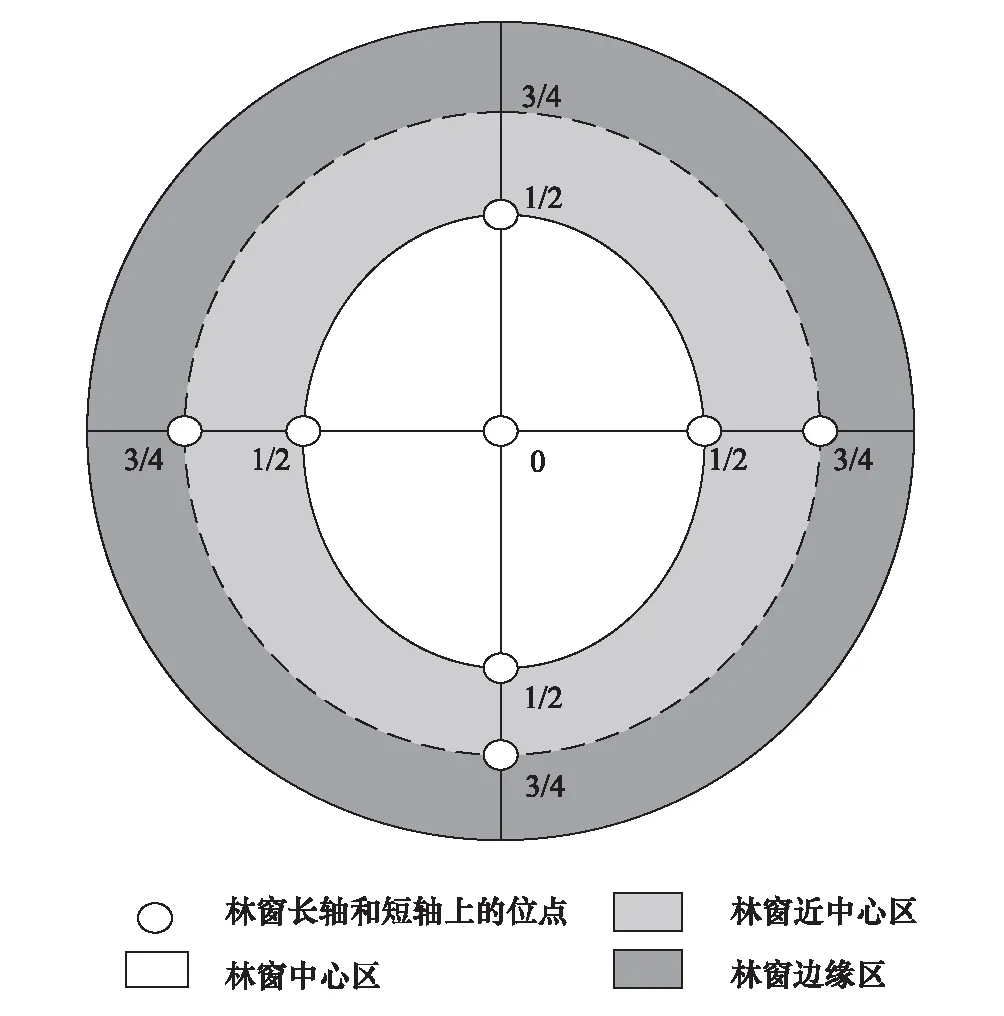
圖1 柏木人工林林窗內位置分區示意圖
1.2 野外試驗設計及樣品采集
2016年8月,使用根鉆挖掘法獲取5a生香椿細根樣品(直徑<2 mm),洗凈后于70 °C下烘干至恒重,剪成<2 cm的小段充分混合稱取4 g,放入10×20 cm、孔徑100 μm的尼龍分解袋中并封口和標記。11月在引入香椿的試驗林窗內選取中心、邊緣位置和柏木純林各3個樣點,每個樣點埋設4個分解袋。通過計算單位面積土層細根分布量,于每個分解袋內裝入原位土壤250 g與細根樣品充分混合后回埋至細根主要分布土層,觀察分解2a時林窗位置對細根降解速率及土壤真菌群落多樣性的影響。2018年11月,采集分解袋內土壤樣品,使用50 mL無菌離心管裝取樣品后于4 ℃保存并快速帶回實驗室(中國科學院成都生物所微生物分子與生理生態實驗室)進行高通量測序分析,剩余土壤樣品作理化性質分析,并對香椿細根樣品進行質量損失及養分含量測定。
1.3 土壤理化性質和細根養分含量測定
土壤溫度(ST)、土壤含水量(SWC)測定采用Thermochron iButton Device(DS1921-G, Maxim,Integrated, San Jose, CA, USA)連續記錄;采用電位法測定土壤pH值;采用重鉻酸鉀氧化容量法測定土壤有機質、植物組織碳含量;采用凱氏定氮法測定土壤、植物組織全氮含量;采用碳酸氫鈉-鹽酸浸提——鉬銻抗比色法測定土壤速效磷;采用原子分光光度計法測定組織鈣、鎂含量(LY/T1271—1999);木質素、纖維素、半纖維含量測定采用“范式中性洗滌纖維法”,采用重鉻酸鉀硫酸亞鐵加熱法測定洗滌后的木質素含量,采用重鉻酸鉀硫酸亞鐵滴定法測定纖維素含量,采用碘銅法測定半纖維含量。香椿細根干物質殘留率計算:W=Xt/X0×100%,式中W為細根殘留率(%),Xt為分解t階段香椿細根殘留質量(g),X0為初始干物質量(g)。細根分解率:Dw=1-W;養分元素質量殘留率:N=Nt/N0×100%=(Xt×Ct)/(X0×C0)×100%,式中N表示養分元素質量殘留率(%),Nt為分解t時間養分元素儲量(g),N0為初始養分元素儲量(g),Ct為解t時間養分元素濃度(%),C0為初始養分元素濃度(%)。細根養分元素釋放率:DN=1-N。
1.4 土壤真菌DNA提取、擴增、測序
采用MO BIO強力土壤DNA提取試劑盒(MO BIO Laboratories, Carlsbad, CA, USA)提取土壤樣本基因組;以稀釋后的基因組DNA為模板,使用帶Barcode的特異引物和高效高保真的酶(TaKaRa, Dalian)進行PCR擴增,使用正向引物ITS4(5′|TCCTCCGCTTATTGATATGC- 3′)和反向引物gITS7F(5′| GTGARTCATCGARTCTTTG- 3′)對真菌ITS2區段進行PCR擴增(擴增體系包括:PCR MIX12.5μL,ITS4引物1 μL,gITS7引物1 μL,DNA1 μL,ddH2O9.5 μL;PCR反應條件為94 ℃預變性5 min,34個循環:“94℃變性30 s,56 ℃退火30 s,68℃延伸45 s,72℃終延伸10 min”,兩次PCR擴增反應后混合;使用1%的瓊脂糖凝膠電泳檢測PCR產物,膠回收試劑盒(DNA Gel Extraction Kit)回收目的條帶,使用Nanodrop測定濃度和質量,根據PCR回收產物濃度進行等量混樣;TruSeq?DNA PCR|Free Sample Preparation Kit建庫試劑盒進行文庫構建并定量,文庫合格后由中科院成都生物所環境基因組高通量測序平臺使用MiSeqTM測序儀(Illumina, San Diego, CA, USA)上機測序。
1.5 生物信息數據統計與分析
Paired-end序列拼接:使用FLASh(V1.2.7, http://ccb.jhu.edu/software/FLASH/)對每個樣品reads進行拼接獲取原始Tags數據(Raw Tags);序列質量控制:將拼接后原始Tags嚴格過濾處理得到高質量的Tags數據(Clean Tags,參照QIIME V1.9.0,http://qiime.org/scripts/split_libraries_fastq.html的Tags質量控制流程),利用Usearch軟件(v8.0,http://drive5.com/uparse/)檢測嵌合體序列,去除后得到最終的有效數據(Effective Tags);聚類:使用QIIME對全部有效數據進行聚類(cd-hit方法),默認以97%相似性將序列聚類成為OUT(Operational Taxonomic Units),選取OTU出現頻數最高的代表性序列,去除只有1條序列的Singleton;利用QIIME對OTU代表序列進行物種注釋(https//unite.uc.ee);使用FUNGuild進行真菌生態營養模式預測;使用ggplot2繪制影響因子在林窗位置間的變化情況;采用非參數多元方差分析(PERMANOVA/Adonis)、隨機置換(Randomized Permutation Test)檢驗不同位置微環境異質性和環境因子差異情況;利用QIIMEv1.9計算α多樣性指數:Chao1指數(Chao1)、觀測到的OTU數(Observed OTUs)、香農指數(Shannon)、辛普森指數(Simpson),采用隨機置換檢驗α多樣性指數在不同位置變化是否顯著;通過多元分散置換(Permutational Test of Multiyariate Dispersions, PERMDISP,999次迭代)、非參數多元方差分析(Adonis)、相似性分析(ANOSIM)、多響應置換過程分析(Multi Response Permutation Procedure, MRPP)、主坐標分析(PCoA)檢驗真菌群落β多樣性差異性對林窗位置的響應;采用非豐度加權分析(unweighted UniFrac)描述各降解階段不同位置間特有種和共有種,使用Mantel test(partial Mantel test)、冗余分析(Redundancy analysis, RDA)檢測生物和非生物因子與真菌群落組成的相關性,并計算相關性系數,判斷驅動真菌群落組成變化的關鍵因子及影響程度。
2 結果與分析
2.1 不同林窗位置土壤理化性質和細根養分含量變化
3個供試林窗位置之間存在顯著的空間異質性(P<0.001)(圖2),土壤理化性質在不同位置上差異顯著(P<0.05)(表2)。土壤溫度從GC到CC位置逐漸降低,土壤濕度則呈上升趨勢;受研究區成土母質影響,不同位置土壤pH值均在8.0左右;觀察到GB位置土壤速效磷、土壤有機質、土壤全氮含量最高,CC位置最低。
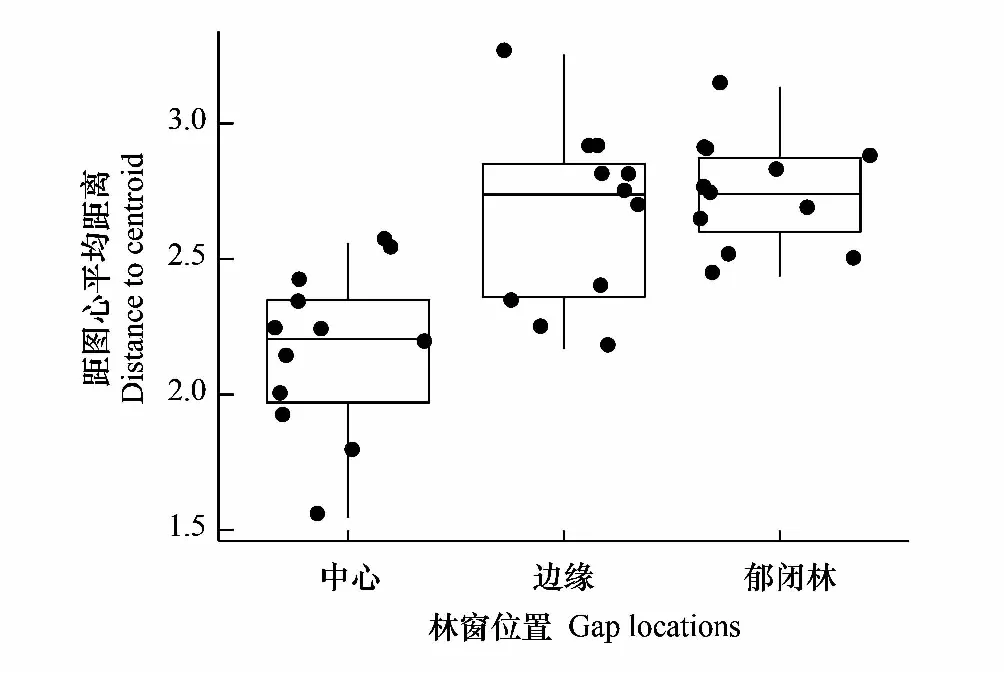
圖2 多元置換分析顯示林窗位置環境差異
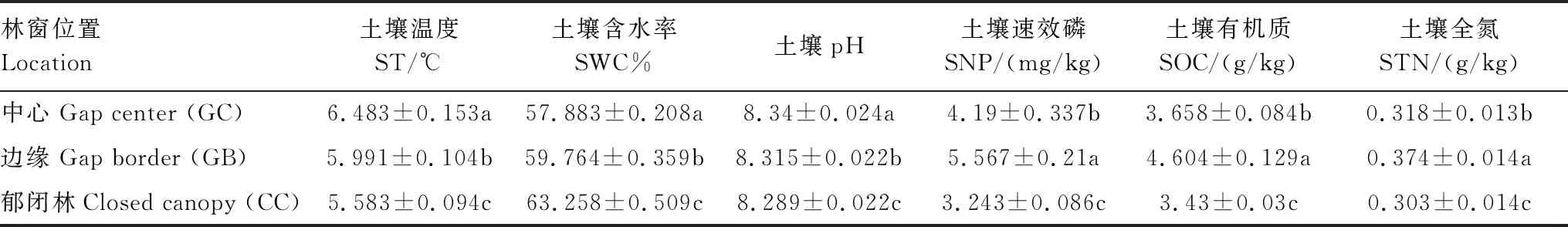
表2 土壤理化性質在林窗位置間的變化
觀察到3個位置上香椿細根分解速率各異,GB位置降解速率最高,質量損失率為40.86%,GC和CC位置降解速率分別為27.89%和27.48%,GB位置細根降解速率顯著高于GC和CC位置(P<0.05)。細根組織中固定(儲存)的各類養分元素含量伴隨著降解過程的持續而改變,木質素、纖維素、半纖維素含量逐漸降低,碳、氮以積累為主,鈣、鎂則交替進行釋放和積累(表3)。
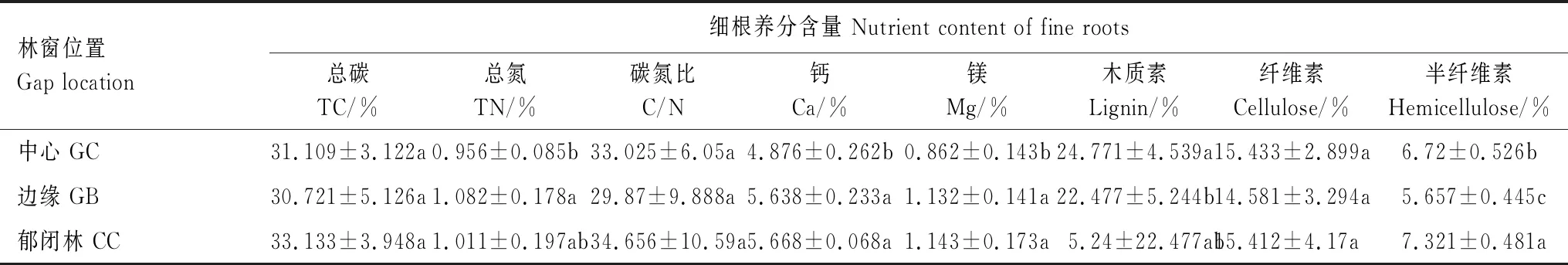
表3 細根養分含量在林窗位置間的變化
2.2 不同林窗位置土壤真菌類群構成
3個林窗位置細根樣品中共檢測出9684條真菌物種OTUs,包括子囊菌門(Ascomycota)、擔子菌門(Basidiomycota)、壺菌門(Chytridiomycota)、接合菌門(Zygomycota)及球菌門(Glomeromycota)。在GC位置樣品中檢測出5門、19綱、62目、187屬真菌;在GB位置樣品中檢測出5門、17綱、62目、198屬真菌;在CC位置檢測出5門、18綱、59目、192屬真菌。子囊菌門和擔子菌門是3個供試位置的優勢真菌類群(圖3),但在門水平層次不同位置間真菌物種構成及相對豐度差異不顯著(R2=0.217,P=0.216;R2=0.039,P=0.814;R2=0.074,P=0.477)。基于FUNGuild進行真菌群落營養模式預測顯示,腐生類、病原類營養模式在不同位置上呈現出明顯差異(表4),腐生類真菌相對豐度從GB到CC呈降低趨勢。在目水平上相對豐度值前11的類群中,散囊菌目(Eurotiales)、肉座菌目(Hypocreales)、糞殼菌目(Sordariales)、刺盾炱目(Chaetothyriales)及傘菌目(Agaricales)是供試位置上的優勢類群(圖3),其相對豐度存在位置差異,Geoglossales、圓盤菌目(Orbiliales)目真菌類群相對豐度在GB和GC之間差異顯著,小囊菌目(Microascales)、Sordariales、瓶口衣目(Verrucariales)真菌在GC和CC位置間具有顯著差異(P<0.05);Geoglossales、Orbiliales、Pleosporales目真菌相對豐度在GC和GB間有顯著差異(P<0.05)。如圖3所示,圓盤菌屬(Orbilia)、曲霉屬(Aspergillus)、枝頂孢霉屬(Acremonium)、圓孢霉屬(Staphylotrichum)、毛殼屬(Chaetomium)屬真菌相對豐度在GB和CC位置間存在差異顯著(P<0.05),青霉屬(Penicillium)、藤倉赤霉屬(Gibberella)屬相對豐度在GC和GB位置間存在顯著差異;而在GC和CC位置,觀察到Orbilia、Gibberella、Penicillium屬真菌類群有顯著的相對豐度差異。
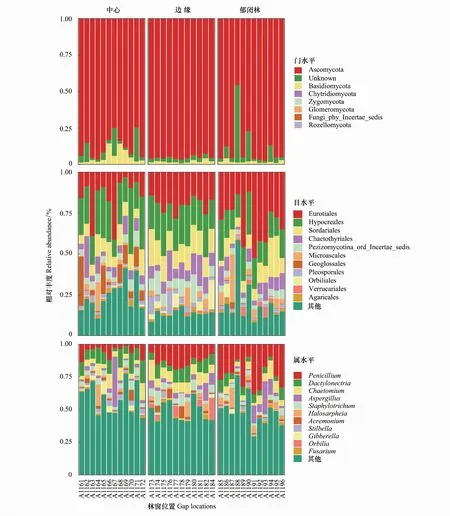
圖3 不同林窗位置間真菌群落相對豐度組成
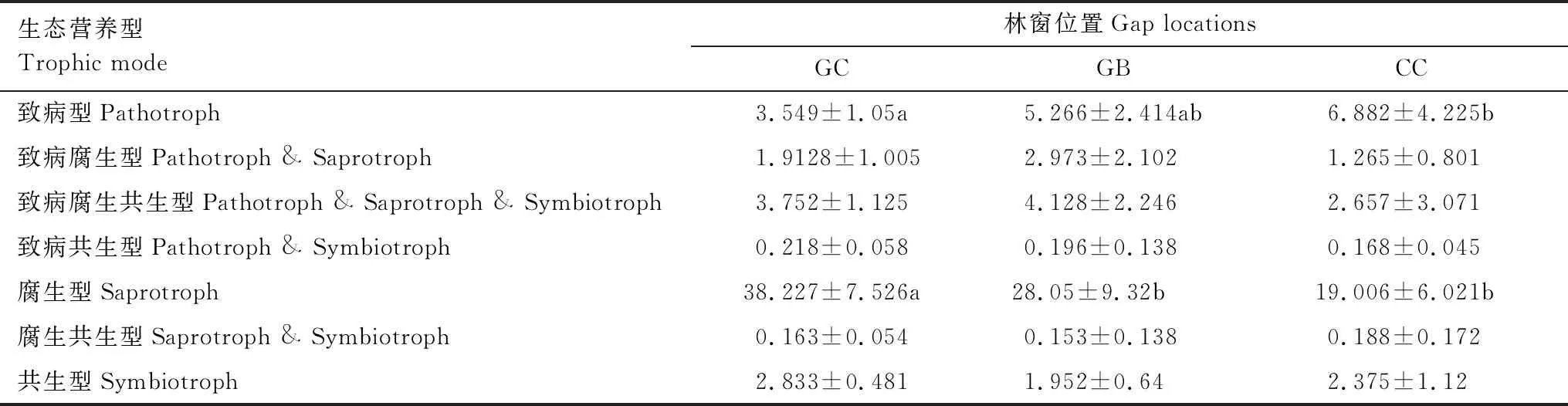
表4 不同位置真菌群落生態營養型相對豐度
非豐度加權分析(unweighted UniFrac)表明OTU水平真菌群落成員在不同林窗位置間的共有種和特有種均存在差異(圖4)。在CC林窗位置的特有種數量最高(307),在GB林窗位置的特有種數量最低(187);3個林窗位置的共有種有855個,在GC和CC位置間共有種為250個,在GB和GC位置間的共有種數量最少(190)。
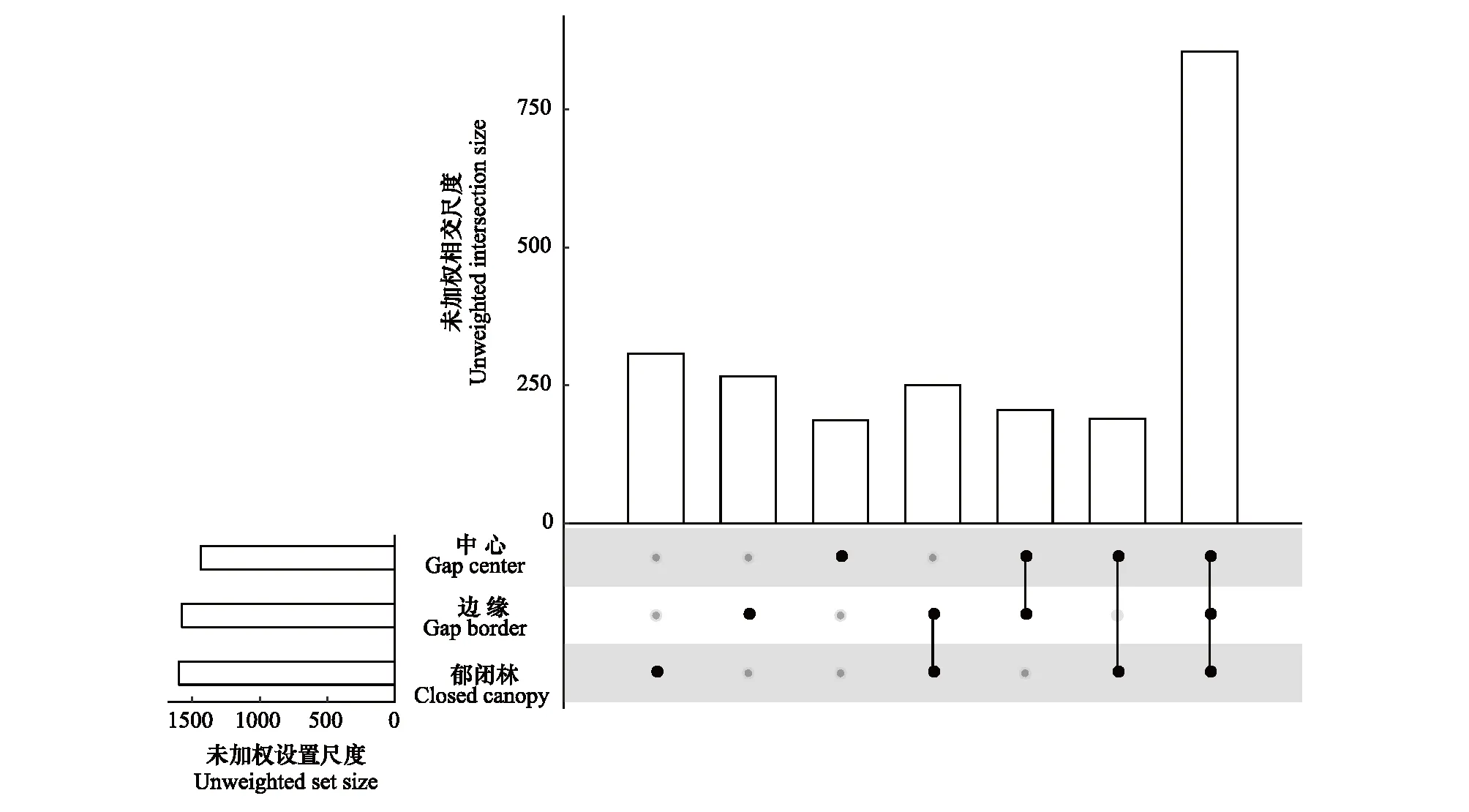
圖4 不同林窗位置真菌群落共有種/特有種分布
2.3 不同林窗位置真菌群落α多樣性變化及其與環境相關性
Spearman′s秩相關分析顯示出3個林窗位置的真菌群落α多樣性指數與影響因子之間的相關性(表5)。相對于植物養分含量,真菌群落α多樣性指數與土壤理化性質之間具有較明顯的相關性,STN與Simpon指數呈極顯著正相關(P<0.01),SNP與Simpon指數、Shannon指數呈顯著正相關(P<0.05)。表中數值代表生物和非生物因子對α多樣性指數的影響程度,其中細根組織Ca含量對多樣性指數影響程度最高。
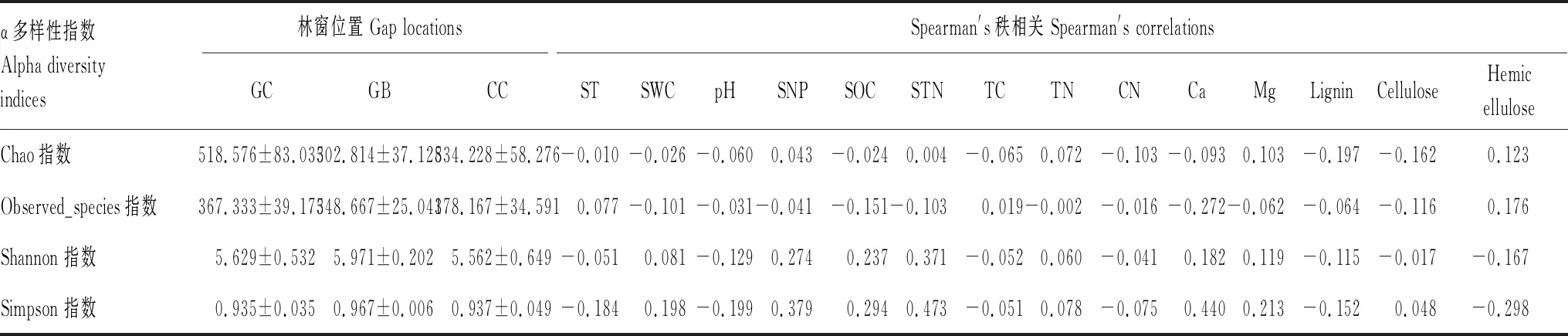
表5 不同林窗位置真菌群落α多樣性指數與影響因子間的相關性
2.4 不同林窗位置真菌群落β多樣性變化
使用多元分散置換分析(PERMDISP)檢測發現,真菌群落β多樣性在不同林窗位置間存在差異(圖5)。GB位置β多樣性最高、CC位置最低,意味著在GB位置的真菌群落異質化程度最高,而在CC林窗位置的真菌群落同質化程度較高,PCoA分析顯示GC位置的真菌群落β多樣性介于GB和CC之間(圖5)。通過PERMANOVA、ANOSIM及MRPP分析發現(表6),在GB和CC、GC和CC位置間真菌群落構成均存在顯著差異差,在GB和GC位置間真菌群落組成則無顯著差異。
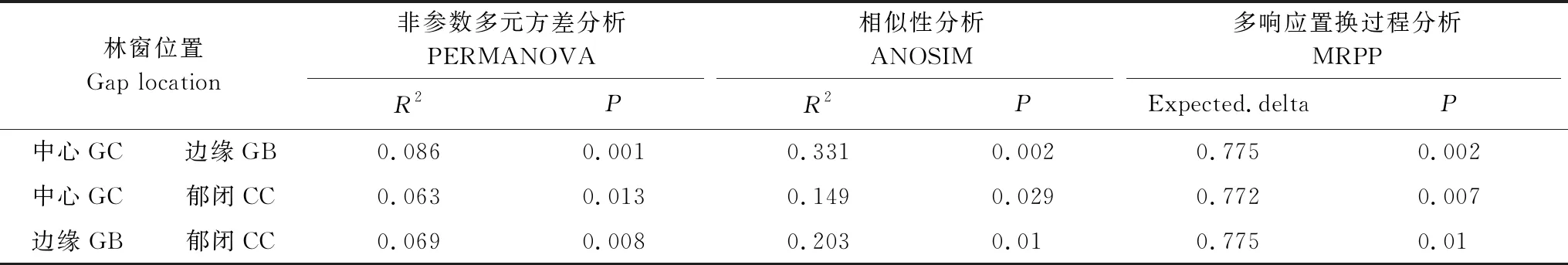
表6 真菌群落組成在不同林窗位置間差異性檢驗
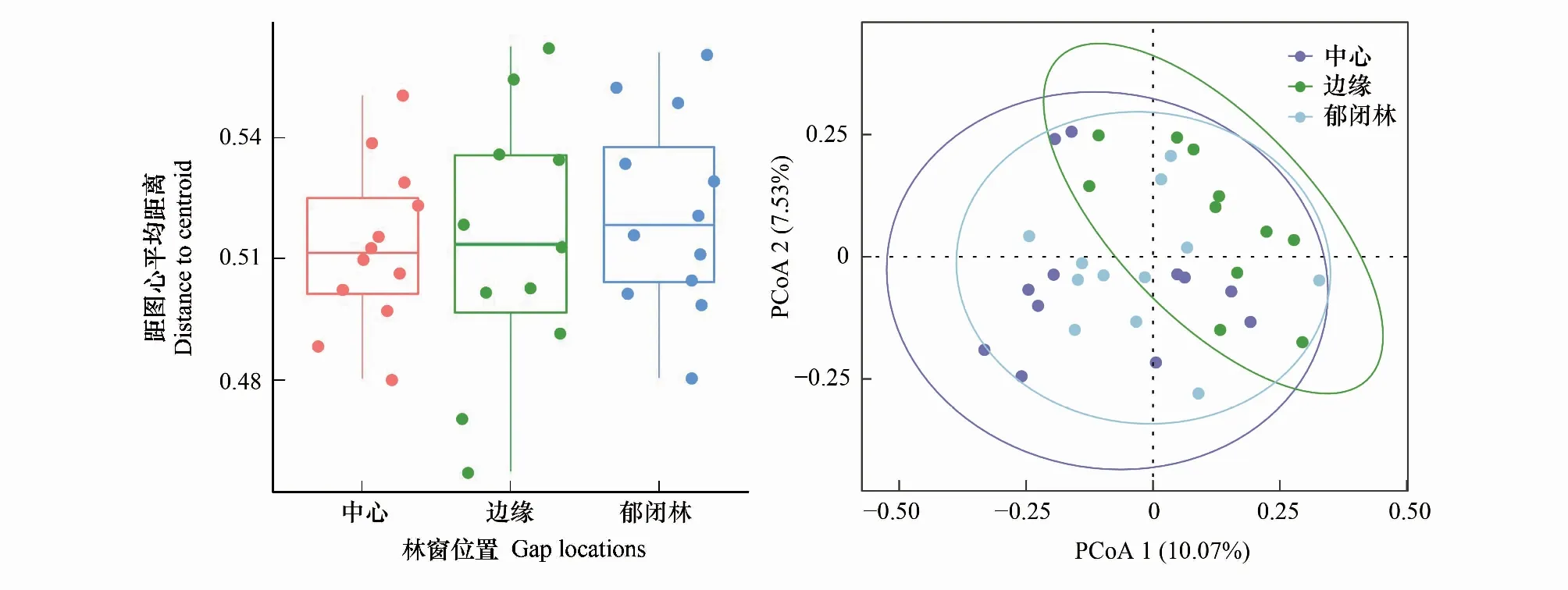
圖5 不同林窗位置間真菌群落β多樣性變化
通過Mantel test檢驗分析,發現大部分細根組織養分含量和土壤理化性質與真菌群落存在正相關關系(圖6),C/N、ST及SWC與真菌群落呈顯著相關(P<0.05),SNP、SOC、STN、TC與真菌群落有極顯著相關性(P<0.01)。經partial Mantel test檢驗分析發現,當環境因子被單獨控制時,僅有SNP、SOC、STN與真菌群落之間呈顯著相關(P<0.05,STN:P<0.01)。
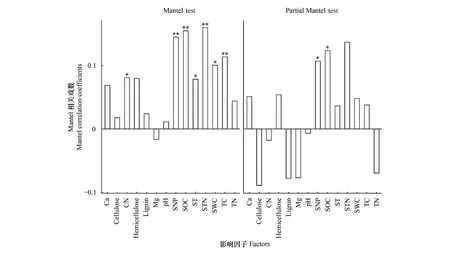
圖6 環境影子對真菌群落影響(Mantel test,和偏Mantel test分析)
經冗余分析發現,較多環境因子對真菌群落的影響程度達到極顯著水平(P<0.01),表明經過2a時間真菌群落對環境異質性的適應能力越來越強(圖7)。土壤pH(R2=0.143,P=0.001)、ST(R2=0.52,P=0.001)是GC位置上重要的非生物影響因子;細根組織鈣含量(R2=0.468,P=0.001)、半纖維素含量(R2=0.457,P=0.001)、木質素含量(R2=0.086,P=0.203)分別對CC林窗位置真菌群落產生主要影響;在GB林窗位置,SOC(R2=0.651,P=0.001)、STN(R2=0.607,P=0.001)是該位置真菌群落的重要影響因子。
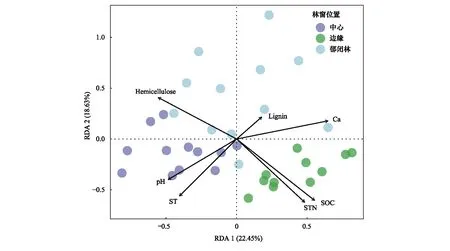
圖7 不同林窗位置環境因子變化對真菌群落的影響(冗余分析)
3 討論
3.1 不同林窗位置土壤理化性質的變化
大量研究表明,森林中一旦形成林窗,太陽輻射直接進入林窗內部,顯著增加了林窗內近地面大氣溫度和土壤溫度。本研究發現林窗內中心位置土壤溫度顯著高于林窗邊緣和郁閉林下,這與大多數關于林窗位置對土壤溫度的研究結果相一致[6,23,26]。受太陽輻射、降水、蒸發等因素的影響,土壤濕度在林窗內和郁閉林下存在明顯差異,土壤濕度亦會隨林窗尺度、位置而發生改變。有研究發現林窗中心土壤濕度最低,郁閉林下土壤濕度最高,這主要與郁閉林下植被生長有關[6]。受研究區海拔及成土母質的影響,土壤pH值變化對林窗的響應不及土壤溫濕度積極[19,27]。土壤中營養元素主要來自于凋落物的分解,本研究中SOC、SNP、STN含量在GC和GB林窗位置存在顯著差異,這是由于林窗形成后有效改善了林地的光照和水分條件,溫度升高可促進土壤養分礦化、提高養分可利用性和微生物活性,從而促進凋落物的分解,增加土壤養分[6,28]。
3.2 不同林窗位置香椿細根降解速率和養分釋放變化
細根分解是植物與土壤進行能量流動和物質交換的復雜生態過程,既有物理和化學作用(如水溶性物質的淋溶作用),也有生物因素(如土壤動物啃食、土壤微生物降解)。細根通常遵循漸進衰減模式,初期主要是一些水溶性物質(如蔗糖、淀粉)的淋溶作用,從而導致細根質量快速損失[29—30];伴隨著分解時間的持續,纖維素、單寧、木質素等難溶性物質大量存在,細根分解速率放緩,這些難分解物質只能由土壤微生物中部分具有胞外酶特征的真菌類群所分解[31];當木質素等物質被降解后,細根組織在生長中儲存的養分會完全釋放到土壤中,這又是一個質量快速損失的過程[30]。
環境條件、基質特征和降解者降解能力是細根分解的三大主要驅動因素。本研究發現,在3個供試林窗位置的香椿細根降解速率存在顯著差異,GB位置細根降解速率顯著高于GC和CC位置(P<0.05)。與郁閉林下相比,林窗形成后改變了林內水熱條件和降解者的群落結構[20]。林窗內不同位置間土壤理化性質的異質性,對土壤微生物活性[32]、種類分布[33]產生影響,從而影響真菌類群的生長[34—35]和競爭[36]等生命活動,最終決定著根系的降解速率和途徑[31],進而導致林窗內不同位置的細根降解速率存在顯著差異。林成芳等[37]分析認為,細根降解主要受底物質量、土壤溫度、水分及微生物等的影響。細根干物質殘留率與細根中纖維素和木質素的濃度呈正相關[18]。
3.3 不同林窗位置真菌群落結構的變化
林窗的形成及其位置對真菌群結構存在不同程度影響。本研究發現在3個供試位置的優勢真菌類群均為Ascomycota門和Basidiomycota門,包含大量具有不同環境適應性的物種[38—39]。Ascomycota門包括大量腐生和寄生營養類型真菌,在土壤中以腐生營養型為主[38,40]。Glomeromycota門真菌主要以叢枝菌根和內生菌根功能與植物形成共生關系[41],從而在根系養分吸收[42]、植物生長等過程中起到重要作用。本研究將分解袋埋設于0—15 cm土層中,這也是香椿細根主要分布區域,在2a時間尺度下部分活細根穿透尼龍網袋,故而在分解袋土壤中檢測到少量球囊菌門真菌類群。真菌營養模式可以反映群落組成的變化,Eurotiales和Agaricales目是土壤中重要的腐生真菌類群,對植物殘體中木質素和纖維素具有較強的降解能力。Chaetothyriales目真菌類群多為植物寄生菌[43],Microascales、Sordariales及Hypocreales目真菌具有腐生性和病理性兩種營養類型[6],其相對豐度在不同林窗位置呈現差異變化。Sordariales目真菌類群屬于寡營養策略者[44],在林窗邊緣位置上豐度較高;Microascales目是林窗中心的主要腐生性真菌類群。Penicillium、Aspergillus、Chaetomium、Dactylonectria及Staphylotrichum屬真菌是3個林窗位置的優勢真菌類群。Penicillium屬真菌通過降解凋落物中有機質實現其對纖維素的降解功能[45—46],Aspergillus屬真菌類群則通過產生能夠降解木質纖維素的酶廣泛參與植物凋落物的降解過程[46—48]。Chaetomium、Dactylonectria及Staphylotrichum屬真菌在各林窗位置的豐度值也較高,Chaetomium屬真菌在纖維素降解過程中具有重要生態功能,其常出現在凋落物降解的早期或中期[49],而Dactylonectria屬真菌是重要的植物病原體類群[50]。
3.4 不同林窗位置的真菌群落多樣性
經過2a的試驗周期研究,未發現不同林窗位置間真菌群落α多樣性存在顯著變化趨勢。與在海拔梯度[51]、土層深度[15]等大空間尺度下的研究結論有所不同,真菌群落α多樣性對環境異質性具有一定程度的抵抗力[52],通過這種能力阻止真菌群落中α多樣性在不同環境的損失,使群落內物種豐富度和均勻度得以維持[8]。真菌群落α多樣性指數在不同林窗位置間無顯著差異,但土壤理化性質和細根養分含量卻對真菌群落α多樣性指數存在差異性影響。由于存在太陽輻射、降水、植被類型的差異,不同林窗位置的土壤理化性質的不同則導致微環境異質性,從而對真菌群落β多樣性產生影響,GB林窗位置真菌群落β多樣性相對較高,CC林窗位置最低。真菌群落β多樣性大小表征群落組成的同質化/異質化程度,在小空間尺度下更具有應用效果[53]。研究發現邊緣受到的太陽輻射強度介于林窗中心和郁閉林下之間,其擁有更適宜的土壤溫濕度和風強度,從而對真菌群落組成結構產生影響[6]。與環境因子的相關性分析顯示,土壤物理性質對真菌群落β多樣性的影響較大,土壤溫濕度調節地下生態系統中香椿細根降解、菌絲擴展、子實體形成[54]、孢子萌發[55]和釋放[35]等過程。GB林窗位置適宜的溫濕度為真菌類群生長和繁殖提供了良好條件,從而導致擁有最高的真菌群落異質化特征,符合邊緣效應追蹤物種資源需要理論[56]。特有種/共有種數量可以解釋真菌群落β多樣性“量”的變化[54],GB林窗位置特有種數量最少,意味著該位置環境條件對真菌群落有著較寬幅度的生態位支持力度。GC林窗位置特有種數量最高,相對于其它林窗位置,其土壤溫度較高濕度較低,這可能會增加真菌群落的生存壓力[3],只有部分對惡劣環境具有較強耐受能力的真菌類群可以生存[57]。
3.5 環境因子對真菌群落多樣性的影響
真菌屬于異養生物[5],其生長和繁殖依靠土壤養分有效性,環境通過決定/選擇過程影響真菌群落的組成和結構[53],較多研究就環境選擇對真菌群落的聚集和結構進行了闡述[6—8]。太陽輻射使得GC林窗位置土壤溫度較高濕度較低,由于缺乏凋落物[58]和根系分泌物輸入[59],SNP、STN、SOC等土壤養分含量和有效性在GC林窗位置相對較低。經Mantel test和partial Mantel test分析顯示,pH、SWC、ST、SNP、STN等土壤理化性質對真菌群落β多樣性影響較大。土壤pH、SWC、ST對土壤微生物群落存在重要影響[3,57,60]。Liu等[4]對中國西南地區不同海拔高度山脈真菌群落多樣性的研究發現,土壤pH值是真菌群落在海拔高度梯度間呈高度多樣性變化的主要驅動因子。真菌在pH5—9中均能生長,其對土壤pH值的適應范圍較細菌廣;Shen等[61]和于天赫等[62]的研究也證實了土壤pH值對真菌群落多樣性的影響,Lauber等[63]發現土壤pH值越高,Ascomycota門豐度相應越高。
Peltoniemi等[57]通過田間控制試驗研究了模擬增溫和降低地下水位對土壤真菌群落的影響,發現增溫對真菌群落影響不大;而將模擬增溫調整至+8 ℃時,升溫處理顯著改變了降解真菌種類的組成和結構,提高了群落多樣性[64]。GC位置土壤溫度最高而群落多樣性最低,這是由于研究中GC位置土壤增溫幅度小,而控制試驗一般會設置較大的溫度梯度差異。SWC通常與ST協同作用,經partial Mantel test分析發現,當土壤理化因子被單獨控制時,SWC是真菌群落多樣性變化重要的驅動因子,這與Zhang等[65]、Yergeau等[66]和Chu等[67]研究結果一致。盡管有研究顯示大部分真菌偏好濕潤環境[3,16,57],但適中的濕度更適合真菌群落發展[6,57],這也解釋了GB位置真菌群落β多樣性相對較高的原因。
土壤養分含量差異也會影響真菌群落,林窗中土壤養分含量變化既受季節影響,也受植被生長影響[18]。不同林窗位置間土壤養分循環各異,植物降解過程中碳、氮、磷、鉀等含量在不同林窗位置間存在顯著差異[32],通常GC位置由于植物養分輸入量和根際分泌物量較GB和CC低,導致GC位置土壤養分含量較低[59]。真菌生長依靠土壤養分有效性,GC位置養分有效性尤其是SNP較低,形成了真菌生長相對惡劣的環境條件,僅部分適應類群可以生存,這對真菌群落來說意味著生存壓力加大[3,57],這個結論解釋了真菌群落β多樣性在不同位置間變化的原因。
4 結論
人工林窗形成后受太陽輻射和降水等因素的影響,林窗內不同位置間微環境存在異質性,從而使植物細根降解速率在各位置間存在差異,邊緣位置降解速率顯著高于林窗中心和郁閉林。真菌群落構成及豐度變化因林窗位置不同而存在差異,優勢真菌類群對細根降解過程起著重要的調控作用,林窗邊緣對真菌種類組成及優勢類群豐度變化的影響最為突出,意味著真菌群落和環境因子之間存在密切的反饋機制。林窗位置對真菌群落α多樣性無顯著影響,但對真菌群落β多樣性存在顯著影響,土壤含水量、pH值及SNP含量在林窗位置間的異質性對真菌物種組成和群落多樣性產生重要影響。林窗位置不同導致的土壤理化性質的異質性對β多樣性存在積極影響。適度考慮林窗所表現的生態效應,深入探究林窗式改造對真菌群落特征的作用機制,清晰認識林窗改造與柏木人工林地下物質循環的關系,可為柏木人工林生態服務功能提升的實踐提供理論依據。

