與胰腺癌免疫預后相關的自噬相關基因預測
蘇澤瑩,劉倩,曾顯容,黃婕,陳斯澤,3
(廣東藥科大學附屬第一醫院1.腫瘤科;2.廣東省食管癌精準治療工程技術研究中心;3.科學研究中心,廣東廣州510080)
胰腺癌是一種惡性程度很高、診斷和治療都很困難的消化道惡性腫瘤。其中最常見的是胰腺導管腺癌。大多數胰腺癌患者在診斷時即為晚期,且5 年生存率更是低至3%~5%,是預后最差的惡性腫瘤之一[1]。因此,確定預后標志物和潛在的藥物靶點對于改善預后和提高療效顯得極為重要。最近研究表明,胰腺癌具有較高的自噬水平,其腫瘤的生長依賴于自噬[2?3]。
自噬是依賴于溶酶體降解受損細胞器和蛋白質的一種重要生物過程[4],在腫瘤的缺氧區,自噬活性的增加可以促使腫瘤細胞在各種應激因素(如營養和缺氧剝奪)下存活,且大多數自噬相關基因(ARGs)的表達隨著自噬活性的增加而上調。目前,部分自噬基因已被證實為癌癥的預測因子。一項關于300名接受根治性切除的肝癌患者的組織芯片研究發現在(抗凋亡基因)Bcl?xl+組中,自噬基因Beclin1的表達與無瘤生存期(DFS,P<0.000 1)和總生存期(OS,P<0.000 1)顯著相關;多因素和單因素分析顯示Beclin1表達是Bcl?xl+患者DFS和OS的獨立預測因子[5]。另一項關于190 例肝癌組織中自噬相關標志物Lc3的表達的研究發現Lc3的表達與腫瘤的TNM、BCLC 分期和Edmonson?Steiner 分級無關,而與較長的總生存期(OS)(P=0.039)及較長的復發時間(TTR)相關(P=0.068);多因素分析顯示,Lc3表達是影響OS(HR,0.42;95%CI:0.22~0.80;P=0.009)和TTR(HR,0.54;95%CI:0.33~0.9;P=0.017)的獨立預后因素[6]。除對自噬因子在腫瘤中的預后研究外,關于自噬因子對癌癥的治療預測上最近也有新的突破。YAMAMOTO 等[7]研究發現自噬通過降解MHC?1促進胰腺癌的免疫逃逸,從而削弱其免疫治療療效,導致胰腺癌療效不佳。
胰腺癌患者中自噬水平與臨床病理特征及免疫預后有部分報道,然而,針對可能存在的潛在的與預后相關的自噬基因尚未被分析。在已發表的基因表達或拷貝數變異分析的基礎上,本研究分析了自噬因子在胰腺癌患者中的表達和突變,以確定自噬基因在胰腺癌中的表達模式、潛在功能和預后價值。
1 資料與方法
1.1 生物信息學分析
1.1.1 資料來源從人類自噬基因集HADB 及GSEA 的GO_REGULATION_OF_AUTOPHAGY數據集整合收集了566 個自噬相關基因。通過GEPIA[8]數據庫,分析上述基因在胰腺癌中的表達和轉錄情況。通過Kaplan?Meier Plotter[9]分析上述差異表達基因與胰腺癌的生存關系。通過Cbioportal[10]在線工具分析具有預后意義的基因在胰腺癌中的突變情況及各基因之間的相關性。通過UALCAN[11]對GEPIA 的分期結果進行進一步驗證。通過DAVID[12?13]及STRING[14]數據庫對上述基因進行GO和KEGG 分析。利用TISIDB[15]分析ARGs的表達量與腫瘤浸潤淋巴細胞及免疫檢查點(PD?1/PD?L1/CTLA4)抑制劑的相關性。
1.1.2 GEPIA 數據庫分析條件:(1)腫瘤類型:PAAD;(2)|Log2FC|Cutoff:1;(3)P?value Cutoff:0.01;(4)Log Scale:Yes;(5)樣本來源:Match TCGA normal and GTEx data。
1.1.3 Kaplan?Meier Plotter 數據庫檢索條件:(1)樣本來源:Pancreatic ductal adenocarcinoma(n=177);(2)生存分析終點:OS/RFS。
1.1.4 cBioportal 數據庫分析條件:(1)樣本來源:Pancreatic Adenocarcinoma(TCGA,PanCancer Atlas)184 samples;(2)呈現的表達譜系:Mutations;Structural Variant;Putative copy?number alterations from GISTIC;mRNA Expression. Select one of the profiles below:mRNA expression z?scores relative to all samples(log RNA Seq V2 RSEM):Enter a z?score threshold±0.2;Protein expression z?scores(RPPA):Enter a z?score threshold±0.2;(3)輸入基因:ATP6V0D1、ATP6V0A1、ATP6V0E2、MAP1LC3A、CTTN、MET、MTDH、RALB、RIPK2、BCL2L1、CHMP2B、EIF2S1、ITGA3、NCKAP1、SH3GLB1。
1.1.5 DAVID數據庫分析條件:(1)輸入基因:CTTN、MET、MTDH、RALB、RIPK2、BCL2L1、CHMP2B、EIF2S1、ITGA3、NCKAP1、SH3GLB1。(2)物種:人。
1.1.6 STRING 數據庫檢索條件:(1)輸入蛋白:CTTN、MET、MTDH、RALB、RIPK2、BCL2L1、CHMP2B、EIF2S1、ITGA3、NCKAP1、SH3GLB1。(2)物種:人。
1.1.7 TISIDB 數據庫分析條件:(1)輸入基因:CTTN、MET、MTDH、RALB、RIPK2、BCL2L1、CHMP2B、EIF2S1、ITGA3、NCKAP1、SH3GLB1;(2)樣本來源:Pancreatic Adenocarcinoma(TCGA)。
2 結果與分析
2.1 胰腺癌患者中ARGs的表達水平
通過GEPIA 數據庫比較ARGs在179 例胰腺癌和171 例正常胰腺組織中的表達水平,并從中篩選差異表達的基因。結果表明566 個ARGs中297 個基因的表達具有顯著差異(P<0.05)。與正常組織相比,有293 個基因在胰腺癌中表達上調,有4 個基因(BNIP3、MAPK8IP1、ULK1、GATA4)表達下調。
2.2ARGs中與胰腺癌預后及進展相關的基因
為探討ARGs表達對胰腺癌預后的影響,采用Kaplan?Meier Plotter 數據庫分析ARGs表達與胰腺癌OS(總生存期)、RFS(無復發生存期)的相關性,并從中選出與胰腺癌OS、RFS相關的具有表達顯著差異意義的基因(P<0.05,FDR≤0.1)。Kaplan?Meier曲 線 和log?rank 檢 驗 顯示,11 個(CTTN、MET、MTDH、RALB、RIPK2、BCL2L1、CHMP2B、EIF2S1、ITGA3、NCKAP1、SH3GLB1)表達水平升高的基因被預測為與OS 和RFS 呈負相關(圖1)。相反,有4個表達水平升高的基因(ATP6V0D1、ATP6V0A1、ATP6V0E2、MAP1LC3A)的患者與OS 和RFS 呈正相關。
2.3 預測胰腺癌高頻突變候選基因和高風險預后基因的功能
由于疾病診斷的復雜性,單基因的改變并不能完全說明其與患者的診斷及預后相關,因此研究進一步探索了15 個基因在患者中的基因突變及基因相關性。通過cBioportal 在線工具分析在胰腺癌患者中上述15 個基因的突變頻率及相關性。結果顯示,在184 例患者中,約有79 例患者(43%)上述ARGs發生改變(圖2A)。基因突變分析發現每個基因的突變率超過5%,其中,MTDH的突變率最高(圖2B)。
使用上述工具對胰腺癌中15 個基因的mRNA表達(RNA Seq V2RSEM)的相關性進行計算分析和Pearson 的校正。結果顯示CTTN、MET、MTDH、RALB、RIPK2、BCL2L1、CHMP2B、EIF2S1、ITGA3、NCKAP1、SH3GLB1 與ATP6V0D1、ATP6V0A1、ATP6V0E2、MAP1LC3A存在負相關性(圖2C)。除CTTN與MTDH、MTDH 與BCL2L1、BCL2L1與SH3GLB1、BCL2L1與MAP1LC3A外,其余基因間的相關性均具有顯著意義(P<0.05)。
針對上述高風險基因進行進一步的功能富集。使用DAVID 和String 分別對11 個高風險的基因進行Gene Ontology(GO,基因本體)and Kyoto Ency?clopedia of Genes and Genomes(KEGG,京都基因與基因組百科全書)分析,預測ARGs的功能及與其改變顯著相關的信號通路。GO 分析從生物過程、細胞成分和分子功能3個方面預測了目標宿主基因的功能。GO 結果顯示,樹突棘維持、細胞黏附、細胞對氨基酸饑餓的反應、脂多糖介導的信號通路、蛋白結合、鈣黏附素結合參與細胞間黏附在胰腺癌中受到上述基因的顯著調控(圖3)。表明上述基因是與細胞代謝相關的基因。通過KEGG 分析,發現了15 條與11 個自噬基因功能改變相關的通路。其中癌癥通路、Ras 信號通路、胰腺癌、PI3K?AKT 信號通路、NOD 樣受體信號通路、癌癥中的轉錄失調、Rap1信號通路等參與了胰腺癌的發生發展(圖4)。
2.4 研究基因表達與腫瘤浸潤淋巴細胞及免疫檢查點抑制藥的關系
PAPACCIO 等研究表明[16],高度腫瘤免疫抑制微環境可導致免疫檢查點抑制劑產生原發耐藥性,并影響其療效。自噬相關基因的上調可能會減少免疫調節細胞的數量,從而發揮免疫抑制作用。為進一步了解候選基因與腫瘤免疫的關系,本研究使用TISIDB 數據庫分析上述11 個基因表達與腫瘤浸潤淋巴細胞及免疫檢查點抑制劑的相關性,結果顯示:11 個基因中,部分基因和腫瘤浸潤淋巴細胞的相關性(圖5)與其和CTLA4/PD?1/PD?L1抑制劑的相關性(表1)存在相似的趨勢。CTTN、MET、NCK?AP1的表達與大多數腫瘤浸潤淋巴細胞呈顯著負相關性,并且與CTLA4和PD?1免疫抑制劑有顯著的負相關性;RALB、BCL2L1、CHMP2B、ITGA3的表達與大多數腫瘤浸潤淋巴細胞和PD?1呈顯著負相關性。RIPK2與大多數腫瘤浸潤淋巴細胞及CTLA4呈顯著正相關性。
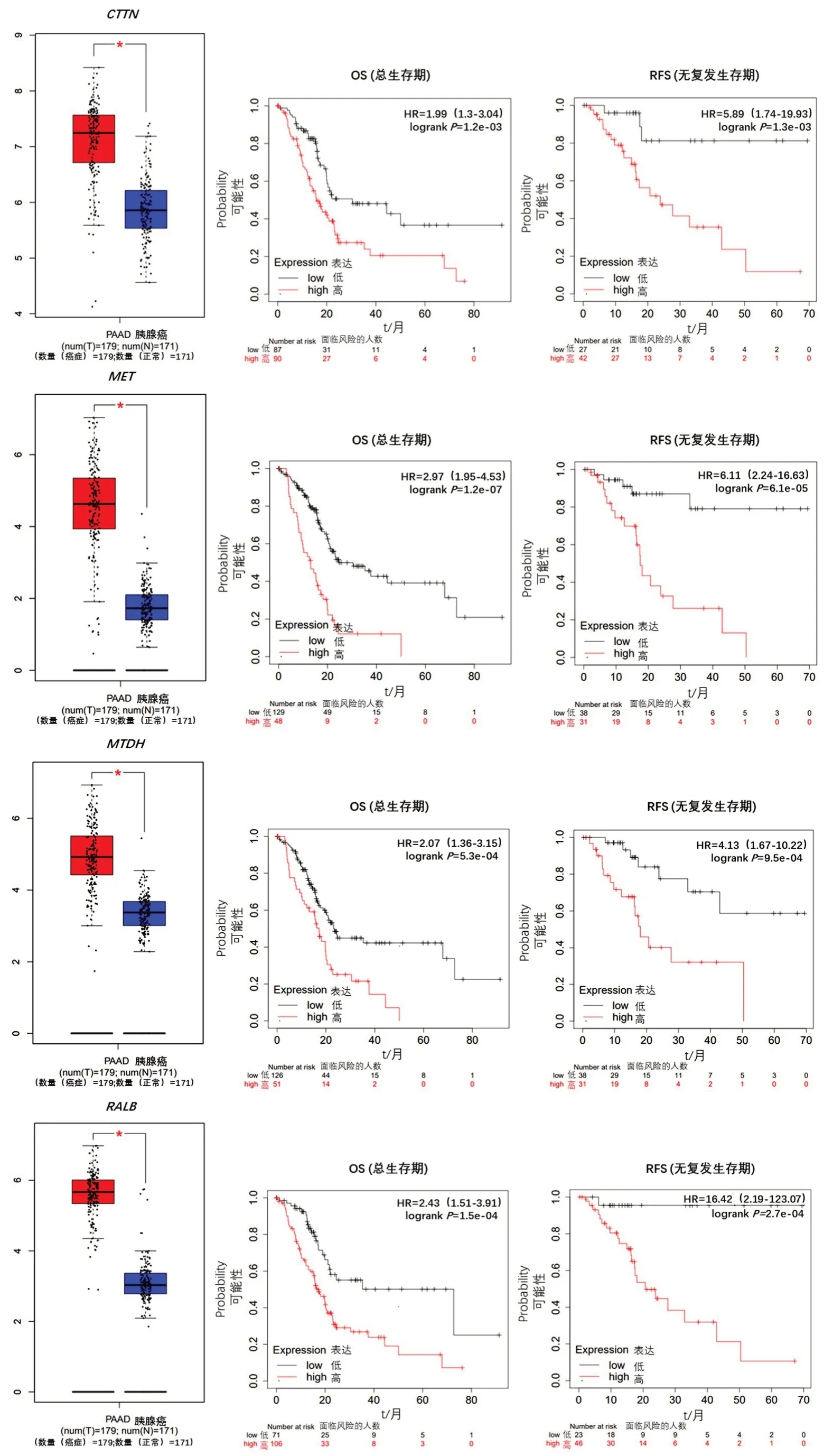
圖1 11個與OS和RFS呈負相關基因的表達水平和Kaplan?Meier曲線Figure 1 Expression and prognostic value of mRNA level of 11 ARGs in patients with pancreatic cancer (Kaplan?Meier curves of overall survival(OS,left)and relapse free survival(RFS,right))
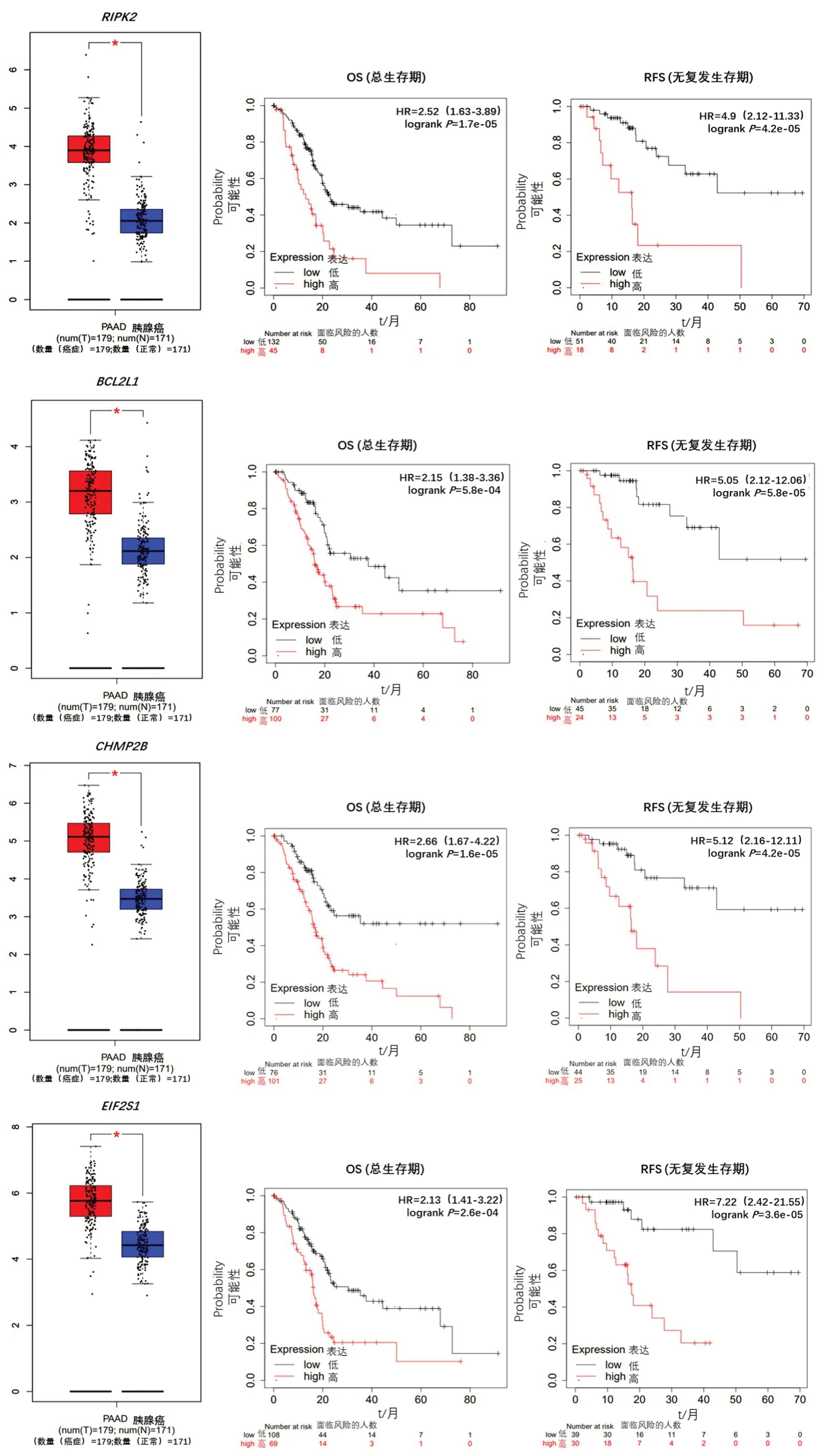
圖1(續) 11個與OS和RFS呈負相關基因的表達水平和Kaplan?Meier曲線Figure 1(continued) Expression and prognostic value of mRNA level of 11 ARGs in patients with pancreatic cancer(Kaplan?Meier curves of overall survival(OS,left)and relapse free survival(RFS,right))
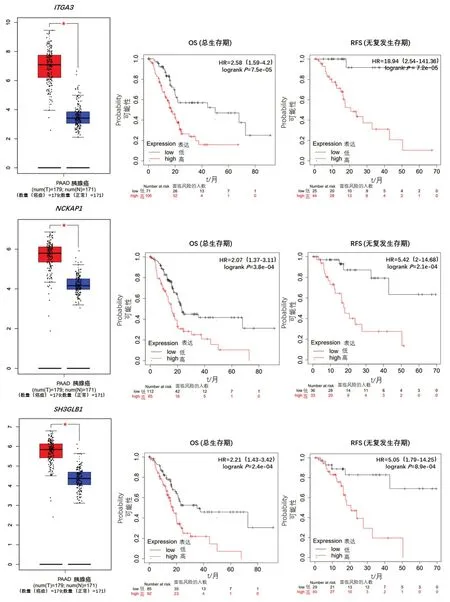
圖1(續) 11個與OS和RFS呈負相關基因的表達水平和Kaplan?Meier曲線Figure 1(continued) Expression and prognostic value of mRNA level of 11 ARGs in patients with pancreatic cancer(Kaplan?Meier curves of overall survival(OS,left)and relapse free survival(RFS,right)
3 討論
自噬已被證實在胰腺癌中升高[3]。研究表明,自噬與胰腺癌的進展有關,是胰腺癌治療的潛在靶點。此外,最近的研究結果證實,自噬與免疫逃避密切相關,這解釋了為什么胰腺癌在大多數情況下對包括ICBs(雙免疫檢查點抑制劑)在內的免疫治療具有抵抗力[7]。并且,相關動物實驗表明抑制自噬對增強免疫治療具有潛在的價值。因此,對自噬相關基因的分析可能為胰腺癌的治療帶來啟示。
本文報道了15 個可能與胰腺癌預后相關的自噬 基 因,其 中 有4 個 基 因(MET[17]、MTDH[18]、RALB[19]、ITGA3[20])已有相關報道。并從基因層面上探索了自噬相關預后基因表達與腫瘤浸潤淋巴細胞及免疫檢查點抑制劑的相關性。本研究通過GEPIA 數據庫評估了自噬相關基因在胰腺癌中的表達水平。結果顯示大多數自噬相關基因在胰腺癌中表達升高,這與相關實驗中胰腺癌中自噬水平升高的結論具有一致性。通過HPA 蛋白數據庫檢索免疫組化結果,表明BCL2L1、ITGA3、RIPK2具有明顯的差異表達,且在腫瘤組織中表達升高。另外相關文獻報道顯示,MET[17]、MTDH[18]、RALB[19]、ITGA3[20]在胰腺癌中表達升高。
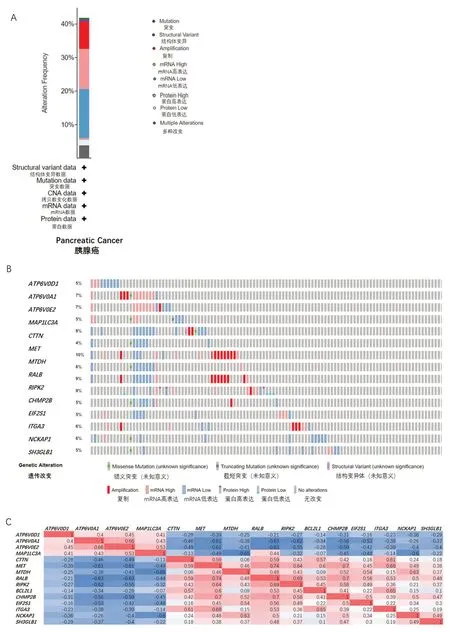
圖2 胰腺癌中15個差異表達的自噬基因的突變分析Figure 2 Mutation analysis of 15 differentially expressed autophagy genes in pancreatic cancer
運用KM?plotter分析上述表達差異顯著的基因與胰腺癌預后的關系。結果顯示,CTTN、MET、MTDH、RALB、RIPK2、BCL2L1、CHMP2B、EIF2S1、ITGA3、NCKAP1、SH3GLB1的高表達與預后呈現負相關。ATP6V0D1、ATP6V0A1、ATP6V0E2、MAP1LC3A的高表達與預后呈正相關。已有部分實驗結果顯示存在一些自噬相關基因與胰腺癌預后相關。例如,研究表明MET與患者的生存期相關,可作為PDAC 患者的不良預后因素之一[21]。ITGA3的高表達與總生存率和無復發生存率相關,特別是在早期癌癥患者中,具有顯著的診斷價值[20]。
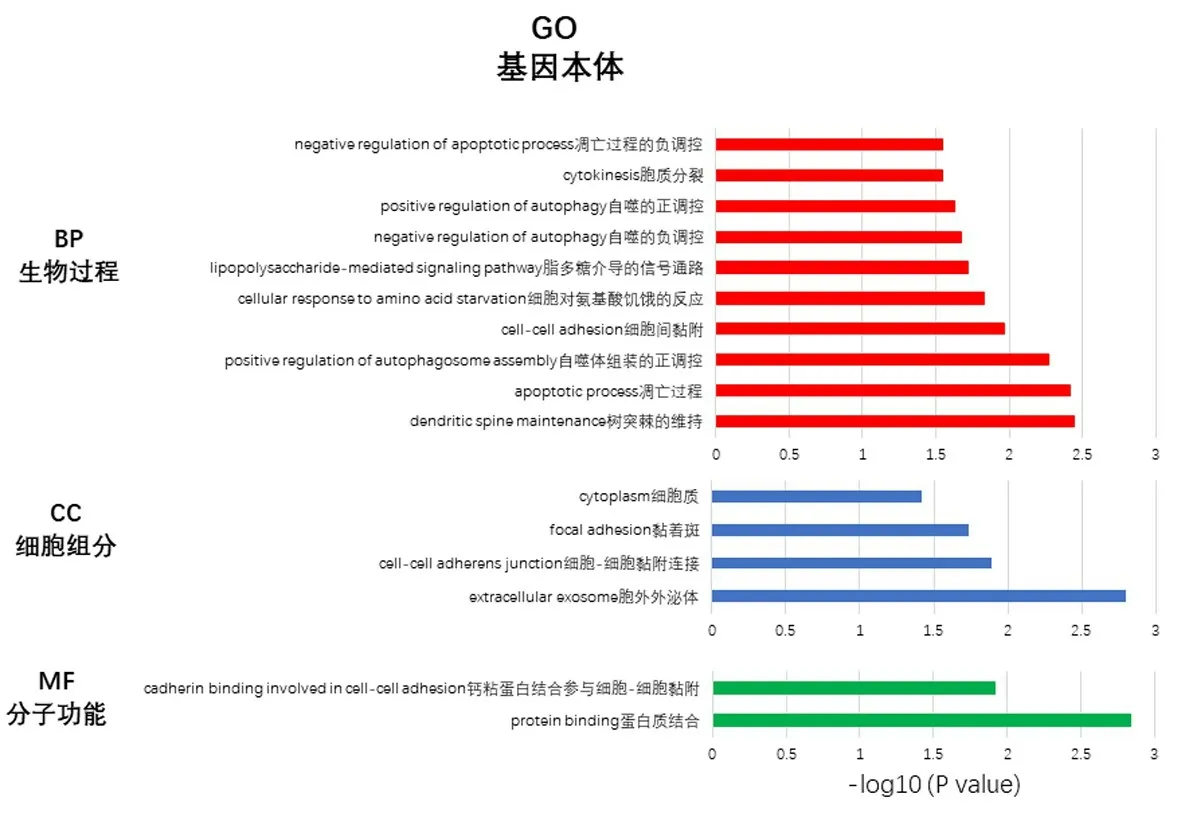
圖3 11個與預后不良相關的ARGs的GO分析Figure 3 GO analysis of 11ARGsassociated with poor prognosis
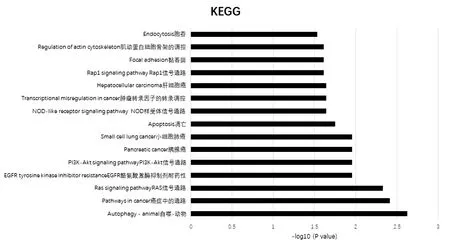
圖4 11個與預后不良相關的ARGs的KEGG分析Figure 4 KEGG analysis of 11ARGsassociated with poor prognosis
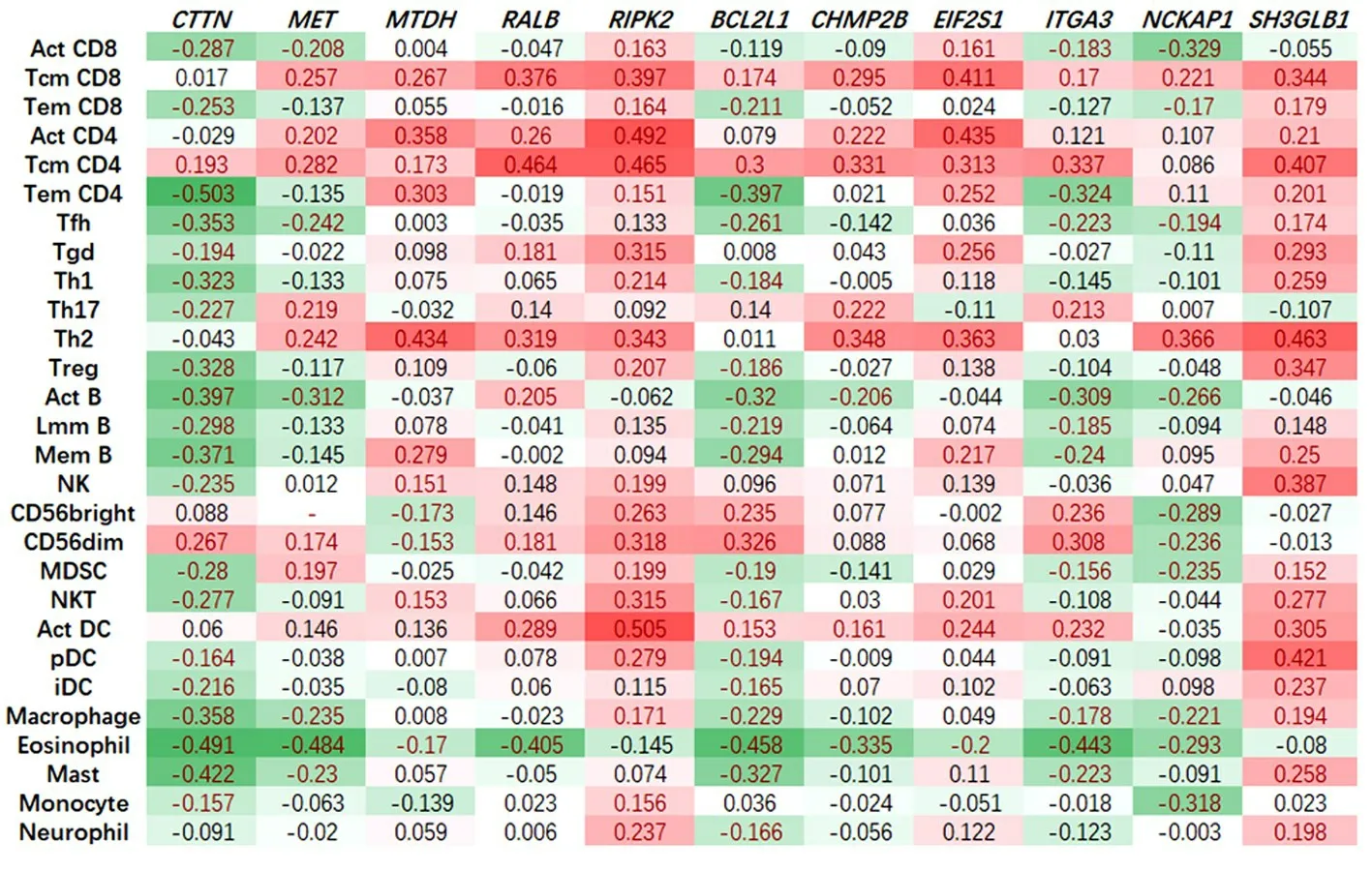
圖5 11個ARGs的表達與腫瘤浸潤淋巴細胞的相關性Figure 5 Correlation between the expression of 11ARGsand tumor infiltrating lymphocytes
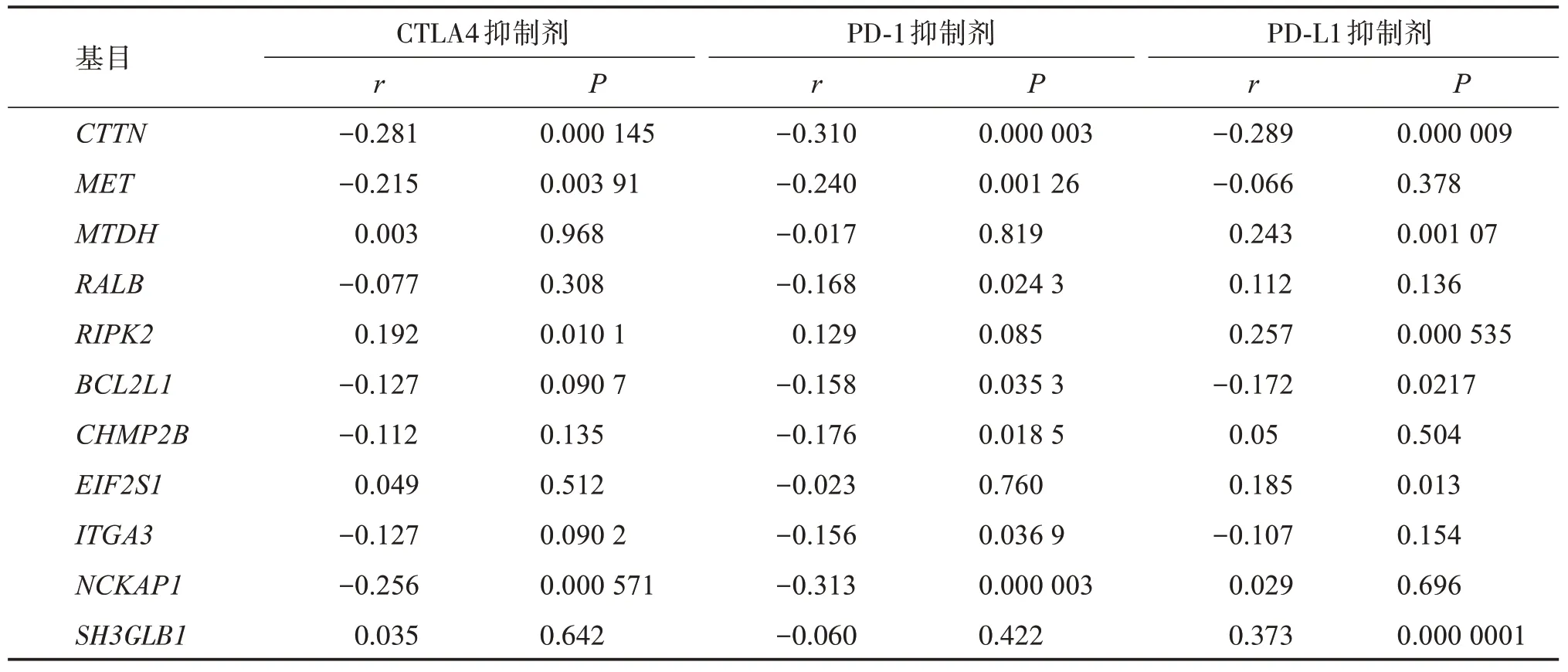
表1 11個基因表達與免疫檢查點抑制劑的相關性Table 1 Correlation between the expression of 11ARGsand immune checkpoint inhibitors
GO 和KEGG 分析可以顯示感興趣的基因在功能和通路的相關富集,對研究結果起提示作用。分析結果表明,上述自噬基因富集胰腺癌相關通路RAS[22]信號通路、EGFR[23]信號通路和PI3K?AK 信號通路。提示上述基因對胰腺癌確有潛在的研究意義。關于預測PD?1/PD?L1 抑制劑的研究表明,PD?1/PD?L1 軸是一個重要的免疫檢查點信號通路,通過抑制RAS?RAF?MEK?ERK 和PI3K?AKT 等信號通路來減少T 細胞的激活;其抑制劑阻斷了該負性調控通路,從而促進T 細胞的增殖和分化。一個關于預后免疫參數的新定義表明,量化腫瘤浸潤淋巴細胞可能比傳統的腫瘤淋巴結轉移(TNM)分期系統對免疫治療更有價值。更重要的是,免疫檢查點抑制劑作用于特定的腫瘤浸潤T 細胞亞群。因此,本研究利用TISIDB 分析了自噬相關基因與腫瘤浸潤淋巴細胞及免疫檢查點抑制劑的關系,結果顯示部分自噬基因與腫瘤浸潤淋巴細胞的相關性同免疫檢查點抑制劑的相關性具有相似的趨勢,并且,研究發現了3 個潛在的與腫瘤浸潤淋巴細胞及雙免疫檢查點抑制劑顯著相關的胰腺癌自噬預后基因。值得注意的是,CTTN、MET、NCKAP1與免疫檢查點抑制劑和腫瘤浸潤性淋巴細胞均呈負相關,提示CTTN、MET、NCKAP1可通過負性作用于腫瘤浸潤性淋巴細胞而被鑒定為免疫抑制刺激。目前,有研究結果提示[16],MET的表達水平升高可能會減少免疫調節細胞的數量,從而發揮對癌癥的免疫抑制作用。
綜上所述,本研究結果提示胰腺癌中具有潛在的與預后不良和免疫浸潤相關的自噬基因。這對于尋找提升免疫治療胰腺癌療效的新靶點具有重要的參考價值。

