柚多聚半乳糖醛酸酶基因家族的鑒定和分析
劉若南 劉林婷 周秋蓉 張蓓 高志鍵 葛聰 莊木來 李延 王平


摘? 要:草莓、桃、蘋果等果實(shí)在生長后期和貯藏過程中逐漸軟化,而柑橘類特別是柚在成熟后期和貯藏過程中出現(xiàn)粒化,嚴(yán)重影響其經(jīng)濟(jì)價(jià)值。本研究分析和鑒定了柚基因組中多聚半乳糖醛酸酶基因(CgPG)家族成員以及PG酶活的變化,旨在揭示柚果實(shí)成熟過程中CgPG表達(dá)與汁胞粒化形成的關(guān)系。本研究對柚基因組庫中CgPG基因家族成員的數(shù)量、基因定位、基因結(jié)構(gòu)進(jìn)行生物信息學(xué)分析,并對CgPG基因家族成員進(jìn)行了表達(dá)鑒定,同時(shí)測定了汁胞粒化程度以及PG活性。結(jié)果表明:從柚全基因組鑒定出26個(gè)CgPG基因,進(jìn)化樹分析聚類為6個(gè)亞類(Group A~Group F),除E類外,所有外顯子,內(nèi)含子結(jié)構(gòu)和基序基本上都是保守的,Group E中的CgPG26的GDDC結(jié)構(gòu)域突變?yōu)镚DDA,SPNTDGI突變?yōu)锳PNTDGI;CgPG基因主要分布于1、2、4、5、7、9號染色體上,在2和5號染色體上都有5~6條基因的串聯(lián)復(fù)制;Group A和Group B與果實(shí)成熟有關(guān),Group A中的CgPG5和Group B中的CgPG1、CgPG24參與了果實(shí)成熟和汁胞軟化,CgPG13、CgPG12、CgPG26參與柚粒化過程中的果膠降解和細(xì)胞壁穩(wěn)態(tài)調(diào)節(jié);通過表達(dá)分析,Group A中的CgPG5和Group B中的CgPG1、CgPG24可能參與了柚不易粒化果成熟過程中汁胞的軟化和最后腐敗,基因的顯著表達(dá)表明汁胞走向衰敗;Group D中的CgPG13和Group E中的CgPG12、CgPG26 3個(gè)基因可能參與了柚易粒化果成熟過程中的果膠暫時(shí)降解,基因的高表達(dá)使汁胞軟化,此時(shí)正是食用的最佳時(shí)期,隨后在汁胞粒化過程中基因表達(dá)顯著下降。因此,CgPG基因表達(dá)呈現(xiàn)不同的趨勢表明CgPG基因在不易粒化果和易粒化果中可能屬于2個(gè)不同的調(diào)節(jié)系統(tǒng),其中CgPG5、CgPG1、CgPG24屬于柚成熟后期汁胞軟化的果膠降解系統(tǒng),CgPG13、CgPG12、CgPG26屬于柚粒化的細(xì)胞壁穩(wěn)態(tài)調(diào)節(jié)系統(tǒng)。
關(guān)鍵詞:柚;多聚半乳糖醛酸酶;汁胞軟化;汁胞粒化中圖分類號:S666.3 ?????文獻(xiàn)標(biāo)識(shí)碼:A
Identification and Analysis ofpolygalacturonasegenesFamily in Pomelo
LIU Ruonan LIU Linting ZHOU Qiurong ZHANG Bei GAO Zhijian GE Cong ZHUANG Mulai LI Yan WANG Ping
1. Institute of Genetics and Breeding in Horticultural Plants, College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China; 2. Pinghe Agriculture Bureau of Fujian Province, Pinghe, Fujian 363700, China; 3. College of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
Abstract: Strawberry, peach, apple and some other fruits gradually soften in the late growth period and during storage, while citrus, especially pomelo, granulated in the later ripening and storage, which seriously affects its economic value. In this study, the members of CgPG gene family in the pomelo genome library and the changes of PG enzyme activity were investigated to reveal the relationship between CgPGs expression and juice sacs granulationin the ripening process of pomelo fruit. The number, location and structure of CgPG gene family members in pomelo genome library were analyzed by bioinformatics, and the expression of CgPG gene family members was identified. The degree of granulation and the activities of PG were determined. 26 CgPG genes from pomelo genome were clustered into 6 subgroups (group A?group F) by phylogenetic tree analysis. Except for class E, all exons and introns and motifs were essentially conservative. GDDC domain ofCgPG26in Group E was mutated to GDDA, and SPNTDGI was mutated to APNTDGI respectively. The CgPG genes were mainly distributed on chromosomes 1, 2, 4, 5, 7 and 9. There were 5-6 tandem duplications of genes on both chromosomes 2 and 5. Group A and group B were related to fruit ripening.CgPG5 in group A andCgPG1, CgPG24in group B were involved in fruit ripening and juice sacs softening, andCgPG13,CgPG12, CgPG26were involved in pectin degradation and homeostatic regulation in cell wall during pomelo granulation. By expression analysis,CgPG5in Group A andCgPG1,CgPG24in Group B might be involved in softening and final decay during the ripening process of the non-granulated fruits, and the significant expression of the genes indicated the juice sacs were decomposed.CgPG5in Group A andCgPG1,CgPG24in Group B might be involved in the temporary degradation of pectin during the ripening process of easily granulated fruits. The high expression of the genes made juice sacs softened, which was the optimal time for consumption. The expressions of the genes were highly decreased during the juice sacs granulation. Therefore, CgPG genes expression showed different trends, indicating that CgPG genes might belong to two different regulatory systems in non-granular fruits and easily granular fruits. Among them,CgPG5, CgPG1,CgPG24 belonged to the pectin degradation system of juice cell softening in pomelo at late maturity, whileCgPG13, CgPG12, CgPG26 belonged to the cell wall homeostasis regulation system of pomelo granulation.
Keywords: pomelo; polygalacturonase; juice sacs softening; juice sacs granulation
DOI: 10.3969/j.issn.1000-2561.2022.04.002
多聚半乳糖醛酸酶(polygalacturonase, PG)在果膠降解的最后一步起著重要作用,是一類重要的果膠修飾酶。根據(jù)其水解活性的差異分為3種類型:內(nèi)切PG、外切PG、鼠李糖PG[1-4]。根據(jù)功能分:與果實(shí)成熟相關(guān)的PG、與器官脫落相關(guān)的PG、與花粉發(fā)育相關(guān)的PG[5-6]。目前,柚CgPG基因的研究雖然較多,但缺乏對其家族的系統(tǒng)鑒定和分析。研究表明,在桃、獼猴桃、蘋果、木瓜、番茄、梨、葡萄、草莓和香蕉等果實(shí)中,PG基因的表達(dá)影響果實(shí)的成熟和軟化[7-8]。果膠結(jié)構(gòu)的改變不僅影響果實(shí)的軟化,也影響著次生壁的形成。柚果實(shí)粒化過程中次生壁木質(zhì)化起始于胞間層,有觀點(diǎn)認(rèn)為細(xì)胞的木質(zhì)化過程是老化細(xì)胞將多糖降解為單糖轉(zhuǎn)移給新生細(xì)胞后木質(zhì)素單體的多聚化[7-8],也有認(rèn)為次生壁形成與果膠降解共調(diào)控[9]。柚基因組測序的完成和序列釋放是在全基因組水平上為柚的重要功能基因的發(fā)掘和功能研究提供基礎(chǔ)。本研究利用生物信息學(xué)方法對柚CgPG基因家族成員的保守結(jié)構(gòu)域、基因結(jié)構(gòu)和表達(dá)情況進(jìn)行分析。以期為進(jìn)一步研究與柚果實(shí)成熟軟化和粒化相關(guān)的CgPG基因調(diào)控機(jī)制打下基礎(chǔ)。
1? 材料與方法
1.1? 材料
以不易粒化(NGF)和易粒化(GF)特性的‘琯溪蜜柚果實(shí)汁胞為材料。不易粒化果種植于平和縣小溪鎮(zhèn)一條小溪兩旁,為河流沉積河床,土壤肥沃深厚,30年健壯果樹,蜜柚果實(shí)汁胞不易發(fā)生粒化、較軟。易粒化果種植于平和縣舊樓村農(nóng)業(yè)農(nóng)村局山地果場,30年健壯果樹,蜜柚汁胞易發(fā)生粒化。樹體正常管理。
2019年分別采取花后120?d、花后150 d、花后180?d(正常成熟采果期)、常溫條件下貯藏30?d、貯藏60 d果實(shí),每次采果18個(gè)。測定果實(shí)品質(zhì),取汁胞混勻,液氮處理后于?80℃保存。
1.2 方法
1.2.1? 汁胞粒化率測定? 按照汁胞粒化形態(tài)特點(diǎn)[10-12],蜜柚果實(shí)汁胞分為正常汁胞、凝膠汁胞和粒化汁胞。汁胞粒化率為粒化汁胞重量占汁胞總重的比值。汁胞凝膠率為凝膠汁胞重量占汁胞總重的比值。
1.2.2? PG活性測定? 多聚半乳糖醛酸酶。采用比色法,取1.0 g樣品,冰浴研磨勻漿,預(yù)冷的80%乙醇清洗3次,加入10?mL預(yù)冷的提取液,于4℃放置提取10?min,4℃、12?000g離心10?min,收集上清液為粗酶液。
取2支25?mL具塞刻度試管,每支試管中都分別加入1.0 mL 50?mmol/L、pH 5.5乙酸-乙酸鈉緩沖液和0.5 mL 10 g/L多聚半乳糖醛酸溶液,在其中一支試管中加入0.5 mL酶提取液,另一支試管中加入0.5 mL經(jīng)煮沸5 min的酶提取液作為對照,混勻后置于37℃水浴1?h。然后迅速加入1.5?mL 3.5-二硝基水楊酸試劑,在沸水浴中加熱5?min,迅速冷卻至室溫,以蒸餾水稀釋至25 mL刻度處混勻。在波長540?nm處測定吸光光度值,重復(fù)3次。
1.2.3? CgPG基因家族成員的鑒定? 以擬南芥PG蛋白的氨基酸序列作為種子序列在柑橘基因組數(shù)據(jù)庫(https: //www.citrusgenomedb.org/)柚分類中進(jìn)行BLASTp比對搜索。為保證候選基因沒有遺漏,使用柑橘(Citrus sinensis)PG蛋白和搜索到的PG蛋白的氨基酸序列在柚基因組數(shù)據(jù)庫進(jìn)行二次BLASTp比對搜索。利用Pfam數(shù)據(jù)庫(http://pfam.Janelia.org/)、NCBI保守結(jié)構(gòu)域數(shù)據(jù)庫分析候選蛋白的結(jié)構(gòu)域,根據(jù)候選蛋白的氨基酸序列是否具有2個(gè)及2個(gè)以上的PG基因保守結(jié)構(gòu)域進(jìn)行候選PG基因的篩選鑒定。此外,擬南芥中At4g20050(ORT3)雖不含有PG基因保守結(jié)構(gòu)域但已被證明為PG基因,在柚基因組庫中單獨(dú)進(jìn)行比對搜索。
1.2.4 ?CgPG基因結(jié)構(gòu)和進(jìn)化分析 ?CgPG基因的序列和基因組信息通過柚基因組數(shù)據(jù)庫(http://citrus.hzau.edu.cn/)獲得,并根據(jù)CgPG基因的序列信息使用TBtools軟件對應(yīng)到染色體的精確位置。通過ComputepI/Mw software(http:// www.expasy.ch/tools/ pi_tool.html)來預(yù)測CgPG蛋白的分子量和等電點(diǎn)。使用MEGA 6.0進(jìn)行進(jìn)化樹構(gòu)建,選擇Neighbor-Joining Tree模式,Bootstrap method檢測重復(fù)1000次。利用GSDS網(wǎng)站(http://gsds.cbi. pku.edu.cn/index.php)來分析CgPG基因的外顯子-內(nèi)含子結(jié)構(gòu)。用DNAMAN 5軟件和Weblog 3(http://weblogo. berkeley.edu/ logo.cgi)在線工具對CgPG蛋白的氨基酸序列進(jìn)行比對。
1.2.5 ?RNA提取及表達(dá)分析? RNA提取試劑盒提取RNA,使用帶有g(shù)DNA Eraser的RNA逆轉(zhuǎn)錄試劑盒(TaKaRa)進(jìn)行逆轉(zhuǎn)錄。從蜜柚成熟果實(shí)汁胞轉(zhuǎn)錄組中篩選有表達(dá)的基因,使用Primer 5.0軟件在開放閱讀框兩側(cè)設(shè)計(jì)特異性引物(表1),引物合成由福州白鯨生物科技有限公司完成。使用羅氏480熒光定量分析儀進(jìn)行實(shí)時(shí)定量PCR(qPCR)。使用2???CT方法分析相對表達(dá)水平,每個(gè)樣品設(shè)置3個(gè)生物學(xué)重復(fù),結(jié)果進(jìn)行統(tǒng)計(jì)分析及繪圖。
1.3數(shù)據(jù)處理
采用Excel 2010軟件進(jìn)行數(shù)據(jù)分析,誤差分析、相關(guān)性和差異顯著性分析使用PASW Statistics 18軟件。
2? 結(jié)果與分析
2.1CgPG基因家族的鑒定和注釋
根據(jù)PG基因的保守結(jié)構(gòu)域,通過對柚基因組數(shù)據(jù)庫的Blast比對66個(gè)擬南芥PG基因和48個(gè)柑橘PG基因的氨基酸序列進(jìn)行搜索,在柚基因組中篩選得到26個(gè)CgPG基因(表2)。分析CgPG的CDS序列在136(CgPG26)~1107(CgPG18)bp之間。CgPG蛋白的等電點(diǎn)在4.78(CgPG20)~9.90(CgPG7)之間,說明CgPG蛋白的酸堿性差異較大,有的顯酸性,有的顯堿性。除CgPG26外,25個(gè)CgPG基因具有Ⅰ、Ⅱ、Ⅲ、Ⅳ 4個(gè)結(jié)構(gòu)域中的2個(gè)或2個(gè)以上結(jié)構(gòu)域。
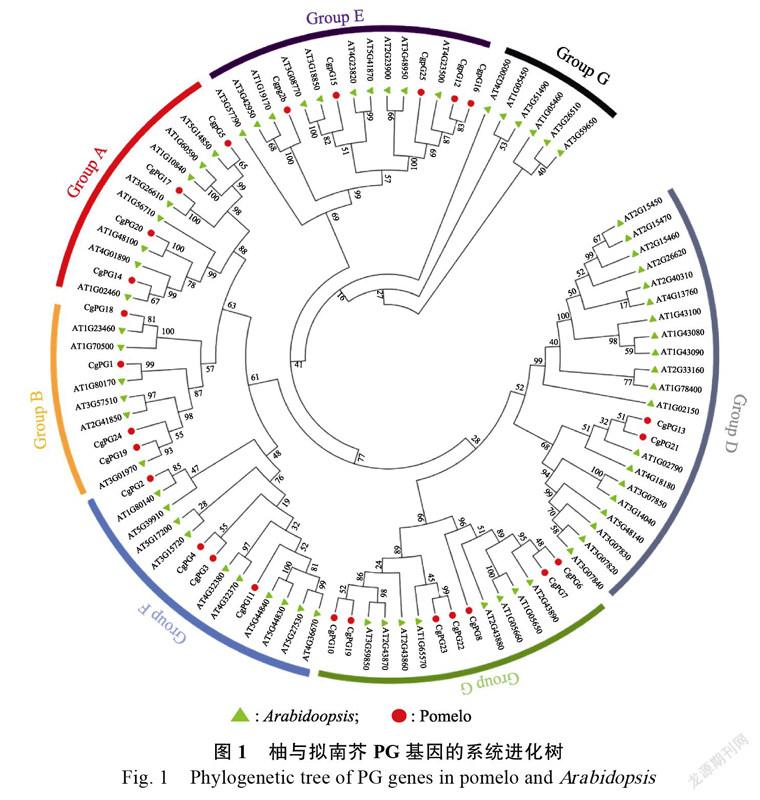
2.2? CgPG家族成員的系統(tǒng)發(fā)育分析
根據(jù)擬南芥PG家族基因的進(jìn)化關(guān)系,將26個(gè)柚PG家族基因聚類為Group A~F 6個(gè)亞類(圖1)。其中Group A含有柚PG家族基因4個(gè),Group B 4個(gè),Group C 7個(gè),Group D 2個(gè),Group E 5個(gè),Group F 4個(gè),沒有發(fā)現(xiàn)Group G亞類。柚Group A和Group B中共8個(gè),遠(yuǎn)小于柑橘的14個(gè)[12]。
2.3? CgPG蛋白多重序列比對和保守結(jié)構(gòu)域分析
CgPG蛋白具有4個(gè)保守結(jié)構(gòu)域,分別為SPNTDGI、GDDC、CGPGHGISI、RIK。在CgPG蛋白中,部分缺少和缺失CGPGHGISI和RIK保守結(jié)構(gòu)域,也有一些保守結(jié)構(gòu)域中的個(gè)別氨基酸發(fā)生了變異。在Group E中CgPG15(未知基因)和CgPG26(未知基因)的GDDC結(jié)構(gòu)域分別突變?yōu)镚DDL和GDDA,且CgPG26的SPNTDGI突變?yōu)锳PNTDGI。亞類E中PG的結(jié)構(gòu)域是不保守的。除此外,其他CgPG蛋白都具有SPNTDGI和GDDC保守結(jié)構(gòu)域(圖2)。
2.4? CgPG家族成員的基因組分布
用TBtools中的染色體定位工具對26個(gè)CgPG基因在染色體上的位置作圖,皆在染色體上準(zhǔn)確定位(圖3)。除了3號、6號、8號染色體外,其余染色體上皆有CgPG基因。1號、2號、4號、5號、7號、9號染色體上分別定位了3條、7條、2條、6條、3條、5條CgPG基因。其中,2號染色體上分布的CgPG基因最多。
2.5汁胞粒化率
柚成熟果實(shí)汁胞分為正常、凝膠、粒化3種。正常汁胞汁水飽滿、透明澄澈。凝膠汁胞間有明顯絮狀渾濁、整體較澄澈。粒化汁胞表面硬實(shí)皺縮且發(fā)黃、絮狀渾濁聚集成束[13](圖4)。不易粒化果汁胞在果實(shí)成熟和貯藏期30 d和60 d皆未出現(xiàn)粒化現(xiàn)象,逐漸軟化,直至腐敗。易粒化果汁胞采收期(花后180 d)蜜柚汁胞開始出現(xiàn)輕度粒化現(xiàn)象,粒化與凝膠汁胞占總汁胞的1.63%,隨貯藏時(shí)間的延長,粒化程度逐漸升高,貯藏30?d,粒化與凝膠汁胞占總汁胞7.81%,貯藏60 d后處于凝膠和粒化狀態(tài)汁胞達(dá)到20.2%,此時(shí)果實(shí)汁胞進(jìn)入粒化的初級階段(圖5)。
2.6 PG酶活性
不易粒化果和易粒化果汁胞在各個(gè)時(shí)期PG活性趨勢一致。在柚果實(shí)生長、成熟和貯藏過程中,PG活性一直上升,貯藏60?d急劇上升,達(dá)到最大值。在各個(gè)時(shí)期中,不易粒化果的汁胞PG活性都較易粒化果高,且差異顯著(圖6)。
2.7? CgPG基因的表達(dá)量分析
對成熟果實(shí)汁胞轉(zhuǎn)錄組中有表達(dá)的6個(gè)基因CgPG13、CgPG12、CgPG26、CgPG5、CgPG1和CgPG24于花后120?d、花后150?d、花后180?d(正常采收期)、貯藏30 d和貯藏60?d在不易粒化果汁胞和易粒化果汁胞進(jìn)行了表達(dá)分析(圖7)。
6個(gè)CgPG基因在果實(shí)成熟期表達(dá)。其中CgPG13、CgPG12、CgPG26在易粒化果中隨著果實(shí)成熟基因表達(dá)量上調(diào),貯藏30 d基因表達(dá)達(dá)到峰值,之后表達(dá)量顯著下降。CgPG5、CgPG1、CgPG243個(gè)基因在不易粒化果中貯藏60 d的汁胞軟化中顯著上調(diào)。
3 ?討論
PG基因表達(dá)于花、花粉、成熟果實(shí)和器官脫落與開裂部位[10]。植物PG基因由PG基因家族的5個(gè)共同祖先基因編碼,已在擬南芥、獼猴桃、桃、番茄等部分植物中得到鑒定[4, 14]。
柚基因組中鑒定出26個(gè)CgPG基因,相對于其他植物較少,如擬南芥66個(gè)、柑橘48個(gè)、桃45個(gè)、蘋果85個(gè)和梨45個(gè)等。進(jìn)化樹分析中,柑橘Group A~Group F中分別有5、9、2、12、3個(gè)PG基因家族成員,而柚分別有4、4、7、2、5、4個(gè)家族成員。在2和5號染色體上都有5~6條基因組成的簇狀的分布,重復(fù)的PG基因序列非常相似,但可能有不同的表達(dá)模式。這些基因產(chǎn)生于植物進(jìn)化過程中的串聯(lián)復(fù)制等復(fù)制事件[3]。
在PG基因聚類分析中,一些A、B、C、D和E亞類PG基因在果實(shí)成熟過程中表達(dá)[14-15]。本研究發(fā)現(xiàn)A亞類CgPG5和B亞類CgPG1、CgPG24基因、D亞類的CgPG13和E亞類的CgPG12、CgPG26與果實(shí)成熟相關(guān)。
PG同工酶1(PG1)和PG同工酶2(PG2)的催化亞基在成熟過程中與果膠酯酶協(xié)同作用參與細(xì)胞壁代謝,特別是多糖降解,PG2是果實(shí)成熟期間果膠代謝中涉及的主要酶[4, 16-18]。在草莓軟化過程中,下調(diào)了成熟貯藏中表達(dá)最多的2個(gè)PG基因FaPG1和FaPG2,轉(zhuǎn)基因成熟果實(shí)比野生型硬度更高[19]。本研究中,不易粒化果實(shí)貯藏后期汁胞高度軟化,汁胞中PG酶活性迅速上升,CgPG5、CgPG1、CgPG24 3個(gè)基因在軟化汁胞型小溪果實(shí)貯藏60 d顯著升高,表明3個(gè)基因可能參與了易粒化果的汁胞軟化和后期腐敗。其中CgPG1和CgPG24結(jié)構(gòu)相似,且CgPG24與番茄PG2預(yù)測功能一致,CgPG1和CgPG24與柚果實(shí)軟化相關(guān)。A亞類的CgPG5果實(shí)成熟過程中沒有表達(dá),只是在果實(shí)貯藏后期的汁胞腐敗和軟化時(shí)期高表達(dá),可能是汁胞進(jìn)入衰敗時(shí)期的標(biāo)志。
研究表明,D類和E類PG基因在多個(gè)器官中普遍表達(dá),但主要表達(dá)在花序中[20]。本研究中,D亞類的CgPG13和同屬E亞類的CgPG12、CgPG26基因在易粒化果成熟軟化過程中高表達(dá),貯藏30 d達(dá)到峰值,而當(dāng)汁胞進(jìn)入粒化初級階段時(shí),3個(gè)基因表達(dá)呈下降趨勢。雖然貯藏30?d的易粒化果實(shí)并未表現(xiàn)出如軟化果實(shí)般的顯著軟化,但較采后果實(shí)口感柔和,表明3個(gè)基因可能只是參與了易粒化果成熟過程中的汁胞暫時(shí)軟化。這種暫時(shí)軟化正好是柚汁胞食用的最佳時(shí)期。說明易粒化果汁胞粒化前的軟化與番茄的軟化并不一樣,可能與易粒化果粒化之前的汁胞軟化和調(diào)節(jié)細(xì)胞壁穩(wěn)態(tài)相關(guān)。在Group E中柚CgPG26的GDDC結(jié)構(gòu)域分別突變?yōu)镚DDA,SPNTDGI突變?yōu)锳PNTDGI。亞類E中PG的結(jié)構(gòu)域是不保守的。這種結(jié)構(gòu)域突變或不保守可能是柚易粒化果汁胞暫時(shí)軟化需要重新選擇的一類基因。
本研究發(fā)現(xiàn)不易粒化果和易粒化果汁胞都在果實(shí)生長、成熟和貯藏過程中PG活性一直上升,貯藏60?d達(dá)到最大值,但各時(shí)期不易粒化果PG活性顯著高于易粒化果。不易粒化果PG活性與CgPG5、CgPG1、CgPG24基因的后期表達(dá)基本一致,說明不易粒化果汁胞軟化與番茄、桃的軟化一樣,是由相關(guān)PG基因驅(qū)動(dòng)的。而易粒化果PG活性也在上升,這可能與整個(gè)果實(shí)的汁胞狀態(tài)有關(guān)。貯藏過程中,汁胞粒化逐漸加深,60?d粒化汁胞占3.92%,進(jìn)入了粒化初級階段[13]。前人研究表明,果膠主要存在于初生壁中,次生壁僅有少量存在[21-22],還有許多汁胞初生壁果膠還在水解之中。從CgPG13、CgPG12、CgPG26基因的后期表達(dá)也可以看出,盡管與其PG活性并不一致,但仍然有一定的表達(dá)量。易粒化果PG活性表現(xiàn)依然呈上升趨勢,但要顯著低于不易粒化果PG活性,說明易粒化果暫時(shí)軟化是一個(gè)復(fù)雜的過程,汁胞粒化與果膠降解存在共調(diào)控,CgPG基因表達(dá)的下降降低了PG活性,并促使汁胞向粒化方向發(fā)展,這與前人研究結(jié)果一致[19],但汁胞粒化程度的加深是否引起PG活性出現(xiàn)轉(zhuǎn)折點(diǎn)還需要進(jìn)一步研究。
不易粒化果汁胞向軟化方向發(fā)展,CgPG5、CgPG1、CgPG24在軟化汁胞型軟化后期高度表達(dá),是汁胞走向衰敗的標(biāo)志。而易粒化果汁胞則向粒化方向發(fā)展,CgPG13、CgPG12、CgPG26在粒化前的暫時(shí)軟化過程中高度表達(dá)。CgPG基因表達(dá)呈現(xiàn)的不同趨勢表明CgPG基因在不易粒化果和易粒化果中可能屬于2個(gè)不同的系統(tǒng),這是一個(gè)很有意義的現(xiàn)象,還需要進(jìn)一步對柚粒化過程中PG對細(xì)胞壁的影響機(jī)制開展深入研究。
參考文獻(xiàn)
- 陸勝民, 席玙芳, 金勇豐, 張耀洲. 植物多聚半乳糖醛酸酶的結(jié)構(gòu)與功能—文獻(xiàn)綜述[J]. 園藝學(xué)報(bào), 1999(6): 369-375.LU S M, XI Y F, JIN Y F, ZHANG Y Z. Structure and function of plant polygalacturonase—a literature review[J]. Acta Horticulture, 1999(6): 369-375. (in Chinese)
- OHASHI T, JINNO J, INOUE Y, ITO S, FUJIYAMA K, ISHIMIZU T. A polygalacturonase localized in the Golgi apparatus in Pisum sativum[J]. Journal of Biochemistry, 2017, 162(3): 193-201.
- MAHMOOD U, FAN Y H, WEI S Y, NIU Y, Li Y H, HUANG H L, CHEN Y L, TANG Z L, LIU L Z, QU C M, ZHANG K, LI J N, LU K. Comprehensive analysis of polygalacturonase genes offers new insights into their origin and functional evolution in land plants[J]. Genomics, 2020, 113(1): 1096-1108.
- KE X B, WANG H S, LI Y, ZHU B, ZANG Y X, HE Y, CAO J S, ZHU Z J, YU Y J. Genome-wide identification and analysis of polygalacturonase genes in Solanum lycopersicum[J]. International Journal of Molecular Sciences. 2018, 19(8): 1-18.
- PARK K C, KWON S J, KIM P H, BUREAU T, Kim N S. Gene structure dynamics and divergence of the polygalacturonase gene family of plants and fungus[J]. Genome, 2008, 51(1): 30-40.
- JIANG C Z, LU F, IMSABAI W, MEIR S, REID M S. Silencing polygalacturonase expression inhibits tomato petiole abscission[J]. Journal of Experimental Botany, 2008, 59(4): 973-979.
- KHAN N, FATIMA F, HAIDER M S, SHAZADEE H, LIU Z, ZHENG T, FANG J. Genome-wide identification and expression profiling of the polygalacturonase (PG) and pectin methylesterase (PME) genes in grapevine (Vitis vinifera L.)[J]. International Journal of Molecular Sciences, 2019, 20(13): 1-17.
- FIGUEROA C R, PIMENTEL P, GAETE-EASTMAN C, MOYA M, HERRARA R, CALIGARI P D S, MOYA-LE?N M A. Softening rate of the Chilean strawberry (Fragaria chiloensis) fruit reflects the expression of polygalacturonase and pectate lyase genes[J]. Postharvest Biology and Technology, 2008, 49(2): 210-220.
- LIN Y C, L I W, SUN Y H, KUMARI S, WEI H R, LI Q, TUNLAYAA S, SEDEROFF R R, CHIANG V L. SND1 transcription factor–directed quantitative functional hierarchical genetic regulatory network in wood formation in Populus trichocarpa[J]. The Plant Cell, 2013, 25(11): 4324-4341.
- YANG Y, YU Y, LIANG Y, ANDERSON C T, CAO J A. Profusion of molecular scissors for pectins: classification, expression, and functions of plant polygalacturonases[J]. Frontiers in Plant Science, 2018, 9: 1208.
- GARRIGA M, MU?OZ C A, CALIGARI P D S, RETAMALES J B. Effect of salt stress on genotypes of commercial (Fragaria ? ananassa) and Chilean strawberry (F. chiloensis)[J]. Scientia Horticulturae, 2015, 195: 37-47.
- SITRIT Y, HADFIELD K A, BENNETT A B, BTADFORD K J, DOWINE A B. Expression of a polygalacturonase associated with tomato seed germination[J]. Plant Physiol 1999, 121(2): 419-428.
- 張振玨, 謝志南, 許文寶. 琯溪蜜柚汁囊分化和粒化過程的解剖學(xué)觀察[J]. 植物學(xué)報(bào), 1999(1): 16-19. ZHANG Z J, XIE Z N, XU W B. Anatomical observation of the sac differentiation and granulation of Guanxi honey pomelo[J]. Acta Botany, 1999(1): 16-19. (in Chinese)
- 葛? 廷, 黃? 雪, 謝讓金. 多聚半乳糖醛酸基因在果樹中的研究進(jìn)展[J]. 植物生理學(xué)報(bào), 2019, 55(8): 1075-1088. GE T, HUANG X, XIE R J. Research progress of polygalacturonic acid gene in fruit trees[J]. Acta Plant Physiology, 2019, 55(8): 1075-1088. (in Chinese)
- 李? 慧, 叢? 郁, 常有宏, 藺? 經(jīng), 盛寶龍. 翠冠梨PG基因家族兩成員的克隆及其表達(dá)與貨架期果實(shí)軟化的關(guān)系[J]. 果樹學(xué)報(bào), 2012, 29(1): 17-23. LI H, CONG Y, CHANG Y H, LIN J, SHENG B L. The relationship between the cloning and expression of two members of the PG gene family of Cuiguan pear and fruit softening during shelf life[J]. Fruit Tree Journal, 2012, 29(1): 17-23. (in Chinese)
- DEAN D P, DANNY C ALEXANDER, ALAN B BENNETT. Molecular cloning of tomato fruit polygalacturonase: analysis of polygalacturonase mRNA levels during ripening[J]. Proceedings of the National Academy of Sciences, 1986, 83(17): 6420-6424.
- PANIAGUA C, RIC-V P, GARCIAG J A, LOPEZC G, BLANCOP R, MUNOZB J, SCHUCKEL J, KNOX J P, MATAS A J, QUESADA M A, POSE S, MERCADO J A. Elucidating the role of polygalacturonase genes in strawberry fruit softening[J]. Journal of Experimental Botany, 2020, 71(22): 7103-7117.
- BIRD C R, SMITH C J S, RAY J A, MOUREAU P, BEVAN M W, BIRD A S, HUGHES S, MORRIS P C, GRIERSON D, SCHUCH W. The tomato polygalacturonase gene and ripening-specific expression in transgenic plants[J]. Plant Molecular Biology1988, 11(5): 651-662.
- RAKESH B, JOE A, GALLAGHER, LEONARDO D, GOMEZ, MAURICE B. Genetic engineering of grass cell wall polysaccharides for biorefining[J]. Plant Biotechnology Journal, 2017, 15(9): 1071-1092.
- QIAN M, ZHANG Y, YAN X Y, HAN M Y, LI J J, LI F, Li FURUI, ZHANG D, ZHAO C P. Identification and expression analysis of polygalacturonase family members during peach fruit softening[J]. International Journal of Molecular Sciences, 2016, 17(11): 1933.
- KERRY H C, DEBRA M. The structure, function, and biosynthesis of plant cell wall pectic polysaccharides[J]. Carbohydrate Research, 2009, 344(14): 1879-1900.
- SELVENDRAN R R. Developments in the chemistry and biochemistry of pectic and hemicellulosic polymers[J]. Journal of Cell Science, 1985, 2: 51-88.

