利用智能手機探究影響化學反應速率的因素
楊世全 張莉華 邱亞明

摘要:為解決部分高中缺少儀器難以開展數字化實驗的問題,教師以FeCl3催化H2O2分解實驗為例,借助常見的材料和智能手機設計簡單可行的教學方案,先測定H2O2分解實驗中O2的壓強和溶液溫度,再將實驗測定數據與教材給出的溫度對速率影響倍數對比,說明H2O2在升溫條件下分解速率增大主要是由催化劑活性決定的,體現了數字化實驗的便捷與高效,提高了教學效率。
關鍵詞:手機傳感器;溫度;化學反應速率;碰撞理論
化學教師按照教材要求,開展定性研究影響化學反應速率因素的實驗,一般會采用數字化手段進行設計與實施。在儀器配備齊全的學校,教師可以利用成套儀器開展實驗教學。對于一些暫時沒有條件裝備先進儀器的學校來說,教師需要利用智能手機和常見材料,設計簡單可行的實驗方案,引導學生思考和操作,以高效實現目標。
一、實驗存在的不足和改進思路
定性研究影響化學反應速率的因素是人教版化學教材內容,人教版《普通高中教科書 化學必修 第二冊》設計了溫度對化學反應速率的影響實驗[1],實驗設計見表1。人教版《普通高中教科書 化學 選擇性必修1 化學反應原理》也涉及定性與定量探究影響化學反應速率因素的實驗,同樣給出5%的H2O2溶液、1 mol/L FeCl3溶液、蒸餾水和熱水等試劑,引導學生設計相應實驗。該實驗的目的是讓學生認識影響化學反應速率的因素,參與設計實驗的過程,學會利用控制變量法研究問題。教材上的論述是實驗者通過觀察產生氣泡快慢的現象得出結論,即其他條件相同時,升高溫度,H2O2分解速率增大。對于有催化劑參與的反應,在分析溫度對化學反應速率的影響時,洪耀輝和周波依據教材從微觀角度利用簡單碰撞理論分析[2][3],認為溫度升高增大了活化分子百分含量,提高了有效碰撞頻率,使化學反應速率增大。然而,值得注意的是,H2O2分解實驗中用到了FeCl3(催化劑),而溫度對催化劑的活性有一定影響,例如,酶的催化活性在35℃左右最高。可見,實驗一中化學反應速率增大的原因也可能是:溫度升高導致Fe3+催化活性增強,使得H2O2分解速率增大。
人教版《普通高中教科書 化學 選擇性必修1 化學反應原理》也從碰撞理論的角度解釋了溫度的影響,但對催化劑活性的影響并沒有提及[4]。近年高考化學卷涉及溫度影響催化劑活性從而改變化學反應速率的考查,例如,2020年高考江蘇卷中就有化學反應原理題(涉及催化劑活性):分析????????催化加氫反應在一定溫度范圍內,隨溫度升高,????????轉化率增大的原因。2016年高考全國Ⅱ卷化學反應原理題也考查了催化劑活性。因此,學生有必要認識溫度對催化劑活性的影響。筆者查閱文獻,范愛玉在教學中引導學生探究升溫原因——是因為碰撞頻率增大還是通過提高催化劑活性導致化學反應速率增大,同時設計了不同溫度下用MnO2做催化劑反應的對比實驗,進一步說明催化劑活性影響反應速率。筆者認為,上述實驗設計方案有不嚴密之處:有催化劑存在的情況下,溫度、活化分子的百分含量和催化劑的活性都會影響實驗,究竟是哪種因素影響速率,通過實驗現象是無法說明的。
實驗者重復教材上的實驗并進行分析,在滴入FeCl3溶液的瞬間,溶液顏色立即變為棕褐色(或棕黃色),說明在滴入FeCl3溶液之后,溶液中生成了有色的過渡態絡合物,如FeⅢ(HO2)2+與FeⅢ(OH)(HO2)+。實驗者拍攝常溫水浴和熱水浴發生反應的視頻并進行對比,在滴入2滴FeCl3溶液瞬間,兩支試管中的液體均零星呈棕褐色,常溫水浴組在經過2.5 s左右整個溶液呈棕褐色,經過4 s左右開始出現少量氣泡;熱水浴組經過1.5 s左右整個溶液呈棕褐色,且立即出現少量氣泡。在溶液變色之前,兩組實驗肉眼均無法看到明顯氣泡,氣泡的產生都是在出現棕褐色物質之后。隨著時間的推移,常溫水浴組氣泡量逐漸增多,熱水浴組中立即出現大量氣泡,觀察者可以清楚地看到化學反應速率先增大,一段時間又開始減小,且在熱水浴情況下反應速率增大更快。學生如按教材說明進行實驗操作,常溫下做兩組實驗,當試管中產生少量氣泡時將其中一支試管放入熱水浴中,觀察到熱水浴試管中,氣泡量快速增多。學生根據這些實驗現象可以得出溫度升高反應速率增大的結論,但對于加快的原因則無法通過現象判斷。學生會存在疑惑,到底是從催化劑活性角度分析還是從碰撞頻率增大的角度分析升溫對速率的影響呢?
根據化學反應動力學理論,H2O2的分解在一定條件下符合一級反應動力學方程,速率方程為v=k·c(H2O2)。如果溫度升高,僅從簡單碰撞理論分析,根據阿倫里烏斯定律推出的速率常數Kexp=Aexpe????,Aexp和Eexp為與溫度、濃度無關的常數。教師可以利用手機壓力傳感器和溫度傳感器,引導學生設計一套實驗裝置用以測量H2O2分解產生的O2壓強變化量和溶液的溫度變化量,根據理想氣體狀態方程pV=nRT,可知,在氣體體積和溫度不變的情況下,利用壓強可以求出產生的O2物質的量,根據方程式系數關系可以換算得到H2O2的量,取得H2O2濃度的變化數據,繪制H2O2濃度變化曲線,對曲線求導得出以H2O2濃度變化表示的速率變化曲線。師生選擇溫度上升段分析,取起始段時間t1時的溫度T1和瞬時速率v1,取速率增大之后某點t2時的溫度T2和瞬時速率v2,根據速率公式t1點和t2點速率之比為??????????????????????????????????????,化簡后得????????????????????????????????????。當Eexp保持不變時,速率的變化由濃度和溫度決定,若H2O2分解反應在升溫過程中速率的增大倍數符合阿倫里烏斯公式的計算結果,則說明升高溫度速率增大是由溫度決定的;若計算結果與實際相差過大,則說明化學反應速率增大并不是溫度造成的,推測是催化劑活性增強的結果。
二、新實驗的設計與驗證
(一)實驗試劑及儀器
實驗試劑:約5% H2O2溶液、1 mol/L FeCl3溶液、無水CaCl2。
實驗儀器:試管、橡膠塞(帶孔)、簡易干燥器、Y形管、玻璃罐頭瓶(1000 mL)、棉花、智能手機一部(帶壓強傳感器、phyphox App)、溫度傳感器、硬紙板(用于固定手機和Y形管)。
說明如下。①容器體積:某型智能手機高13.81 cm、寬6.7 cm、厚0.69 mm;溫度傳感器高10.1 cm、寬4 cm、厚1.15 cm,線長1 m,直徑0.3 cm;硬紙板高16 cm、寬10 cm、厚0.2 cm。綜合考慮,罐頭瓶中收集氣體體積近似為850 mL。②計算數據的選擇:由于智能手機測壓非常靈敏,收集數據會出現波動(連續的時間段有升高又有降低),不會出現完全單調增加或減少的理想情況,因此將一段時間內的數據平均值作為計算依據。
(二)實驗的步驟
1.實驗裝置的組裝及實驗前的準備
簡易干燥器的制作:取醫用輸液管,將滴壺一端剪開形成大口,另一端不變,去掉多余的細軟管,在滴壺中裝入一團棉花,堵住細管口,加入足量無水CaCl2,用棉花堵住大口;將帶細軟管的一端插入帶孔的橡膠塞中,制成簡易干燥器。
教師打開智能手機,將屏幕設置為常亮模式,打開Phyphox App,進入壓力測量界面,點擊開始按鈕,或者設置定時開始,放入罐頭瓶中。教師演示實驗時,打開手機投屏軟件,將手機屏幕投放到交互式電子白板上,此時Phyphox測壓界面會呈現在交互式電子白板上。
2.實驗操作
第一步:向Y形管一端滴入2滴 1 mol/L的FeCl3溶液,用量筒量取2 mL 5%H2O2溶液,倒入Y形管的另一端,將溫度傳感器插入滴有FeCl3溶液的一端,塞緊帶有干燥器的橡膠塞,將Y形管和溫度傳感器同時放入罐頭瓶中。將罐頭瓶瓶蓋扣好,觀察智能手機中壓強的變化。一段時間后,壓強趨于穩定,表明裝置氣密性良好。
第二步:使罐頭瓶傾斜,迅速將Y形管中的H2O2倒入滴有FeCl3溶液的一端,記下混合的時間,觀察屏幕中壓力曲線的變化情況。
第三步:當壓力數值趨于一條平滑直線時,打開罐頭瓶瓶蓋,拿出智能手機點擊Phyphox軟件中暫停鍵,停止測壓。同時,點擊溫度傳感器按鍵,停止測溫,將數據導入電腦進行分析。
(三)實驗數據的處理與分析
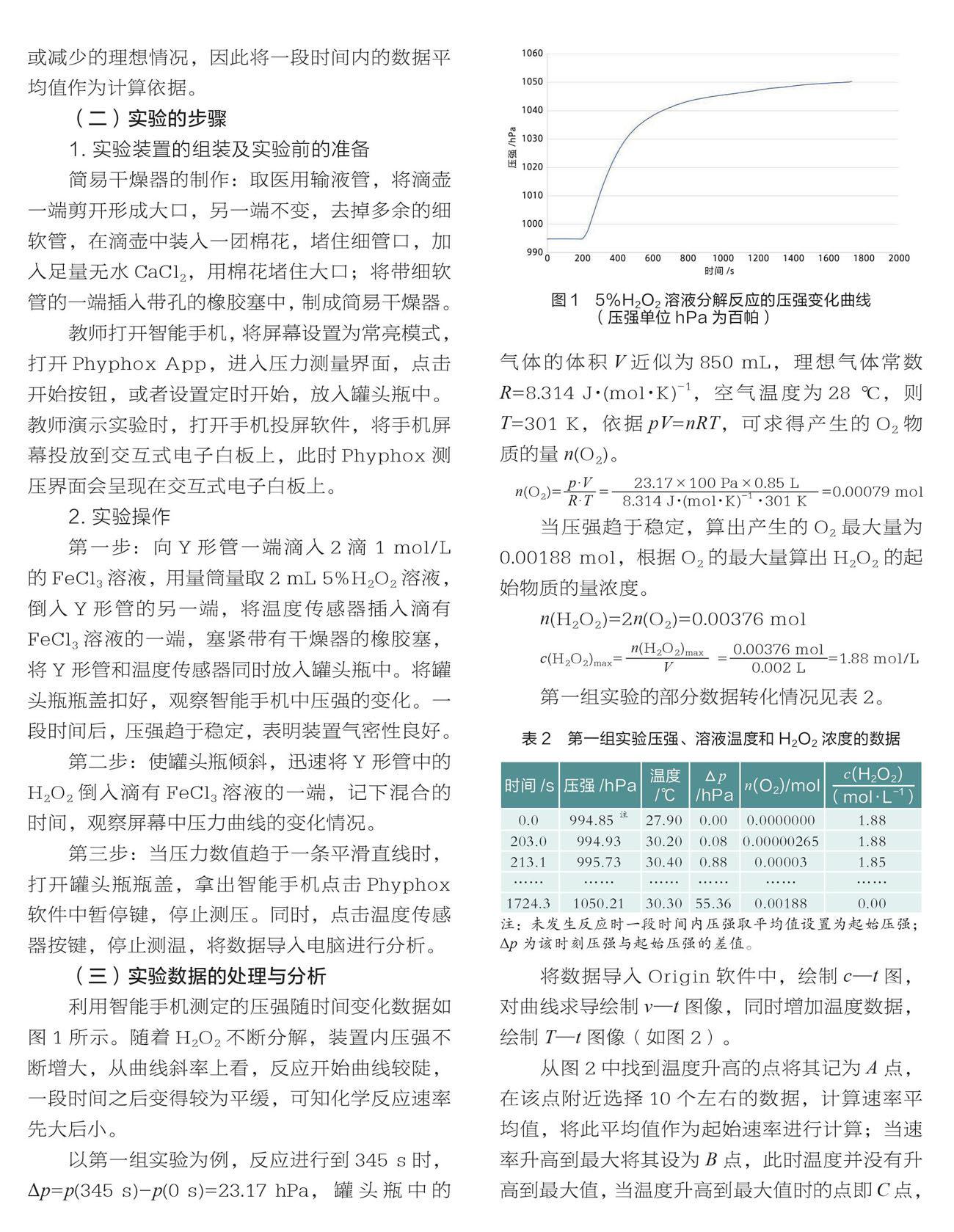
利用智能手機測定的壓強隨時間變化數據如圖1所示。隨著H2O2不斷分解,裝置內壓強不斷增大,從曲線斜率上看,反應開始曲線較陡,一段時間之后變得較為平緩,可知化學反應速率先大后小。
以第一組實驗為例,反應進行到345 s時,Δp=p(345 s)-p(0 s)=23.17 hPa,罐頭瓶中的氣體的體積V近似為850 mL,理想氣體常數R=8.314 J·(mol·K)-1,空氣溫度為28 ℃,則T=301 K,依據pV=nRT,可求得產生的O2物質的量n(O2)。
當壓強趨于穩定,算出產生的O2最大量為0.00188 mol,根據O2的最大量算出H2O2的起始物質的量濃度。
n(H2O2)=2n(O2)=0.00376 mol
第一組實驗的部分數據轉化情況見表2。
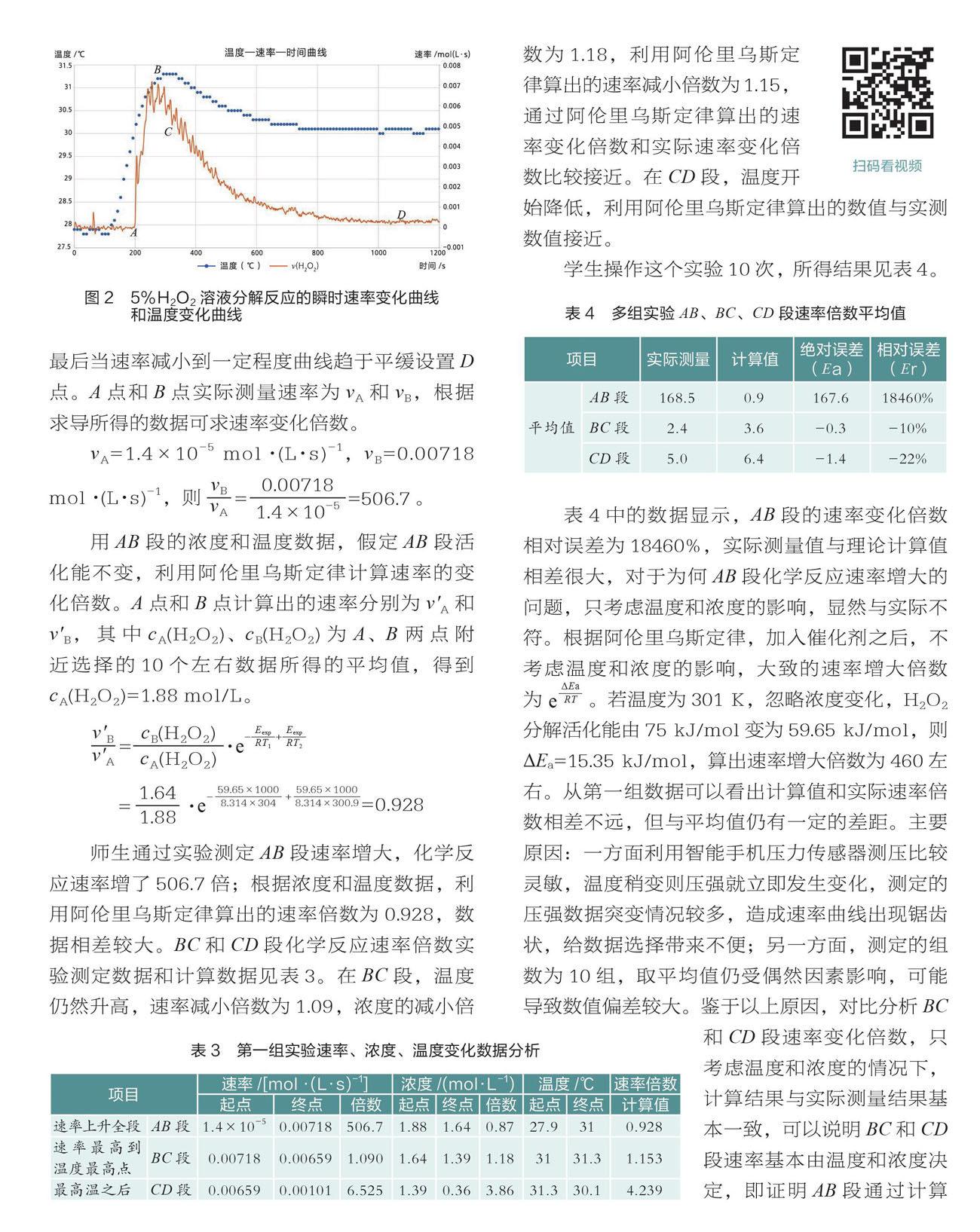
將數據導入Origin軟件中,繪制c—t圖,對曲線求導繪制v—t圖像,同時增加溫度數據,繪制T—t圖像(如圖2)。
從圖2中找到溫度升高的點將其記為A點,在該點附近選擇10個左右的數據,計算速率平均值,將此平均值作為起始速率進行計算;當速率升高到最大將其設為B點,此時溫度并沒有升高到最大值,當溫度升高到最大值時的點即C點,最后當速率減小到一定程度曲線趨于平緩設置D點。A點和B點實際測量速率為vA和vB,根據求導所得的數據可求速率變化倍數。
vA=1.4×10-5mol·(L·s)-1,vB=0.00718 mol·(L·s)-1,則???????????????????????????????????。
用AB段的濃度和溫度數據,假定AB段活化能不變,利用阿倫里烏斯定律計算速率的變化倍數。A點和B點計算出的速率分別為v'A和v'B,其中cA(H2O2)、cB(H2O2)為A、B兩點附近選擇的10個左右數據所得的平均值,得到cA(H2O2)=1.88 mol/L。
師生通過實驗測定AB段速率增大,化學反應速率增了506.7倍;根據濃度和溫度數據,利用阿倫里烏斯定律算出的速率倍數為0.928,數據相差較大。BC和CD段化學反應速率倍數實驗測定數據和計算數據見表3。在BC段,溫度仍然升高,速率減小倍數為1.09,濃度的減小倍數為1.18,利用阿倫里烏斯定律算出的速率減小倍數為1.15,通過阿倫里烏斯定律算出的速率變化倍數和實際速率變化倍數比較接近。在CD段,溫度開始降低,利用阿倫里烏斯定律算出的數值與實測數值接近。
學生操作這個實驗10次,所得結果見表4。
表4中的數據顯示,AB段的速率變化倍數相對誤差為18460%,實際測量值與理論計算值相差很大,對于為何AB段化學反應速率增大的問題,只考慮溫度和濃度的影響,顯然與實際不符。根據阿倫里烏斯定律,加入催化劑之后,不考慮溫度和濃度的影響,大致的速率增大倍數為??????。若溫度為301 K,忽略濃度變化,H2O2分解活化能由75 kJ/mol變為59.65 kJ/mol,則ΔEa=15.35 kJ/mol,算出速率增大倍數為460左右。從第一組數據可以看出計算值和實際速率倍數相差不遠,但與平均值仍有一定的差距。主要原因:一方面利用智能手機壓力傳感器測壓比較靈敏,溫度稍變則壓強就立即發生變化,測定的壓強數據突變情況較多,造成速率曲線出現鋸齒狀,給數據選擇帶來不便;另一方面,測定的組數為10組,取平均值仍受偶然因素影響,可能導致數值偏差較大。鑒于以上原因,對比分析BC和CD段速率變化倍數,只考慮溫度和濃度的情況下,計算結果與實際測量結果基本一致,可以說明BC和CD段速率基本由溫度和濃度決定,即證明AB段通過計算所得的結果是可信的。
可見,AB段正是由于催化劑的活性改變,造成速率發生變化。由此確定AB段溫度升高,化學反應速率增大,僅依據碰撞理論解釋溫度對該階段化學反應速率的影響,不妥。
達格瑪·維喬切克(Dagmar Wiechoczek)參考H2O2被Fe3+催化分解的過程,得到H2O2分解的原理。
根據催化原理可知,催化劑降低了反應的活化能,結合過渡態理論,降低活化能實際就是與反應物形成能量更低的中間體,例如,FeⅢ(OOH)2+和FeⅢ(OH)(HO2)+等。一旦形成了穩定的中間體,活性中心便失去繼續反應的能力。因此,需要驅動力迅速打破這種穩定態,從而使體系再次回到高能態或活化態,使活性中心再生。溫度升高實現了催化活性中心的再生,促使化學反應速率增大。簡言之,在FeCl3催化H2O2分解反應中,溫度升高化學反應速率增大,有必要考慮催化劑活性的影響。
(四)啟示
在化學反應速率的教學中,學生利用控制變量法探究催化劑對化學反應速率的影響后,通常會提出問題:反應中出現的溫度變化,也會影響化學反應速率。教師可以簡化實驗方案,解答學生的疑問。根據人教版教材的描述“溫度每升高10 ℃,化學反應速率增大2~4倍”,實驗溫度最高達31.3 ℃,升高了3.4 ℃,而實際測定的速率變化倍數為506.7,顯然速率增大的情況不符合溫度對速率的影響規律,推測AB段的速率增大不是溫度導致的。教師引導學生對拍攝的視頻進行分析,根據慢鏡頭顯示的溶液滴入催化劑的顏色變化和氣泡量,分析得到AB段速率的變化是由于催化劑的活性增強導致的結論。教師借此幫助學生認識溫度對反應速率的影響。學生不僅需要從碰撞理論角度認識,而且需要從催化劑活性角度認識。如此,教師在教學中提高學生的證據推理與模型認知素養,提升學生的綜合能力。
三、總結
實踐證明,教師借助常見的材料和智能手機開展數字化實驗,可以彌補學校儀器裝備的不足。設計簡易測壓裝置,利用手機壓力傳感器測定反應產生的氣體壓強變化,在近似恒容恒溫的情況下,用定量計算的方式對問題進行分析,不失為一種有效解決化學實驗教學的手段。學生對比分析測定結果和計算結果,分析得出結論:對于單一有催化劑參與的反應,化學反應速率先增大后減小,需要考慮溫度和濃度的影響,同時需要考慮溫度對催化劑活性的影響。溫度如何影響化學反應速率,可以從兩個角度解釋:一是從碰撞理論角度解釋,升高溫度提高了活化分子的百分量,提高了活化分子之間的碰撞頻率從而增大了化學反應速率;二是從過渡態理論解釋,升高溫度使催化活性中心再生,增大了催化劑的活性,增大化學反應速率。教師引導學生探究化學反應速率的影響因素時,針對不同的化學反應,應從多角度看待速率的變化本質,聯系實際,提高教學的科學性。
注:本文系湖北省教育科學規劃課題“關鍵能力視域下的高三化學復習策略的制定及教學研究——以化學反應原理模塊的復習為例”的研究成果。
參考文獻
[1] 王晶,鄭長龍.普通高中教科書 化學 必修 第二冊[M].北京:人民教育出版社,2019.
[2] 周波.核心素養視角下高中化學“學生活動”設計案例分析[J].中學教學參考,2020(1):59.
[3] 洪耀輝,郭毅紅,陳新華.基于發展性評價的課堂實踐探索 [J].福建基礎教育研究,2021(1):119.
[4] 王晶,鄭長龍.普通高中教科書 化學 選擇性必修1 化學反應原理[M].北京:人民教育出版社,2020.
(作者楊世全、張莉華系湖北省安陸市第一高級中學一級教師;邱亞明系湖北省安陸市第一高級中學高級教師)
責任編輯:祝元志

