口腔鱗狀細胞癌組織miR-31-5p、LATS2表達變化及其臨床意義
成思源,楊文華,孫庚林
1 天津市北辰醫院口腔科,天津300400;2 天津醫科大學總醫院口腔科
口腔癌是發生在口腔內惡性腫瘤的總稱,其中90%以上為口腔鱗狀細胞癌(OSCC)[1-2]。近年來,隨著人民生活水平提高,吸煙、酗酒、咀嚼檳榔等不良生活習慣增多,以及人乳頭瘤病毒感染增加,OSCC 的發病率不斷上升。目前,外科手術仍然是OSCC 最有效的治療手段,但術后復發和轉移的風險較高,而現有的治療策略對術后復發和轉移的效果不佳[3]。因此,深入研究OSCC 發病的分子機制,探索新的分子治療靶點,對改善患者預后意義重大。微小RNA(miRNA)是一類短鏈非編碼小RNA分子,能夠在轉錄后水平負向調控靶基因的表達。近年研究發現,miRNA 能夠作為癌基因或抑癌基因參與腫瘤的發生、發展[4]。miR-31-5p是miRNA家族中的一員。有研究報道,miR-31-5p在結直腸癌和膀胱癌組織中異常表達,并且其異常表達與腫瘤細胞增殖、侵襲和遷移密切相關[5-6]。大腫瘤抑制激酶2(LATS2)是一種能夠抑制腫瘤發生、發展的激酶。有研究報道,LATS2 在非小細胞肺癌和乳腺癌組織中低表達,并且其低表達能夠促進腫瘤細胞增殖、侵襲和遷移[7-8]。但目前臨床鮮見miR-31-5p、LATS2在OSCC 組織中表達的報道,并且其表達與患者臨床病理特征和預后的關系尚不清楚。本研究探討了OSCC 組織miR-31-5p、LATS2 表達變化及其臨床意義。現報告如下。
1 資料與方法
1.1 臨床資料 選擇2017年1月—2018年10月天津市北辰醫院收治的OSCC患者97例。所有患者經術后組織病理檢查明確診斷。納入標準:①符合OSCC 診斷標準;②接受口腔癌根治術、下頜-唇劈開術或拉通術治療;③初診,術前未接受任何抗腫瘤治療;④臨床病理資料和術后隨訪資料完整。排除標準:①年齡<18歲者;②合并其他部位惡性腫瘤者;③合并心、肝、腎等重要臟器嚴重疾病者;④合并全身感染性疾病者。其中,男65例、女32例,年齡36~78(58.25 ± 8.65)歲;腫瘤直徑:≥3 cm 65 例,<3 cm 32例;組織分化程度:低分化21 例,中高分化76 例;TNM 分期[9]:Ⅰ、Ⅱ期51例,Ⅲ、Ⅳ期46例;有淋巴結轉移41例,無淋巴結轉移56例。本研究經天津市北辰醫院醫學倫理委員會批準(倫理批號:2022022501),所有研究對象或其家屬知情同意并簽署書面知情同意書。
1.2 miR-31-5p、LATS2 mRNA 表達檢測 采用RTqPCR 法。收集術中切除的OSCC 組織及其配對的癌旁組織(距腫瘤組織邊緣>5 cm,并經組織病理檢查明確為正常口腔黏膜組織),液氮下速凍。取凍存的OSCC 組織及其配對的癌旁正常組織,液氮下充分研磨后,采用TRIzol 法抽提組織總RNA,經Nano-Drop 2000C 超微量分光光度計鑒定,提取的總RNA濃度和純度合格。按PrimeScriptTMRT Master Mix(Perfect Real Time)說明將總RNA 反轉錄為cDNA。反轉錄條件:42 ℃1 h,95 ℃5 min。以cDNA 為模板,按實時熒光定量PCR 試劑盒說明進行PCR 擴增。所有引物序列由武漢金開瑞生物工程有限公司設計合成。引物序列:miR-31-5p 上游引物5′-CCCTCGAGACATTTGAAAGCCATTAGACT-3′、下游引 物5′-GCGTCGACAGGTTGAGCGAGCGAAG-3′,U6 上游引物5′-CTCGCTTCGGCAGCACA-3′、下游引物5′-AACGCTTCACGAATTTGCGT-3′;LATS2 上游引物5'-AAGAGCTACTCGCCATACGCCTTT-3'、下游 引 物 5'-AGCTTTGGCCATTTCTTGCTCCAG-3',GAPDH 上游引物5'-AACTTTGGCATTGTGGAAGG-3'、下 游 引 物5'-ACACATTGGGGGTAGGAACA-3'。PCR 反應體系共10.0 μL:5 × SYBR Premix Ex Taq 5 μL,cDNA 模板1 μL,上下游引物各0.2 μL,ROX參考染料0.2 μL,DEPC 處理水3.4 μL;反應條件:95 ℃預變性90 s,95 ℃變性30 s、63 ℃退火30 s、72 ℃延伸15 s共40個循環。擴增反應結束后,繪制熔解曲線,收集循環閾值(CT)數。以U6 或GAPDH為內參,采用2-ΔΔCT法計算miR-31-5p、LATS2 mRNA相對表達量。
1.3 miR-31-5p 與LATS2 的結合位點預測 通過https://starbase. sysu. edu. cn/在線網站,預測miR-31-5p與LATS2的靶向結合位點。
1.4 隨訪 所有患者出院后通過門診復查或電話形式定期隨訪3 年,隨訪截至2021 年10 月,統計患者生存情況,計算3年累積生存率。
1.5 統計學方法 采用SPSS26.0 統計軟件。計量資料經Shapiro-Wilk 檢驗符合正態分布,以±s表示,結果比較采用獨立樣本t檢驗;計數資料比較采用χ2檢驗。相關性分析采用Pearson 相關分析法。影響因素分析采用多因素Cox 比例風險回歸模型。生存分析采用Kaplan-Meier 法,生存率比較采用Log-Rank檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 OSCC 組織與癌旁正常組織miR-31-5p、LATS2 mRNA 表達比較 OSCC 組織與癌旁正常組織miR-31-5p 相對表達量分別為3.258 ± 0.562、1.096 ± 0.220,LATS2 mRNA 相對表達量分別為1.216 ± 0.252、3.354 ± 0.449。OSCC 組織miR-31-5p 相對表達量高于癌旁正常組織,LATS2 mRNA 相對表達量低于癌旁正常組織(t分別為35.314、40.900,P均<0.01)。
2.2 OSCC 組織miR-31-5p 表 達與LATS2 mRNA 表達的關系 經在線網站預測,miR-31-5p與LATS2存在靶向結合位點,見圖1。Pearson 相關分析顯示,OSCC 組織miR-31-5p 表達與LATS2 mRNA 表達呈負相關關系(r=-0.688,P<0.01)。

圖1 miR-31-5p與LATS2的靶向結合位點示意圖
2.3 miR-31-5p、LATS2 mRNA 表達與OSCC 患者臨床病理特征的關系 見表1。

表1 miR-31-5p、LATS2 mRNA表達與OSCC患者臨床病理特征的關系
2.4 miR-31-5p、LATS2 mRNA 表達與OSCC 患者預后的關系 97 例OSCC 患者中,miR-31-5p 表達≥3.258 者55 例、miR-31-5p 表 達<3.258 者42 例,LATS2 mRNA 表達≥1.216 者40 例、LATS2 mRNA 表達<1.216 者57 例。 miR-31-5p 表 達≥3.258 者與miR-31-5p 表達<3.258 者3 年累積生存率分別為60.00%、78.57%,LATS2 mRNA 表達≥1.216 者 與LATS2 mRNA 表達<1.216 者3 年累積生存率分別為80.00%、59.65%。miR-31-5p表達≥3.258者3年累積生存率低于miR-31-5p表達<3.258者,LATS2 mRNA表達≥1.216者3年累積生存率高于LATS2 mRNA表達<1.216 者(χ2分別為5.829、6.616,P均<0.05)。見圖2、3。
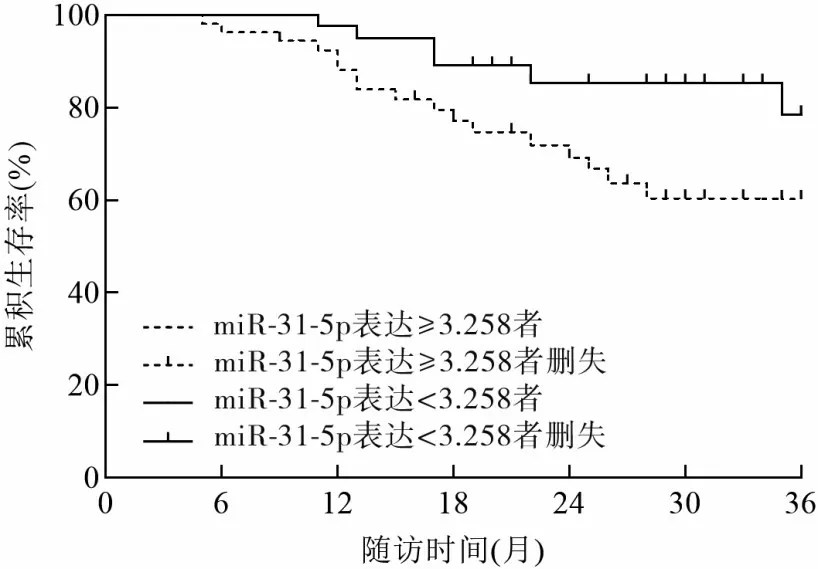
圖2 OSCC患者不同miR-31-5p表達者的生存曲線

圖3 OSCC患者不同LATS2 mRNA表達者的生存曲線
2.5 OSCC 患者預后的影響因素分析 所有患者術后隨訪4~36個月,中位隨訪時間26個月,隨訪期間死亡31 例。OSCC 患者死亡者與存活者臨床病理資料比較見表2。

表2 OSCC患者死亡者與存活者臨床病理資料比較[例(%)]
以隨訪時間為時間變量,以OSCC 患者預后(存活=0,死亡=1)為因變量,以單因素分析中有統計學差異的指標為自變量,納入多因素Cox 比例風險回歸模型。結果顯示,TNM 分期Ⅲ、Ⅳ期及有淋巴結轉移、miR-31-5p 表達≥3.258 為OSCC 患者死亡的獨立危險因素,而LATS2 mRNA 表達≥1.216 則為其獨立保護因素(P均<0.05),見表3。

表3 OSCC患者預后影響因素的多因素Cox比例風險回歸分析結果
3 討論
口腔癌是口腔頜面部常見的惡性腫瘤,其中90%以上為OSCC。OSCC是起源于口腔黏膜上皮并伴有鱗狀分化的上皮性惡性腫瘤,患者預后主要取決于腫瘤臨床分期。臨床上60%以上的OSCC 患者確診時已屬晚期,并有10%~40%患者出現淋巴結轉移或遠處轉移。盡管近年來廣泛開展多學科綜合治療,在一定程度上延長了OSCC 患者的生存期,但晚期OSCC 患者5 年生存率仍不足50%[10-11]。因此,深入研究OSCC 發病的分子機制,探索新的分子治療靶點,對改善患者預后意義重大。
miRNA 是一類長度為18~25 個核苷酸的內源性非編碼單鏈小分子RNA,通過與mRNA 的3′非翻譯區特異性結合,降解mRNA或阻礙其翻譯,從而調控靶基因的表達。近年研究發現,miRNA能夠作為癌基因或抑癌基因參與腫瘤的發生、發展[4]。已有研究報道,miR-770 能夠靶向調節Sir2 相關酶類7/Smad4信號通路促進OSCC細胞侵襲和遷移[12]。miR-31-5p是miRNA 家族中的一員,基因定位于人染色體9p21.3。柴晶晶等[13]研究報道,miR-31-5p在結直腸癌細胞中表達下調,而上調miR-31-5p 表達則能抑制結直腸癌細胞增殖、侵襲并促進其凋亡。YU等[14]研究發現,miR-31-5p 在肺腺癌細胞中表達上調,并且miR-31-5p能夠靶向下調特異性AT序列蛋白2而促進肺腺癌細胞上皮間質轉化。由此可見,miR-31-5p可作為抑癌或促癌基因參與多種腫瘤的發生、發展。本研究結果發現,OSCC 組織miR-31-5p 相對表達量高于癌旁正常組織,并且OSCC 組織miR-31-5p 表達與腫瘤組織分化程度、TNM分期、淋巴結轉移有關,提示miR-31-5p 在OSCC 中發揮促癌基因作用,其表達上調能夠促進腫瘤惡性進展。這可能與miR-31-5p能夠增強腫瘤細胞線粒體活性有關。線粒體是細胞內能量生成的關鍵細胞器,在細胞新陳代謝、遷移、凋亡等過程中發揮重要作用。線粒體功能障礙是腫瘤發生、發展的重要原因[15]。王恩程等[16]研究發現,沉默miR-31-5p 能夠通過破壞OSCC 細胞的線粒體活性,抑制OSCC 細胞增殖并誘導其凋亡。本研究結果顯示,miR-31-5p表達≥3.258者3年累積生存率低于miR-31-5p 表達<3.258 者;多因素Cox 比例風險回歸分析顯示,miR-31-5p 表達≥3.258 是OSCC 患者死亡的獨立危險因素。結果提示miR-31-5p 表達與OSCC患者預后有一定關系。
LATS 是AGC 家族中的一種絲氨酸/酪氨酸蛋白激酶,C 端序列高度保守而N 端序列變化多樣,其功能亦具有多樣性。LATS2 是LATS 家族的重要成員,在各種組織中廣泛表達,以肌肉和心臟中表達最高。LATS2 基因定位于人染色體13q11~12 區域,該區域與多種抑癌基因的早期雜合性丟失抑制有關,提示LATS2 可能是一種抑癌基因。近年研究報道,LATS2在非小細胞肺癌、卵巢癌等惡性腫瘤細胞中低表達,上調LATS2 表達能夠抑制腫瘤細胞增殖、分化和遷移等[17-18]。本研究結果顯示,OSCC 組織LATS2 mRNA 相對表達量低于癌旁正常組織,并且OSCC 組織LATS2 mRNA 表達與腫瘤組織分化程度、TNM分期、淋巴結轉移有關。提示LATS2在OSCC中發揮抑癌基因作用,LATS2 mRNA 表達降低可促進腫瘤惡性進展。這可能與LATS2 能夠參與組成Hippo 信號通路有關。Hippo 信號通路上游膜蛋白受體作為胞外生長抑制信號的感受器,在感受到胞外生長抑制信號后可激活一系列激酶級聯磷酸化反應,使下游Yes 相關蛋白(YAP)、具有PDZ 結合基序的轉錄共激活因子(TAZ)磷酸化,從而抑制腫瘤細胞增殖、分化、遷移等[19]。LATS2 擁有PPXY 基序,能夠結合并磷酸化帶有WW 結構域的YAP、TAZ,從而組成Hippo 信號通路,使YAP、TAZ 失去促癌作用[20]。本研究結果顯示,LATS2 mRNA 表達≥1.216者3 年累積生存率高于LATS2 mRNA 表達<1.216者;而多因素Cox 比例風險回歸分析顯示,LATS2 mRNA 表達≥1.216 是OSCC 患者預后的獨立保護因素。結果表明,LATS2 表達與OSCC 患者預后密切相關。
本研究經在線網站預測發現,miR-31-5p 與LATS2 存在靶向結合位點;相關性分析發現,OSCC組織miR-31-5p 表達與LATS2 mRNA 表達呈負相關關系。提示miR-31-5p、LATS2 可能共同影響OSCC患者預后。YUAN等[21]通過雙熒光素酶報告基因試驗證實,miR-31-5p 能夠靶向下調LATS2 表達使Hippo信號通路失活,從而促進OSCC 生長。由于腫瘤惡性程度高、伴有淋巴結轉移、耐藥性高等原因,晚期OSCC 患者術后預后較差,5 年生存率較低。本研究結果亦發現,TNM 分期Ⅲ、Ⅳ期和有淋巴結轉移是OSCC患者死亡的獨立危險因素。
綜上所述,OSCC 組織miR-31-5p高表達、LATS2低表達,二者表達變化與腫瘤組織分化程度、TNM分期、淋巴結轉移以及患者預后有關。但目前miR-31-5p 和LATS2 在OSCC 發生、發展中的具體分子機制尚不完全清楚,仍需進一步研究。

