三黃瀉心湯煎煮過程中13種指標成分動態變化與分布規律研究
吳學淵,房春林,李 文,曾佑琴,傅 舒,李 銳,章津銘,傅超美,王 鳳
三黃瀉心湯煎煮過程中13種指標成分動態變化與分布規律研究
吳學淵1, 2,房春林2,李 文1*,曾佑琴3,傅 舒1,李 銳1,章津銘1,傅超美1*,王 鳳4
1.成都中醫藥大學藥學院西南特色中藥資源國家重點實驗室,四川 成都 611137 2.成都農業科技職業學院,四川 成都 611130 3.成都中醫藥大學醫學技術學院,四川 成都 611137 4.四川全泰堂中藥飲片有限公司,四川 遂寧 629000
建立經典名方三黃瀉心湯(Sanhuang Xiexin Decoction,SXD)中13種指標成分(表小檗堿、黃連堿、巴馬汀、小檗堿、黃芩苷、漢黃芩苷、黃芩素、漢黃芩素、大黃酸、蘆薈大黃素、大黃素、大黃酚、大黃素甲醚)的含量同時測定方法,探索SXD煎煮過程中成分動態變化和分布規律,揭示SXD復合分散體系的制劑特征。按照SXD傳統煎煮方法制備煎液,建立樣品中13種指標成分的含量同時測定方法,檢測各指標成分在湯劑、離心上清液、離心沉積物中的含量;進一步地,分別制備浸泡結束、剛沸騰以及煎煮不同時間后的樣品進行測定,繪制SXD煎煮過程中13種指標成分動態變化和分布規律圖,分析煎煮過程中各成分在湯劑、離心上清液和離心沉積物中的含量變化情況。SXD煎液中,含量最高的指標成分為黃芩苷(15.496 mg/g),其次為小檗堿(3.048 mg/g),含量最低的指標成分為大黃素甲醚(0.046 mg/g);離心沉積物中黃連堿、小檗堿含量分別為離心上清液的4.13、3.44倍,離心上清液中黃芩苷、漢黃芩苷、蘆薈大黃素含量分別為離心沉積物的2.04、2.76、1.33倍;煎煮過程中,自浸泡結束起,湯劑、離心上清液、離心沉積物中均含有13種指標成分,自加熱沸騰起,除黃芩苷、漢黃芩苷、蘆薈大黃素外,離心沉積物中其余10個指標成分含量均明顯高于離心上清液。所建方法合理可行,可用于SXD樣品中13種指標成分的含量測定,詮釋了《金匱要略》對SXD有“以水三升,煮取一升,頓服之”的科學內涵,為揭示SXD復合分散體系的制劑特征提供了依據。
三黃瀉心湯;HPLC;煎煮過程;沉積物;上清液;表小檗堿;黃連堿;巴馬汀;小檗堿;黃芩苷;漢黃芩苷;黃芩素;漢黃芩素;大黃酸;蘆薈大黃素;大黃素;大黃酚;大黃素甲醚
三黃瀉心湯(Sanhuang Xiexin Decoction,SXD)全方由大黃、黃連、黃芩3味藥材組成,首載于張仲景所著《金匱要略》,為中醫臨床治療火熱壅盛、吐衄之經方,療效顯著[1]。現代研究表明,該方具有抗菌[2]、抗炎[3]、保護胃黏膜[4]、降血糖[5]、免疫調節[6]等多種藥理作用,主要藥效活性成分包括生物堿類、黃酮類、蒽醌類化合物及衍生物,如小檗堿、表小檗堿、巴馬汀、黃芩苷、黃芩素、大黃酸、大黃素、蘆薈大黃素-8--葡萄糖苷等[7-9]。
湯劑是我國中醫臨床應用最廣泛的劑型,其外觀似混懸劑,實系液體復合分散體系,藥物以離子、分子、液滴、不溶性固體微粒等多種形式存在于湯液中[10],通過群藥合煎,可達到增效、減毒和擴大臨床應用范圍等目的。湯劑內部分子之間存在化學鍵或非化學鍵相互作用,如氫鍵和范德華力,可使分子間相互結合形成“分子聚集體”,包括單分子自身聚集、不同單分子之間的聚集、單分子與初級代謝物之間的聚集等,這些分子聚集體的形成會影響中藥成分的吸收和代謝,進一步影響藥物療效的發揮[11-13]。課題組前期研究發現,SXD湯劑外觀為均勻的棕黃色混懸液,而大黃、黃芩、黃連單煎液均為澄明狀溶液,將其兩兩混合或全部混合后,混合液同樣變渾濁或產生沉淀,表明SXD中成分之間會發生相互作用而形成聚集物,導致湯劑呈混懸狀或產生沉淀析出,因此,SXD湯劑可能為溶液、膠體和混懸液共存的復合分散體系。
目前對SXD的研究大多集中在湯劑化學成分、藥理作用等方面,對湯劑中分子聚集體或不溶性沉淀的關注還很少,有文獻對SXD的煎煮工藝、化學成分檢測等進行了研究[14-18],但普遍存在工藝參數與古方差異大、指標成分少、色譜條件復雜、色譜技術要求高等不足,不利于科學、快速、簡便地控制SXD質量及評價湯劑制劑特征。本實驗通過建立SXD湯劑、離心上清液和離心沉積物中13種指標成分含量的同時測定方法,并對湯劑煎煮過程中各指標成分動態變化和分布規律進行研究,為進一步揭示SXD復合分散體系的制劑特征與藥效機制深入研究提供依據。
1 儀器與材料
1.1 儀器
島津LC-20A型高效液相色譜儀,包括LC-20 AT四元梯度泵、SIL-20AHT進樣器、CTO-20A柱溫箱、SPD-M20A檢測器和Labsolutions色譜數據系統,日本Shimadzu公司;CPA225D型十萬分之一電子分析天平、Acculab ALC-210型萬分之一電子分析天平,德國Sartorius公司;HC-3018R型高速冷凍離心機,科大創新股份有限公司中佳分公司;KQ5200DE型超聲波清洗器,昆山市超聲儀器有限公司;2000 mL調溫電熱套,北京中興偉業儀器有限公司。
1.2 藥品與試劑
對照品小檗堿(批號wkq20032408)、黃連堿(批號wkq20021306)、表小檗堿(批號wkq20031807)、巴馬汀(批號wkq20051201)、蘆薈大黃素(批號wkq20032708)、黃芩苷(批號wkq20010908)、漢黃芩苷(批號wkq20040108)、漢黃芩素(批號20030204)、黃芩素(批號wkq20022608)、大黃酸(批號wkq20052209)、大黃素(批號wkq20041308)、大黃酚(批號wkq20081705)、大黃素甲醚(批號wkq20040101),質量分數均≥98%,購于四川省維克奇生物科技有限公司;甲醇、乙腈為色譜純,購于Fisher公司;甲酸、氨水等其他試劑均為分析純,購于成都市科隆化學品有限公司;水為超純水。
1.3 藥材
黃連飲片(產地四川,批號2005052)、黃芩飲片(產地山西,批號2006079)、大黃飲片(產地四川,批號1912062),均購自四川新荷花中藥飲片股份有限公司,經成都中醫藥大學中藥鑒定專業裴瑾教授鑒定,黃連為毛茛科黃連屬植物黃連Franch.的干燥根莖,黃芩為唇形科黃芩屬植物黃芩Georgi的干燥根,大黃為蓼科大黃屬植物掌葉大黃L.的干燥根和根莖,經檢驗均符合《中國藥典》2020年版一部相關標準規定。
2 方法與結果
2.1 色譜條件
Thermo Hypersil Gold C18色譜柱(250 mm×4.6 mm,5 μm);流動相乙腈-(0.5%甲酸-0.2%氨水)水溶液,梯度洗脫:0~10 min,18%~25%乙腈;10~16 min,25%乙腈;16~20 min,25%~27%乙腈;20~27 min,27%~31%乙腈;27~60 min,31%~80%乙腈;60~65 min,80%乙腈;柱溫30 ℃;體積流量1 mL/min;進樣量10 μL;檢測波長為254 nm。
2.2 混合對照品溶液的配制
分別精密稱取對照品表小檗堿、黃連堿、巴馬汀、小檗堿、黃芩苷、漢黃芩苷、黃芩素、漢黃芩素、大黃酸、蘆薈大黃素、大黃素、大黃酚、大黃素甲醚適量,置同一量瓶中,加甲醇制成質量濃度分別為96.04、70.56、279.30、248.92、773.22、285.18、88.20、72.52、102.90、79.38、51.94、82.32、49.00 μg/mL的混合對照品溶液,過0.22 μm微孔濾膜,即得。
2.3 供試品溶液的制備
2.3.1 SXD傳統湯劑的制備 取大黃30 g,黃連、黃芩飲片各15 g,置2000 mL燒瓶中,加10倍量超純水,浸泡30 min,大火煮沸(加熱功率約500 W),保持微沸40 min(加熱功率約230 W),煎液用300目濾布濾過,測量體積,備用。
2.3.2 湯劑上清液和沉積物的離心分離 精密量取“2.3.1”項下制備的煎液8.0 mL,置于10 mL離心管中,在14 000 r/min、4 ℃條件下離心(離心半徑8.3 cm)處理10 min,取上清液和沉積物,備用。SXD煎液離心前后的對比照片見圖1。

圖1 離心前和離心后的SXD煎液
2.3.3 供試品溶液的制備 精密量取“2.3.1”項下制備的煎液8.0 mL,置蒸發皿中,70 ℃水浴蒸干,殘渣加80%甲醇溶解,轉移至50 mL量瓶中,加80%甲醇至刻度,搖勻,過0.22 μm微孔濾膜,取續濾液,即得湯劑供試品溶液;取“2.3.2”項下制備的上清液和沉積物,置蒸發皿中,其余操作同上,分別制備離心上清液、離心沉積物供試品溶液。
2.4 陰性湯劑樣品溶液的制備
按照“2.3”項下供試品溶液制備方法,分別制備缺大黃、黃連、黃芩的陰性湯劑樣品溶液。
2.5 系統適應性試驗
按照“2.1”項下色譜條件測定混合對照品溶液、供試品溶液和陰性湯劑樣品溶液,結果表明,樣品中各成分均能達到基線分離,13種指標成分的理論塔板數均大于5000,各成分與其他成分之間的分離度均大于1.5,且陰性無干擾,混合對照品溶液、供試品溶液及陰性湯劑樣品溶液的色譜圖見圖2。
2.6 方法學考察
2.6.1 線性關系考察 取“2.2”項下混合對照品溶液,分別稀釋2、4、8、16、32倍,制成系列質量濃度的混合對照品溶液,按“2.1”項下色譜條件進行測定。以色譜峰峰面積()對質量濃度()進行線性回歸,得各成分的線性回歸方程分別為表小檗堿=34 610.947 5+2 043.008 2,2=0.999 9,線性范圍3.00~96.04 μg/mL;黃連堿=44 176.910-25 640.059,2=0.999 7,線性范圍2.21~70.56 μg/mL;巴馬汀=36 107.934+2 047.082,2=0.999 9,線性范圍8.73~279.30 μg/mL;小檗堿=44 954.718+39 590.547,2=0.999 9,線性范圍7.78~248.92 μg/mL;黃芩苷=21 580.550+90 080.962,2=0.999 8,線性范圍24.16~773.22 μg/mL;漢黃芩苷=12 909.490+5 276.650,2=0.999 9,線性范圍8.91~285.18 μg/mL;黃芩素=33 591.192-14 683.909,2=0.999 8,線性范圍2.76~88.20 μg/mL;漢黃芩素=16 334.063+1 061.407,2=0.999 9,線性范圍2.27~72.52 μg/mL;大黃酸=46 854.282+2 690.832,2=0.999 9,線性范圍3.22~102.90 μg/mL;蘆薈大黃素=49 274.461+17 680.212,2=0.999 9,線性范圍2.48~79.38 μg/mL;大黃素=36 531.385-1 996.734,2=0.999 9,線性范圍1.62~51.94 μg/mL;大黃酚=55 732.931+9 320.310,2=0.999 9,線性范圍2.57~82.32 μg/mL;大黃素甲醚=34 887.855+6 270.611,2=0.999 8,線性范圍1.53~49.00 μg/mL;表明各成分在測定范圍內線性關系良好。
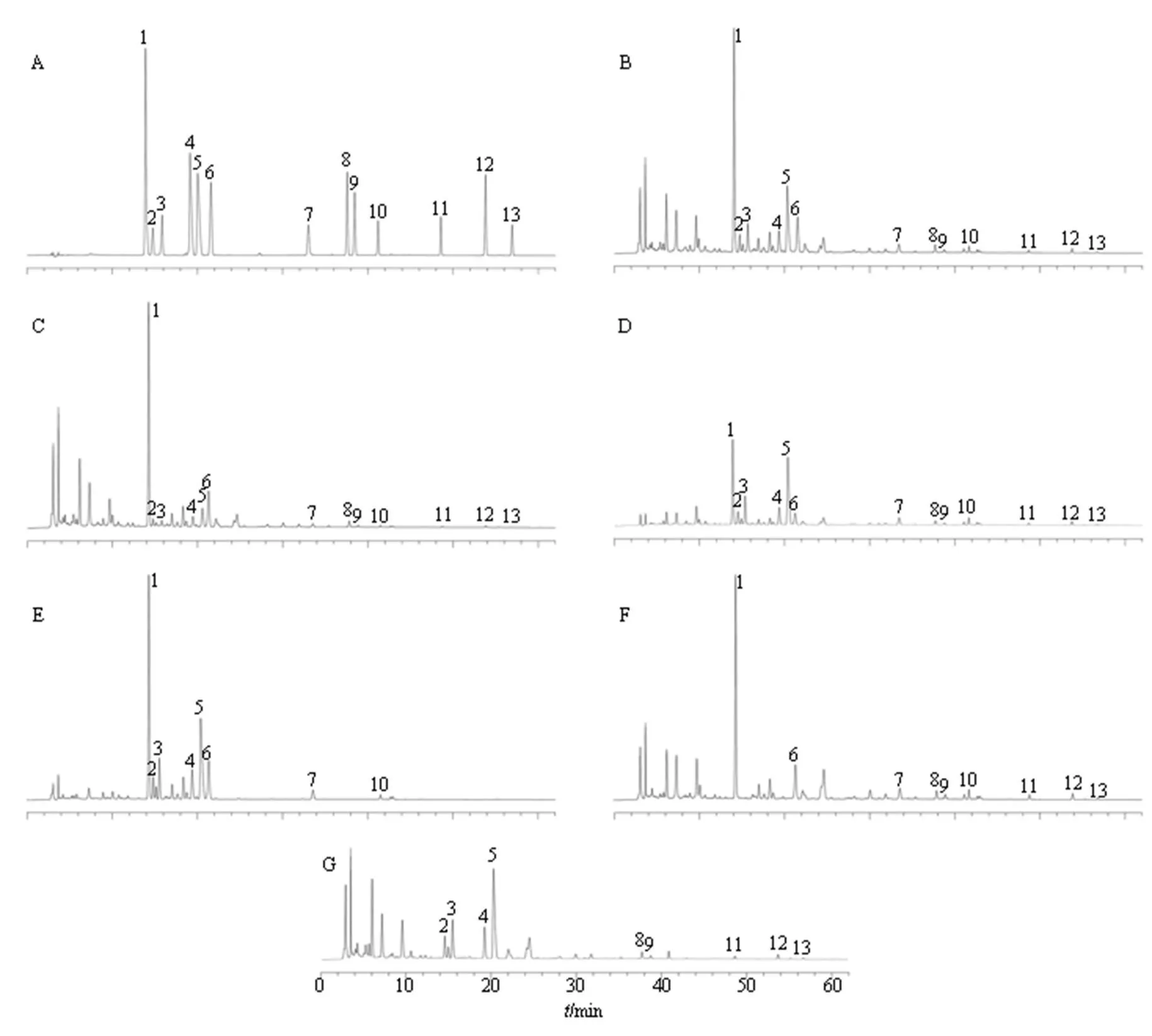
1-黃芩苷 2-表小檗堿 3-黃連堿 4-巴馬汀 5-小檗堿 6-漢黃芩苷 7-黃芩素 8-大黃酸 9-蘆薈大黃素 10-漢黃芩素 11-大黃素 12-大黃酚 13-大黃素甲醚
2.6.2 精密度試驗 取“2.2”項下混合對照品溶液,按“2.1”項下色譜條件連續進樣6次,計算各成分峰面積的RSD。結果表小檗堿、黃連堿、巴馬汀、小檗堿、黃芩苷、漢黃芩苷、黃芩素、漢黃芩素、大黃酸、蘆薈大黃素、大黃素、大黃酚、大黃素甲醚峰面積的RSD分別為0.38%、0.47%、0.37%、0.41%、0.43%、0.57%、0.40%、0.41%、0.34%、0.59%、0.60%、0.35%、0.66%,表明該儀器精密度良好。
2.6.3 重復性試驗 按“2.3”項下供試品溶液制備方法,分別平行制備湯劑、離心上清液、離心沉積物供試品溶液6份,按“2.1”項下色譜條件進行測定,計算各成分含量。結果湯劑供試品溶液中表小檗堿、黃連堿、巴馬汀、小檗堿、黃芩苷、漢黃芩苷、黃芩素、漢黃芩素、大黃酸、蘆薈大黃素、大黃素、大黃酚、大黃素甲醚的RSD分別為1.20%、1.06%、1.23%、0.81%、1.50%、0.81%、1.72%、0.72%、1.56%、1.76%、1.03%、0.75%、0.98%,離心上清液供試品溶液中13種成分的RSD分別為1.83%、1.72%、1.31%、1.51%、1.22%、1.83%、1.77%、1.75%、1.29%、1.89%、1.16%、1.59%、1.98%,離心沉積物供試品溶液中13種成分的RSD分別為1.96%、1.45%、1.59%、0.99%、1.59%、1.29%、1.49%、1.28%、1.59%、1.46%、1.58%、1.71%、1.48%,表明該方法重復性良好。
2.6.4 穩定性試驗 按“2.3”項下供試品溶液制備方法,制備湯劑供試品溶液,室溫放置,按“2.1”項下色譜條件,分別于0、2、4、8、12、24 h進樣,計算各成分峰面積的RSD。結果表小檗堿、黃連堿、巴馬汀、小檗堿、黃芩苷、漢黃芩苷、黃芩素、漢黃芩素、大黃酸、蘆薈大黃素、大黃素、大黃酚、大黃素甲醚峰面積的RSD分別為0.61%、0.66%、0.97%、1.29%、1.06%、0.55%、0.89%、0.87%、0.79%、0.75%、0.63%、0.48%、0.51%,表明該供試品溶液在室溫條件下24 h內穩定性良好。
2.6.5 加樣回收率試驗 精密量取已知含量的大黃瀉心湯煎液6份,每份4.0 mL,置蒸發皿中,精密加入各對照品溶液適量,按“2.3”項下供試品溶液制備方法制備湯劑供試品溶液,按“2.1”項下色譜條件進行測定,記錄峰面積,計算各指標成分的回收率和RSD。結果表小檗堿、黃連堿、巴馬汀、小檗堿、黃芩苷、漢黃芩苷、黃芩素、漢黃芩素、大黃酸、蘆薈大黃素、大黃素、大黃酚、大黃素甲醚的平均加樣回收率分別為99.6%、99.0%、101.9%、101.2%、101.8%、99.7%、101.4%、100.4%、99.7%、100.9%、98.1%、99.4%、99.8%,RSD分別為1.42%、1.39%、1.75%、1.35%、1.58%、1.91%、1.21%、1.87%、1.35%、1.65%、1.18%、1.18%、1.97%,表明該方法準確可靠。
2.7 傳統湯劑樣品測定
分別取大黃、黃連、黃芩飲片6份,按“2.3”項下供試品溶液制備方法,分別平行制備SXD湯劑、離心上清液、離心沉積物供試品溶液,按“2.1”項下色譜條件進行測定,采用外標法計算各成分含量,結果見表1。結果表明,SXD湯劑中含量最高的指標成分為黃芩苷(15.496 mg/g),其次為小檗堿(3.048 mg/g),含量最低的指標成分為大黃素甲醚(0.046 mg/g),湯劑離心上清液和離心沉積物中均含有大量指標成分。黃芩苷、漢黃芩苷、蘆薈大黃素3個成分主要分布在離心上清液中,分別為離心沉積物含量的2.04、2.76、1.33倍,而其余10個指標成分在離心沉積物中的含量均明顯高于離心上清液,其中黃連堿、小檗堿含量分別為離心上清液的4.13、3.44倍。
表1 SXD樣品中13種成分含量測定結果(n = 6)
Table 1 Determination results of 13 components in SXD samples (n = 6)
樣品質量分數/(mg?g?1) 表小檗堿黃連堿巴馬汀小檗堿黃芩苷漢黃芩苷黃芩素 湯劑0.422±0.0100.836±0.0300.854±0.0293.048±0.11015.496±0.5242.652±0.0840.626±0.024 離心上清液0.151±0.0100.169±0.0080.357±0.0130.693±0.0239.523±0.2592.001±0.0870.171±0.007 離心沉積物0.271±0.0090.698±0.0220.557±0.0152.386±0.0894.668±0.1130.726±0.0180.416±0.018 樣品質量分數/(mg?g?1) 漢黃芩素大黃酸蘆薈大黃素大黃素大黃酚大黃素甲醚 湯劑0.222±0.0130.051±0.0030.161±0.0080.053±0.0020.062±0.0020.046±0.004 離心上清液0.081±0.0070.020±0.0020.093±0.0050.016±0.0010.016±0.0010.012±0.001 離心沉積物0.134±0.0080.031±0.0020.070±0.0030.033±0.0020.043±0.0010.032±0.002
2.8 煎煮過程樣品測定
分別取大黃30 g、黃連、黃芩飲片各15 g,共11份,按“2.3.1”項下SXD傳統湯劑的制備方法,分別于浸泡結束、剛沸騰以及保持微沸的第2.5、5、10、15、20、25、30、40、50 min倒出煎液,用300目濾布濾過,分別測量體積,備用。按“2.3.2”及“2.3.3”項下方法,分別取樣制備各時間點SXD湯劑、離心上清液及離心沉積物供試品溶液,按“2.1”項下色譜條件進行測定,采用外標法計算各成分含量,繪制SXD煎煮過程中13種指標成分動態變化和分布規律圖,結果見圖3。
成分動態變化研究結果表明,SXD煎煮過程中,各指標成分溶出較快,自浸泡結束起,SXD湯劑、離心上清液、離心沉積物中均含有13種指標成分;加熱沸騰后,湯劑中13種成分即可達各自最大煎出量的46.6%~89.6%,離心沉積物中13種指標成分可達各自最大離心沉積物質量分數的47.9%~79.0%,離心上清液中13種指標成分可達各自最大離心上清液質量分數的45.3%~92.7%,之后緩慢增加,各樣品中指標成分達到最大含量的煎煮時間約為25~30 min,煎煮時間超過30 min后,湯劑、離心沉積物和離心上清液中黃芩苷、漢黃芩素等黃酮類成分含量顯著下降,可能與該類成分長時間加熱水解破壞有關,而其他成分含量則趨于穩定或緩慢下降。
成分動態分布研究結果表明,自加熱沸騰起,離心上清液中黃芩苷、漢黃芩苷、蘆薈大黃素含量均高于離心沉積物,其中黃芩苷、漢黃芩苷煎煮過程中平均含量可達離心沉積物的2倍以上,而離心沉積物中其余10個指標成分含量均高于離心上清液,以表小檗堿、小檗堿、黃連堿、黃芩素、大黃素、大黃酚、大黃素甲醚尤為顯著,其中黃連堿、小檗堿煎煮過程中平均含量可達離心上清液的3倍以上;13種指標成分在離心上清液和離心沉積物中的大量分布,提示SXD有效成分自浸泡開始便可能以離子、分子、不溶性微粒等多種形式分布于湯劑中;同時發現,剛沸騰至保持微沸2.5 min時間段樣品中部分成分含量存在短暫下降趨勢,可能與剛沸騰時各成分間發生了較為劇烈的相互作用有關。
3 討論
3.1 樣品處理方法
實驗前期,分別考察了SXD煎液在不同離心轉速(4000、8000、14 000 r/min)和離心時間(10、20、30 min)條件下離心上清液和離心沉積物中13種指標成分的含量差異,結果表明,各指標成分含量差異不顯著,但當離心轉速為4000 r/min時,得到的沉積物較為松散,不利于上清液和沉積物的分離處理,同時還比較了70 ℃水浴蒸干和冷凍干燥2種方法對樣品中各指標成分含量的影響,結果表明,2種方法制備的樣品中各指標成分含量無顯著差異,因此,為保證樣品的均一性,提高分析效率,確定了供試品溶液的制備方法。
3.2 色譜條件篩選和優化
實驗前期,比較了不同廠家(Agilent、Thermo Fisher、Shimadzu)色譜柱的分離效果,對不同流動相[乙腈-0.3%甲酸水溶液、乙腈-0.5%乙酸銨水溶液、甲醇-0.1%磷酸溶液、乙腈-(0.5%甲酸-0.2%氨水)水溶液]、不同梯度洗脫條件、不同柱溫(25、30、35 ℃)等進行了研究,并采用二極管陣列檢測器對供試品溶液進行了全波長掃描,比較了不同波長(254、316、345 nm)條件下色譜圖的峰面積與分離度情況,確定采用254 nm作為檢測波長,最終確立了本實驗的色譜條件[14-16,19-20],可對樣品中13種指標成分同時進行測定,有利于降低檢測成本和提高檢測效率。
3.3 SXD傳統湯劑的最佳煎煮時間和服用方法
中國古代湯劑制法考究,工藝嚴謹,對加水量、煎煮程度均有相關規定和要求[21],《金匱要略》對SXD要求“大黃二兩,黃連、黃芩各一兩,右三味,以水三升,煮取一升”[1]。本實驗遵循古今計量單位換算規則,并考慮到方便實驗研究和數據處理原則,將處方定為大黃30 g、黃芩15 g、黃連15 g,加水量定為600 mL;同時,考慮到傳統復方湯劑多采用敞口砂鍋進行煎煮,煎煮過程中溶劑揮發較多,為煎煮和濃縮同步進行的過程,為盡量保證煎煮條件的一致性,本實驗采用電熱套配套敞口燒瓶進行煎煮,以充分模擬傳統湯劑的煎煮過程;預實驗結果表明,當浸泡時間為30 min,煎煮時間為40 min時,濾液體積約為200 mL,與古方要求基本一致,故將該煎煮工藝得到的湯劑作為SXD傳統湯劑樣品開展多成分定量分析方法學研究。

圖3 SXD煎煮過程中13種指標成分動態變化和分布規律(n = 6)
SXD煎煮過程中13種指標成分動態變化研究結果表明,各指標成分達到最大煎出量的煎煮時間約為25~30 min,繼續增加煎煮時間對有效成分的提取無益,反而導致湯劑中黃芩苷、黃芩素等黃酮類成分含量下降,可能與該類成分長時間加熱水解破壞,或因煎液體積大量減少致藥渣吸附量增大有關,該煎煮時間與模擬古方的煎煮時間并不完全一致,可能與煎藥器具、煎煮溫度、煎煮環境等因素有關。因此,為保證處方的臨床療效,綜合考慮其它影響因素,建議SXD的煎煮時間為25~30 min。
此外,中藥湯劑在臨床中多為煎煮后直接服用,《金匱要略》對SXD也要求“頓服之”[1],《簡明中醫辭典》謂“頓服”是指“一次性較快地將藥物服完”,《傷寒論》瀉心湯類方也有“溫服”要求[22]。研究結果表明,從性狀上觀察,SXD煎液為棕黃色混懸液,靜置24 h后會產生少量沉淀,離心處理后會產生大量沉積物,從多成分定量分析結果來看,整個煎煮過程中,離心沉積物中包含大量有效成分,表明離心沉積物為湯液的重要組成部分,也是湯劑發揮藥效的重要物質基礎。因此,本研究證實了《金匱要略》中SXD煎煮和服用方法的科學性和合理性,有利于充分發揮處方的臨床療效。
3.4 SXD復合分散體系的形成機制和制劑特征
中藥復方中化學成分類別多而復雜,中藥湯劑中的分子聚集體或沉淀蘊含著中藥復方配伍理論的科學內涵;SXD處方由大黃、黃連、黃芩組成,主要含生物堿類、黃酮類、蒽醌類及衍生物、鞣質等化學成分,酸、堿類成分之間可發生絡合反應;有研究表明,大黃酸和小檗堿在煎煮條件下可形成難溶性大分子復合物[23],黃芩苷和小檗堿在80 ℃、煮沸條件下均會產生不溶性沉淀,且沉淀量與成分比例、加熱溫度和pH值等因素相關[24]。本研究結果表明,SXD煎液為離子、分子、固體微粒等共存的復合分散體系,SXD煎煮過程中,自加熱沸騰起,湯劑離心后會產生沉積物,且沉積物中大量存在表小檗堿、小檗堿、黃芩苷、漢黃芩苷、大黃酸、大黃酚等化學成分,證明各成分之間可能發生了復雜的酸堿絡合反應,進一步形成微粒而離心析出,且離心沉積物與離心上清液中的指標成分分布呈動態平衡,各成分含量隨煎煮時間的延長而不斷增加,至煎煮25~30 min時基本達到穩定。
同時,實驗前期還考察了SXD傳統湯劑在不同溫度(5、25、45 ℃)條件下放置不同時間(0、3、6、9、12、18、24、36、48 h)后13種指標成分在離心沉積物和離心上清液中的分布差異,結果表明,湯劑在5 ℃放置6 h以上,離心沉積物中部分指標成分含量與放置前相比有一定增加,但差異不顯著,可能為低溫條件下部分成分溶解度降低析出所致,而在其余溫度和時間條件下放置后,各成分分布與放置前相比均無顯著差異,進一步地表明SXD中離心沉積物主要形成于煎煮過程中,而非因放置環境、放置時間等因素變化而析出,穩定貯存條件下,離心上清液和離心沉積物中各成分分布處于相對平衡和穩定狀態。
本實驗重點對SXD煎煮過程中主要指標成分動態變化和分布規律進行了研究,有關藥效成分在SXD煎液中的存在形式、分布特點以及分子聚集體或沉淀的形成機制,值得進一步研究。
利益沖突 所有作者均聲明不存在利益沖突
[1] 范永升.金匱要略 [M].第2版.北京: 中國中醫藥出版社, 2007: 240.
[2] 孫濤, 張洪峰, 劉璐.三黃瀉心湯不同提取溶媒抑菌活性研究 [J].中國醫院用藥評價與分析, 2015, 15(6): 711-713.
[3] 馬秉亮, 馬越鳴, 嚴東明, 等.瀉心湯不同配伍抗炎作用比較研究 [J].中草藥, 2007, 38(11): 1690-1693.
[4] 岳麗軍, 劉暢, 張華軍, 等.三黃瀉心湯治療上消化道出血療效及對患者血紅蛋白、尿素氮、Rockall評分的影響 [J].陜西中醫, 2021, 42(5): 594-596.
[5] 吳家勝, 陸雄, 馬越鳴, 等.瀉心湯對糖尿病大鼠早期腎病的影響 [J].中草藥, 2010, 41(1): 73-77.
[6] Li C Y, Hou Y C, Chao P D L,.Potentialimmunomodulatory effects of San-Huang-Xie-Xin-Tang and its component herbs on mice and humans [J]., 2010, 127(2): 292-298.
[7] 劉晶晶, 張貴君, 彭慧, 等.三黃瀉心湯藥效組分分析 [J].中國實驗方劑學雜志, 2013, 19(18): 103-108.
[8] 姚佳琪, 肖永慶, 劉穎, 等.三黃瀉心湯水、醇提取物抗炎作用比較及有效提取物的成分分析 [J].中國實驗方劑學雜志, 2015, 21(13): 31-35.
[9] 戴瑩, 施凱, 竇志華, 等.大黃標準湯劑量值傳遞規律研究 [J].中草藥, 2021, 52(10): 2938-2950.
[10] 楊明.中藥藥劑學 [M].第3版.北京: 中國中醫藥出版社, 2012: 121.
[11] Hu J, Wu Z S, Yan J J,.A promising approach for understanding the mechanism of traditional Chinese medicine by the aggregation morphology [J]., 2009, 123(2): 267-274.
[12] Su B L, Kan Y J, Xie J W,.Relevance of the pharmacokinetic and pharmacodynamic profiles ofto aggregation of multi- component molecules in aqueous decoctions [J]., 2016, 21(7): 845.
[13] Zhuang Y, Yan J J, Zhu W,.Can the aggregation be a new approach for understanding the mechanism of traditional Chinese medicine? [J]., 2008, 117(2): 378-384.
[14] 水棟, 王宇卿, 耿榕徽.高效液相色譜法測定三黃瀉心湯中13個有效成分的含量 [J].中國醫院藥學雜志, 2018, 38(21): 2235-2239.
[15] Zhang Q, Wang C H, Ma Y M,.UPLC-ESI/MS determination of 17 active constituents in two categorized formulas of traditional Chinese medicine, Sanhuang Xiexin Tang and Fuzi Xiexin Tang: Application in comparing the differences in decoctions and macerations [J]., 2013, 27(8): 1079-1088.
[16] Li S L, Song J Z, Qiao C F,.UPLC-PDA-TOFMS based chemical profiling approach to rapidly evaluate chemical consistency between traditional and dispensing granule decoctions of traditional medicine combinatorial formulae [J]., 2010, 52(4): 468-478.
[17] 李智勇, 陳雪婷, 王洛臨, 等.三黃瀉心湯配方顆粒和標準煎劑中主要有效組分含量對比研究 [J].江西中醫藥大學學報, 2018, 30(4): 79-81.
[18] 傅丹青, 徐莉, 葛爾寧, 等.三黃瀉心湯主要有效成分溶出規律研究 [J].中華中醫藥學刊, 2020, 38(10): 16-19.
[19] 劉磊, 陳婷, 成旭東, 等.HPLC-DAD法同時測定三黃洗劑中5種成分的含量 [J].亞太傳統醫藥, 2019, 15(12): 25-28.
[20] Wu T Y, Chang F R, Liou J R,.Rapid HPLC quantification approach for detection of active constituents in modern combinatorial formula, San- Huang-Xie-Xin-Tang (SHXXT) [J]., 2016, 7: 374.
[21] 陳士林, 劉安, 李琦, 等.中藥飲片標準湯劑研究策略 [J].中國中藥雜志, 2016, 41(8): 1367-1375.
[22] 汪曉奕, 王騫.瀉心湯類方方證淺析 [J].成都中醫藥大學學報, 2015, 38(3): 102-104.
[23] 裴妙榮, 宣春生, 段秀俊, 等.酸堿對藥所含酸堿性成分共煎形成復合物的結構研究 [J].中國中藥雜志, 2009, 34(23): 3054-3059.
[24] 雷艷麗, 孫磊, 隋宏, 等.黃芩苷-小檗堿復合物的形成規律 [J].中成藥, 2018, 40(3): 577-582.
[責任編輯 鄭禮勝]
Study on dynamic variation and distribution rules of thirteen components during decocting process of Sanhuang Xiexin Decoction
WU Xue-yuan1, 2, FANG Chun-lin2, LI Wen1, ZENG You-qin3, FU Shu1, LI Rui1, ZHANG Jin-ming1, FU Chao-mei1, WANG Feng4
1.State Key Laboratory of Characteristic Chinese Drug Resources in Southwest China, College of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 2.Chengdu Agricultural College, Chengdu 611130, China 3.College of Medical Technology, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 4.Sichuan Quantaitang Chinese Herbal Pieces Co., Ltd., Suining 629000, China
To establish a method for simultaneous determination of thirteen components (epiberberine, coptisine, palmatine, berberine, baicalin, wogonoside, baicalein, wogonin, rhein, aloe-emodin, emodin, chrysophanol, and physcion), and exploring the dynamic variation and distribution rules of components during decocting process in a classical prescription named Sanhuang Xiexin Decoction (SXD, 三黃瀉心湯), to reveal the preparation characteristics in the composite and dispersive system of SXD.The decoction was prepared according to the traditional decocting method of SXD, the simultaneous determination method of 13 index components was established to detect the contents of components in the whole decoction, centrifugal supernatant and centrifugal sediment, respectively.Furthermore, the samples after soaking, boiling and decocting for different times were prepared for determination, the figure of the dynamic variation and distribution rules of thirteen components during decocting of SXD were drawn, and the content change of components in decoction, centrifugal supernatant and centrifugal sediment was analyzed, respectively.The content of baicalin (15.496 mg/g) in SXD was the highest, followed by the content of berberine (3.048 mg/g).The content of emodin methyl ether (0.046 mg/g) was the lowest.The contents of coptisine and berberine in centrifugal sediment were 4.13 and 3.44 times higher than those in centrifugal supernatant, and the contents of baicalin, wogonoside, aloe emodin in centrifugal supernatant were 2.04, 2.76 and 1.33 times higher than those in centrifugal sediment.Thirteen index components were all distributed in decoction, centrifugal supernatant and centrifugal sediment since after soaking.However, the contents of ten index components in centrifugal sediment were significantly higher than those in centrifugal supernatant except baicalin, wogonin and aloe emodin since boiling during decocting process.The established method for simultaneous determination of thirteen components in SXD sample is reasonable and feasible.This study explained the scientific connotation of the application and dosage of SXD in, which recorded that“Add three liters of water, decoct to a liter of decoction and take it quickly at one time”.Moreover, this study provided a basis for revealing the preparation characteristics in the composite and dispersive characteristic system of SXD.
Sanhuang Xiexin Decoction; HPLC; decocting process; sediment;supernatant;epiberberine; coptisine; palmatine; berberine; baicalin; wogonoside; baicalein; wogonin; rhein; aloe-emodin; emodin; chrysophanol; physcion
R283.6
A
0253 - 2670(2022)09 - 2659 - 09
10.7501/j.issn.0253-2670.2022.09.008
2021-11-01
國家自然科學基金青年基金項目(81903812)
吳學淵,博士研究生,主要從事中藥新制劑和新劑型研究。E-mail: 67116042@qq.com
通信作者:李 文,博士,副教授,主要從事中藥新制劑和新劑型研究。E-mail: wander1210@sina.cn
傅超美,博士,教授,博士生導師,主要從事中藥新制劑和新劑型研究。E-mail: chaomeifu@126.com

