模型認知在“水溶液中的離子反應與平衡”圖像中的應用
廣東
一、概述
《普通高中化學課程標準(2017年版2020年修訂)》關于“證據推理與模型認知”素養的描述為:“知道可以通過分析、推理等方法認識研究對象的本質特征、構成要素及其相互關系,建立認知模型,并能運用模型解釋化學現象,揭示現象的本質和規律。”
“水溶液中的離子反應與平衡”是高考化學必考內容,試題多會以圖像的形式呈現,具有一定的綜合性、靈活性和技巧性,很好地考查學生化學學科核心素養。這部分內容也是學生學習的難點,基于高中化學必修1“離子反應”和選擇性必修1“水溶液中的離子平衡”等內容的學習,學生基本具備從微觀角度去分析溶液中存在何種微粒的能力,但仍缺乏系統的分析策略,多數學生對“兩軸三點”(橫、縱坐標軸,起點、終點和特殊點)沒有形成系統認識,不能將圖像與離子反應、微粒種類及物理量建立起關聯。
為此,本文以“水溶液中的離子反應與平衡”圖像復習教學為例,運用模型分類認知,傳授教師幫助學生突破思維障礙的方法,完善知識結構及認識思路。
二、熱點圖像分類展示
1.pH-V圖
【探題源】(2010·江蘇卷·12)常溫下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0 mol·L-1CH3COOH溶液所得滴定曲線如圖1。下列說法正確的是
( )
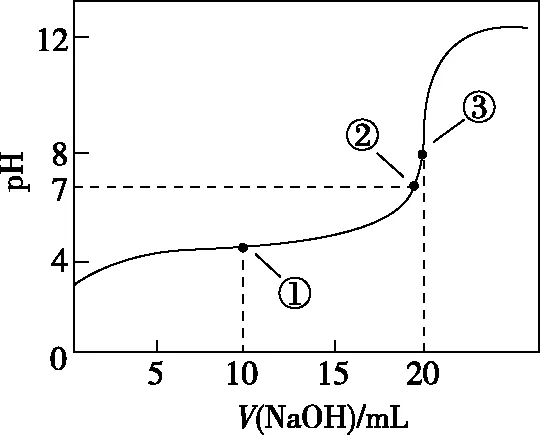
圖1
A.點①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.點②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.點③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定過程中可能出現:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
【參考答案】D
【解析】點①溶液中的溶質為0.001 mol的CH3COOH和0.001 mol的CH3COONa,據元素質量守恒“2c(Na+)=c(CH3COOH)+c(CH3COO-)”和電荷守恒“c(Na+)+c(H+)=c(CH3COO-)+c(OH-)”,整理后消去c(Na+)可得:c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),故A錯誤;點②溶液的pH=7,即c(H+)=c(OH-),再據電荷守恒“c(Na+)+c(H+)=c(CH3COO-)+c(OH-)”可得:c(Na+)=c(CH3COO-),故B錯誤;點③溶液中的溶質為0.002 mol的CH3COONa,又因為CH3COO-水解且程度較小,則離子濃度大小關系為:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C錯誤;當CH3COOH較多,滴入的堿較少時,則生成CH3COONa少量,則可能出現c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故D正確。
【建模型】基本方法:抓住關鍵點→確定酸堿性→厘清微粒組成→用好“三守恒”
突破酸堿中和滴定曲線圖像的關鍵是“五點四段”,如以常溫下用0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1HA溶液的滴定曲線為例,其溶液pH的變化如圖2所示。
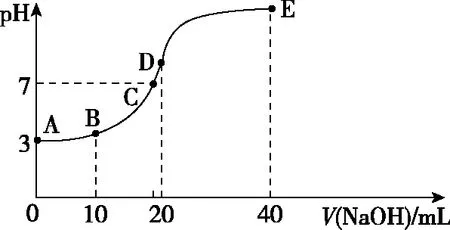
圖2
溶液中的溶質成分經歷了“酸→酸、鹽混合→鹽→鹽、堿混合”的“四段”變化。巧用“五點”,即曲線的起點、反應一半點、恰好完全反應點、溶液中性點和過量點,先判斷各點所對應溶液的酸堿性(pH),再思考溶質在溶液中的宏觀表現、各粒子間相互是否反應以及宏觀相對的量,最后應用電荷守恒、元素質量守恒等守恒關系去分析變化體系中不變的關系。
筆者總結抓住滴定曲線的5個關鍵點的一般方法:抓反應的“起始”點,判斷酸、堿的相對強弱;抓反應的“一半”點,判斷是哪兩種溶質的等量混合,若為二元弱酸H2A,則溶質為弱酸酸式鹽NaHA單一成分;此時n(HA)=n(NaA),抓溶液的“中性”點,判斷溶液中溶質的成分及哪種物質過量或不足,此時溶液中的c(H+)=c(OH-);抓“恰好”完全反應點,此時酸堿混合恰好完全反應生成正鹽,溶液的酸堿性只由鹽水解決定;抓反應的“過量”點,判斷溶液中的溶質及量的關系。結合圖2曲線,應用方法思路可總結如表1。
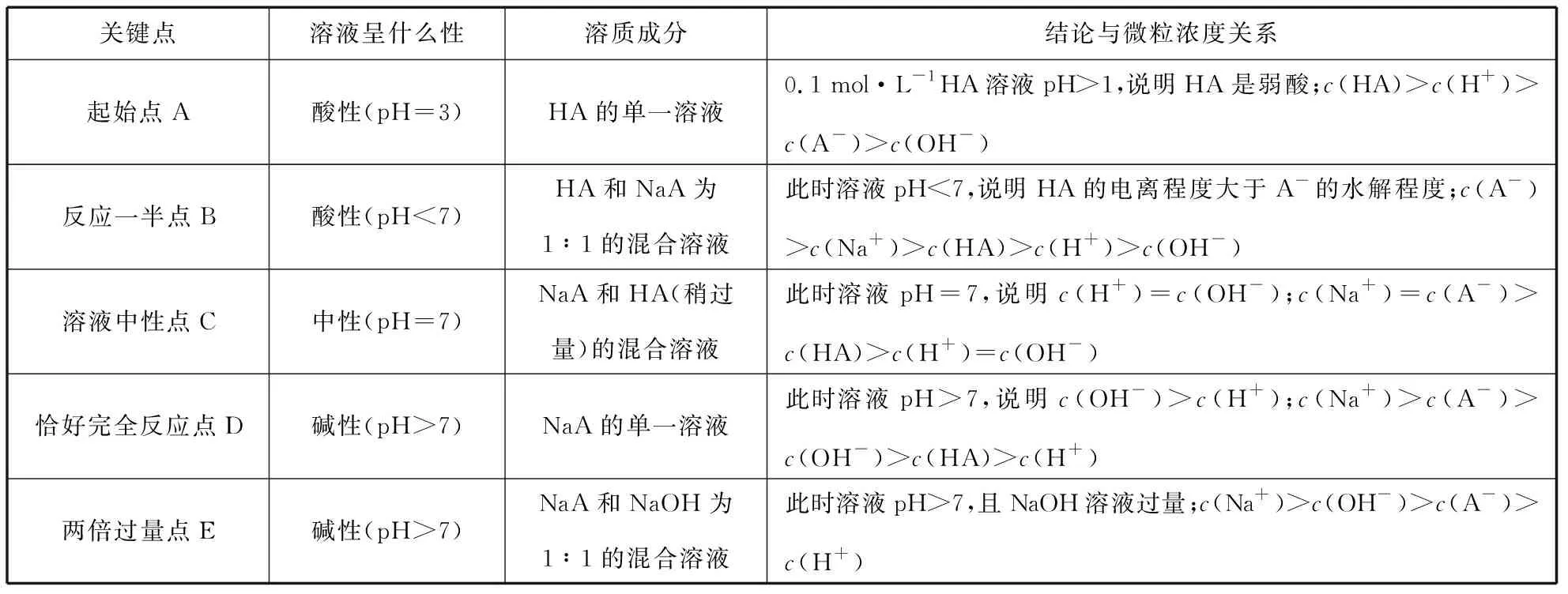
表1
【實操應用1】(2021·浙江6月選考·23)取兩份10 mL 0.05 mol·L-1的NaHCO3溶液,一份滴加0.05 mol·L-1的鹽酸,另一份滴加0.05 mol·L-1NaOH溶液,溶液的pH隨加入酸(或堿)體積的變化如圖3。
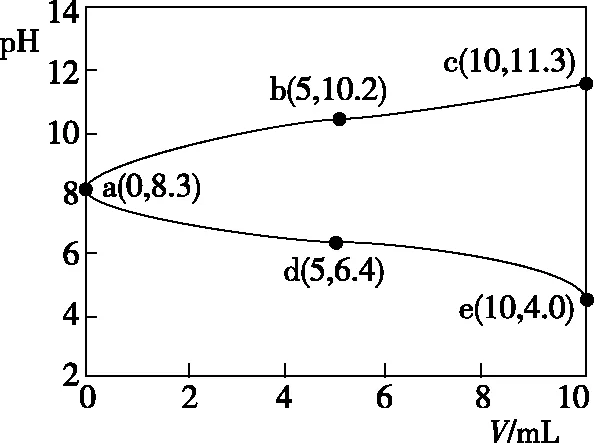
圖3
下列說法不正確的是
( )
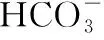
D.令c點的c(Na+)+c(H+)=x,e點的c(Na+)+c(H+)=y,則x>y
【參考答案】C
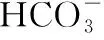
2.δ-pH圖
( )
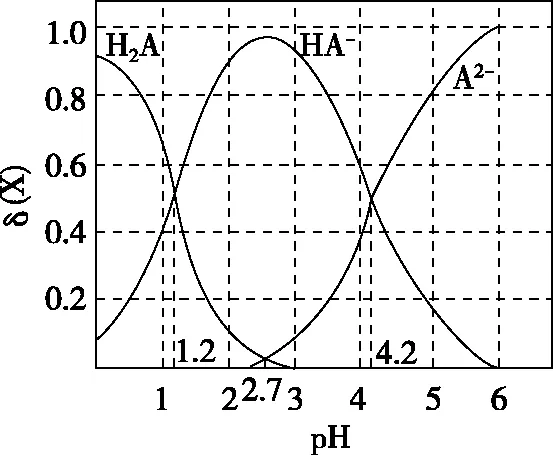
圖4
A.pH=1.2時,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7時,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2時,c(HA-)=c(A2-)=c(H+)
【參考答案】D

【建模型】基本方法:分清微粒線→關注交叉點→借用“三守恒”→構建關聯式。
分布系數(δ)圖像是酸堿中和滴定曲線的一種變式,常以pH為橫坐標,分布系數(δ)為縱坐標,結合滴定實驗數據而繪制出的關系曲線,分布系數(δ)代表組分的平衡濃度占總濃度的比值。因此,學生在解題時應先按照“此起彼伏”的規律分清各微粒所對應的曲線,結合題意明確其來源,再根據曲線交點的pH確定電離常數,也可借用三大守恒確定溶液中離子濃度的等式或不等式關系等。圖像中的交點是兩種微粒濃度相等的點,可以由交點的相關數據快速求出弱酸(或弱堿)的Ka(或Kb)。對于二元弱酸H2A,隨著pH的增加,第一個交點即為溶液c(H2A)=c(HA-)的點,此時pH1=pKa1,第二個交點即為溶液c(HA-)=c(A2-)的點,此時pH2=pKa2。
【實操應用2】(2021·山東省學業水平等級考試·15)賴氨酸[H3N+(CH2)4CH(NH2)COO-,用HR表示]是人體必需氨基酸,其鹽酸鹽(H3RCl2)在水溶液中存在如下平衡:
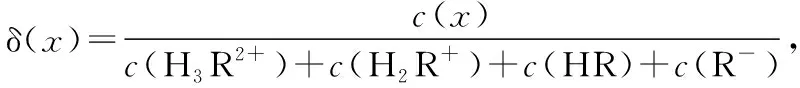
( )
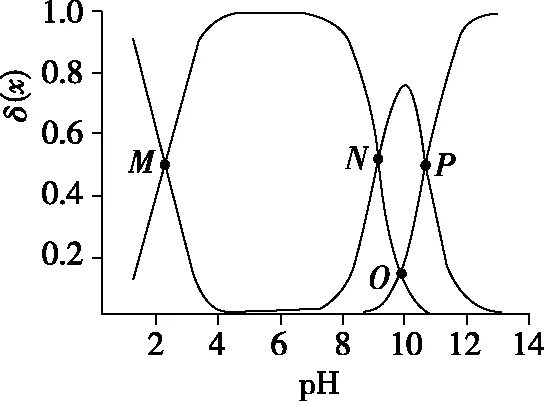
圖5
B.M點,c(Cl-)+c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+)
D.P點,c(Na+)>c(Cl-)>c(OH-)>c(H+)
【參考答案】CD

3.lgx-pH圖
【探題源】(2017·全國卷Ⅰ·13)常溫下將NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH與離子濃度變化的關系如圖6所示。下列敘述錯誤的是
( )
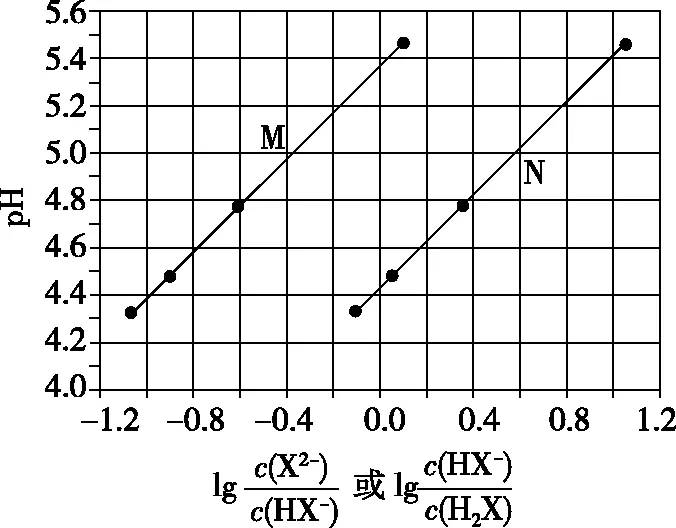
圖6
A.Ka2(H2X)的數量級為10-6
C.NaHX溶液中c(H+)>c(OH-)
D.當混合溶液呈中性時,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
【參考答案】D
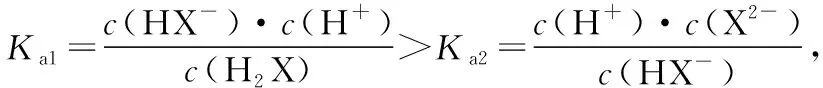
【建模型】基本方法:明確對數意義→分清微粒線→關注交叉點→構建關系式
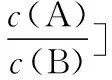
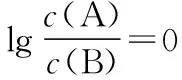
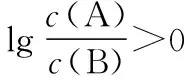
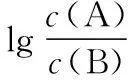
④交叉點為微粒濃度相等點,再用三大守恒構建出溶液離子濃度的等量或不等量關系。
【實操應用3】(2020·山東卷·15)25℃時,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,lgc(CH3COOH)、lgc(CH3COO-)、lgc(H+)和lgc(OH-)隨pH變化的關系如圖7所示。Ka為CH3COOH的電離常數,下列說法正確的是
( )
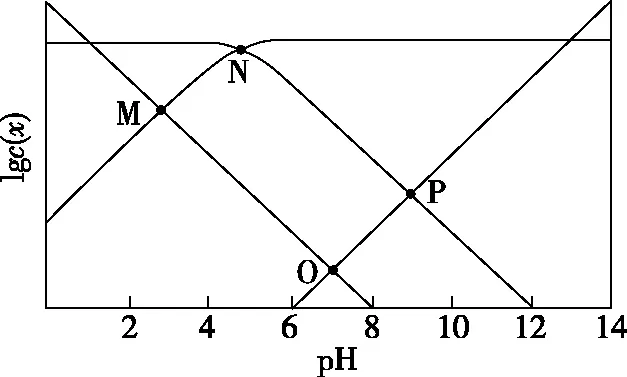
圖7
A.O點時,c(CH3COOH)=c(CH3COO-)
B.N點時,pH=-lgKa
D.pH由7到14的變化過程中,CH3COO-的水解程度始終增大
【參考答案】BC
【解析】明確對數意義,分清微粒線。隨著pH的升高,c(OH-) 和c(CH3COO-)增大,c(H+)和c(CH3COOH)減小,又由于pH=7時,c(H+)=c(OH-),故可推知,圖8中曲線1為lgc(CH3COO-)隨pH的變化曲線,曲線2為lgc(H+) 隨pH的變化曲線,曲線3為lgc(OH-)隨pH的變化曲線,曲線4為lgc(CH3COOH)隨pH的變化曲線。
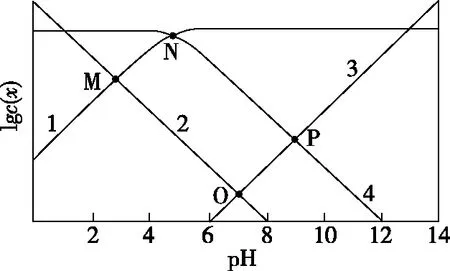
圖8
4.δ-V-pH圖
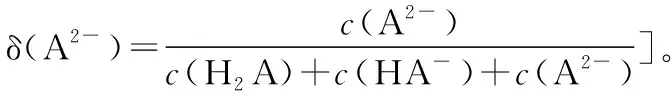
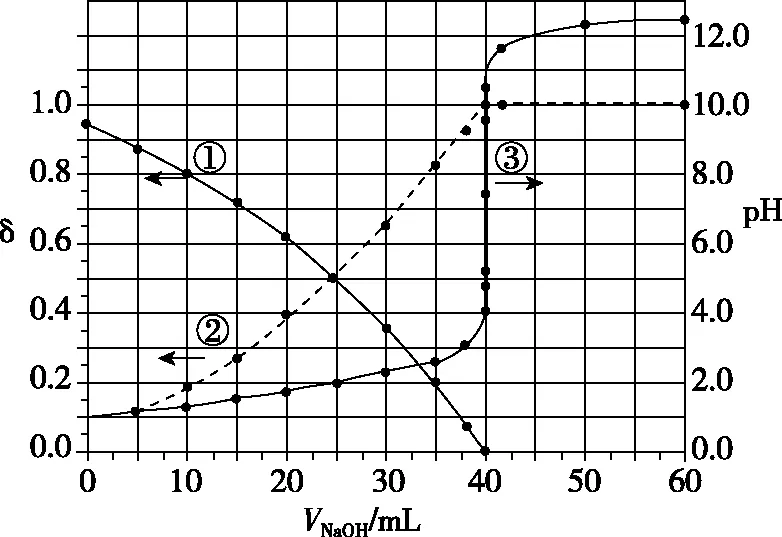
圖9
下列敘述正確的是
( )
A.曲線①代表δ(H2A),曲線②代表δ(HA-)
B.H2A溶液的濃度為0.200 0 mol·L-1
C.HA-的電離常數Ka=1.0×10-2
D.滴定終點時,溶液中c(Na+)<2c(A2-)+c(HA-)
【參考答案】C

【建模型】基本方法:確認共同軸→拆解復合圖→遷移二元圖
【實操應用4】(2021·遼寧省選擇性考試·15)用0.100 0 mol·L-1鹽酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-的分布分數δ隨pH變化曲線及滴定曲線如圖10。下列說法正確的是
( )
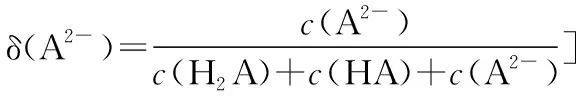
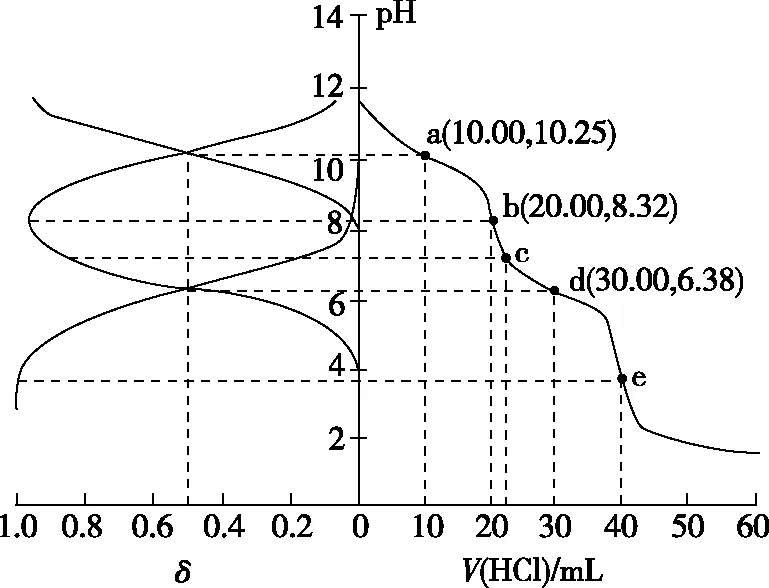
圖10
A.H2A的Ka1為10-10.25
B.c點:c(HA-)>c(A2-)>c(H2A)
C.第一次突變,可選酚酞作指示劑
D.c(Na2A)=0.200 0 mol·L-1
【參考答案】C
【解析】由圖像可知,隨著pH的減小,A2-的分布分數δ逐漸減小,HA-的分布分數δ逐漸增大,恰好生成NaHA之后,HA-的分布分數δ逐漸減小,H2A的分布分數δ逐漸增大,由此可得表示H2A、HA-、A2-的分布分數δ的曲線如圖11所示。
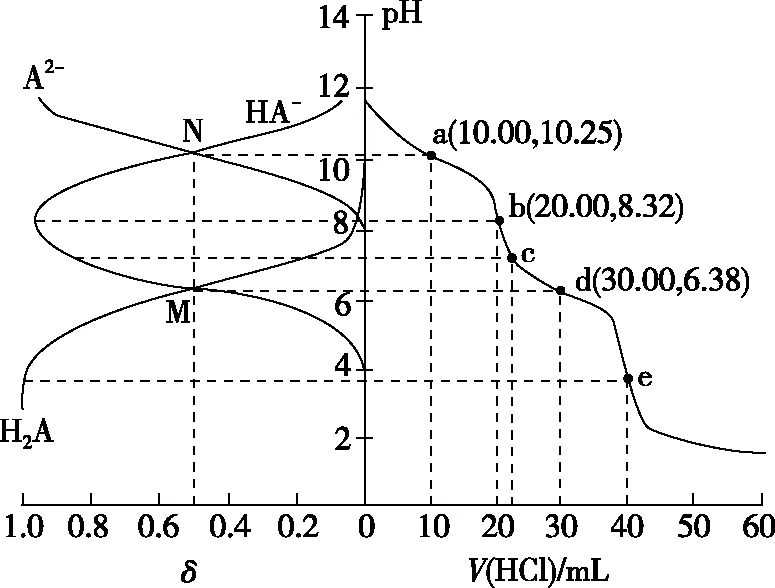
圖11
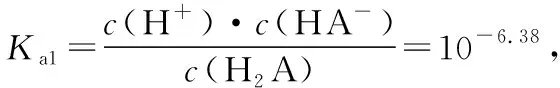
三、結語
“水溶液中的離子反應與平衡”圖像類試題很好地將基于真實情境下的化學實驗過程用圖像予以表征,要求考生能對圖像從靜態到動態化的閱讀,從而獲取有關的感性認知,再將基礎知識與提取的關鍵信息相結合來解決有關問題。總之,突破此類試題的整體思路是基于微粒觀、變化觀、守恒觀等從宏觀到微觀,重視模型的遷移應用。巧妙解讀圖像的關鍵是明確圖像縱、橫坐標的物理意義,從圖像中找特殊點,并對特殊點中所蘊含的信息從定性與定量兩個維度進行準確解讀。


