大黃魚來源波羅的海希瓦氏菌SB-19的hfq基因功能分析
江京洋,韋旭航,朱軍莉,吳 敏,馮立芳*
(浙江工商大學食品與生物工程學院,浙江 杭州 310018)
大黃魚(Larimichthys crocea)又稱黃魚、黃花魚、黃瓜魚,是我國四大傳統海產品(大黃魚、小黃魚、帶魚、烏賊)之一,其2019年的全國養殖量22.6萬 t,居海水養殖魚類之首,為我國東南沿海的重要經濟魚類[1]。大黃魚體色金黃,含有豐富的微量元素、維生素、蛋白質、不飽和脂肪酸,肉質細致滑嫩,深受消費者喜愛,因此大黃魚的市場需求極大。大黃魚常因運輸工具的顛簸導致死亡,故其常以冷藏方式進行運輸和銷售。隨著冷藏時間的延長,大黃魚在內源酶作用下發生自溶、脂肪氧化、以及耐冷細菌的繁殖并代謝,導致魚體腐敗和產生臭味變質,這部分適合生存和繁殖的細菌就是水產品貯藏過程中的特定腐敗菌[2]。
波羅的海希瓦氏菌(Shewanella baltica)為革蘭氏陰性桿菌,隸屬交替單胞菌目(Alteromonadales)希瓦氏菌科(Shewanellaceae)希瓦氏菌屬[3],能還原氧化三甲胺(trimethylamineN-oxide,TMAO)為三甲胺(trimethylamine,TMA),產生胺類化合物、硫化氫,具有較強的致腐能力,是大黃魚、南美白對蝦等海產品在冷藏過程中常見的特定腐敗菌[4-5]。在海產品腐敗過程中,特定腐敗菌會合成并釋放群體感應信號分子——自誘導物(autoinducer,AI),以調控菌體密度和生理行為,并加速海產品腐敗變質[6]。在波羅的海希瓦氏菌中已鑒定到兩種信號分子——二酮哌嗪類化合物(diketopiperazines,DKPs)和AI-2,二者均參與細菌的群體感應事件[7-8]。
RNA噬菌體Qβ復制酶的宿主因子Hfq是一種RNA分子伴侶蛋白,亦是一個結構保守的六聚體蛋白,存在于革蘭氏陽性和陰性菌[9]。Hfq通過正向和負向兩種調控方式,調節細菌的小RNA(sRNA)和信使RNA(mRNA)的堿基配對,從而影響翻譯的進程和RNA的穩定性[10]。Hfq調控細菌多種代謝通路,影響的生理生化表型包括:生長速率、泳動能力、趨化能力、毒力、抗逆境能力以及群體感應現象等[11]。例如,在哈維氏弧菌(Vibrio harveyi)的群體感應調控系統中,Hfq在細胞密度較低的情況下與群體調控RNA(quorum regulatory RNAs,Qrr RNA)結合,抑制LuxR的轉錄和降低群體感應現象[12]。在單核細胞性李斯特菌(Listeria monocytogenes)中,hfq基因缺失株的毒力和生物被膜形成能力顯著降低[13]。在奧奈達希瓦氏菌(S.oneidensis)中,hfq基因缺失株的指數期生長速率變慢、穩定期細胞密度降低[14]。在大腸桿菌(Escherichia coliK-12)中,hfq基因突變株不僅表現為生長速率變慢和穩定期細胞密度降低,還表現為細胞體積增大、滲透敏感性增強、抗紫外線能力減弱等[15]。但在金黃色葡萄球菌(Staphylococcus aureus)中,hfq基因表達水平較低,且hfq基因缺失株的生長速率和抗逆境能力與對照組無差異[16]。這說明Hfq在不同物種中存在功能趨異現象。
目前有關波羅的海希瓦氏菌中Hfq功能的研究還鮮見報道,亦未知Hfq與水產品腐敗的相關性。鑒于此,本實驗從波羅的海希瓦氏菌SB-19株中鑒定到1個hfq基因,并構建hfq基因敲除株,通過分析細菌的生長速率、群體感應現象、抗逆境能力、致腐能力,旨在為海產品腐敗菌的Hfq功能研究和明晰其致腐機制提供理論基礎。
1 材料與方法
1.1 材料與試劑
波羅的海希瓦氏菌SB-19株為本課題組前期分離自冷藏大黃魚,經生化鑒定和全基因組測序[17],菌株保存于-80 ℃冰箱[17]。
所有培養基 青島海博生物技術有限公司;聚合酶鏈式反應(polymerase chain reaction,PCR)擴增、RNA抽提、cDNA反轉錄試劑盒、實時熒光定量PCR(realtime PCR)檢測試劑盒 寶日醫生物技術(北京)有限公司;其余生化試劑 國藥集團化學試劑有限公司。
1.2 儀器與設備
QuantStudio 6 Flex熒光定量PCR儀 美國Applied Biosystems公司;7890/5975氣相色譜-質譜(gas chromatography-mass spectrometer,GC-MS)儀 美國安捷倫科技有限公司;970CTR熒光分光光度計 上海精科實業有限公司;Victor X酶標儀 美國PerkinElmer公司;UV2550紫外分光光度計 日本島津公司。
1.3 方法
1.3.1 Hfq序列分析
以本課題組前期測序、組裝、預測后的波羅的海希瓦氏菌SB-19株基因組為對象,構建本地BLAST數據庫,將從NCBI網站查找并下載的波羅的海希瓦氏菌、奧奈達希瓦氏菌、腐敗希瓦氏菌(S.putrefaciens)以及大腸桿菌Hfq的氨基酸序列進行比對,篩選條件為E-value>103。使用Clustalx軟件對篩選所得波羅的海希瓦氏菌SB-19株、希瓦氏菌屬和大腸桿菌的Hfq序列進行同源序列比對。
1.3.2 real-time PCR的檢測
將活化菌株按照體積分數1‰的接種量接入LB肉湯中,并在30 ℃搖床160 r/min進行培養,每隔4 h取樣一次,提取細菌總RNA,樣品中DNA殘留消化后即反轉錄為cDNA。以16S rRNA為內參基因,進行real-time PCR擴增,采用2-ΔΔCt法計算hfq基因的相對表達水平[18]。
1.3.3 波羅的海希瓦氏菌hfq基因敲除株的構建
根據波羅的海希瓦氏菌SB-19株的hfq基因及其兩側序列,設計PCR擴增hfq基因上游和下游的同源臂片段引物(表1),然后用PCR擴增和回收純化。巢式PCR將hfq基因上、下游片段與Cm基因表達框進行連接,按照本課題組前期操作過程[17]進行PCR片段的轉染和敲除株的篩選。

表1 實驗所用PCR引物Table 1 Primers used for PCR in this study
1.3.4 細菌生長曲線的測定
將活化的波羅的海希瓦氏菌SB-19株野生型(wide type,WT)與hfq基因敲除株(knock out,KO)分別接種到去離子水中,調整菌體濃度107CFU/mL,10 倍梯度稀釋至菌體濃度為106CFU/mL后轉接至裝LB肉湯的試管中,使起始菌體密度約為105CFU/mL,在30 ℃或4 ℃搖床160 r/min進行培養。每隔4 h取100 μL進行平板涂布,在30 ℃培養24 h、4 ℃培養144 h計數,繪制細菌的生長曲線。細菌的生長動力學模型參考李學英等[19]提出的修正后Gompertz方程:
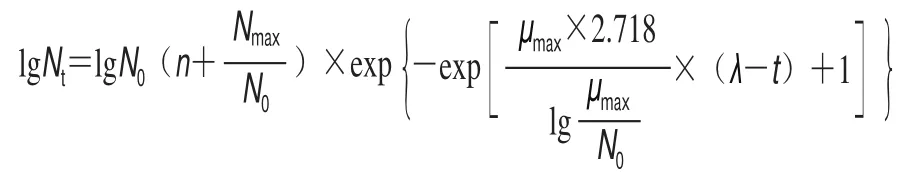
1.3.5 DKPs和AI-2的檢測
將活化的WT和KO菌株按照1‰接種于LB肉湯中,并在30 ℃搖床160 r/min進行培養,每隔6 h取樣一次。
DKPs的檢測:10 000 r/min離心10 min后取上清液,用等體積氯仿萃取并收集有機相,經旋轉蒸發后再次用氯仿溶解提取物,定容至1 mL后用GC-MS檢測,色譜和質譜條件同本課題組前期操作[20]。DKPs生成量以μg/mL表示。
AI-2的檢測:10 000 r/min離心3 min,上清液用0.22 μm濾紙過濾,另將活化后培養至穩定期的哈維氏弧菌BB170用AB培養基作1∶5 000稀釋,分別將10 μL待測上清液和90 μL稀釋的BB170菌液添加至96 孔酶標板。在30 ℃孵育0.5 h,用熒光分光光度計在490 nm波長處檢測熒光強度[8]。AI-2水平以哈維氏弧菌BB170誘導熒光強度表示。
1.3.6 生物被膜的檢測
將活化后培養至穩定期的WT和KO菌株按照體積比1∶100分別接種至含LB培養基的96 孔板中,在30 ℃生化培養箱培養24 h。將96 孔板中菌液傾倒干凈,隨后用無菌水清洗3次,置于超凈臺風干。每孔加入0.2%結晶紫溶液200 μL,靜置染色15 min。棄去結晶紫溶液,用無菌水清洗干凈,再用33%冰醋酸溶液溶解,最后用酶標儀測量595 nm處吸光度。
1.3.7 胞外蛋白酶活性的檢測
將1.5%瓊脂與10%脫脂牛奶混勻后滅菌制備脫脂牛奶瓊脂平板,取活化后培養至穩定期的WT和KO菌液5 μL點樣,隨后置于30 ℃生化培養箱培養24 h,測量蛋白水解圈直徑。
1.3.8 細菌抗逆能力的檢測
將活化后培養至穩定期的WT和KO菌株按照體積分數1‰接種于不同脅迫條件中,以檢測細菌的抗逆境能力。NaCl脅迫:活化菌株接種至含不同質量濃度NaCl(2、3、4 g/100 mL)的LB肉湯中;營養脅迫:活化菌株接種至用滅菌超純水稀釋(1∶2、1∶4、1∶8,V/V)的LB肉湯中;重金屬脅迫:活化菌株接種至含不同濃度Cu2+(0.05、0.15、0.3 mmol/L)的LB肉湯中;消毒劑脅迫:活化菌株接種至含不同質量濃度NaClO(0.1、0.15、0.2 g/100 mL)的LB肉湯中。經30 ℃搖床160 r/min培養24 h,然后用紫外分光光度計檢測菌液OD600nm。
1.3.9 滅菌魚汁中揮發性鹽基氮(total volatile basic nitrogen,TVB-N)和TMA的測定
滅菌魚汁的制作過程參照前期實驗[17],取新鮮大黃魚背部肌肉與純凈水按照1∶2(g/mL)混合,均質機拍打成勻漿后煮至70 ℃以沉淀蛋白質,上清液用定性濾紙過濾后煮沸15 min,然后在室溫下5 000 r/min離心30 min,再次過濾取上清液,每升上清液中添加終濃度0.1 mol/L磷酸鹽緩沖液(0.056 mol/L KH2PO4、0.044 mol/L K2HPO4,pH 6.6)、0.02 mol/L氧化三甲胺、0.4 mmol/LL-半胱氨酸、0.3 mmol/LL-甲硫氨酸,最后經121 ℃高壓滅菌制備成滅菌魚汁。將活化后培養至穩定期的WT和KO菌株按照體積分數1‰接種于滅菌魚汁中,置于4 ℃生化培養箱。采用半微量定氮法測定魚汁中的TVB-N生成量,采用苦味酸法測定魚汁中的TMA生成量[21]。
2 結果與分析
2.1 波羅的海希瓦氏菌SB-19株hfq基因的鑒定與表達規律
Hfq在革蘭氏陰性和陽性菌中均有分布,是一個結構保守的蛋白質[9]。在本實驗中,經本地BLAST比對后從波羅的海希瓦氏菌SB-19株中篩選到1個Hfq,且其與目前已報道的波羅的海希瓦氏菌完全一致(圖1A),與奧奈達希瓦氏菌、腐敗希瓦氏菌以及大腸桿菌的Identity值分別為97.8%、98.9%和75.6%,這說明波羅的海希瓦氏菌hfq基因是一個結構保守的基因。Hfq最早發現為大腸桿菌Qβ噬菌體在RNA復制過程中所必需的一種宿主因子,隨后又證實Hfq對細菌的生理活動大有裨益,如提高細菌的耐熱能力,hfq基因缺失株則表現出較低的環境適應能力和抗逆能力等[22]。由此推測波羅的海希瓦氏菌SB-19株的hfq基因可能具有類似的生物學功能。
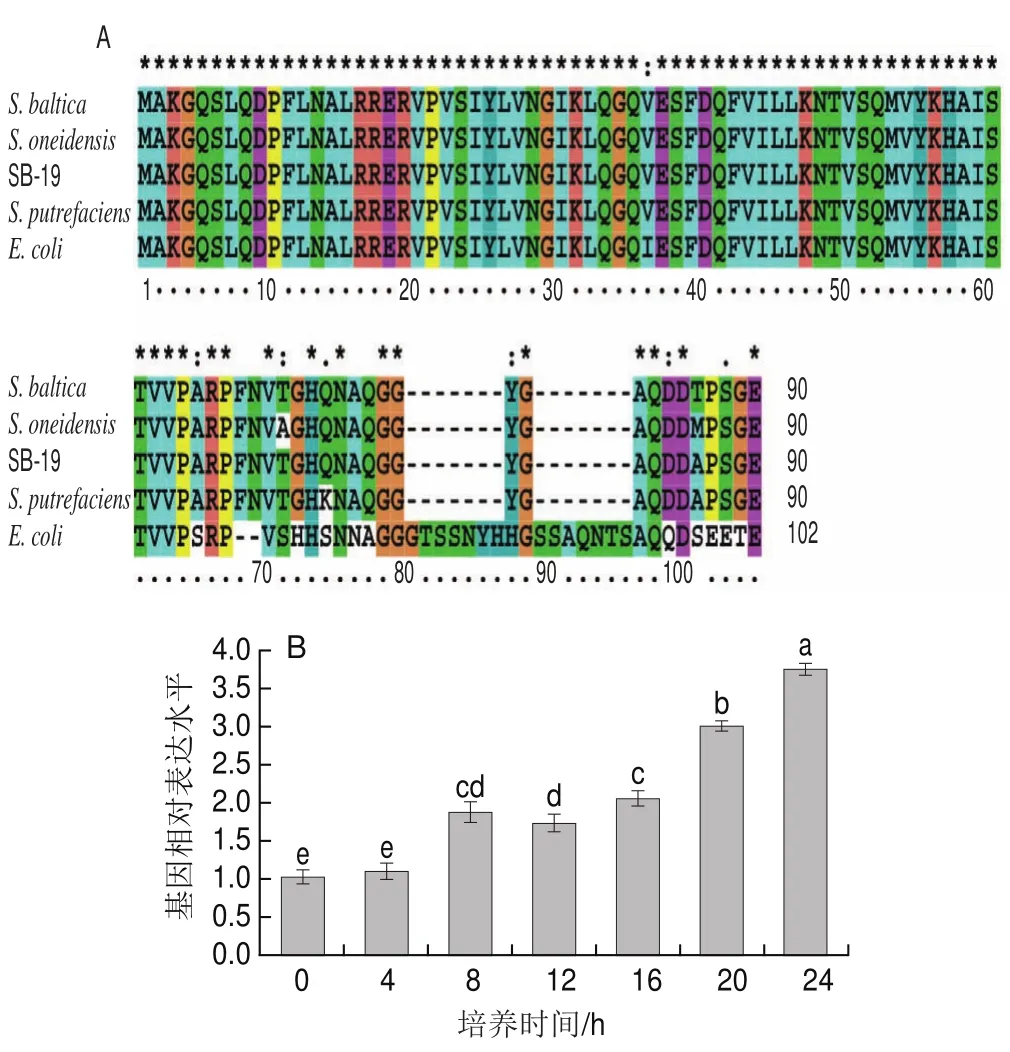
圖1 Hfq氨基酸序列比對(A)和hfq基 因表達水平在波羅的海希瓦氏菌生長期間的變化規律(B)Fig.1 Amino acid sequence alignment of Hfq (A) and relative expression level of hfq gene determined by qPCR in S.baltica during a 24 h culture period (B)
為分析波羅的海希瓦氏菌SB-19株hfq基因的功能,檢測其在遲緩期、對數期、穩定期這3個重要的細菌生長階段的表達水平。由圖1B可知,在細菌培養至4 h的延緩期,hfq基因表達水平尚未發生顯著變化;在細菌進入對數生長時期第8小時,hfq基因表達水平較起始提高了1 倍;此后hfq基因的表達水平持續升高,直至穩定期第24小時,hfq基因表達水平較起始提高了3.7 倍。該現象與銅綠假單胞菌(Pseudomonas aeruginosa)和嗜肺軍團菌(Legionella pneumophila)類似,hfq基因表達水平會隨著這兩種細菌生長時期的推進而提高[23-24]。這說明hfq基因在波羅的海希瓦氏菌SB-19株生長的對數期和穩定期發揮重要作用。
2.2 hfq基因缺失對波羅的海希瓦氏菌SB-19株生長速率的影響
WT株在30 ℃培養條件下生長迅速,一般在20 h左右即可進入穩定期,其最大比生長速率(μmax)為0.203 7,穩定期的最大細菌數為8.31f0.11(lg(CFU/mL))。hfq基因KO株在30 ℃培養條件下,其生長曲線與WT株接近,只是在對數期的生長速率相對略低,其μmax為0.170 5,穩定期的最大細菌數為8.25f0.12(lg(CFU/mL)),與WT株的細菌密度無顯著性差異(圖2A)。Brennan等[14]發現奧奈達希瓦氏菌中,hfq基因的缺失會導致突變株的生長速率變慢,穩定期的細菌密度降低;但Bohn等[16]觀察到金黃色葡萄球菌的hfq基因突變株生長速率與對照組接近。表明hfq基因在不同菌株內發揮不同程度的生物學效應,而當波羅的海希瓦氏菌SB-19株處于最佳生長條件下,hfq基因為非必要因子。
在4 ℃低溫培養條件下,WT株生長速率顯著降低,μmax為0.030 1,但其穩定期的最大細菌數(8.16f 0.13(lg(CFU/mL)))接近于30 ℃培養條件。然而KO株在4 ℃低溫培養條件下生長速率更低,其μmax僅為0.010 2,且穩定期的最大細菌數較相同條件下WT株降低了約2個數量級(圖2B)。此結果提示hfq基因有助于波羅的海希瓦氏菌SB-19株抵御低溫脅迫,即該基因可能參與細菌的抗環境脅迫過程。
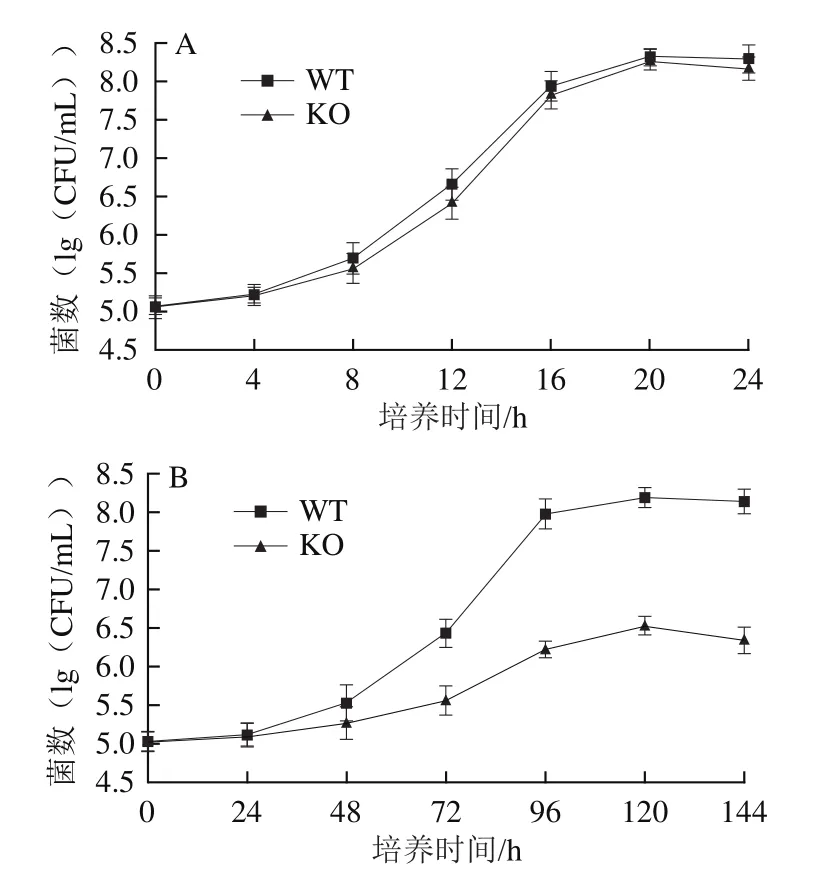
圖2 WT株和KO株在30 ℃(A)和4 ℃(B)的生長曲線Fig.2 Growth curves of WT and KO strains at 30 (A) and 4 ℃ (B)
2.3 hfq基因對波羅的海希瓦氏菌SB-19株信號分子分泌和群體感應的影響
波羅的海希瓦氏菌在生長過程中會產生群體感應現象,其分泌的信號分子DKPs和AI-2均調控細菌的群體感應過程[8,17]。DKPs是由兩個氨基酸經肽鍵連接而成的環二肽,存在于細菌、放線菌、真菌等,具有抗菌、神經保護、免疫抑制等多種生物學活性和藥理學活性[25]。在細菌30 ℃培養的最初6 h,WT株和KO株的DKPs生成量非常接近,培養12 h,WT株的DKPs生成量達到(10.46f 0.34)μg/mL,顯著高于KO株的(9.21f0.32)μg/mL(圖3A);而此時WT株的細菌數(6.65f0.20(lg(CFU/mL)))也高于KO株(6.41f0.21(lg(CFU/mL)))(圖2A),所以WT株與KO株之間DKPs的差異可能是由細菌數量的不同所造成。隨著培養時間的延長(18 h和24 h),細菌進入穩定期,此時細菌對DKPs的消耗量大于生成量,培養液中DKPs含量逐漸降低,KO株的DKPs生成量略高于WT株,無顯著差異,這說明hfq基因不參與信號分子DKPs的分泌過程。AI-2在革蘭氏陽性和陰性細菌中均有發現,是細菌種間交流的信號分子,參與生物被膜形成等群體感應現象[26]。WT株和KO株在24 h內均以接近水平生成AI-2,且KO株AI-2水平在12~24 h期間略高于WT株(圖3B),這表明hfq基因同樣不參與信號分子AI-2的分泌過程。
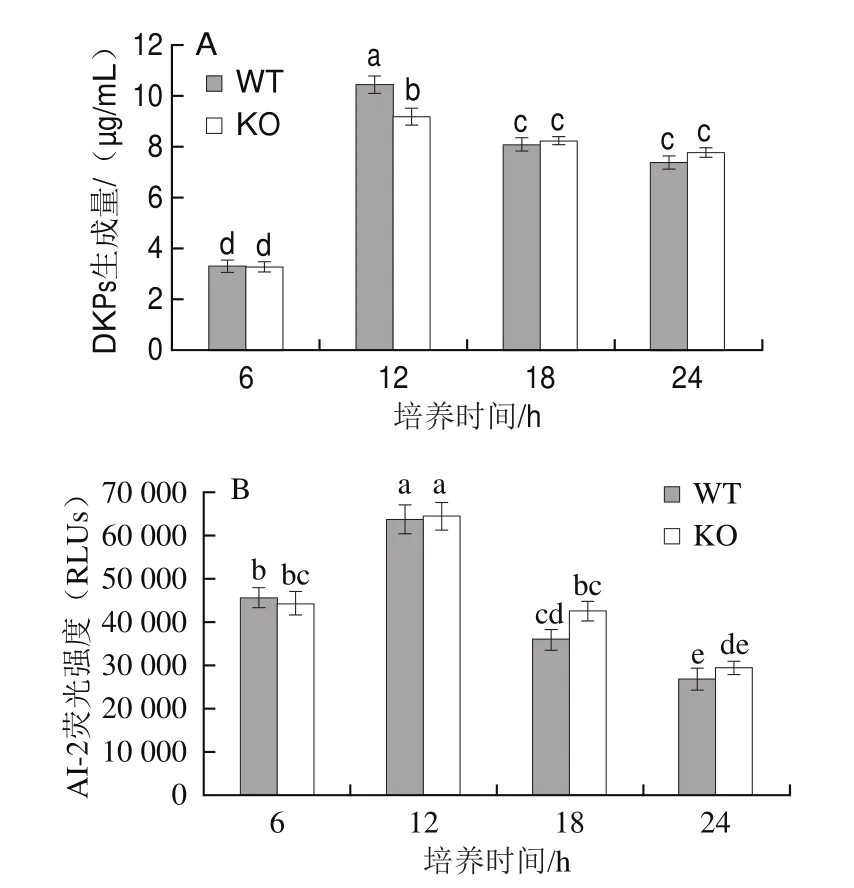
圖3 WT株和KO株分泌信號分子DKPs(A)和AI-2(B)的水平Fig.3 Levels of DKPs (A) and AI-2 (B) secreted by WT and KO strains
生物被膜是微生物在附著表面分泌的帶有黏性基質的胞外聚合物,有助于增強微生物抵御環境脅迫的能力[27]。經培養24 h后,WT株的生物被膜形成量高于KO株,且二者存在顯著差異(P<0.05)(表2),說明hfq基因參與波羅的海希瓦氏菌SB-19株的生物被膜形成過程。在單核細胞性李斯特菌中也有類似現象,其hfq基因缺失株不僅表現為生物被膜形成能力降低,而且對小鼠的致毒能力也明顯下降[13];嗜水氣單胞菌有2個hfq基因拷貝,hfq2基因缺失株會表現出生物被膜形成能力的降低[28],推測hfq基因參與細菌的群體感應調控通路,與其生物被膜的形成密切相關。
腐敗菌通過分泌胞外蛋白酶水解水產品中的蛋白質和氨基酸,以獲取自身繁殖所需的營養物質,這進而加劇水產品的腐敗變質。在波羅的海希瓦氏菌中添加信號分子DKPs會促進細菌胞外蛋白酶的活性和增強致腐能力[17]。在本實驗中,WT株和KO株經培養24 h后,WT株的胞外蛋白酶水解圈直徑顯著大于KO株(P<0.05)(表2),說明hfq基因也參與了波羅的海希瓦氏菌SB-19株的胞外蛋白酶分泌過程,即Hfq調控該菌的群體感應事件,但不參與信號分子的分泌過程。

表2 培養24 h WT株和KO株的生物被膜和胞外蛋白酶水解活力Table 2 Biofilm formation ability and extracellular protease activity of WT and KO strains
2.4 hfq基因對波羅的海希瓦氏菌SB-19株抗逆境能力的影響
在單核細胞性李斯特菌中,hfq基因的缺失會導致突變株對高鹽、乙醇、H2O2的適應能力顯著降低[29],大腸桿菌中hfq基因的缺失也會降低其抗紫外線能力[15]。與對照組相比,在NaCl暴露條件下,2 g/100 mL NaCl略微促進了WT株和KO株的生長,而隨著NaCl質量濃度的提高,WT株和KO株菌株密度均降低,且KO株始終低于WT株(圖4A)。在營養脅迫條件下,當LB營養肉湯添加量為1/2時,WT株與KO株的OD600nm分別較對照組減少了19.07%與62.87%;隨著LB營養肉湯含量的持續降低,WT株與KO株的OD600nm持續降低,但KO株始終低于WT株(圖4B)。在重金屬脅迫條件下,0.05 mmol/L Cu2+不影響WT株的密度,但此時KO株OD600nm較對照組降低了33.31%;當Cu2+濃度繼續升高,WT株也表現出密度降低,只是相同條件下其OD600nm高于KO株(圖4C)。在消毒劑脅迫條件下,0.1 g/100 mL NaClO不干擾WT株的生長,而此時KO株非常敏感,密度較對照組降低了75.31%;NaClO質量濃度為0.15 g/100 mL時,WT株OD600nm較對照組降低了60.90%,KO株此時幾乎不生長(圖4D)。上述結果表明,Hfq參與了波羅的海希瓦氏菌SB-19株對鹽分、營養、重金屬、消毒劑等脅迫環境的適應過程,推測其通過影響sRNA與mRNA二者之間的結合來調節抗逆基因翻譯或蛋白質降解,從而改變細菌的環境適應能力,hfq基因缺失降低了波羅的海希瓦氏菌SB-19株的抗逆境能力。
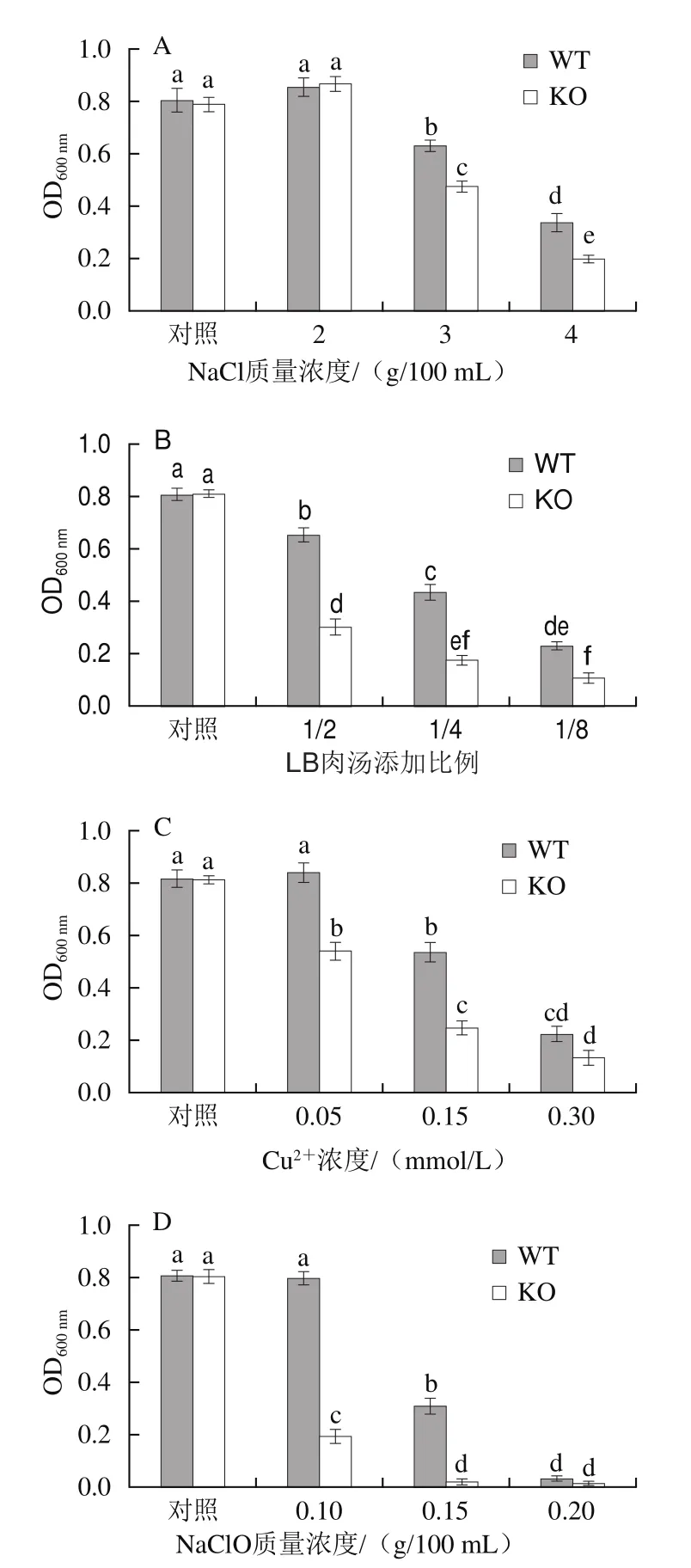
圖4 WT株和KO株抗NaCl(A)、營養(B)、重金屬Cu2+(C)和NaClO(D)脅迫Fig.4 Resistance of WT and KO strains to salt (A), nutrient (B), heavy metal (C), and disinfectant (D)
2.5 hfq基因對波羅的海希瓦氏菌SB-19株致腐能力的影響
水產品中蛋白質在腐敗過程中被分解為氨和胺類等堿性含氮物質,即TVB-N;海水魚富含TMAO,在腐敗菌作用下TMAO脫氧還原成有臭味的TMA,因此TVB-N和TMA含量已成為鑒定水產品腐敗的重要指標[2]。在4 ℃冷藏條件下,接種WT株和KO株的滅菌魚汁內TVB-N和TMA含量隨著培養時間的延長而持續增加。在培養3 d,接種WT株的魚汁內TVB-N質量濃度達到(35.55f 3.32)mg/100 mL,超過了30 mg/100 mL的感官可接受閾值[30];接種KO株的魚汁在培養第4天時超過此閾值,且其所產生TVB-N含量始終低于同一時期WT株(圖5A)。TMA生成規律與TVB-N相似,接種WT株的滅菌魚汁在相同培養時間始終高于KO株(圖5B);上述TVB-N和TMA含量的變化說明hfq基因缺失后波羅的海希瓦氏菌SB-19株的致腐能力也相應減弱。hfq基因缺失削弱了波羅的海希瓦氏菌SB-19株的致腐能力。
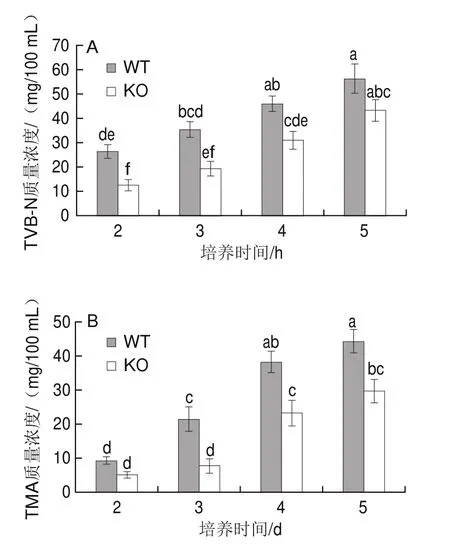
圖5 接種WT株或KO株滅菌魚汁的TVB-N(A)和TMA(B)生成量Fig.5 Levels of TVB-N (A) and TMA (B) in sterilized fish juice inoculated with WT or KO strain
Hfq在RNA翻譯水平存在正負兩種調控途徑:1)負向調控:Hfq與調控靶標mRNA的sRNA結合,阻止靶標mRNA在核糖體就位,進而阻礙靶標mRNA的翻譯;有些靶標mRNA的5’非翻譯區堿基發生自我配對形成莖環結構,也會阻礙靶標mRNA的翻譯;2)正向調控:Hfq與調控靶標mRNA的sRNA結合,形成的復合體阻止靶標mRNA在5’非翻譯區形成莖環結構,保證后續的翻譯順利進行[10]。哈維氏弧菌中Hfq以負向調控方式發揮作用:當細胞密度較低時,Qrr1-5產生的sRNA在Hfq作用下會抑制受體蛋白LuxR的表達;當細胞密度較高時,qrr基因不發生表達,失去Hfq抑制的LuxR結合信號分子,進而激活下游的群體感應事件,如誘導細菌發出熒光[12]。對于波羅的海希瓦氏菌SB-19 WT株,隨著細菌密度的增加,其所分泌的信號分子水平升高,hfq基因表達水平也隨之上升,細菌表現出的群體感應現象和滅菌魚汁的腐敗程度愈發明顯;而對于KO株,隨著細菌密度的增加,雖然其分泌的信號分子水平與WT株接近,但其群體感應和滅菌魚汁的腐敗程度卻低于同時期的WT株,這說明波羅的海希瓦氏菌SB-19株的Hfq以正向調控方式發揮作用,這為今后研究海產品中特定腐敗菌的致腐能力奠定了理論基礎。
3 結 論
波羅的海希瓦氏菌SB-19株中存在一個hfq基因,且該基因表達水平隨著細菌的生長而升高;在4 ℃培養條件下,與WT株相比,KO株的生長速率明顯遲滯且穩定期細菌密度較低,顯示hfq基因在波羅的海希瓦氏菌SB-19株的生長對數期和穩定期發揮重要作用。WT株與KO株所分泌信號分子DKPs和AI-2水平接近,可見hfq基因不參與信號分子的分泌過程;然而,KO株卻表現為更低的生物被膜形成能力和胞外蛋白酶活性;接種KO株的滅菌魚汁也產生較少的TVB-N和TMA,說明Hfq正向調控波羅的海希瓦氏菌的群體感應事件,但不參與信號分子的分泌過程。此外,KO株對鹽分、營養、重金屬、消毒劑等脅迫條件更為敏感,推測Hfq通過影響sRNA與mRNA二者之間的結合來調節抗逆基因的翻譯或蛋白質的降解,從而改變細菌的環境適應能力。綜上所述,波羅的海希瓦氏菌SB-19株中Hfq是一個全局性調控因子,整體調節該菌的諸多生理活動。本實驗為波羅的海希瓦氏菌的基礎生物學研究和海產品微生物的致腐機制提供理論基礎。

