環境因子對茅臺鎮不同輪次釀造環境細菌群落結構多樣性的影響
王 琳,胡小霞,黃永光*
(貴州大學釀酒與食品工程學院,貴州省發酵工程與生物制藥重點實驗室,貴州 貴陽 550025)
作為中國傳統白酒的典型代表之一,醬香型白酒產量雖然只占中國白酒的3%左右,但利潤卻占了中國白酒行業的40%以上[1-2]。醬香型白酒發酵主要分為3個典型固態發酵階段,即大曲制備、堆積發酵和入池發酵[3-4],其中大曲制備和堆積發酵會網羅釀造環境中的微生物菌群,說明釀造環境中必然存在與發酵相關的微生物[5]。王歡等[6]在醬香型白酒機械化釀造7個輪次堆積發酵酒醅中檢測出14個門、456個屬,Kroppenstedtia、Acinetobacter、Caulobacter、Bacillus和Lactobacillus等12個為優勢細菌屬。吳徐建[7]利用傳統可培養方法研究了醬香型白酒2~7輪次環境、大曲及酒醅中的酵母和細菌多樣性,結果表明,Zygosaccharomyces bailii、Saccharomyces cerevisiae、Bacillus licheniformis和Bacillus amyloliquefaciens是堆積發酵過程中最主要的酵母與細菌種屬,其還驗證了堆積酒醅中的細菌主要來源于大曲,而酵母主要來自于堆積發酵的地面。Wang Xuanshan等[8]運用高通量測序技術與Source Tracker方法相結合,研究了釀造環境微生物對白酒發酵過程的貢獻,結果表明環境微生物是發酵微生物的重要來源,而且環境微生物可以驅動白酒發酵生態系統的穩定性。Pang Xiaona等[9]研究了環境微生物菌群對清香型白酒釀造微生物的影響,發現酒醅中的Lactobacillus acetotolerans主要來源于空氣。龐曉娜[10]對比分析了不同時期釀造環境與大曲微生物的多樣性,結果表明大曲和空氣中的細菌菌群結構比較相似;并應用Source Tracker對不同時期發酵過程的細菌來源進行分析,發現車間和地缸表面為清香型白酒發酵提供了重要的微生物來源。上述文獻均表明參與釀造過程的微生物與釀造環境微生物關聯非常密切,而且釀造環境中微生物之間存在相互作用,這些微生物在長期自然馴化過程中借助復雜的微生物相互作用實現了功能定向進化[11]。
微生物的生長、繁殖、衰亡與其生存的環境密切相關,受環境因子的影響較大[10,12-13]。研究表明茅臺地區赤水河水體[14]和茅臺鎮空氣[15]夏季樣品中的微生物多樣性相對其他3個季節更加豐富,說明該地區夏季的氣候條件更適合微生物生長繁殖。王鵬等[16]利用冗余分析和蒙特卡洛置換檢驗研究環境因子對中國白酒發酵過程中核心微生物群的影響,結果表明水分含量、溫度等環境因素對核心微生物菌群影響較大。杜海[17]通過考察白酒釀造特定環境因子,如水分、溫度和pH值等環境因子對產土味素菌株的影響,發現產土味素的鏈霉菌在含水量50%的釀造基質、溫度30 ℃、中性偏堿性的環境中可大量繁殖。陳雪等[18]分析了鳳香型白酒發酵酒醅微生物多樣性與環境因子的相關性,發現溫度與細菌多樣性呈極顯著負相關。由此可見,環境因子直接影響了釀造環境微生物的生長繁殖,對白酒釀造過程中的微生物菌群存在直接或間接作用,從而導致白酒風味的差異。因此,研究環境因子與環境微生物的相關性對于了解環境因子對白酒產區的形成、功能影響具有重要意義。
為揭示茅臺鎮1~7輪次釀造環境中的細菌菌群結構多樣性及環境因子對其影響,本研究以茅臺鎮釀造環境中細菌群落為研究對象,通過高通量測序技術與數理統計結合研究釀造環境樣本中細菌菌群結構組成、分布和環境因子的關聯性,旨在解析環境因子與釀造環境優勢細菌群落的相關性,為茅臺鎮醬香型白酒釀造環境微生態結構、資源價值評價、產業發展等研究提供數據基礎理論及科學依據。
1 材料與方法
1.1 材料與試劑
1.1.1 樣品
樣品采自貴州省仁懷市茅臺鎮醬香型白酒釀造區域的17個代表性釀酒企業(分布于7個主要釀酒區域,簡稱7個主釀區)周邊的釀造環境[19]。環境樣品采集涵蓋采樣釀造企業周邊200 m內范圍的生產車間晾堂、產房墻角地面土塵、灰塵,車間窗戶玻璃、窗臺、墻體表面的灰塵、粉塵等。取樣時間為2018年1ü9月,茅臺鎮醬香型白酒釀造1~7輪次的堆積發酵期,每輪次對釀造環境進行3~5 d采樣。每個采樣企業的樣品采集均固定在同一采樣點。從17個釀造企業釀造環境中共采集119個環境樣品,按照區域劃分將從每個酒廠采集的樣品采用等量混合為該區域的綜合樣,7個輪次共計49個環境區域的最終混合樣品,每輪次采集樣品取完后及時轉移至-80 ℃冰箱密封保存。
1.1.2 試劑
E.Z.N.A.Soil DNA Kit 美國Omega BioTek公司;rTaqDNA聚合酶試劑盒 北京全式金生物技術有限公司;DNA Marker 寶日醫生物技術(北京)有限公司;磷酸鹽緩沖液(phosphate buffered saline,PBS)、引物合成 上海生物工程股份有限公司;異丙醇(分析純) 天津市富宇精細化工有限公司;TEA緩沖液、Gengreen染料 上海賽百盛有限公司。
1.2 儀器與設備
臺式高速冷凍離心機 德國Sigma公司;G154DW高壓蒸汽滅菌鍋 廈門致徽儀器有限公司;GeneAmp?9700型聚合酶鏈式反應(polymerase chain reaction,PCR)儀美國ABI公司;DYY-8C電泳儀 北京六一儀器廠;JS-680C凝膠成像儀 上海培清科技有限公司;MiSeq測序儀 美國Illumina公司。
1.3 方法
1.3.1 樣品總DNA提取
參考文獻[19]報道的方法,主要步驟為:1)取每個混勻的最終樣品各20 g于100 mL離心管中,加入35 mL滅菌后的0.1 mol/L PBS懸浮和3~5 顆玻璃珠,充分振蕩7 min,400 r/min離心5 min,吸取上清液;2)沉淀用PBS洗滌,漩渦振蕩4 min,400 r/min離心5 min,收集上清液;3)重復上一步操作共收集40~50 mL上清液,配平后于12 000 r/min離心5 min,棄上清液,收集細胞沉淀。預處理后每個樣品的總DNA提取步驟參考E.Z.N.A.Soil DNA Kit的操作說明書。
1.3.2 PCR擴增
細菌PCR擴增引物:338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和 806R(5’-GGACTACHVGG GTWTCTAAT-3’)。擴增程序:95 ℃預變性3 min,27個循環(95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。擴增體系(20 μL):4 μL 5hFastPfu緩沖液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL FastPfu聚合酶,10 ng DNA 模板。
1.3.3 Illumina MiSeq測序
利用Illumina公司的MiSeq PE 300平臺,分別對細菌V3-V4高變區序列進行測序分析(上海美吉生物醫藥科技有限公司)。
1.3.4 環境因子
貴州省氣象局檢測提供每輪次采樣期及其前后3 d的環境因子值,包括環境溫度、空氣濕度、降雨量、光照時長和大氣壓。
1.4 數據及圖像處理
采用Microsoft Office Excel 2016進行數據計算和分析。基于Illumina MiSeq測序平臺,利用IBM SPSS Statistics 26.0進行Student’st-檢驗和Spearman相關性分析;Origin 2017和TB-tools繪制箱線圖、豐度圖和Heatmap圖等。
2 結果與分析
2.1 α多樣性分析
通過α多樣性分析可以得到群落中物種的豐富度、覆蓋度和多樣性等信息,常用的度量標準有Shannon指數、Chao指數、ACE指數和覆蓋率。運用統計學Student’st-檢驗方法分析不同輪次釀造環境樣本之間的指數值是否具有顯著差異。本研究茅臺鎮不同輪次釀造環境樣本的菌群多樣性指數顯著性分析(可操作分類單元(operational taxonomic units,OTU)水平)見圖1。
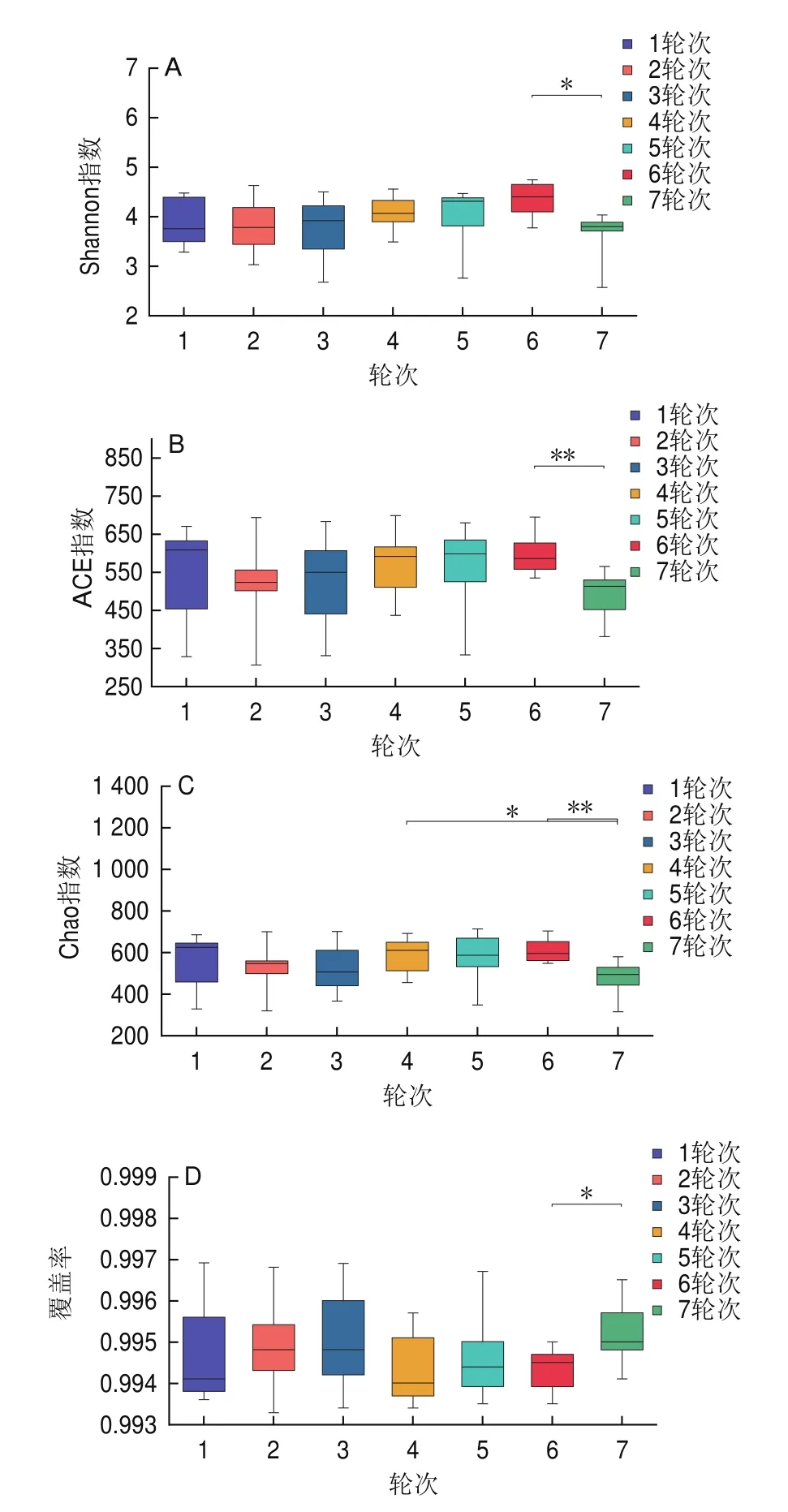
圖1 各環境樣品細菌菌群多樣性指數及其顯著性分析(OTU 水平)Fig.1 Diversity index and significance analysis of bacterial communities in environmental samples (OTU Level)
從圖1可看出,7個輪次的釀造環境樣品之間的差異顯著性較小。從圖1A、B可知各個輪次的Shannon指數和ACE指數相差不大,Shannon指數和ACE指數表明,1、4、5、6輪次釀造環境的細菌多樣性和豐富度明顯高于其他輪次,該結果表明這4個輪次期間(1月、5月、6月和7月)的環境氣候條件適宜于細菌生長[19]。Chao指數主要衡量樣本的物種豐富度信息,其值越大群落豐度越高(圖1C)。經t-檢驗發現,7輪次與6輪次差異極顯著(P<0.01,n=49),與4輪次有差異(P<0.05,n=49)。覆蓋率主要用于衡量測序深度(圖1D),各輪次釀造環境的覆蓋率均大于0.99,說明該信息足以揭示釀造環境樣品中大多數樣本的細菌菌群。基于Shannon指數、ACE指數和覆蓋率經t-檢驗,6輪次與7輪次有差異(P<0.05,n=49)。
通過α多樣性分析結合t-檢驗進一步分析茅臺鎮醬香型白酒不同輪次釀造環境中的物種豐富度和差異顯著性。結果表明,茅臺鎮7個輪次釀造環境的細菌多樣性豐富度高,且只有7輪次與4輪次和6輪次環境細菌群落結構多樣性和物種多樣性存在差異,其他輪次釀造環境中的細菌菌群結構具有明顯的相對穩定性特征。
2.2 α多樣性與環境因子的關系
為揭示茅臺鎮釀造環境中的微生物多樣性與環境因子間的相關性,利用SPSS Statistics 26.0進行Spearman相關性分析[20]。從圖2可看出,Shannon指數、ACE指數、Chao指數和覆蓋率與降雨量相關性較弱,但與其余4個環境因子相關性強,其中Shannon指數與環境溫度和光照時長相關性顯著;ACE指數和Chao指數與環境溫度和濕度顯著相關;覆蓋率與環境溫度、濕度和大氣壓存在顯著相關性。同樣,從輪次角度分析發現,4個指數在6輪次釀造環境樣本中均與5個環境因子具有較弱的相關性,而其他輪次與1種或多種環境因子存在顯著相關。例如,在1輪次中Shannon指數與光照時長呈顯著負相關,在7輪次中Chao指數與溫度和濕度呈顯著正相關,而在2輪次中ACE指數與濕度顯著負相關,Chao指數和覆蓋率與溫度、濕度和大氣壓具有顯著正相關。綜上結果表明,不同輪次的環境因子對細菌菌群多樣性存在一定調控,細菌α多樣性在一定程度上與氣候條件因子相關,而且各輪次的相關程度存在差異,對細菌菌群的顯著影響主要在2輪次和3輪次。

圖2 細菌α多樣性指數與環境因子的Spearman等級相關系數的熱圖Fig.2 Heatmaps of Spearman’s rank correlation coefficients of bacterial α-diversity metrics with environmental factors
2.3 細菌物種與菌群結構分析
如圖3A所示,從茅臺鎮醬香型白酒1~7輪次釀造環境依次檢出27、28、29、30、28、31個和26個細菌綱,共檢出33個綱類。從微生物的含量豐度高低看,其中Gammaproteobacteria(平均相對豐度為36.09%)在所有樣本中的含量最為豐富,且在7輪次樣本中占比最高,達到了59.15%,在3輪次中占比最低(19.78%)。第2豐富的優勢菌綱為Bacilli(25.40%),其在1~6輪次釀造環境樣本中相對豐度較穩定,為20.70%~32.10%,但在7輪次的相對豐度僅7.33%。第3優勢細菌綱為Sphingobacteriia(15.79%),第4優勢菌綱為Alphaproteobacteria(7.05%),第5優勢菌綱為Actinobacteria(6.92%)。其他優勢細菌綱分別為Flavobacteriia(5.35%)、Betaproteobacteria(2.08%)、Bacteroidia(0.42%)、norank_p_Saccharibacteria(0.28%)、Cytophagia(0.19%)和Clostridia(0.11%)。除了前述11個優勢綱外,其余22個相對豐度<0.10%的綱出現在“others”中,包括Deinococci(0.08%)、Cyanobacteria(0.03%)、Chlamydiae(0.03%)、Verrucomicrobiae(0.03%)、Deltaproteobacteria(0.02%)等。結果表明,茅臺鎮醬香型白酒釀造環境不同輪次間的優勢細菌菌綱基本一致,其中Gammaproteobacteria、Bacilli、Sphingobacteriia、Alphaproteobacteria、Betaproteobacteria、Flavobacteriia和Actinobacteria為釀造環境中的優勢細菌綱。進一步說明茅臺鎮釀造環境中的微生物具有一定的共性和穩定性,這為茅臺鎮釀造產區的形成奠定了微生物生態基礎優勢及其特征微生態結構。Du Hai等[21]研究也發現制曲環境樣品中的5個綱(Bacilli、Gammaproteobacteria、Alphaproteobacteria、Actinobacteria和Sphingobacteriia)為優勢細菌綱,與本研究結果一致。其中,Bacilli和Gammaproteobacteria也是高溫大曲[22]和酒醅[23]中的優勢細菌綱。Zuo Qiancheng等[22]比較了醬香型高溫大曲傳統制曲和機械化制曲中的細菌菌綱,發現Alphaproteobacteria、Betaproteobacteria、Actinobacteria和Cyanobacteria的相對豐度在機械化高溫大曲發酵過程中顯著高于傳統制曲。
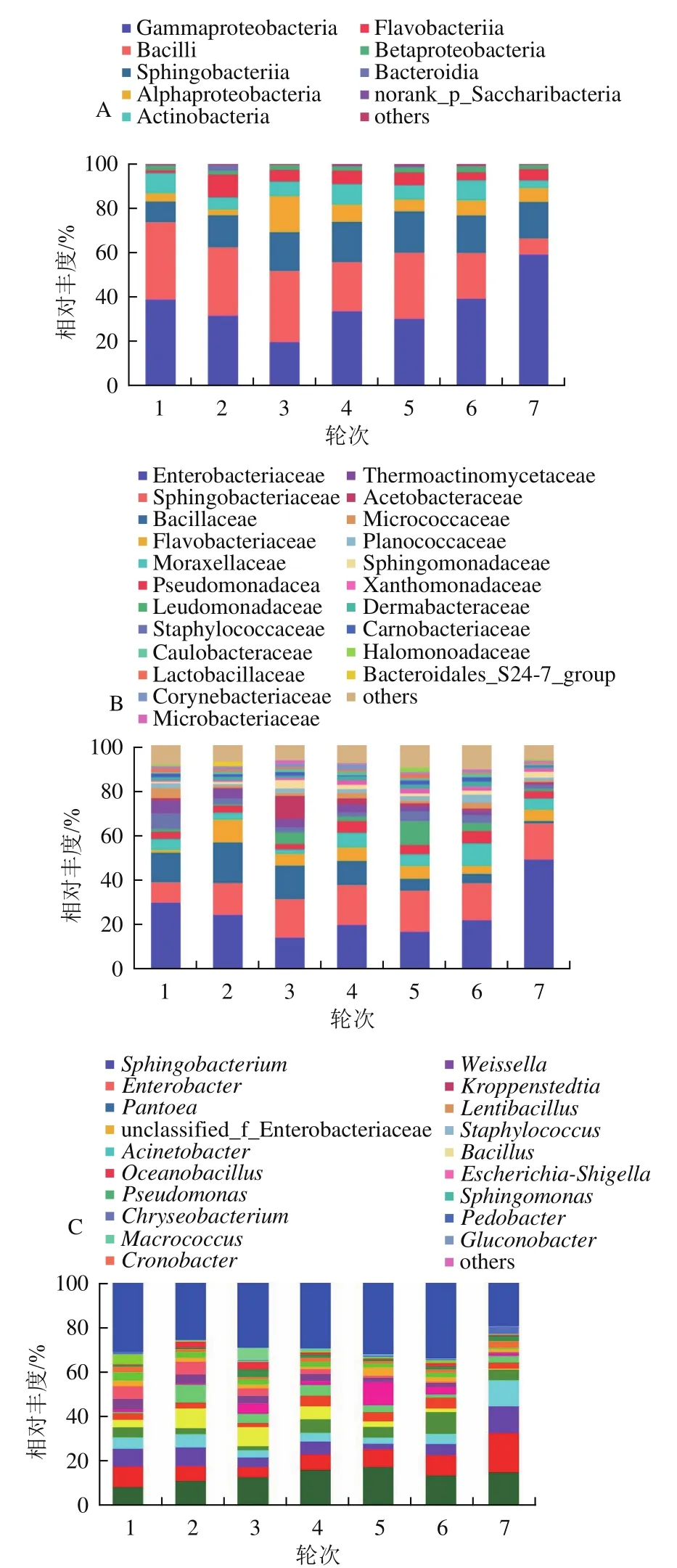
圖3 環境樣品在綱水平(A)、科水平(B)和屬水平(C)上的細菌菌群結構Fig.3 Bacterial community structure of environmental samples at class level (A), family level (B) and genus level (C)
如圖3B所示,在科水平上,不同輪次釀造環境中的細菌群落在數量及結構分布上多樣性特征較明顯,從1~7輪次分別檢測出120、119、117、127、132、144個和119個科,共檢出153個科。第1優勢細菌科為Enterobacteriaceae(平均相對豐度為24.86%),其在7輪次釀造環境樣本中含量最高(48.70%),3輪次含量最低(13.95%),Sphingobacteriaceae為第2優勢科,其在7個輪次的相對豐度較穩定,平均相對豐度為15.68%。第3優勢科為Bacillaceae(平均相對豐度為9.59%),在2輪次最高,達到了18.03%,隨著生產輪次的進行,其相對含量逐漸降低到1.03%。其他優勢細菌科主要包括Flavobacteriaceae(5.35%)、Moraxellaceae(5.18%)、Pseudomonadaceae(3.86%)、Leuconostocaceae(3.41%)、Staphylococcaceae(3.29%)、Thermoactinomycetaceae(3.29%)、Acetobacteraceae(2.44%)、Planococcaceae(1.06%)、Lactobacillaceae(0.59%)和Enterococcaceae(0.27%)等,占各輪次釀造環境樣品細菌總科和的87.79%~93.09%。從圖3B還可知,2輪次釀造環境中的特有優勢細菌科(僅在1個輪次中的相對含量≥1%)包括Bacillales(1.19%)和Bacteroidales_S24-7_group(1.85%),Microbacteriaceae(1.56%)為3輪次特有優勢科,Halomonadaceae(2.02%)為5輪次特有優勢科,Brucellaceae(1.04%)是7輪次特有優勢科,而1、4輪次和6輪次無特有優勢科。本研究還發現,Flavobacteriaceae、Planococcaceae、Bacteroidales_S24-7_group、Microbacteriaceae和Brucellaceae是目前尚未在白酒釀造環境中被認為是優勢菌的微生物科類。Wang Li等[24]基于高通量測序技術對醬香型白酒發酵過程中的3個重要階段(制曲、堆積發酵和窖池發酵)的細菌菌群結構多樣性進行了研究,發現Bacillaceae、Lactobacillaceae、Leuconostocaceae和Enterococcaceae的相對含量大于15.84%,還在茅臺鎮醬香型白酒釀造過程中檢出了Planococcaceae,而且在其他類型的白酒釀造過程中鮮少被報道過。推測此細菌極有可能來源于茅臺鎮釀造環境。由此可見,釀造環境中的微生物可能通過大曲制曲、堆積發酵遷徙進入到釀造過程,為白酒釀造提供微生物來源。前述部分優勢微生物也被證實為釀造過程的功能微生物,如Bacillaceae可以代謝C4化合物、吡嗪、揮發性酸、芳香族和酚類化合物,以增加醬香型白酒的特色香氣濃度[25]。Leuconostocaceae、Lactobacillaceae和Enterococcaceae為主要的乳酸菌科類,其功能可將乳糖轉化為乳酸,也是代謝醬香型白酒的主要風味成分乙酸乙酯的重要微生物[24,26]。同樣,Li Xianran等[27]從清香型白酒發酵酒醅中檢出了15個細菌科,結果顯示,Lactobacillaceae、Bacillaceae和Staphylococcaceae為酒醅樣本中的優勢菌科。Tian Ning等[28]基于宏基因組學發現Lactobacillaceae、Enterobacteriaceae、Leuconostocaceae、Bacillaceae、Pseudomonadaceae和Acetobacteraceae等為十里香白酒大曲中的主要細菌科。李可[29]在濃香型白酒發酵黃水中發現Planococcaceae為可培養細菌菌群的優勢菌科。
如圖3C所示,在釀造環境樣本中屬水平上共檢出396個屬[19],平均相對豐度≥1.00%有22個,主要包括Sphingobacterium、Enterobacter、Pantoea、unclassified_f_Enterobacteriaceae、Acinetobacter、Oceanobacillus和Pseudomonas等。屬水平的結果表明,茅臺鎮醬香白酒各釀造輪次期間釀造環境中的細菌群落在屬水平上其種類非常豐富,為該釀造產區醬香白酒釀造提供給了豐富的微生物生態資源,進一步為醬香白酒復雜風味結構形成奠定了基礎。
上述結果表明,在綱、科和屬水平上,不同輪次釀造環境樣本中的細菌菌群種類非常豐富,而且優勢菌綱、優勢菌科和優勢菌屬在結構組成上具有高度的一致性。說明茅臺鎮醬香白酒釀造環境中的主要細菌菌群結構具有較高的相對穩定性,也表征了茅臺鎮在釀造醬酒活動過程中長期馴化環境微生物所形成固有的特征性菌群結構,為釀酒微生態結構的優化、穩定性奠定了基礎。
2.4 優勢細菌菌群與環境因子的關系
基于醬香型白酒釀造過程中的釀造微生物一部分來自于釀造環境中的優勢微生物,而且微生物也存在復雜的分類結構,因此有必要篩選出綱、科和屬水平下的優勢細菌(平均相對豐度≥1.00%),研究其與環境因子之間的相關性(圖4)。從茅臺鎮1~7輪次釀造環境樣本中檢測出的細菌在綱、科和屬水平上篩選出了48種優勢細菌類別,其中7種優勢細菌綱、19種優勢細菌科和22種優勢細菌屬。統計分析表明,環境溫度與16種優勢細菌相關性顯著(10種呈正相關,6種負相關),主要是Alphaproteobacteria綱及其亞類群和Bacilli綱及其亞類群。Alphaproteobacteria綱及其亞類群與溫度呈顯著正相關,包括Alphaproteobacteria(ρ=0.350)、Acetobacteraceae(ρ=0.488)、Sphingomonadaceae(ρ=0.283)、Caulobacteraceae(ρ=0.290)和Brevundimonas(ρ=0.284)。Bacilli綱中的Bacillaceae(ρ=-0.489)、Lentibacillus(ρ=-0.598)、Bacillus(ρ=-0.387)、Oceanobacillus(ρ=-0.419)、Thermoactinomycetaceae(ρ=0.284)和Kroppenstedtia(ρ=-0.347)與溫度顯著負相關,而Planococcaceae(ρ=0.291)、Leuconostocaceae(ρ=0.384)、Weissella(ρ=0.394)與溫度顯著正相關。環境濕度與7種優勢細菌相關性顯著(5種呈正相關,2種呈負相關),其中Gammaproteobacteria(ρ=0.342)、Enterobacteriaceae(ρ=0.376)、Escherichia-Shigella(ρ=0.366)、Enterobacter(ρ=0.367)和Pantoea(ρ=0.347)與濕度呈顯著正相關,Rhodospirillales(ρ=-0.363)、Acetobacteraceae(ρ=-0.298)呈負相關。Acetobacteraceae(ρ=-0.298)和Actinobacteria(ρ=-0.359)與濕度顯著負相關。降雨量與10種優勢細菌相關性顯著(2種呈正相關,8種呈負相關),顯著負相關的菌主要是Bacilli綱的大多數亞類群,例如Bacillaceae(ρ=-0.393)、Lentibacillus(ρ=-0.450)、Thermoactinomycetaceae(ρ=-0.451)和Lactobacillaceae(ρ=-0.325)等。Cronobacter(ρ=0.312)、Alphaproteobacteria(ρ=0.278)與降雨量呈顯著正相關。光照時長與20種優勢細菌相關性顯著(15種呈正相關,5種呈負相關),其中顯著負相關的菌有Enterobacteriaceae(ρ=-0.401)、Escherichia-Shigella(ρ=-0.381)、Enterobacter(ρ=-0.333)、Pantoea(ρ=-0.349)和Lentibacillus(ρ=-0.341);顯著正相關的菌主要是Bacilli綱及其亞類群和Actinobacteria綱及其亞類群,在Bacilli綱及其亞類群中主要是Planococcaceae(ρ=0.383)、Leuconostocaceae(ρ=0.390)、Weissella(ρ=0.425)、Carnobacteriaceae(ρ=0.367)等;Actinobacteria綱及其亞類群全部都與光照時長呈顯著正相關,包括Actinobacteria(ρ=0.418)、Micrococcaceae(ρ=0.323)、Kocuria(ρ=0.403)、Dermabacteraceae(ρ=0.453)、Brachybacterium(ρ=0.453)。大氣壓與5種優勢細菌相關性顯著(2種呈正相關,3種呈負相關),與大氣壓顯著負相關的菌群有Cronobacter(ρ=-0.314)、Pseudomonadaceae(ρ=-0.352)、Pseudomonas(ρ=0.313),與大氣壓呈顯著正相關的菌群有2個,分別是Lentibacillus(ρ=0.342)、Actinobacteria(ρ=0.418)。
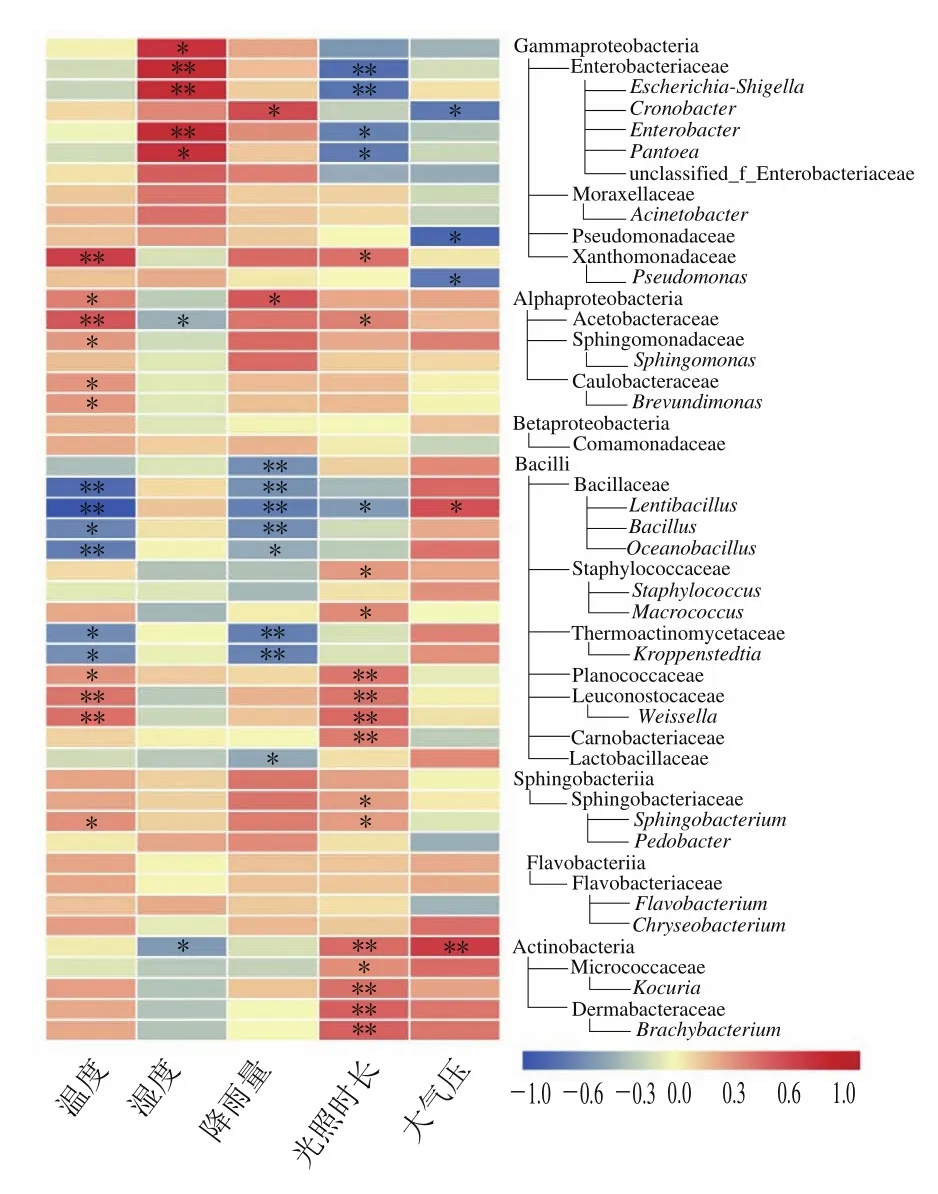
圖4 綱、科、屬水平優勢細菌菌群的相對豐度(平均相對豐度≥1.00%)與環境因子之間的Spearman等級相關系數的熱圖Fig.4 Heatmap of Spearman’s rank correlation coefficients between relative abundances of dominant bacterial classes, families and genera(average relative abundance ≥1.00%) and environmental factors
Bacillus和Weissella是白酒發酵過程中的主要功能細菌菌群,在多種香型白酒發酵過程中均有報道[30,23]。其中作為大曲重要核心細菌屬的Bacillus為關鍵的產酸和產香菌,可代謝4-甲基吡嗪、乙偶姻等白酒關鍵風味物質[19]。Weissella為高、中、低溫大曲和小曲中的主要細菌之一,可代謝產生乳酸、乙酸等有機酸類,是發酵的啟動劑[31]。研究發現,環境溫度是影響Bacillus[32]和Acetobacter[33]性能的重要原因之一,40 ℃條件下的Bacillus菌株比20 ℃條件下具有更多的高溫耐受性,代謝更多脂肪酸[32],其能加快乙醇在體內的代謝,降低白酒的醉度[34]。Wang Li等[24]發現Planococcaceae受氣候條件的調控較大,其可能通過產生其他次級代謝產物而影響白酒的質量和風味。本研究還發現該菌與環境溫度與光照時長正相關性顯著。
上述結果表明,環境因子與茅臺鎮釀造環境中大約73%的優勢細菌群落相關性顯著,其中環境溫度和光照時長對釀造環境中優勢細菌菌群結構起決定性調控作用,其次是濕度和降雨量,大氣壓對環境微生物的影響最小。進一步證明了茅臺鎮特有的氣候環境為參與醬香型白酒釀造的微生物菌群繁衍生息提供了適宜的條件,使釀造微生物得到了長期穩定的繁殖、生長、富集。
3 結 論
基于高通量測序技術及數理統計分析方法研究了茅臺鎮不同輪次釀造環境細菌菌群結構多樣性及環境因子對其的影響,在綱水平上共檢出33個細菌綱類,其中Gammaproteobacteria、Bacilli、Sphingobacteriia、Alphaproteobacteria、Actinobacteria、Flavobacteriia和Betaproteobacteria為優勢細菌綱,在科水平上共檢出153個細菌科類,優勢科有19個,包括Enterobacteriaceae、Sphingobacteriaceae、Bacillaceae、Flavobacteriaceae、Thermoactinomycetaceae、Planococcaceae等。其中Flavobacteriaceae、Planococcaceae、Bacteroidales_S24-7_group、Microbacteriaceae和Brucellaceae是目前尚未在白酒釀造環境中被認為是優勢菌的微生物科類。在釀造環境樣本中屬水平上一共檢出396個屬,平均相對豐度≥1.00%有22個,主要包括Sphingobacterium、Enterobacter、Pantoea、unclassified_f_Enterobacteriaceae、Acinetobacter、Oceanobacillus和Pseudomonas等。α多樣性分析結合t-檢驗發現茅臺鎮醬香型白酒7個釀造輪次期釀造環境細菌多樣性極其豐富,且只有7輪次與4輪次和6輪次環境細菌群落結構多樣性和物種多樣性存在差異。細菌α多樣性與環境因子存在一定程度的相關性,2輪次和3輪次釀造環境中細菌群落與溫度和濕度的相關性較顯著。運用Spearman相關性分析環境因子與釀造環境中的優勢細菌菌群之間的相關性,發現綱、科、屬水平的48種優勢細菌類群中,有35種與一種或多種環境因子具有顯著相關性,其中Gammaproteobacteria綱及其亞類群和Bacilli綱及其亞類群與5個環境因子均有顯著相關性,特別是溫度、濕度和光照時長對這兩個綱類的影響較大,其中主要包括Escherichia-Shigella、Enterobacter、Pantoea、Lentibacillus、Bacillus和Oceanobacillus等。Alphaproteobacteria綱中,Acetobacteraceae、Sphingomonadaceae、Caulobacteraceae、Brevundimonas與環境溫度正相關顯著。Sphingobacteriia綱及其亞類群中的Sphingobacterium與溫度和降雨量的相關性較顯著。Actinobacteria綱的Micrococcaceae、Kocuria、Dermabacteraceae、Brachybacterium均與光照時長呈顯著正相關。Betaproteobacteria綱及其亞類群和Flavobacteriia綱的Flavobacterium和Chryseobacterium受環境因子的影響最小。
本研究對茅臺鎮不同輪次釀造環境樣本的細菌群落結構進行了分析,對茅臺鎮環境中的細菌菌群結構更加了解,環境因子不僅調節細菌多樣性,還直接影響了細菌菌群結構組成及其功能,特別是環境溫度和光照時長。為充分認識釀造環境中的細菌菌群結構及其與環境因子之間的關系提供了基礎理論和學科依據。

