鐵調節蛋白2高表達對PC12細胞活力及鐵調節蛋白1表達水平的影響
王淑華 賈鳳菊 焦倩 傅琳 杜希恂 陳曦 姜宏
(青島大學基礎醫學院,山東省神經相關疾病的機制與重點防治實驗室,山東省沿海地區神經退變疾病協同創新中心,山東 青島 266071)
細胞鐵穩態是指細胞內鐵濃度維持動態平衡,鐵含量過多或過少都可能導致細胞損傷[1-2]。鐵穩態的調節主要依賴于鐵調節蛋白(IRPs),IRPs分為IRP1和IRP2兩種。研究發現IRP1主要與腎臟和肺組織特定細胞中的鐵反應元件(IRE)結合,IRP1基因敲除(IRP1-/-)小鼠則會出現紅細胞增多癥和肺動脈高壓[3];IRP2也可以與細胞中鐵轉運和儲存蛋白的IRE結構結合而發揮調節鐵代謝的作用[4],IRP2基因敲除(IRP2-/-)小鼠會出現貧血、鐵穩態失衡并且帶有神經退行性疾病癥狀(如姿勢異常、尾巴僵硬、步態不協調等)[5-6]。另外,IRP1-/-并IRP2-/-小鼠在胚胎期即可死亡[7]。研究發現,將IRP2高表達的人肺癌細胞H1299注射到裸鼠皮下,可通過調節鐵代謝促進腫瘤生長[8],但IRP2高表達對神經元細胞活力的影響目前尚無報道。
既往的研究結果表明,IRP2-/-小鼠中IRP1代償性表達增加[9],但同時也有研究報道結果顯示,IRP2和IRP1在各類癌細胞中的表達水平并不一致[10-11]。在MDA-MB-231乳腺癌細胞中IRP1以及IRP2蛋白的表達水平均顯示呈顯著性升高,但是在MDA-MB-175乳腺癌細胞中IRP1和IRP2蛋白的表達水平卻呈現相反的趨勢[12]。在神經退行性疾病當中,IRP2高表達對IRP1蛋白表達水平的影響并不明確,本研究旨在進一步探討高表達的IRP2對PC12細胞存活率以及細胞中IRP1蛋白表達的影響。
1 材料與方法
1.1 材料來源
PC12細胞購自中國科學院上海生命科學研究所;Vector空載質粒購自和元生物技術(上海)股份有限公司;MYC-IRP2質粒由實驗室前期構建; Lipofectamine 2000轉染試劑購自美國Invitrogen公司;MTT Formazan試劑盒購自美國Sigma公司;BCA蛋白定量試劑盒(Protein Assay Kit)購自江蘇康為世界生物科技有限公司;IRP1抗體和IRP2抗體購自美國Abcam公司;GAPDH抗體購自美國CST公司;羊抗兔IgG-HRP購自上海愛必信生科科技有限公司。
1.2 PC12細胞培養
將含有PC12細胞的凍存管從液氮罐取出后立即轉移到37 ℃水浴鍋中至完全融化,吸取凍存管中的PC12細胞懸液并轉移到含有5 mL完全培養基(DMEM培養基+體積分數0.10胎牛血清+體積分數0.01青鏈霉素混合液)的離心管中。然后用吸管吹打混勻后以1 000 r/min離心5 min,棄掉上清液。再次與5 mL完全培養基混勻,接種到培養瓶中,在37 ℃、含體積分數0.05 CO2的培養箱中培養。每2~3 d傳代1次,傳到第3代且細胞融合度達到90%時進行下一步實驗。
1.3 細胞轉染及分組
將培養好的細胞分別接種于96孔板(每組各設置5個復孔,用于MTT實驗)和12孔板(每組各設置3個復孔,用于免疫印跡分析)中,在細胞密度達到60%~70%時進行質粒轉染。轉染MYC-Vector空載質粒的細胞設為Vector組,轉染MYC-IRP2質粒的細胞設為IRP2組。分別將MYC-Vector空載質粒、MYC-IRP2質粒、Lip 2000與DMEM培養基混合,靜置5 min后將MYC-Vector空載質粒混合物及MYC-IRP2質粒混合物分別與Lip 2000混合物吹打混勻,靜置15~20 min后加到96孔板和12孔板的PC12細胞中轉染。細胞轉染6~8 h后觀察細胞形態,細胞有變圓趨勢時將培養液換成完全培養基。轉染48 h后根據實驗目的進行后面的MTT實驗或免疫印跡實驗。
1.4 MTT法檢測PC12細胞存活率
棄掉96孔板中的培養基,每孔加入5 g/L的MTT溶液20 μL,在培養箱中避光孵育4 h;棄上清液后,每孔均加入DMSO 100 μL,室溫下避光孵育10 min后;使用酶標儀檢測各孔在波長570 nm處的吸光度(A)值并進一步計算細胞存活率,細胞存活率(%)=AIRP2組/A對照組×100%。
1.5 免疫印跡法檢測PC12細胞中IRP2及IRP1的表達水平
對培養在12孔板中的Vector組和IRP2組細胞進行蛋白提取,使用BCA法檢測并計算上樣量,Vector組和IRP2組每個蛋白樣品的上樣量均為20 μg,然后加入5×上樣緩沖液混勻以后,金屬浴10 min以后進行SDS-PAGE凝膠電泳。然后以300 mA穩定電流轉膜90 min,以含體積分數0.10脫脂奶粉室溫封閉2 h,根據實驗目的在每個條帶分別對應加入IRP2、IRP1及GAPDH一抗4 ℃輕搖過夜。第2天于室溫下以TBST洗膜3次,每次10 min。然后羊抗兔二抗孵育1 h,TBST洗3次,每次10 min。最后用ECL發光液顯影,并用Image J軟件分析IRP2、IRP1和GAPDH條帶的灰度值,IRP2、IRP1的相對表達水平以IRP2/GAPDH比值和IRP1/GAPDH比值表示。
1.6 統計學分析
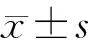
2 結 果
2.1 IRP2高表達對PC12細胞存活率的影響
Vector組和IRP2組PC12細胞存活率分別為(95.79±1.91)%和(81.71±2.98)%,與Vector組進行比較,IRP2組的細胞活力明顯降低(t=3.97,P<0.01)。
2.2 IRP2高表達對PC12細胞中IRP1表達水平的影響
Vector組IRP1和IRP2蛋白的表達水平分別為0.88±0.05、0.55±0.04,IRP2組IRP1和IRP2蛋白的表達水平分別為1.24±0.13、0.84±0.09,兩組比較,IRP1和IRP2蛋白的表達水平差異均具有顯著性(t=2.59、3.01,P<0.05)。見圖1。

A:兩組細胞中IRP2表達水平,B:兩組細胞中IRP1表達水平
3 討 論
IRPs在靶基因5′mRNA與非翻譯區的IRE結合,阻斷翻譯起始,或結合在靶基因3′mRNA附近,增強其穩定性[13],從而影響調節鐵代謝的靶蛋白,這些靶蛋白包括負責將鐵轉入細胞內的轉鐵蛋白受體1(TFR1)、二價金屬離子轉運體1(DMT1)、在細胞內儲存鐵的鐵蛋白以及負責轉出鐵的鐵轉出蛋白(FPN)。當外源性給予三價或二價鐵試劑處理導致細胞內高鐵時,IRPs與IRE結合力減弱,FPN和鐵蛋白表達增加,TFR1和DMT1表達減少,以降低胞內鐵含量;當外源性加入鐵螯合劑或誘導缺氧等因素誘導細胞內低鐵時,IRPs與IRE結合力增強,鐵蛋白與FPN表達減少,TFR1與DMT1表達增加以升高細胞內鐵含量[14]。研究發現,IRP2是大腦中鐵代謝的關鍵蛋白,可以調節鐵的吸收與利用、血紅蛋白的合成及影響氧氣運輸等,以直接或間接的方式參與肺癌、乳腺癌以及神經退行性疾病的發展過程[14]。研究顯示IRP2與帕金森病(PD)有關,IRP2-/-小鼠TFR1和DMT1的表達水平明顯降低,FPN和鐵蛋白的表達水平增高,誘導黑質鐵沉積,加劇多巴胺能神經元損傷,導致紋狀體中多巴胺的釋放減少,從而出現PD相關癥狀[15-17]。在腫瘤細胞中,IRP2也可通過調節鐵代謝促進腫瘤細胞死亡[18]。因此,我們推測IRP-IRE系統是通過調控TFR1、DMT1、鐵蛋白、FPN等鐵代謝相關蛋白的表達影響PD的發生和發展[15]。
本研究結果顯示,IRP2高表達后細胞存活率降低,說明IRP2的高表達對PC12細胞具有損傷作用,其損傷機制可能與IRP-IRE調節有關。一方面,IRP2表達上調后,IRP2與鐵代謝相關基因上的IRE莖環結構結合,干擾細胞內鐵穩態,進而導致細胞存活率降低。另一方面,IRP2還可以與抑癌基因P53、缺氧誘導因子[19]、影響腫瘤和神經系統功能的線粒體烏頭酸酶[20]、影響血紅素合成的δ-氨基-γ-酮戊酸合成酶[21]等基因上的IRE莖環結構結合,影響這些基因的表達,可能對細胞的存活率產生影響,但作用機制仍需進一步的研究。
據報道,IRP1也可通過與IRE結合而影響鐵代謝相關蛋白的表達,其機制與IRP2相似,這可能與兩者同源性較高有關[13],IRP1與IRP2有64%的氨基酸序列重疊[22-23]。但是兩者在鐵代謝的調節作用上存在差異,IRP2在鐵充足的細胞中可通過泛素化降解調節鐵代謝[22],IRP1可以特別地結合鐵硫簇感知細胞內鐵水平,但調節鐵穩態的能力相較IRP2弱[24]。本研究的實驗結果顯示,在PC12細胞中高表達IRP2后IRP1蛋白表達水平升高,提示IRP2高表達或可促進IRP1蛋白水平的表達。目前IRP1表達水平增高的作用并不明確,它可能起到保護細胞的作用,因為有研究表明在阿爾茨海默病的典型標志物——淀粉樣前體蛋白(APP)的5′端的非翻譯區亦存在IRE樣RNA莖環,在人源神經細胞中IRP1可以選擇性地與該莖環結構結合并抑制其翻譯,減少細胞損傷,進而發揮神經保護的作用[25]。但也有研究指出,IRP1過表達可導致細胞鐵代謝紊亂,進而導致鐵分布異常[26],有可能造成器官或機體損傷。因此,IRP1增多對細胞的作用仍需進一步的研究。本實驗結果顯示,在PC12細胞中,當IRP2蛋白水平升高時,IRP1蛋白表達水平亦增高。這與在乳腺癌腫瘤細胞中得到的結果一致,即IRP2高表達導致腫瘤細胞生長過快時,可引起IRP1高表達來發揮抑制腫瘤生長的作用[12]。也有研究發現,IRP2與IRP1蛋白的表達呈相反趨勢,在IRP2-/-小鼠的小腦、前腦以及腦干細胞中IRP1水平升高。可能與IRP1能部分代償IRP2的功能有關[9],因為盡管IRP2對鐵代謝相關蛋白的調節起主導作用,而IRP1可能相當于潛在的“替補部隊”,來彌補IRP2的缺失以維持機體鐵代謝穩定[9]。總之,IRP2與IRP1的關系并不明確,可能因細胞來源、在體或離體條件的不同而存在差異。
綜上所述,IRP2高表達對PC12細胞具有損傷作用,同時IRP2高表達也可引起PC12細胞中的IRP1表達升高,本研究為進一步明確IRP2與IRP1的關系提供了實驗依據,對闡明IRP2與IRP1在鐵代謝紊亂相關疾病中的作用具有一定的科學意義。
利益沖突聲明:所有作者聲明不存在利益沖突。
ConflictsofInterest: All authors disclose no relevant conflicts of interest.
作者貢獻:王淑華、賈鳳菊、陳曦、姜宏參與了實驗設計;王淑華、焦倩、傅琳、杜希恂參與了論文的寫作和修改。所有作者均閱讀并同意發表該論文。
Contributions: The study was designed byWANGShuhua,JIAFengju,CHENXi, andJIANGHong. The manuscript was drafted and revised byWANGShuhua,JIAOQian,FULin, andDUXixun. All the authors have read the last version of the paper and consented submission.

