環糊精葡萄糖基轉移酶在天然產物糖基化修飾中的應用
張國寧 馮婧嫻 楊穎博 陳萬生,3 肖瑩
(1. 上海中醫藥大學中藥研究所中藥資源與生物技術中心,上海 201203;2. 上海圖鋒醫藥科技有限公司,上海 201203;3. 海軍軍醫大學附屬長征醫院醫療保障中心,上海 200003)
環糊精(CDs)是一種具有親水外部和疏水中心腔的環狀低聚糖,由6-100個左右的葡萄糖單元組成,由于環糊精分子具有獨特的疏水空腔結構,能包含疏水性客體分子,從而改變客體分子的溶解度、穩定性等物理化學性質,因此在醫藥、農業、食品、紡織、環保、化妝品、生物技術和分析化學等領域具有廣泛的應用[1-2],而可催化淀粉或多糖中α-1, 4鍵斷裂并環化形成CDs的環糊精葡萄糖基轉 移 酶(cyclodextrin glycosyltransferase,CGTase,EC 2.4.1.19)受到廣泛關注。CGTase可以催化4種不同的反應類型,包括環化反應、耦合反應、歧化反應和水解反應。其中CGTase特有的環化反應主要應用于環糊精的制備[3],而利用歧化反應和偶合反應的轉糖基作用改造天然產物的性質的研究近年來顯現出良好的應用前景。本文結合CGTase的來源、蛋白結構及功能等,重點對近年來CGTase在天然產物糖基化修飾中的應用進行綜述及展望。
1 CGTase的來源
大多數CGTase是一種細菌胞外酶,自從第一個CGTase基因在浸麻芽孢桿菌(Bacillus macerans)中被鑒定[4],到目前為止已經發現了多種細菌來源的CGTase,包括芽孢桿菌(Bacillus)、類芽孢桿菌(Paenibacillus)、克雷伯氏菌(Klebsiella)、熱厭氧菌(Thermoanaerobacterium)、 短 桿 菌(Bacillus brevis)和放線菌(Actinomycetes)[5-6]等。古菌和真菌也能產生CGTase[7-8]。產生CGTase的微生物主要存在于湖水、土壤、溫泉、面粉業廢水和腐爛的土豆中[9],特殊環境可以篩選具有特殊性能的CGTase,如從溫泉環境中分離出產熱穩定CGTase的極熱厭氧古生菌菌株B1001[10],極大地拓展了CGTase的應用范圍。
2 CGTase蛋白結構及催化機制
2.1 CGTase蛋白結構
CGTase屬于α-淀粉酶家族,隸屬于糖基水解酶13家族,具有(α/β)8桶狀蛋白結構[11]。1991年首個來自于環狀芽孢桿菌(Bacillus circulans)的CGTase晶體結構被報道[12],為CGTase蛋白結構解析奠定了基礎。目前已經有許多CGTase結構被報道,它們結構均非常相似,都包含5個結構域:A、B、C、D和E。與α-淀粉酶家族的結構域(A、B和C)相比,CGTase包含兩個額外的D域和E域[13](圖1)。結構域A包含8條α-螺旋和8條平行的β-折疊氨基酸,稱為(α/β)8桶狀催化域[14],被認為是催化核心區域[4],關鍵催化殘基位于β鏈的c端。結構域B是結構域aβ-strand 3和α-helix3之間的突起環,將 A 域分成 A1和 A2域[15](圖 1),B 域包含 44-133個氨基酸殘基,在底物結合中起重要作用[4]。Leemhuis等[16]在B域表面引入新的鹽橋顯著提高了圓環桿菌251 CGTase的穩定性。C域有1個麥芽糖結合位點,參與底物結合[4]。E域被認為是一個原始的淀粉結合域[4],有2個麥芽糖結合位點(MBS),分別負責淀粉結合(MBS1)和引導底物進入活性位點(MBS2),有文獻報道E域上MBS2受損(Tyr633Ala)會導致產物的非競爭性抑制顯著降低[17]。結構域D的功能尚不明確,但有研究表明C和D域與E域的正確空間定位有關[18]。此外最近關于CGTase抗病研究發現,結構域D是CGTase水解活性的關鍵結構域,結構域A1和C是CGTase誘導植物抗病的關鍵結構域[19]。
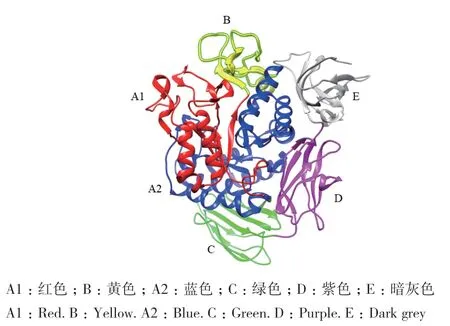
圖1 CGTase蛋白結構(PDB登錄碼:4JCL)Fig. 1 CGTase protein structure(PDB accession number:4JCL)
目前關于CGTase的結構改造研究主要聚焦于環糊精和L-抗壞血酸(AA)糖基化產物2-O-葡萄糖基-L-抗壞血酸(AA-2G)的定向合成制備。Li等[20]將環狀芽孢桿菌(Bacillus circulans)STB01的CGTase的鈣結合位點III(CaIII)氨基酸殘基Asp 577進行定點突變提高了其對麥芽糖糊精的親和力和環化反應的催化效率;同時研究較多的還有通過定點突變增加 CGTase對 α-環糊精[21]、β-環糊精[22]、γ-環糊精[23]的產物專屬性。Tao 等[24]對Bacillus stearothermophilus NO2的CGTase的9個殘基進行迭代飽和誘變,增強了合成AA-2G的特異性,是迄今為止高產AA-2G的最優策略;Han等[25]對Paenibacillus macerans的CGTase的6個亞位殘基(Y167,G179,G180和N193)進行了迭代飽和誘變,通過提高CGTase對麥芽糖糊精的特異性,提升了AA-2G的產量。
2.2 CGTase的催化機制
CGTase主要催化4種反應類型,包括3種轉糖基反應(歧化反應、環化反應和偶合反應)及水解反應。環化反應是CGTase的特征反應,是一種分子內轉糖基反應,原理是將直鏈麥芽低聚糖上非還原末端的O-4或C-4轉移到同一直鏈上還原末端的C-1或O-1上(圖2-A),形成6-8個糖基的環狀結構,分別對應α-、β-和γ-環糊精;偶合反應是環化反應的逆反應,可以將環糊精的環打開,然后轉移到直鏈麥芽低聚糖上(圖2-B);歧化反應是先把一個直鏈麥芽低聚糖切斷,然后將其中一段轉移到另外的直鏈受體上(圖2-C)[9]。與天然產物的糖基化相關的主要是偶合反應和歧化反應,兩者均為分子間轉糖基反應,例如通過CGTase將AA糖基化合成AA-2G。水解反應則是將直鏈淀粉分子切斷,然后兩段均轉移到水分子上(圖2-D),有報道利用CGTase水解真菌細胞壁β-1, 4糖苷鍵(幾丁質)的功能,增強了棉花植物抵御真菌大麗輪枝菌導致的黃萎病的抗病能力[19]。需要指出的是,在以CGTase為催化酶進行糖基化反應的過程中,若以直鏈麥芽糖為糖供體,轉糖基反應主要是以歧化反應為主[25-26],若以環糊精為糖供體時,轉糖基反應以歧化反應和偶合反應為主[26],而水解反應微弱,在反應前期或后期均會發生。
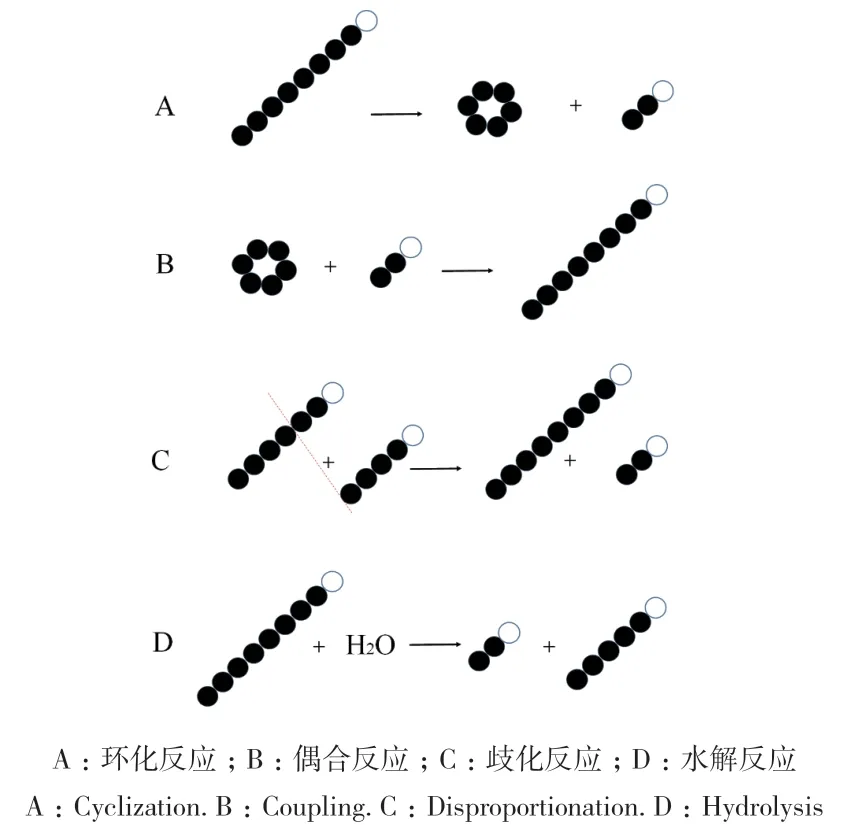
圖2 CGTase催化4種反應類型Fig. 2 CGTase catalyzes four types of reactions
α-淀粉酶轉糖苷化催化機理于1953年由美國科學家Koshland首次提出[27],稱為雙取代機制。α-淀粉酶家族中的CGTase有7個最保守的氨基酸殘基聚集在(α/β)8桶狀蛋白結構表面底物結合口袋的底部,位于催化位點的中心[27],其中Asp229、Glu257和Asp328是絕對保守的3個關鍵氨基酸殘基。在雙取代反應中,Glu257是質子供體,Asp229是一般的堿基或親核試劑,而Asp328參與底物結合,可能對Glu257的pKa升高有重要作用[28]。具體催化過程如圖3所示:第一步,由Glu257提供質子,CGTase在底物淀粉上裂解一個α-1, 4糖苷鍵,并與Asp229形成一個共價的β-1, 4糖基酶中間體;第二步,中間體的共價鍵裂解,受體被Glu257所激活,隨后攻擊共價連接的中間產物α-1, 4糖苷鍵并形成新的產物[29]。受體可以是水、另一個糖基的4-OH基團(4位的羥基)或其它化合物的羥基基團。此外,CGTase的環化反應除了與轉糖基反應原理相似外,還有其它的氨基酸殘基參與了中間產物的環化,使得其還原末端與非還原末端的4-OH基團形成共價鍵而形成環糊精。
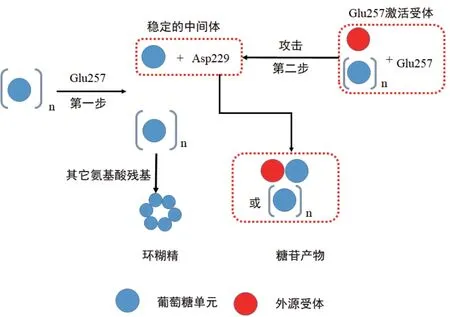
圖3 CGTase催化機制示意圖Fig. 3 Schematic diagram of the catalytic mechanism of CGTase
3 CGTase在天然產物糖基化修飾中的應用
轉糖基化是將糖基從供體轉移到受體的過程。與化學合成相比,通過酶促反應進行糖基化修飾具有反應步驟簡單、空間位阻低、區域專一性高、副產物少、后處理簡單、生產成本低、反應條件溫和及環境友好等優點[9]。通過CGTase的轉糖基功能催化天然產物底物合成糖基化產物,可有效改善天然產物的原有性質,包括提高水溶性、增強生物活性、改善口感、提高穩定性等(圖4),目前已經廣泛應用于食品、制藥、化妝品等各個領域,展現出良好的應用前景。
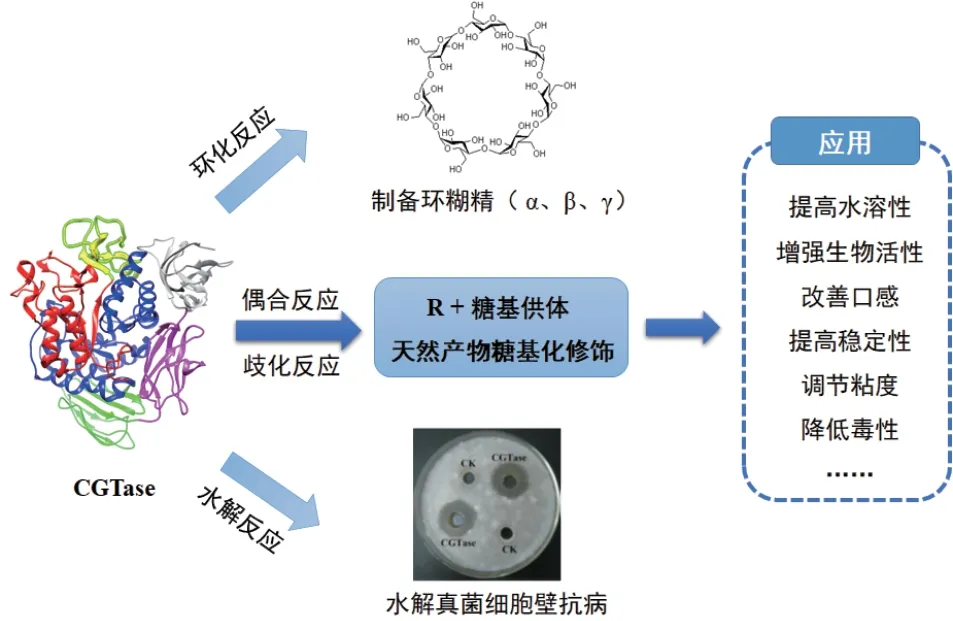
圖4 CGTase的應用Fig. 4 Application of CGTase[19]
3.1 提高天然產物溶解度
溶解度是化合物的重要化學特性,許多具有應用價值的化合物因溶解度低而嚴重限制了其應用。糖基化是增加化合物溶解度的重要方法,使用CGTase進行糖基化修飾以改變化合物溶解度相關研究已有較多報道。如黃酮類化合物山奈酚-3-o-β-d-吡喃葡萄糖(astragalin,AS)具有抗氧化、抗腫瘤、抗人類免疫缺陷病毒(HIV)等生物活性,但因水溶性低限制了其應用。Choung等[30]使用CGTase(Toruzyme)進行糖基化修飾,糖苷產物G1-AS的溶解度提高了65倍;同理,白藜蘆醇具有抗炎、抗癌、免疫調節等生物活性,也因溶解度低影響其生物利用度,Marié等[31]使用來自于Thermoanaerobacter sp.的CGTase催化白藜蘆醇,其糖苷產物在水中的溶解度提高了65倍。表1列舉了近年來利用CGTase糖基化修飾提高天然產物溶解度的應用實例。
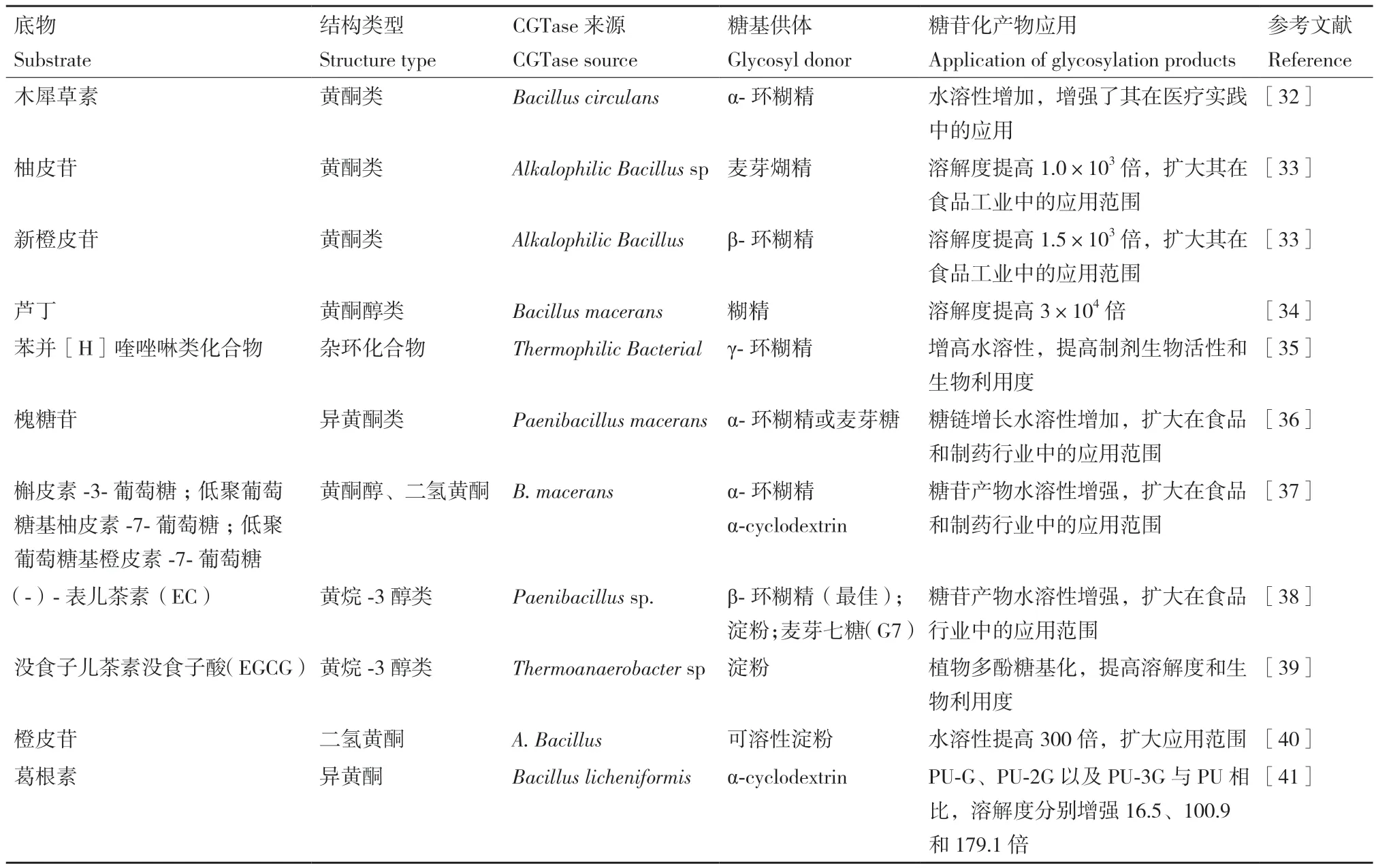
表1 CGTase糖基化修飾提高天然產物溶解度的應用Table 1 Application of CGTase glycosylation modification to improve the solubility of natural products
3.2 改善或增強天然產物生物活性
許多天然化合物本身具有生物活性,其糖基化產物可以進一步增強或者改善生物活性,擴大應用范圍。Huang等[41]使用地衣芽孢桿菌(Bacillus licheniformis)CGTase為催化劑,以α-環糊精為糖供體催化PU,其糖苷(PU-G)比PU具有更強的抗骨質疏松活性;Choung等[30]以麥芽糖為供糖體,山奈酚-3-o-β-d-吡喃葡萄糖(AS)為受體,糖苷產物G1-AS抗炎活性與醛糖還原酶抑制活性顯著增強;表2列舉了使用CGTase糖基化修飾以增強或改善天然產物生物活性的相關應用。

表2 CGTase糖基化修飾增強或改善天然產物生物活性的應用Table 2 Application of CGTase glycosylation modification to improve the bioactivity of natural products
3.3 改善化合物口感
口感是天然產物在食品及醫藥應用中一項重要的評價指標,糖基化可以有效改善某些天然產物的苦味。甜菊糖苷是從菊科植物甜葉菊Stevia Rebaudia的葉子中提取出來的一種糖苷,甜度為蔗糖的250-450倍,被譽為“世界第三糖源”,但是帶有一定程度的苦味[56]。Abelian等[57]使用來自于嗜溫(mesophilic)、嗜熱(alkaliphilic)、嗜堿(thermophilic)和嗜鹽(halophilic)桿菌的CGTase對甜菊糖苷進行糖基化修飾,顯著降低了其苦味。Yu等[58]從甜菊種植土壤中分離到一株產CGTase的芽孢桿菌(Paenibacillus sp. cgmcc5316),以淀粉為糖基供體,將甜菊糖苷轉化為單糖基化甜菊糖苷,甜味提高了35.4%。Kim等[59]使用來源于B.stearothermophilus、B.macerans的CGTase催化人參皂苷Rb1、Rc、Re、Rg1,以糊精為供糖體,產物苦味明顯降低。表3列舉了使用CGTase糖基化修飾以改善天然產物口感的相關應用。

表3 CGTase糖基化修飾改善天然產物口感的應用Table 3 Application of CGTase glycosylation modification to improve the taste of natural products
3.4 其他
CGTase糖基化修飾除了提高天然產物的水溶性、增強生物活性、改善口感外,還具有其它多種應用,包括提高穩定性、調節粘度、降低毒性等,也可同時具有多方面的應用。例如:L-抗壞血酸(維生素C)不穩定,容易被氧化,在實際生產中可利用CGTase的轉糖基活性,將葡萄糖基連接在L-抗壞血酸的2號位C上,得到的維生素C衍生物AA-2G穩定性顯著提高,水溶性和抗氧化活性增強,在人體內可發揮L-抗壞血酸的多種生理功能[64-65];使用來自于Thermoanaerobacter sp.的CGTase,以蔗糖為底物,淀粉為糖供體,合成的偶聯糖是一種非致齲甜味劑,也可用作粘度調節劑,且比其他還原糖混合物更穩定[66]。此外,Moon等[67]以糊精為糖供體,使用來源于Thermoanaerobacter sp的CGTase催化人參皂苷F1,α-糖基化人參皂苷F1(G1-F1)顯示出比人參皂苷F1更高的溶解性、對人皮膚成纖維細胞(HDF)更低的細胞毒性、更高的酪氨酸酶活性和紫外線誘導的對基質金屬蛋白酶-1(MMP-1)的抑制活性。隨著越來越多的CGTase發現以及蛋白質工程對酶的改造,CGTase的糖基化應用將更加廣泛。
4 總結和展望
盡管目前已獲得多種不同來源的CGTase,但催化效率高、穩定性好、專屬性強的新型CGTase仍有待發現,而基因組測序及生物信息學的進步為新型CGTase的挖掘帶來了前所未有的機遇,CGTase的應用范圍將隨之進一步拓寬。當前除了制備環糊精,CGTase工業化應用主要集中在維生素C糖基化產物AA-2G的制備。通過蛋白質工程的策略[68]對天然CGTase進行改造,提高催化效率或對糖基供體的特異選擇性等以提升AA-2G的產量是當前研究的一個熱點,極大地推進了該應用的工業化進程[24-25,69]并將持續得到關注。
利用CGTase對天然產物進行糖基化修飾以提高穩定性、增加生物活性、提高安全性等已取得較多研究成果,但是均僅限于實驗室,與工業生產還有很大的距離。其重要原因之一是CGTase對特異底物和催化產物的選擇性均較低,應用于工業化生產底物轉化率低,目標產物的精準合成難以實現,副產物較多,生產成本較高。CGTase的底物雜泛性較高,單個CGTase可以同時催化幾種不同的底物,如來源于Thermoanaerobacter sp.的CGTase可以催化白藜蘆醇[31,51]、對苯二酚(HQ)[44]等 ;而多種不同來源的CGTase對某種底物也可能都具有催化活性[61,63];但同時也存在不同來源的 CGTase催化天然產物的底物特異性差異巨大的情況。因此,解析清楚CGTase底物特異性的催化機制是實現以CGTase作為催化元件的天然產物定向改造,推進其工業化進程的首要任務。在此基礎上可以充分調用或設計CGTase實現目標產物的定向高效合成,將CGTase在天然產物糖基化修飾中的應用推向深入和新高度。

