MALAT1介導β-catenin通路參與Salvinorin A減輕腦卒中后血腦屏障損傷的機制
馬曉曉,董海平,周薇,忻紀華,王震虹
腦卒中是世界范圍內人類死亡和殘疾的主要原因,是僅次于缺血性心臟病的第二大死亡原因。根據最新發布的《2016年腦卒中流行病學報告》顯示,腦卒中已成為中國居民第一致殘原因。在所有腦卒中病例中,高達86%是缺血性腦卒中[1]。眾所周知,在缺血性腦卒中期間血液供應受損后出現的低氧和低葡萄糖等狀態,導致血腦屏障(blood brain barrier,BBB)破壞,形成血管源性水腫并發生出血轉化[2],后續出現神經元損傷[3]。因此,BBB的保護已成為預防缺血性腦卒中腦血管功能障礙的重要治療策略。
κ阿片受體(kappa opioid receptor,KOR)在人類和動物的大腦組織中分布廣泛,不僅在腦皮質和海馬紋狀體等部位表達豐富[4],在腦血管內皮中也高水平地表達并發揮重要的生物學功能[5]。近期研究表明,KOR激動劑可以有效地減輕腦缺血再灌注后的神經損傷和腦水腫[6],保護BBB的功能[7]。丹酚A(salvinorin A,SA)作為一種短效的高選擇性KOR激動劑,可以容易地通過BBB,安全性高,對于腦缺血再灌注損傷(ischemia-reperfusion injury,IRI)機制的研究具有獨特的優勢[6]。腦血管內皮細胞作為BBB最基本的組成結構,其在IRI中起到了關鍵性作用,內皮細胞功能改善是IRI后BBB穩定的基石。因此,本研究將針對腦血管內皮細胞參與SA對IRI后的腦保護和BBB改善的機制進行闡明。
現有的研究表明,非編碼RNA(noncoding RNAs,NcRNAs),包括長鏈非編碼RNAs(long noncoding RNAs,LncRNAs)、環狀RNAs(circular RNAs,CircRNAs)和微RNAs(mini RNAS,MiRNAs)均參與了IRI的病理發展,可作為生物標志物、治療靶點或預后指標[8]。LncRNA-MALAT1是最近才被研究發現在內皮細胞上發揮重要作用的LcnRNA,其作用和內皮細胞的生長、炎癥和增殖以及細胞緊密連接均有關系[9]。研究表明,MALAT1在缺血刺激后明顯增加,并參與血管內皮細胞損傷和腦微血管完整性的調控[10-11]。MALAT1定位于細胞核參與mRNA 前體可變剪切,對mRNAs具有調節吸附功能,進而發揮其下游功能。β-catenin信號通路是中樞神經系統血管形成、BBB形成的基礎[12-13]。最近有研究表明,內皮細胞β-catenin信號對于維持成熟BBB的完整性是必需的,并且在腦卒中患者中可檢測到β-catenin水平的降低和連接蛋白claudin-1的缺失[14]。
因此,本研究采用大鼠大腦中動脈閉塞(middle cerebral artery occlusion,MCAO)模型和腦血管內皮細胞糖氧剝奪(oxygen-glucose deprivation,OGD)模型闡明了SA在缺血再灌注導致的BBB損傷中的保護作用,并探討SA通過促進內皮細胞中MALAT1表達,進而調控β-catenin的表達從而減輕內皮細胞損傷,改善BBB功能的作用。
1 材料與方法
1.1 材料 實驗動物:雄性SD大鼠(180~200 g),購自上海交通大學實驗動物中心[SYXK(滬)2018-0028]。人腦微血管內皮細胞(human brain microvascular endothelial cells,HBMECs),購自美國ScienCell。主要實驗藥物、試劑與儀器:SA(Sigma,美國);NB(Sigma,美國);伊文思藍試劑(Evans Blue,EB,Sigma-Aldrich, 美國);Cell counting kit-8(Dojindo, 日本);一抗ZO-1 、occludin (Proteintech,美國),一抗claudin-5、β-catenin、actin (Abcam,英國);二抗和DAPI(ZSGB-Bio,中國);Annexin V-FITC/PI 雙染細胞凋亡檢測試劑盒(Yeasen,美國);siRNA 質粒(武漢樞密腦科學技術有限公司,中國);大鼠線栓(北京西濃科技有限公司);化學天平(BS110S, Sartourius,德國);二氧化碳培養箱、細胞培養箱(Thermo Fisher Scientific,美國);熒光顯微鏡(Ti2E,尼康,日本)。
1.2 方法
1.2.1 MCAO模型制作 在本研究中,使用10%水合氯醛(0.4 mL/100 g)大鼠腹腔注射麻醉后,分離大鼠右側頸總動脈(common carotid artery,CCA)、頸內動脈(internal carotid artery,ICA)和頸外動脈(external carotid artery,ECA)。將圓形尖的單絲尼龍線栓經ECA殘端插入ICA,放置線栓后將頸總動脈的絲線結扎固定,阻斷大腦中動脈起點90 min后恢復血流灌注。整個手術過程中使用加熱毯和加熱燈將直腸溫度維持在(37.0±0.8)℃。24 h后參照Bederson 評分評估大鼠腦梗死后神經功能障礙。
1.2.2 動物分組及處理 實驗動物分成4組(每組15只),隨機分組如下:SH組(假手術組);MCAO組(大鼠中動脈栓塞組);SA組(salvinorin A組+MCAO組);NB組(KOR拮抗劑組+SA+MCAO組)。SH組大鼠進行頸部切口及血管分離操作,不放置線栓。MCAO組采用線栓阻斷一側頸內中動脈90 min后拔除線栓恢復血流再灌注。SA組為進行MCAO操作過程中于線栓置入后即刻經尾靜脈注射SA(20 μg/kg)。NB組為SA前30 min使用KOR拮抗劑norbinaltorphimine (NB,4 mg/kg,尾靜脈注射),其余同SA組操作。根據本研究以往文獻中使用的有效劑量選擇本次藥物劑量[15]。
1.2.3 運動神經功能檢測 大鼠在MCAO術后1、2、5 d,用改良大鼠神經功能缺損評分(modified neurological severity score,mNSS)測定大鼠的神經功能狀況。如前所述[16],mNSS被認為是大鼠運動、反射、感覺和平衡的評價標準。主要行為終點為神經綜合評分(1~6分:輕度損傷;7~12分:中度損傷;13~18分:嚴重損傷)。
1.2.4 腦水腫檢測 采用干濕法測定大鼠MCAO后24 h的腦含水量(brain water content,BWC)以便量化腦水腫。取大鼠缺血腦半球,采用化學天平測定濕重,然后放入烤箱中烘烤(110 ℃,24 h)得到干重。通過下列公式:腦水增益%=(濕重-干重)/濕重×100%計算得出BWC值。
1.2.5 BBB通透性檢測 使用伊文思藍試劑(Evans Blue,EB)測量BBB的完整性。MCAO后24 h,大鼠尾靜脈注射2% EB(4 mL/kg),循環2 h后,用0.9% NaCl經口灌注至右心房流出液清晰。然后分離腦梗側腦半球,稱重,并在37 ℃水浴的甲酰胺溶液中孵育。48 h后,1 000 g離心15 min,分離上清。最后,用分光光度計在632 nm波長對樣品進行檢測,并測量EB滲出量。
1.2.6 細胞培養和分組 在100 mm培養皿中按照106個/孔的密度,將細胞置于含10%胎牛血清(fetal calf serum,FBS)、1%青霉素和鏈霉素溶液的RPMI 1640培養基中培養,置于加濕培養箱(37 ℃、5% CO2)中培養。siRNA轉染細胞:將細胞按50%的融合度接種到24孔板,加入培養基DMEM+10%FBS。按照說明將siRNA-轉染試劑混合液加入含有細胞及原培養液(約含400 μL)的孔中,在37 ℃的CO2培養箱中培養。6 h后將培養基換為含血清的完全培養基。將HBMECs隨機分為5組: 空白對照組(Blank組)、糖氧剝奪組(OGD組)、SA組(SA+OGD組)、M組(MALAT1 siRNA+OGD組)、SA+M組(SA+MALAT1 siRNA+OGD組)。SA組為OGD復氧即刻細胞培養中加入SA(2 uM), M組為MALAT1特異性小干擾RNA(siRNA,100 nM)轉染細胞48 h后進行OGD處理,SA+M組中細胞轉染同M組處理,OGD復氧即可加入SA。
1.2.7 OGD模型 棄去細胞完全培養液,以D-Hank’s沖洗細胞兩遍,換 Kreb’s 溶液(NaCl 119 mmol/L、KCl 4.7 mmol/ L、KH2PO41. 2 mmol/L、NaHCO325 mmol/L、 CaCl22.5 mmol/L、MgCl21 mmol/L);置于37 ℃、85% N2+5% CO2+0.02%~0.2% O2密閉缺氧箱中培養6 h,之后更換培養基為完全培養液,并進行 5% CO2+ 95% 空氣通氣復氧24 h。
1.2.8 細胞活性及凋亡檢測 使用細胞計數試劑盒-8(cell counting kit-8,CCK-8)檢測細胞相對活性,96孔板中每孔按4×103個細胞的密度接種細胞(每組設置2個復孔),待細胞貼壁后繼續在細胞培養箱中培養24 h;進行OGD模型處理,復氧24 h;每孔中加入新鮮配制的含 10 μL的毒性檢測液CCK-8,并置于培養箱中繼續培養4 h ;使用酶標儀測波長為450 nm的光密度(optical density,OD)值,按公式計算細胞相對活性=[(對照組OD-實驗組OD)/對照組 OD] ×100%。使用流式細胞術檢測細胞凋亡率(AnnexinV-FITC/PI雙染法):收集細胞,用預冷的1×PBS洗滌細胞2次,2 000 rpm、4 ℃離心5 min,收集沉淀細胞并重懸;加入500 μL的1×Binding Buffer重懸浮細胞;Annexin V-FITC標記:加入5 μL Annexin V-FITC混勻后,避光,室溫孵育15 min;PI標記:上機前5 min加入5 μL Propidium Iodide,混勻,室溫、避光;上機前,加入200 μL 1×Binding Buffer,進行流式細胞檢測;用流式細胞儀檢測:Annexin V-FITC的綠色熒光通過FITC通道(FL1)檢測,激發波長Ex=為488 nm,發射波長Em=525 nm;PI的紅色熒光通過PI通道(FL2或FL3)檢測,建議使用FL3,激發波長Ex=535 nm,發射波長Em=615 nm。此外,應使用未經凋亡誘導處理的正常細胞,作為Blank組進行熒光補償調節去除光譜重疊和設定十字門的位置。
1.2.9 免疫熒光檢測 制備細胞爬片,用4%多聚甲醛固定細胞,使用含有0.1% Triton X-100和5%山羊血清的PBS封閉1 h,然后用一抗ZO-1(1∶50), occludin(1∶50)和claudin-5(1∶100)于4 ℃冰箱孵育過夜。0.3% PBST溶液洗片3次,加入與FITC結合的二抗(1∶100)避光室溫孵育細胞1 h。0.3% PBST溶液洗片3次,用含DAPI的封片劑封片。使用熒光顯微鏡拍攝熒光圖像。
1.2.10 內皮細胞通透性 用Transwell檢測內皮細胞通透性,每個遷移小室加入100 μL培養基含1×105個細胞,下室孔中加入600 μL培養基,24 h后分組造模處理,造模處理完成后每個遷移小室加入10 μL FITC-BSA(1 mg/mL),繼續培養2 h,取100 μL下室孔中的培養基,用熒光分光光度計485/525 nm檢測FITC-BSA漏過情況。
1.2.11 蛋白質印跡(Western Blot)分析 收集細胞樣本,裂解液裂解后使用BCA法測定樣品蛋白濃度,蛋白變性后可置于-20 ℃冰箱保存。根據目的蛋白分子量大小選用合適濃度的蛋白電泳膠,進行蛋白電泳,轉膜結束后室溫封閉1 h。分別使用相應一抗(β-catenin、actin:1∶1 000)孵育,放入4 ℃搖床孵育過夜。二抗孵育后(1∶5 000)用ECL顯影液顯影,用Bio-Rad ChemidocXRS+成像系統記錄顯影結果。使用Image J軟件讀取條帶灰度值,計算并比較目的蛋白表達變化。
1.2.12 實時熒光定量PCR分析 設計MALAT1引物(LcnRNA MALAT1-hF GCTCTGTGGTGTGGG-ATTGA; LcnRNA MALAT1-hR GTGGCAAAATGG-CGGACTTT)構建MALAT1 siRNA,細胞轉染48 h后進行定量PCR檢測,以評估不同siRNA的效率。根據試劑盒說明,使用Trizol試劑提取細胞總RNA,檢測濃度。取500 ng總RNA作為模板,用cDNA第一鏈合成試劑盒合成cDNA。用去離子水將cDNA溶液稀釋至濃度為100 ng/μL,按照試劑盒說明操作,根據反應的CT值,計算并統計數據。
2 結 果
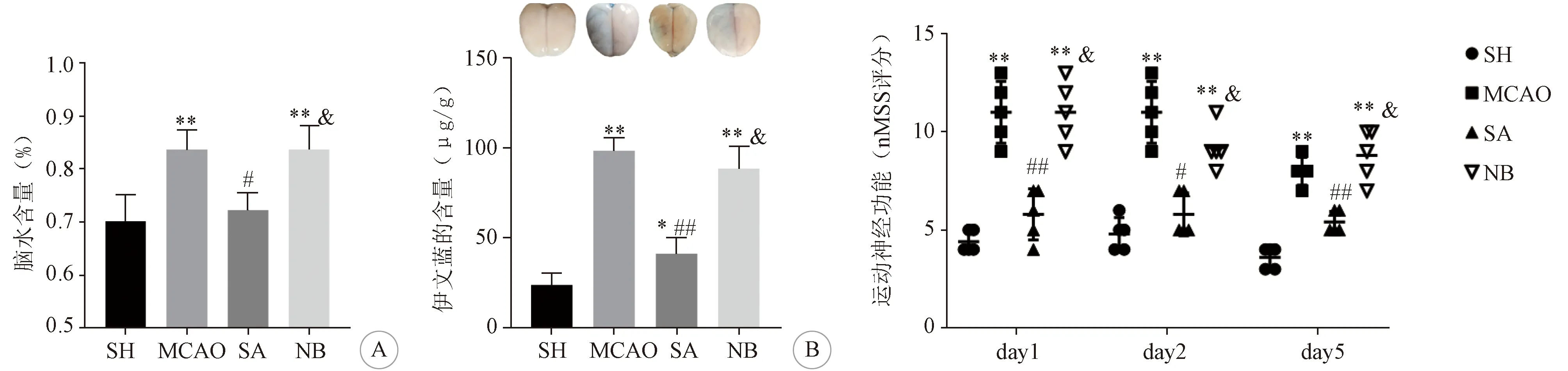
2.1 各組腦水腫和BBB通透性比較 干濕法結果顯示,MCAO組腦水含量增加明顯高于SH組(P<0.01);SA組腦水含量增加明顯低于MCAO組(P<0.05);而NB組腦水含量增加明顯高于SH組和SA組(P<0.05)。EB結果顯示,MCAO組EB滲出明顯高于SH組(P<0.01);SA組EB滲出高于SH組(P<0.05)但明顯低于MCAO組(P<0.05); NB組EB滲出量較SH和SA組明顯增加(P<0.05)。見圖1。
2.2 各組運動神經功能比較 MCAO術后1、2、5 d的mNSS評分結果顯示MCAO組的運動神經功能分值明顯高于SH組(P<0.05);SA組運動神經功能分值較M組顯著下降(P<0.05); NB組的運動神經功能分值與SH和SA組相比明顯增加(P<0.05)。見圖2。
2.3 各組內皮細胞的存活率、凋亡和通透性比較 CCK-8和流式細胞檢測結果顯示,與Blank組相比,OGD后細胞活性顯著降低,而細胞凋亡率顯著上升(P<0.01);與OGD組相比,SA組中細胞相對活性明顯增加,細胞凋亡率明顯降低(P<0.05)。見圖3A、B。細胞通透性結果顯示,與Blank組相比,OGD組細胞通透性明顯增加(P<0.01);與OGD組相比,SA組細胞通透性明顯降低(P<0.01)。見圖3C。
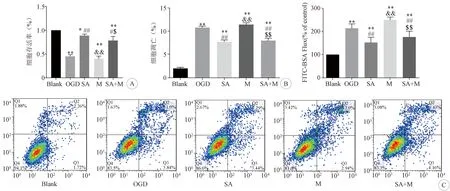
A:各組細胞存活率的比較; B:各組細胞凋亡的比較; C:各組細胞通透性的比較。與Blank組比較:*P<0.05,**P<0.01;與OGD組比較:#P<0.05,##P<0.01;與SA組比較:&P<0.05,&&P<0.01;N=5 (只/組)
2.4 各組內皮細胞連接蛋白和β-catenin的表達比較 免疫熒光結果顯示,與Blank組相比,OGD組內皮細胞中連接蛋白(ZO-1、occludin、claudin-5)的表達水平明顯降低(P<0.05);與OGD組相比,SA組內皮細胞中連接蛋白(ZO-1、occludin、claudin-5)的表達水平明顯增加(P<0.05)。見圖4A。Western Blot結果顯示, 與Blank組相比,OGD組內皮細胞中β-catenin的表達水平明顯降低(P<0.01);與OGD組相比,SA組內皮細胞中β-catenin的表達水平明顯升高(P<0.01)。見圖4B。
2.5 MALAT1干擾對各組內皮細胞的影響 RT-PCR結果可見MALAT1的RNA干擾效率。見圖5A。與Blank組相比,OGD組HBMECs 內MALAT1的表達明顯降低(P<0.05);與OGD組相比,SA組HBMECs內MALAT1的表達可明顯增加(P<0.01)。見圖5B。而MALAT1干擾后可見,與SA組相比,SA+M組的內皮細胞活性明顯降低,內皮細胞的凋亡和細胞通透性明顯增加(P<0.05)。見圖3A、B、C。免疫熒光和Western Blot結果顯示,MALAT1被干擾后,與SA組相比,SA+M組中β-catenin和連接蛋白(ZO-1、occludin、claudin-5)的表達水平也發生了明顯的降低(P<0.05)。 見圖4A、B。
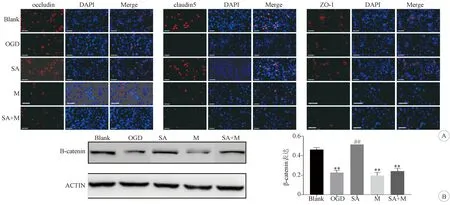
A:各組內皮細胞連接蛋白occludin,claudin,ZO-1表達的比較(紅色:occluding,claudin5,ZO-1染色;藍色:DAPI染色;×20); B:各組內皮細胞β-catenin表達的比較。與Blank組比較:*P<0.05,**P<0.01;與OGD組比較:#P<0.05,##P<0.01
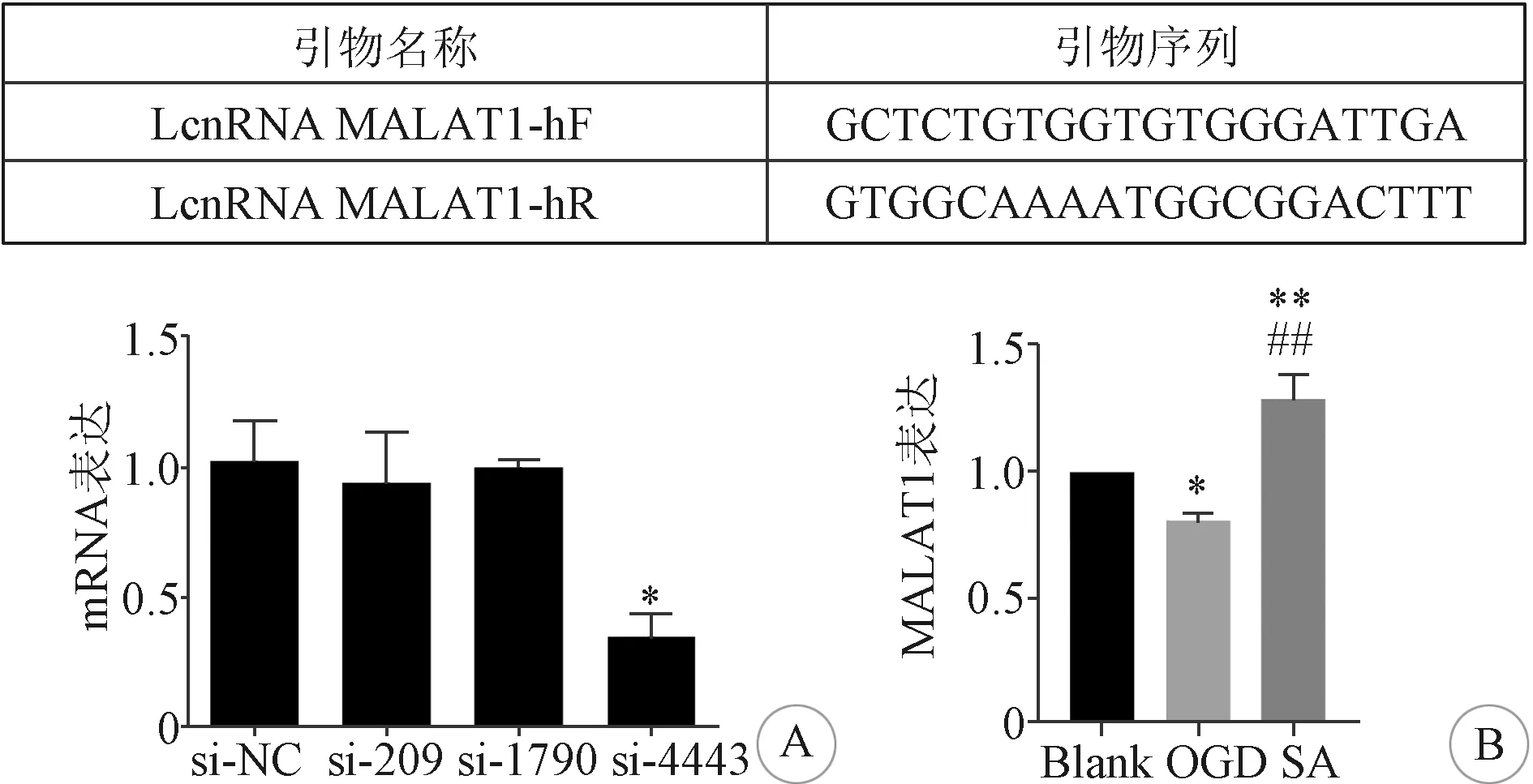
A:MALAT1的RNA干擾效率; B:各組內皮細胞MALAT1表達的比較。與Blank組比較:*P<0.05,**P<0.01;與OGD組比較:#P<0.05,##P<0.01
3 討 論
缺血性腦卒中發生后,腦血流的中斷導致相應區域的腦血管結構和功能最早遭受到損害,造成缺血區血供障礙,物質交換異常甚至誘發腦水腫等嚴重病理損害,最終神經細胞損傷,導致患者死亡或嚴重殘疾。腦血管是BBB的主要結構,其中由神經元、血管內皮細胞、膠質細胞以及周細胞和血管平滑肌細胞等組成的腦神經血管單元(neurovascular unit,NVU),是BBB的基本結構[17]。目前為止,尚且缺乏對于IRI誘導BBB結構和功能障礙的有效預防和治療措施。內皮細胞構成了NVU最內側的一層,是維持BBB功能完整,調節腦血管功能和新生等的關鍵結構[18-20]。有研究證實,腦卒中后內皮細胞的連接蛋白破壞可導致BBB通透性的改變[21]。因此,保護腦血管內皮細胞已成為減輕腦卒中后BBB破壞的關鍵。因此,本研究使用在體和離體IRI模型進行SA對腦缺血再灌注后腦血管內皮的保護及機制的相關研究。
研究表明高選擇KOR激動劑對于IRI具有腦保護作用,本研究結果同樣證實SA可以減輕缺血再灌注后的腦損傷和運動神經功能障礙。而有研究表明KOR激動劑的腦保護與抑制腦缺血區神經元的凋亡和保護腦血管的完整性有關[6, 22-23],但其對BBB的具體保護機制尚不明確。因此,首先本研究在大鼠MCAO模型上通過Evans Blue明確了SA對BBB損傷的保護作用,結果表明SA能有效減輕MCAO導致的BBB通透性增加。腦血管內皮細胞作為在腦缺血刺激時最先受到損傷的細胞之一,與IRI相關的細胞凋亡、細胞代謝等過程的調控機制值得更多的研究關注。對此,本研究進一步使用HMEBC的OGD模型探討了SA對BBB的保護作用是否與內皮細胞有關。結果表明,SA可明顯減輕OGD引起的內皮細胞凋亡和通透性增加,起到內皮細胞保護作用。有研究表明,內皮細胞內β-catenin的激活可轉錄控制粘附蛋白Claudin的表達,并對維持BBB功能的完整性具有重要作用[14]。β-catenin作為一種多功能蛋白,既是一種粘附蛋白可以將粘附蛋白粘附到細胞骨架,也是Wnt信號通路中心的轉錄因子[24-25]。在內皮細胞中,連接蛋白不僅起到封閉細胞間隙的作用,同時也是可對多種外部刺激和病理條件做出快速反應的結構[26-27]。內皮細胞中的連接蛋白對于血管微環境的改變更敏感,其結構的改變可導致內皮屏障破壞[28],并且連接蛋白地表達可受到Wnt/β-catenin通路的調控[29]。因此,為明確內皮細胞β-catenin和連接蛋白在SA對內皮細胞的保護作用中的變化,本研究使用免疫熒光和Western Blot對此進行了分析。結果顯示,SA可明顯促進OGD后內皮細胞中β-catenin和連接蛋白(ZO-1、occludin、claudin-5)的表達。基于以上研究結果,本研究推測SA可通過促進β-catenin的表達發揮缺血再灌注后對內皮細胞的保護作用。
已知MALAT1可參與調節內皮細胞功能和血管生長[30]。正常狀態下,MALAT1對內皮細胞的影響不明顯,但內皮細胞受到外界刺激時,MALAT1是早期(缺血后數小時即可明顯增高)發生改變最明顯的LcnRNA之一,起到了調控內皮細胞功能的作用。在腦血管內皮細胞中的研究表明,當出現缺血缺氧時誘發MALAT1大量表達,可以明顯抑制細胞的凋亡發生[31]。而在體外血管內皮細胞進行OGD處理后,MALAT1可通過調節相應mRNA的吸附來促進缺血缺氧后細胞自噬以及提高細胞的存活[32]。本研究發現,OGD后HMEBCs中MALAT1的表達明顯下調,而SA的暴露可以明顯上調OGD后內皮細胞中MALAT1的表達。因此,本研究進一步通過siRNA技術干擾MALAT1在HBMEC中的表達,探討MALAT1在SA的內皮細胞保護作用中的作用機制。本研究結果表明,MALAT1表達被干擾后,SA對HMEBCs的保護作用被拮抗,即細胞活性降低,內皮細胞的凋亡和細胞通透性增加。同時,SA對于OGD后HMEBCs中β-catenin和連接蛋白(ZO-1、occludin、claudin-5)的表達促進作用被抑制。因此,明確了SA對OGD后內皮細胞的保護作用與調控MALAT1表達有關。
綜上所述,本研究結果提示SA可能通過調控內皮細胞中LncRNA-MALAT1表達,促進β-catenin的表達來減輕內皮細胞損傷,進而減輕腦缺血再灌注后的BBB損傷,起到腦保護作用。但是本研究尚且有一定的局限性,比如,雖然本研究在離體細胞實驗中證明SA可通過上調MALAT1促進β-catenin的表達來發揮內皮細胞保護作用,然而,由于信號通路的復雜性,對于該通路在動物體內是否與其他信號通路交互作用,需要進一步的實驗證明。但本研究仍為缺血再灌注后內皮細胞保護減輕BBB損傷的研究提供了新的理論基礎。
利益沖突:所有作者均聲明不存在利益沖突。

