當歸種子航天誘變一代(SP1)的成藥性能
劉宇曉,郭鳳霞,陳垣,3,劉金印,陳永中,金建琴,許宏亮
(1.甘肅農業大學生命科學技術學院,甘肅省中藥材規范化生產技術創新重點實驗室,甘肅省藥用植物栽培育種工程研究中心,甘肅省干旱生境作物學重點實驗室,甘肅 蘭州 730070;2.天津市現代中藥資源研究企業重點實驗室,天津天士力現代中藥資源有限公司,天津 300410;3.甘肅天士力中天藥業有限責任公司,甘肅省特色藥用植物資源保護與利用工程實驗室,甘肅省特色藥材規范化可追溯栽培工程技術研究中心,甘肅 定西 748100)
傘形科植物當歸(Angelicasinensis)的干燥根,有濃郁的香氣,味甘、辛、微苦,有補血活血,調經止痛,潤腸通便等功能,主治血虛萎黃,眩暈心悸,月經不調等癥[1],已被列入既是食品又是中藥材的物質(食藥物質)目錄(食品安全標準與監測評估司2019年第8號)。甘肅省岷縣一帶是當歸的傳統優質道地主產區,氣候寒冷陰濕,被推介為“中國當歸之鄉”,藥材世稱岷歸,產品享譽海內外[2]。當歸野生資源已趨瀕危[3],藥源以栽培品種為主[4]。由于當歸為多年生植物,當歸地上部分生長繁茂,產草量大,是高寒區農牧交錯帶的重要藥飼兼用型優良品種,在高寒農牧區土壤改良中發揮了積極作用。
然而,當歸栽培品種主要為農家地方品種,為多種類型的混合體[5],隨著種植年限的延長,品種退化明顯,表現為早期抽薹率高,根病嚴重,成藥率很低。盡管有研究者[5]開展了當歸新品種選育研究,選育的岷歸系列品種早期抽薹率為13.9%~19.1%,麻口病率為27.9%~45.0%,病情指數為9.3%~18.3%,但實際成藥率只有35.9%~58.2%,且這些新品種尚處于繁種階段。當歸正常種子為3年生植株的種子[6-7],2年生植株抽薹稱為早期抽薹,根部木質化不能入藥[8],所結種子稱為火藥籽,用火藥籽育苗其后代早期抽薹率更高。正常成熟種子也唯有成藥性能好且抗病性強的個體才能成藥和繁種,純有機栽培可顯著提高當歸成藥率[8]。
航天誘變育種是通過將植物種子搭載宇宙飛船或返回式衛星,利用航天中的強輻射、微重力、高真空和弱磁場等使種子性狀發生變異,然后從中選育出具有優良特性種子的現代育種新技術[9-12]。太空中的微重力等因素能夠影響植物細胞質膜、轉錄組和蛋白質組、細胞壁和Ca2+信號傳導狀態[10],不僅能誘導出長勢旺盛的植株,而且還可提高產量和品質,這對側重于性狀特異性選育的藥用植物育種來講應用潛力巨大[9]。利用太空誘變選育中藥材品種已初步應用[13-24],但至今對航天誘變當歸品種選育的研究報道很少。近年來,受全球氣候變暖影響,加上連作重茬,化肥投入比增大,當歸早期抽薹率更高,根病加重,成藥率更低[8-9],嚴重影響了藥農栽培當歸的經濟效益,而生產上早期抽薹率低、抗病性強的高產優質當歸品種極其缺乏。有機種植是在種植過程中完全使用自然原料投入的種植方法,有機肥替代化肥是藥用植物栽培發展的必然趨勢[25],選育適宜生態有機栽培的當歸優良新品種是道地藥材當歸可持續發展的重要戰略目標。因此,在有機栽培條件下探索當歸航天誘變新品種選育途徑具有重要意義。本研究對航天搭載的當歸種子SP1的生長發育狀況和藥材活性成分進行測定,以期選育符合育種目標的當歸新品種。
1 材料和方法
1.1 試驗地概況
試驗地位于甘肅省定西市岷縣禾馱鄉石家臺村,地理位置為N 34°25′36″,E 104°16′ 03″,屬典型高寒陰濕區,海拔3 186.75 m,年均降水量600~800 mm,平均溫度4.7 ℃,4-10月當歸生長期平均溫度5.5 ℃。土壤類型為高寒草甸土,土質肥沃疏松,適宜當歸生長和繁育,是當歸主要道地產區[2,4]。
1.2 種子來源及航天搭載
供試當歸種子2015年8月10日采自岷縣當歸地方農家品種3年生種株,由甘肅農業大學農學院陳垣教授鑒定。
根據航天搭載要求,由天士力控股集團醫藥集團股份有限公司委托國家航天局搭載“長征七號”運載火箭發射的貨運飛船和長征二號運載火箭發射的“神舟十一號”載人飛船對應載種器。
長征七號返回艙于2016 年6月26日返回,在太空運行22 h,攜載當歸種子20 g,編號為長征22 h(22 h)。“神舟十一號”于2016年10月17日7∶30在酒泉衛星發射中心由長征2號運載火箭發射,2016年11月18日13∶59返回艙在內蒙古中部著陸,歷時33 d,攜載當歸種子100 g,編號為神舟33 d(33 d)。返回地面后種子均在低溫4 ℃干燥條件下貯藏[7]。
1.3 航天搭載當歸種子播種育苗
育苗前清選種子,除去果柄和殘留物,計取粒數。留樣后播種,種子播種量和種子數詳見表1。種子于2017年6月2日在岷縣高寒草甸生荒地進行播種,處理有3個,即長征22 h和神舟33 d當歸種子,未搭載種子(CK)。播種前結合整地撿拾雜草,施有機肥1 800 kg/hm2,小區間距0.75 m,中間起埂相隔,各處理坡度和土壤條件一致,小區長4.5 m,小區寬按種子量確定。為嚴防品種混雜,每個處理集中播種,自西向東依次播種CK1、33 d、22 h和CK2當歸種子。CK1和33 d小區面積均為4.5 m2(4.5 m×1.0 m),小區播種量均為30 g;22 h和CK2面積均為0.75 m2(1.5 m×0.5 m),小區播種量均為6 g,播后覆蓋麥草保墑,田間管理均一致[7]。育苗期懸掛生態黃板防蟲,采用鼠夾嚴防鼠害,7月每小區撒施草木灰(300 kg/hm2)1次,其他管理同大田,共除草5次。
2017年10月7日采挖種苗,裹鮮土扎把并掛牌標記,裝入尼龍網袋窖藏越冬。每處理裝1袋,分別編號為CK、航天群體一代種苗(Space population,SP1)33 d和22 h,越冬貯藏種苗數詳見表1。
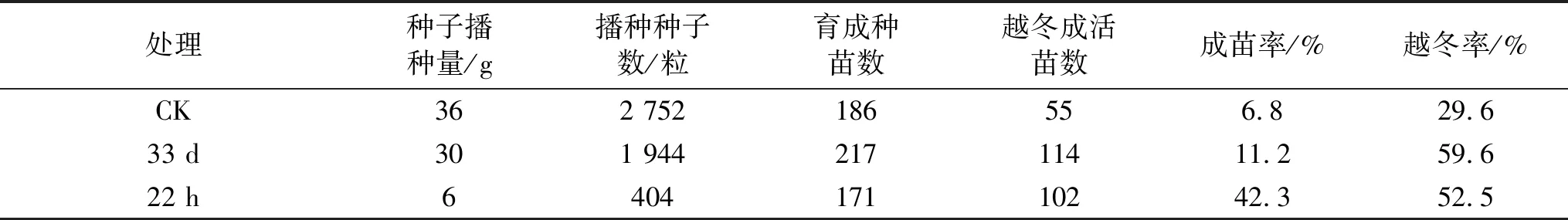
表1 當歸種子播種量和育成種苗數
1.4 航天搭載當歸種子育成SP1種苗移栽
移栽前剔除病爛苗,移栽種苗數詳見表1。種苗于2018年4月7日移栽,移栽采用單因素試驗方案,隨機區組設計,2次重復,共6個小區,小區間距0.8 cm,拉線起埂相隔,小區內拉線劃行穴栽,行距40 cm,每穴栽1株,株距30 cm。試驗地結合整地均勻撒施草木灰300 kg/m2,有機肥1 800 kg/m2。按照大田管理每隔20 d中耕鋤草1次,共除草5次,全生育期不施用化肥和農藥,采用生態黃板防蟲,鼠夾防鼠,7月每小區追施草木灰(300 kg/hm2)1次。
1.5 當歸成藥栽培期個體物候和生長發育指標測定
當歸移栽后觀察各小區種苗返青動態,每月中旬統計返青株和早期抽薹株數,藥材采挖期統計成藥株數和返青死亡株數,最后計算返青率、早期抽薹率、返青成藥率、返青死株率和種苗成藥率[4,6-7]。返青結束,每小區隨機選擇15株掛牌標記,每處理30株,對照越冬成活種苗少,全部測定。在5-10月每月中旬測定植株生長指標。株高和株幅用卷尺測定(精度1/10 cm),莖粗用數顯游標卡尺測定(精度1/100 mm)。株高是根莖基部至頂部的距離,株幅為植株地上部展開所能形成的最大寬度,莖粗為根莖基部直徑[6-7]。
返青率=(返青株數/移栽總苗數)×100%
早期抽薹率=(早期抽薹株數/返青總株數)×100%
返青成藥率=(成藥株數/返青總株數)×100%
返青后死株率=[(返青株數-早期抽薹株數-成藥株數)/返青總株數]×100%
種苗成藥率=(成藥株數/移栽總苗數)×100%
變異系數(CV)=(標準差SD/平均數)×100%
由于當歸以根入藥,早期抽薹后地上部生長難以區分品種間有利變異的差異性,因此,按返青結束早期抽薹未發生前計算各處理生長指標的變異系數。
1.6 當歸藥材活性成分測定
當歸采挖后參照《中國藥典》[1]去除泥土和須根,揉制晾干[7]。浸出物含量參照(通則2201)熱浸法測定,用70%乙醇作為溶劑[1]。當歸阿魏酸含量參照高效液相色譜法(通則0512)測定,色譜條件以乙腈-0.085%磷酸溶液(17∶83)為流動相;柱溫35 ℃,檢測波長為316 nm[1]。
1.7 數據統計分析
采用Excel 2007進行數據整理和制圖,生長指標的平均數差異性檢驗采用t檢驗。表中數據為平均數±標準差SD,圖中數據點為平均數±標準誤SE。
2 結果與分析
2.1 航天誘變對當歸種苗返青和早期抽薹的影響
不同處理當歸種子成苗率差異性很大(表1),普通種子成苗率僅6.8%,而航天搭載神舟33 d和長征22 h種子分別為11.2%和42.3%,分別較未搭載普通種子提高4.4%和35.6%。種苗越冬率差異性更大,對照為29.6%,22 h和33 d分別為59.6%和52.5%。說明當歸成苗率很低,航天搭載有利于提高成苗率,搭載22 h誘導(長征七號太空條件)效應更為明顯。
不同處理當歸種子育成種苗移栽返青后,航天搭載當歸群體的返青率和早期抽薹率均顯著高于CK(表2),與CK相比較,33 d和22 h返青率分別提高24.0%(t=5.58,P<0.05)和14.9%(t=3.43,P<0.05),早期抽薹率分別提高29.7%(t=9.56,P<0.01)和21.4%(t=4.43,P<0.05)。航天誘變群體的返青株成藥率略低于CK,但差異不顯著(P>0.05)。33 d返青株的死株率較CK極顯著降低26.8%(t=15.00,P<0.01),22 h的死株率較CK顯著降低16.0%(t=7.12,P<0.05)。各處理返青率和早期抽薹率高低次序均為33 d>22 h>CK,而返青株成藥率和死亡率均為CK>22 h>33 d,最終使種苗成藥率依次為33 d>22 h>CK(表2)。
2.2 航天誘變對當歸返青株生長的影響
神舟33 d和長征22 h當歸種子育成種苗移栽后,成藥栽培期返青株群體與CK的生長指標整體變化趨勢相似(圖1),返青植株在8月中旬前持續增高和展開,株冠達到最大,并不斷長出新葉,在6月下旬已進入叢葉期,基部莖粗在7月中旬已達到最大。8月中旬后植株不再增高和擴展,功能葉維持相對穩定狀態直到9月下旬,成藥株進入根部營養積累轉化期,10月上旬老葉枯黃脫落。
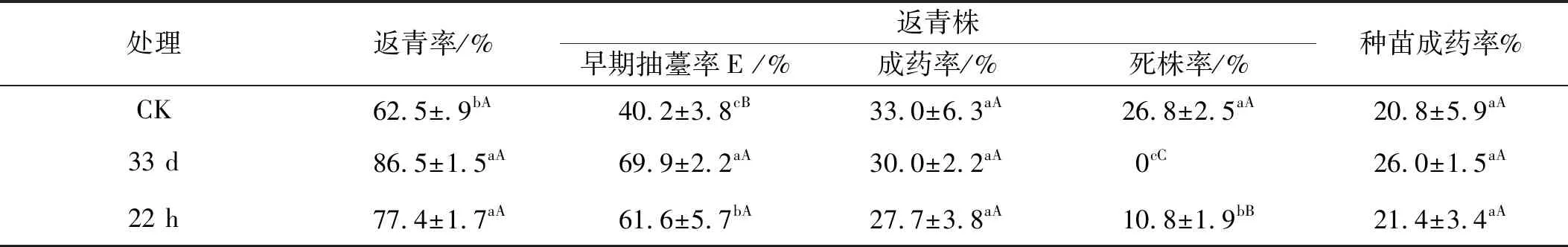
表2 當歸種苗的返青率和成藥率
神舟33 d和長征22 h的當歸返青株均較CK株生長快,生長量大(圖1)。4月上旬返青期33 d和22 h返青株分別較CK增高0.54 cm(t=1.73,P>0.05)和0.05 cm(t=0.10,P>0.05),株幅分別增大0.39 cm(t=3.39,P>0.05)和0.39 cm,莖粗和葉數與CK的差異均不顯著。6月開始生長差距拉大,6月下旬33 d和22 h較CK植株分別極顯著增高8.34 cm(t=5.59,P<0.01)和7.31 cm(t=5.06,P<0.01),此后誘變群體迅速生長,在8月中旬均達到最大值并趨于穩定,而CK在9月上旬趨于穩定。當歸誘變群體莖粗的迅速生長期較CK提早20 d左右,并且快速增長的時間比CK延長。植株葉片迅速增多主要有2個時期,第1個時期為5月上旬至6月下旬,葉片數依次為33 d>22 h>CK,第2個增長期為7月上旬至8月中旬,葉片數依次為CK>22 h>33 d,但莖粗和葉片數的差異三者均未達到顯著水平(P>0.05)。

圖1 當歸種苗成藥期植株生長動態Fig.1 Plant growth dynamics of A.sinensis seeding in medicinal stage
各處理返青期形態指標的變異系數顯示(表3),當歸返青期株高和株幅的CV依次為22 h>33 d>CK,葉片數的CV依次為33 d>CK>22 h,莖粗的CV依次為CK>22 h>33 d。各指標平均CV依次為莖粗>株幅>株高>葉片數,22 h和33 d群體株高和株幅的CV均高于CK,33 d群體葉片數的CV最大。說明太空誘變使當歸株型發生改變,株高和株幅誘變效應更大,創造優異變異群體的幾率更高,這從生長動態變化趨勢也可得到驗證(圖2),也與早期抽薹率統計的結果相似(表1,表2)。太空誘變使莖粗趨于更穩定,因為CK莖粗的CV最大,也說明岷歸地方農家群體中個體的差異性較大。

表3 SP1代種苗成藥期植株生長指標的變異系數
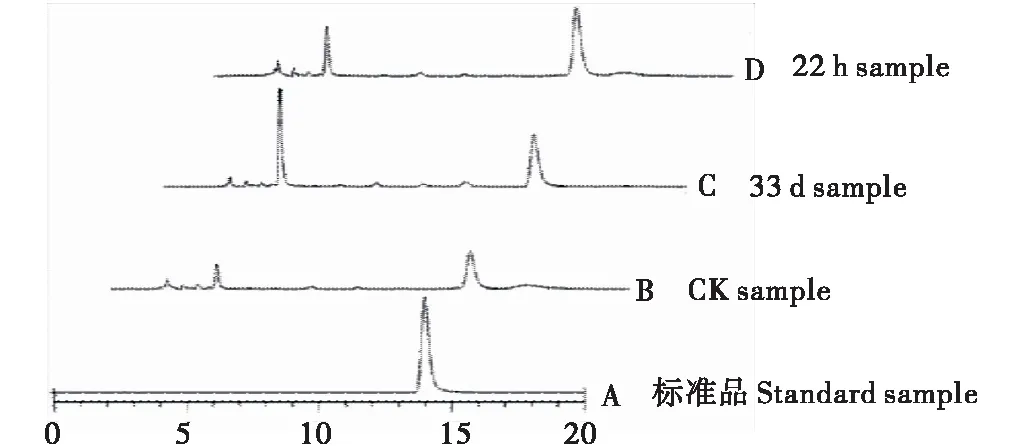
圖2 成藥根阿魏酸HPLC色譜圖Fig.2 HPLC chromatogram of ferulic acid in A.sinensis medicinal stage
2.3 航天誘變對當歸藥材主要成分含量的影響
33 d和22 h的SP1藥材樣品和CK藥材樣品在測定時間段內均出現多個峰且峰數基本一致,33 d和22 h的對應峰均較CK面積大,22 h藥材樣品的阿魏酸峰值最高(圖2)。在0~10 min以33 d的峰面積最大,22 h次之,CK均最小。對當歸藥材活性成分的組成影響不大(表4)。

表4 藥材根主要成分
不同太空誘變時間對當歸藥材主要成分含量的影響雖未達到顯著水平,但均不同程度誘導當歸藥材主要成分含量發生變化(表4),阿魏酸含量從高到低依次為22 h>33 d>CK,搭載33 d和22 h當歸藥材阿魏酸含量較CK分別提高0.01%(P>0.05)和0.02%(P>0.05)。33 d藥材的浸出物含量最高,較CK提高3.8%,22 h較CK的浸出物含量降低2.8%。
3 討論
3.1 航天搭載當歸種子增強了當歸SP1代的抗逆性和繁殖力
當歸多年栽培成藥,第1年種子育苗,第2年成藥栽培,第3年繁種[4]。成藥期早期抽薹也是當歸在極端環境條件脅迫下通過自我繁殖進行生態補償的表現[8]。根腐病、麻口病等土傳病害與當歸連作重茬自毒和土壤病原微生物的富集有關,道地產區土地面積極其有限,單一化種植為病原物的積累和傳播擴散創造了條件。目前早期抽薹和根病成為限制當歸栽培成效的主要因子,早期抽薹率高達40%以上[5-8]。新選育的岷歸系列新品種因早期抽薹和麻口病造成的實際成藥率也只有35.9%~58.2%,本課題組在產區大田調查農家地方品種早期抽薹率和死株率均在40%以上。本研究發現,航天搭載當歸種子其SP1代個體株型發生明顯變化,普遍增強了存活個體的抗逆性和繁殖力,CK種子的成苗率僅6.8%,而航天搭載33 d和22 h種子的成苗率分別較CK種子提高4.4%和35.6%,這也揭示了普通當歸種子成苗率低的生產現實,航天搭載有利于提高種子的成苗率,長征22 h誘變正向效應更為明顯。另外,成藥栽培期CK群體返青率僅為62.5%,早期抽薹率為40.2%,神舟33 d和長征22 h處理當歸群體的返青率分別提高到70%以上,早期抽薹率分別提高到60%以上,返青后死株率卻降低20%左右,使當歸種苗成藥率均維持在20.0%以上,留地健壯的成藥株為下一年的繁種和建立優異變異群體奠定了良好基礎。由于種苗移栽后的返青率是反映植株對環境適應性和抗逆性的主要指標,田間發現越冬死苗和未返青苗一般都是根病引發腐爛死亡,說明經過太空誘變后的當歸成活個體株增強了對環境的適應性和應激能力,從而提高了極端環境條件下的存活率。太空誘導當歸早期抽薹率的提高也進一步說明太空誘變增強了存活個體的熟性分配比率和年際間個體繁衍配比,增強了物種的生態適應性,由于早期抽薹株無法形成正常肉質根,不利于農業生產,進一步揭示太空誘變具有雙向誘導效應,帶來有利正向變異的同時也帶來不利于農業生產的反向變異。
3.2 航天搭載當歸種子促進了當歸SP1個體的生長發育
航天誘變有擴大黃芩(Scutellariabaicalensis)各性狀變異譜的作用[13],使決明(Cassiaobtrusively)農藝性狀表現出豐富的遺傳多樣性[18]。總體來看,航天搭載黃芩[13]和桔梗(Platycodongrandiflorum)[14]對其SP1代的負效應大于正效應。這與本研究中航天搭載33 d和22 h當歸種子育成SP1種苗移栽后,其成藥群體株高和株幅的CV增大的結果較為一致。不同的是,返青株群體的株高、株幅和莖粗較CK顯著提高,說明太空誘變對當歸成藥期生長具有正向誘導效應,生長更旺盛,植株高大,可能是當歸等多年生藥用植物在育苗期和越冬返青期已將誘變受損的不利基因型自然淘汰的緣故,另外早期抽薹株比例的增大也是造成其群體生長勢增強的原因。航天搭載33 d和22 h群體成藥期生長前期的葉片數的增長速度比CK快,但后期較CK慢,說明太空誘變影響了當歸植株葉片的時空異速增長,返青后植株迅速抽枝散葉,首先占據優勢生態位,而對照則在返青后經歷了一定時間的環境適應性,后期才迅速生長,這一結果從其他藥用植物的研究也可以得到印證,經航天誘變后藥用植物決明[18]和丹參[19]植株的生長勢明顯優于對照品種,均表現為促進作用,而在黃芩[13]和桔梗[14]上卻表現為抑制作用,這可能是由于復雜的空間環境因素對種子的誘變作用因物種的不同而異,不同基因型植物種子對太空誘變的敏感程度也會有一定的差異。航天誘變后二色胡枝子(Lespedezabicolor)變異系數較對照提高30%~70%[20]。本研究中,航天誘變33 d和22 h使當歸SP1成藥期植株性狀發生明顯變異,增大了返青期的變異幅度,創造出多樣化的變異株后代群體,搭載22 h對生長指標的正向誘導效應更大。前期葉片數越多的群體后期葉片越少,這可能也與當歸的早期抽薹有關,因為返青后植株生長越旺盛的植株早期抽薹率越高,營養優先供應抽薹、開花和結實等有性繁育,基葉數增長較少,而未抽薹成藥株需要抽生基生葉為肉質根生長膨大及活性成分積累轉化提供養分,也說明成藥期當歸基葉新生也是衡量當歸成藥特性的重要指標。
3.3 航天搭載種子對當歸SP1成藥根有效成分含量具有一定正向效應
藥用植物內在品質和化學組分是基因型與環境共同作用的結果,也是維持個體生存并延續后代的物質基礎。航天誘變對藥用植物牛膝(Achyranthesbidentata)[21]、甘草(Glycyrrhizauralensis)[22]的某些化學成分含量均產生影響。廣東紫珠(Callicarpakwangtungensis)經航天誘變后優選F3品系藥物總含量和對照的差異不明顯[23],但高文遠等[24]將甘草種子搭載返回式衛星18 d種子發育成熟根的甘草酸和甘草苷含量分別比對照組高2.19倍和1.18倍。當歸是我國的主要道地中藥材品種,2020版《中國藥典》規定當歸的浸出物含量不得少于45%,阿魏酸含量不得低于0.05%。本研究發現,在有機栽培條件下,岷縣產當歸主要成分遠高于《中國藥典》最低標準,平均浸出物含量為54.1%,阿魏酸含量為0.10%,航天誘變當歸種子后,盡管SP1代藥材成分差異性未達到顯著水平,但也可揭示航天誘變的雙向效應,搭載33 d和22 h處理的阿魏酸含量分別高于CK,浸出物含量因搭載條件而不同,33 d當歸SP1藥材浸出物含量比CK高出3.8%,22 h浸出物含量比CK降低2.8%。說明不同物種對航天誘變的敏感性不同,航天誘變具有不確定性,藥用植物經過航天誘變后有可能會提高某些成分含量,但也有可能降低某成分,航天誘變創造的優異變異群體為后世代內在品質目標性狀的選擇奠定了良好種質基礎。本研究首次通過航天誘變創造當歸變異群體并進行新品種選育探索,對獲得的優異變異株后代群體還有待在有機栽培條件下進一步連續定向選擇和鑒定,以期選育出抗逆性強,早期抽薹率低,豐產優質的當歸新品種。
4 結論
當歸地方農家品種種子成苗率僅6.8%,種苗成藥率僅20.8%,種子經航天誘變后可增強抗逆性,育成種苗的返青率和成活率顯著提高,對株高、株幅和莖粗等主要農藝性狀具有正向誘變效應,并提高了藥材根內在品質的豐富度,但同時也提高了SP1代早期抽薹率,各處理種苗成藥率依次為33 d(26.0%)>22 h(21.4%)>CK(20.8%),獲得的抗逆成藥株將是新品種選育的優異寶貴種質資源。由于誘導的變異隨機發生,第1代誘變株基因分離的局限性大,性狀穩定性差,需要在后時代大量定向選育,并結合分子鑒定技術,才能選育出符合性狀整齊一致、遺傳穩定和主要性狀突出的當歸優良新品種。
致謝:天士力控股集團董事局閆希軍主席、周水平、朱永宏,天津天士力現代中藥資源有限公司張蘭蘭、張學敏、徐波、韓亞朋,甘肅數字本草檢驗中心有限公司王浩亮等提供合作與幫助。甘肅省定西市岷縣郎銀忠、李雪芳和賈哈柱提供試驗地和種苗貯藏條件并協助田間管理。隴西縣鞏昌鎮園藝村郭志軍、郭天明、郭太平、郭愛偉和郭愛峰提供種子貯藏條件并協助田間管理及取樣。甘肅農業大學博士生白剛、高雪、姜小鳳、梁偉,碩士生王紅燕、葛鑫、劉蘭蘭、焦旭升、袁洪超、金彥博參與當歸育苗、移栽及指標測定。

