感染性休克患者的凝血功能特征
蔣逸 沈佳麗 王超萍
【摘要】目的:感染性休克患者容易出現嚴重的凝血功能紊亂,本研究分析感染性休克患者凝血功能紊亂的臨床特征。方法:選取2019年1月至2021年4月本院收治的感染性休克的患者29例作為研究組,同期入院血培養陰性的患者36例作為對照組,分別比較兩組的一般臨床資料、傳統凝血功能指標和血栓彈力圖(TEG)參數,并進行 ROC 曲線分析。結果:與對照組相比,研究組的血漿凝血酶原時間(PT)、活化部分凝血活酶時間(APTT)、.凝血酶時間(TT)和 R 值均顯著延長,纖維蛋白原(Fg)、D-二聚體(DD)、纖維蛋白降解產物(FDP)均顯著增加,差異有統計學意義(P <0.05);抗凝血酶Ⅲ(AT-Ⅲ)、凝固角(Angle)均顯著降低,與對照組相比差異有統計學意義(P <0.05); K 值、MA 值、G 值和 A30與對照組相比差異無統計學意義(P >0.05)。各指標判斷感染性休克的曲線下面積依次為 DD(1.0)、AT-Ⅲ(0.989)、R 值(0.843)、Fg(0.713)、Angle(0.673)。DD、AT-Ⅲ診斷感染性休克的敏感度和特異度均較高, R 值診斷的特異度較高(91.67%),敏感度稍低(75.86%)。Angle診斷的特異度較高(94.44%),敏感度一般(55.17%)。結論:感染性休克患者的凝血功能特征表現為:出血時間延長(PT、APTT、TT、R 值延長),血管內微血栓形成(Fg、DD 和 FDP 升高),抗凝血酶含量降低(AT-Ⅲ減低),纖維蛋白原功能減低(Angle 減小),但血小板功能基本正常。當 DD≥0.97.mg/L, AT-Ⅲ≤76.2%時提示可能出現感染性休克。R 值≥6.6.min 時即提示感染性休克患者凝血因子活性異常, Angle<58.6提示感染性休克患者出現纖維蛋白原功能障礙。
【關鍵詞】感染性休克;凝血;血栓彈力圖
【中圖分類號】R446【文獻標識碼】A 【文章編號】2096-5249(2022)06-0142-04
感染性休克是由嚴重感染引起的急性循環衰竭,表現出持續的低血壓,組織灌注不足以及嚴重臟器功能不全。有研究證明,凝血系統的激活和炎性反應相互促進,是膿毒癥凝血紊亂的病理生理基礎[1-3]。目前,臨床上最常用的凝血功能指標有血漿凝血酶原時間(PT)、活化部分凝血活酶時間(APTT)、纖維蛋白原(Fg)、凝血酶時間(TT)、D-二聚體(DD)、纖維蛋白降解產物(FDP)、抗凝血酶Ⅲ(AT-Ⅲ)等,使用的是血清標本,僅能評價凝血體系的一部分[4]。血栓彈力圖(thromboelastography,TEG)是使用全血標本進行檢測的,反映的是從血小板聚集到凝血、纖溶的整個動態過程,可實時、全面地觀察患者整個凝血過程的變化[5-6]。因此,本研究擬通過對常規凝血功能指標及 TEG參數的聯合檢測對感染性休克患者的凝血功能特征進行監測和評估。
1 對象與方法
1.1研究對象
選取本院2019年1月至2021年4月收治的感染性休克患者共29例作為研究組,其中男16例、女13例,年齡(68.76±12.74)歲。
納入標準:符合2016版國際膿毒癥和感染性休克管理指南中感染性休克的定義[7]。
排除標準:妊娠期與哺乳期患者;存在已知的先天性凝血功能紊亂;長期使用抗凝藥物與抗血小板藥物者;肝腎功能不全、腫瘤晚期患者;免疫功能缺陷或正接受免疫抑制劑治療者。
選取同期入院血培養陰性的患者36例作為對照組,其中男19例、女17例,年齡(64.00±8.96)歲。研究組與對照組患者年齡、性別差異比較均無統計學意義(P>0.05)。
納入標準:有局灶性感染、發熱表現;血培養為陰性;確定排除血流感染者。
排除標準:與研究組排除標準相同。
1.2儀器和試劑
血培養:選擇 BD9120全自動血培養儀(雅培公司),含溶血素厭氧瓶和含樹脂需氧瓶進行血培養。
常規凝血指標:選擇 CS5100全自動血凝分析儀(日本希森美康)及配套試劑,采集外周血2.7 mL,所有血樣均采用枸櫞酸鈉抗凝管,以3000 r/min離心10 min,在 CS5100全自動凝血分析儀上測定血漿PT、 APTT、FIB、TT、DD、FDP、AT-Ⅲ。
TEG 檢測:選擇 TEG5000型血栓彈力圖儀(美國Haemoscope公司)及相應檢測試劑盒進行檢測。采用枸櫞酸鈉抗凝管(3.2%枸櫞酸鈉)采集外周血,采集后2h內完成 TEG監測,測試結束后,記錄R值、 K值、 Angle、MA值、 G值、A30。
1.3統計學分析
數據應用 SPSS 22.0統計軟件進行分析。計量資料采用(±s)表示,采用獨立樣本 t 檢驗;計數資料以例數和百分比表示,采用χ2檢驗。采用受試者工作特征(ROC)曲線評估有統計學差異的指標對感染性休克的診斷價值。以 P<0.05為差異有統計學意義。
2 結果
2.1臨床資料
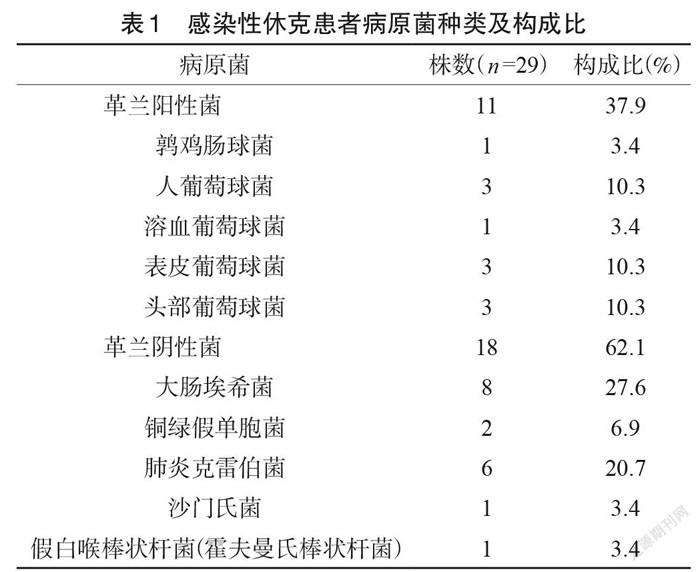
研究組感染的病原菌種類根據革蘭染色特征分為革蘭陽性菌和革蘭陰性菌。29例研究組中共檢出革蘭陽性菌11株,占37.9%,革蘭陰性菌18株,占62.1%,感染的病原菌種類及構成比見表1。
2.2兩組間常規凝血指標及TEG參數比較
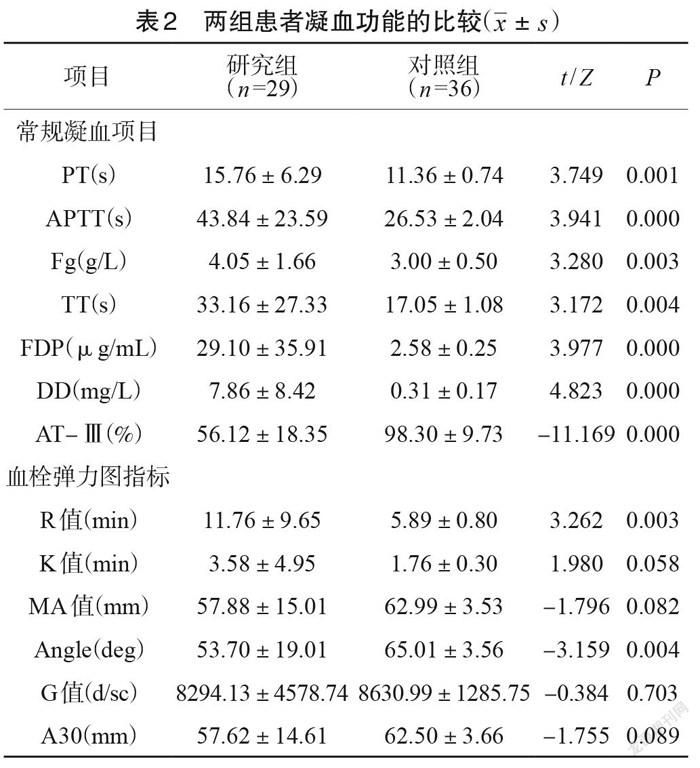
常規凝血項目PT、APTT、TT較對照組延長,Fg、DD、FDP較對照組增加, AT-Ⅲ較對照組明顯減低,差異均有統計學意義(P<0.05)。血栓彈力圖 R 值較對照組明顯延長、Angle 明顯減小,與對照組相比差異均有統計學意義(P<0.05)。 K值、 MA值、 G 值、A30與對照組相比差異無統計學意義(P>0.05),見表2。
2.3凝血指標判斷感染性休克的ROC曲線分析
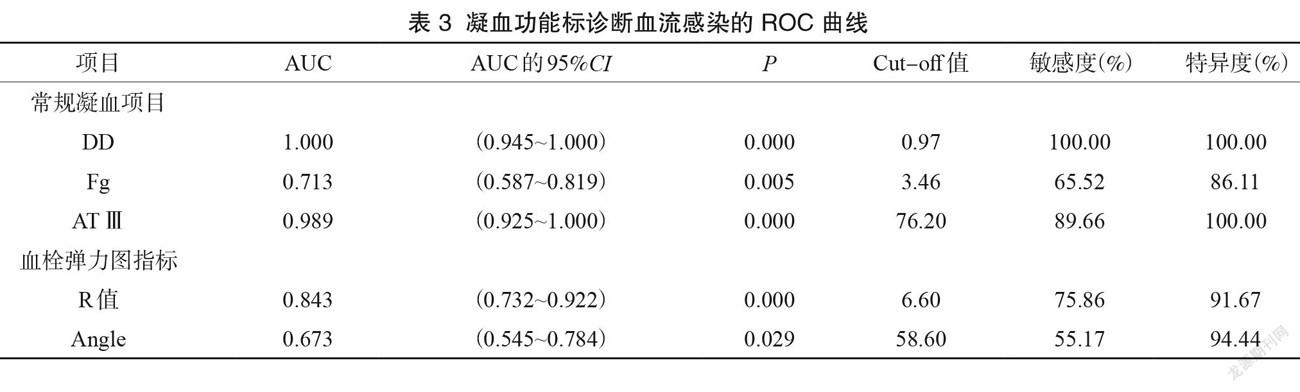
將DD、FG、AT-Ⅲ、R值、Angle 納入 ROC 曲線分析。結果顯示,各指標判斷感染性休克的曲線下面積依次為DD(1.0)>AT-Ⅲ(0.989)>R值(0.843)>Fg(0.713)>Angle(0.673)。DD、AT-Ⅲ的曲線下面積最大,判斷感染性休克的診斷價值是最高的,其特異度和敏感度均較高。當DD≥0.97 mg/L,AT-Ⅲ≤76.2%時診斷感染性休克的特異度能達到100%。 R值診斷的特異度較高,敏感度稍低。 Angle 診斷的特異度較高,敏感性一般,見表3和圖1。
3 討論
凝血功能紊亂是感染性休克的中心環節,嚴重感染時宿主發生的炎癥反應可過度激活凝血因子[8-9],導致宿主促凝功能上調,抗凝機制下調,纖溶系統抑制,引起器官功能障礙、 DIC,最終發展為膿毒性休克[10]。因此,凝血功能紊亂發生于感染性休克病理發展的全過程[11-12],兩者的相互交織也導致了休克的不可逆[13-14]。多項研究均已表明,在調控膿毒癥患者炎癥反應的同時,對凝血系統功能障礙的早期識別和干預,能更有效地阻斷嚴重感染對機體造成的損傷,遏制患者病情進一步惡化,降低病死率,改善預后[15]。
本研究血培養結果顯示,革蘭陽性菌占37.9%,革蘭陰性菌占62.1%,表明引起本院感染性休克的病原菌主要是革蘭陰性菌,其原因可能是革蘭陰性菌、內毒素可以直接激活Ⅶ凝血因子,損傷血管內皮,促使粒細胞釋放凝血物質。當血管內皮細胞受損,其分泌和釋放的活性物質發生改變,從而使其抗凝或抗血栓功能減弱甚至消失,纖溶活性減低。凝血激活,導致纖維蛋白的大量生成,凝血因子及抗凝物質的大量消耗,血管內廣泛的纖維蛋白沉積導致微血管血栓形成,進而引起廣泛的器官缺血性損傷甚至壞死,臨床表現出多臟器功能衰竭。膿毒血癥時凝血激活、抗凝物質減少及纖溶抑制是 DIC 的主要原因。
本研究結果顯示,感染性休克患者常規凝血項目的PT、APTT、TT 明顯延長, TEG 檢測的R值明顯延長、 Angle 明顯降低,說明研究期處于顯著低凝狀態,這可能與凝血因子的大量消耗、凝血因子活性明顯下降有關。與此同時,感染性休克患者的Fg、FDP、DD 明顯高于對照組,感染性休克階段的DD 和FDP較正常水平升高10倍以上,說明感染性休克時已出現廣泛的微血栓負荷。與對照組相比,研究組的AT-Ⅲ顯著減少,差異有統計學意義(P<0.05),可能是由于感染性休克時, AT-Ⅲ與凝血酶合成復合物而被消耗、被活化中心粒細胞所產生的蛋白酶降解增加、肝臟合成減少等原因。
利用凝血指標繪制感染性休克的ROC 曲線分析顯示, DD、AT-Ⅲ的曲線下面積最大,判斷感染性休克的診斷價值是最高的,其特異度和敏感度均較高,當 DD≥0.97 mg/L,AT-Ⅲ≤76.2%時診斷感染性休克的特異度能達到100%,這可能與本研究的病例數較少有關。其次是R值,診斷的特異度較高,敏感度稍低,當 R值≥6.6 min 時,預測感染性休克的敏感度和特異度分別為75.86%、91.67%。 Angle 診斷的特異度較高,敏感度一般,當Angle<58.6時,預測感染性休克的敏感度和特異度分別為55.17%、94.44%。故DD 的增加和AT-Ⅲ的減少可作為感染性休克患者診斷的指標之一,與其他指標結合,能更準確地評估感染性休克患者。
本研究結果顯示, Angle 用于判斷纖維蛋白原功能的特異度要優于Fg。感染性休克組與對照組患者K 值、 MA值、 G值、A30差異無統計學意義,說明感染性休克時血小板功能可能未受影響或處在代償期,導致兩組在血小板的功能上沒有明顯的統計學差異。
總之,感染性休克患者的凝血功能特征表現為:出血時間延長(PT、APTT、TT、R值延長),血管內微血栓形成(Fg、DD 和 FDP升高),抗凝血酶含量降低(AT-Ⅲ減低),纖維蛋白原功能減低(Angle 減小),但血小板功能基本正常。當DD≥0.97 mg/L,AT-Ⅲ≤76.2%時提示可能出現感染性休克。 R值≥6.6 min時即提示感染性休克患者凝血因子活性異常, Angle<58.6提示感染性休克患者出現纖維蛋白原功能障礙。
參考文獻
[1] 崔利丹,金志鵬,王琪,等.血栓彈力圖在膿毒癥及膿毒性休克患兒并彌散性血管內凝血病情評估中的價值[J].中華實用兒科臨床雜志,2017,32(18):1398-1401.
[2] 郭影霞,董艷飛,梁桂林,等. scvo2、CRP 與 SAA 聯合檢測在膿毒血癥預后評估中的應用分析[J].醫學食療與健康,2021,19(3):143-144.
[3] 鐘林翠,宋景春,曾慶波,等.血流感染相關膿毒癥不同時相凝血功能紊亂的臨床特征[J].醫學研究生學報,2019,32(1):43-47.
[4] 宋景春.膿毒癥合并彌散性血管內凝血的機制與監測[J].醫學研究生學報,2017,30(7):703-708.
[5] Kim SY,Gu JY,Yoo HJ,et al. Bene?ts ofthromboelastographyand thrombin generation assay for bleeding prediction in patients with thrombocytopenia or hematologic malignancies[J]. Ann Lab Med,2017,37(6):484-493.
[6] Othman M ,Kaur H. Thromboelastography(TEG)[J].Methods Mol Biol,2017,1646:533-543.
[7] Rhodes A,Evans LE,Alhazzani W,et al. Surviving Sepsis Campaign:International Guidelines for Management of Sepsis and Septic Shock:2016[J]. Intensive Care Med,2017,43(3):304-377.
[8] He Y,Peng Y,Tao L,et al. Peroxiredoxin-1 aggravates lipopolysaccharide-induced septic shock via promoting inflammation[J]. BiochemBiophys Res Commun,2020,527(4):861-865.
[9] Abdelmalik PA,Stevens RD,Singh S,et al. Antiaging factor,serum alpha-Klotho,as a marker of acute physiological stress,and a predictor of ICU mortality,in patients with septic shock[J]. J Crit Care,2018(44):323-330.
[10] Schneck E,Edinger F,Hecker M,et al. Blood levels of free-circulating mitochondrial DNA in septic shock and postsurgical systemic inflammation and its influence on coagulation:a secondary analysis of a prospective observational study[J]. J Clin Med,2020,9(7):2056.
[11] 祝益民,吳瓊 . 膿毒癥與抗凝治療 [J]. 中國實用兒科雜志,2017,32(6):443-448.
[12] 盧世軍 . 重癥急性胰腺炎并發膿毒血癥患者治療過程中抗凝的應用 [J]. 醫學食療與健康,2020,18(4):14-15.
[13] 鐘小明,鐘梅,羅開源,等 .37 ℃ 擴容液對感染性休克新生兒凝血功能及血乳酸的影響 [J]. 中華危重病急救醫學,2018,30(12):1146-1149.
[14] Backer DD,Ricottilli F,Ospina-Tascon GA. Septic shock:a microcirculation disease[J]. CurrOpinAnaesthesiol,2021,34(2):85-91.
[15] 劉歐亞,王媛媛,蘇美仙,等 . 外科膿毒癥患者抗凝血酶Ⅲ與疾病嚴重程度和預后關系的臨床研究 [J]. 中國急救醫學,2016,36(10):876-879.
(收稿日期:2021-08-12)

