檳榔芋萌發早期的營養物質及激素水平變化研究
李莉莉 商飛飛 謝玉花 陳云堂 崔 龍 段振華
(1 大連工業大學食品學院,遼寧 大連 116034;2 賀州學院食品與生物工程學院,廣西 賀州 542899;3河南省科學院同位素研究所有限責任公司/河南省核農學重點實驗室,河南 鄭州 450015)
檳榔芋又稱香芋,是天南星科莖塊類多年生水生作物,可做主食,其品種多樣,主要生長于熱帶與亞熱帶地區[1-2]。檳榔芋的營養價值極高,其蛋白質、脂肪、碳水化合物與膳食纖維含量分別是馬鈴薯的1.7、5.7、1.7及1.25倍[3]。發芽是導致檳榔芋采后損失的一個重要原因。每年11月采收至翌年清明前后為檳榔芋的貯藏期,此期間內檳榔芋含水量較高,在一定條件下極易發芽,不利于貯藏[4],加之冷庫濕度較大,能促進檳榔芋芽點部位細胞的生長,促進快速發芽。而發芽會帶來自身營養消耗、水分散失等問題。
種子萌發過程十分復雜,由幾條不同的途徑共同作用[5-6]。以脫落酸(abscisic acid,ABA)和赤霉素(gibberellin,GA3)為主的植物激素在調節種子休眠和萌發方面發揮著重要作用[7]。GA3在萌發的早期和后期均可抵消ABA的抑制作用,維系種子的萌發與生長[8-9]。生長素調節著植物的生長和發育,誘導種子萌發[10-12]。目前國內外關于植物萌發早期的報道主要集中在馬鈴薯[13]、黑豆[14]、綠豆[15-16]等植物上,如薛莉媛[13]對馬鈴薯塊莖發芽的有關特性進行研究,發現發芽會使馬鈴薯芽端淀粉含量下降;Julián 等[14]研究了去皮、發芽和擠壓對黑豆理化特性的影響,結果表明發芽會導致黑豆淀粉及蛋白質含量下降。但針對檳榔芋發芽后機體內部生理變化規律的研究甚少。本試驗對3種不同發芽程度檳榔芋的芽點部位淀粉、蛋白質、水分遷移動態及發芽后不同部位(芽、塊莖、根須)的激素水平進行測定分析,探究萌發早期檳榔芋營養物質及激素水平的變化規律,以期初步了解檳榔芋休眠及萌發機理,為探究檳榔芋休眠及貯藏后的萌發規律提供理論支持。
1 材料與方法
1.1 材料與試劑
檳榔芋,采購于賀州市八步區知富農業開發有限責任公司冷庫,選取大小均勻,單個球莖重量在600~700 g之間的檳榔芋;總蛋白(total protein, TP)測定試劑盒(考馬斯亮藍法)、植物淀粉含量測試盒,南京建成生物工程研究所;其他試劑均為國產分析純。
1.2 儀器與設備
Kromasil C18反相色譜柱(250 mm×4.6 mm,5 μm),瑞典阿克蘇諾貝爾公司;Rigol L3000高效液相色譜儀,北京普源精儀科技有限責任公司;NB90水分測定儀,常州奧豪儀器有限公司;NMI20核磁共振儀,蘇州紐邁電子科技有限公司;H1650-W微量臺式高速離心機,湖南湘儀實驗室儀器開發有限公司;EVO300 PC紫外可見光分光光度計、可調節式移液槍,美國Thermo Fisher公司;FJ 2000均質機,上海標本儀器有限公司;HH-S2數顯恒溫水浴鍋,江蘇金怡儀器科技有限公司;YP1201N電子天平,上海天平儀器總廠。
1.3 試驗方法
1.3.1 檳榔芋發芽處理 將檳榔芋于25℃條件下自然發芽,發芽芋頭按芽的長度可分為短芽(1~4 cm)、中芽(5~8 cm)和長芽(9~12 cm),如圖1-A所示。

圖1 3種發芽長度檳榔芋(A)和距球莖頂端1~5 cm部位(B)Fig.1 Areca taro three germinating lengths (A) and 1~5 cm from the top of the corm (B)
1.3.2 淀粉含量的測定 球莖頂端以下以1 cm厚度為單位斷層取樣,由于距離超過3 cm后的部位淀粉含量無明顯變化,因此本試驗選取距球莖頂端1~3 cm部位進行淀粉含量測定,3個芋頭為一組混合取樣,獲取均勻樣品。采用植物淀粉含量測試盒進行淀粉含量測定。
1.3.3 蛋白質含量的測定 選取距球莖頂端1~5 cm部位進行總蛋白質含量測定,其他處理與淀粉含量測定一致。采用總蛋白(TP)測定試劑盒(考馬斯亮藍法)進行蛋白質含量測定。
1.3.4 水分含量的測定 采用快速水分測定儀對不同發芽程度檳榔芋塊莖頂部的1~5 cm斷層部位進行水分含量測定,每次3個重復。
1.3.5 低場核磁(low field nuclear magnetic resonance, LF-NMR)及磁共振成像(magnetic resonance imaging,MRI) 檳榔芋球莖頂部1~5 cm部位,每1 cm厚度為1片,共切5片,如圖1-B。在每片芋頭的中間分別取長1.5 cm×寬0.8 cm×高0.8 cm的長方體為樣品,待測定。試驗采用低場核磁共振分析儀,同時利用分析軟件FID脈沖序列校正初始系統參數,參數測定參考梅成銘等[17]的方法。
多脈沖回波序列CPMG參數:主頻(spectrometer frequency, SF)18 MHz,偏移頻率(frequency offset 1, O1)430 400.17 Hz,90°脈沖時間(90° pulse length, P1)8.52 μs,180°脈沖時間(180°pulse length, P2)17.04 μs,累加采樣次數(the summation of number, NS)為4,回波個數(the number of echoes, NECH)為 8 000, 采樣點數(time data, TD)為160 004,采樣頻率(spectral width, SW)為100 kHz,采樣等待時間(time wait, TW)為3 500 ms,開始采樣時間(regulate first data, RFD)為0.25 ms。
MRI參數:主頻SF01為18.42 MHz,重復采樣等待時間(repetition time, TR)為500 ms,回波時間(echo time, TE)為20 ms。
1.3.6 激素水平測試
1.3.6.1 樣品取樣 由于發芽后芋頭球莖頂端1~2 cm處的塊莖部位生長最迅速,此部分激素含量更能表現檳榔芋萌發早期過程中塊莖部位的激素水平變化,因此選取不同發芽長度檳榔芋球莖頂端1~2 cm處的塊莖、萌發的芽和根須3個部位的組織,分別測定脫落酸(ABA)、赤霉素(GA3)水平。
1.3.6.2 樣品預處理 稱取約0.1 g樣本,放入研缽中磨碎,加入1 mL預冷的5%磺基水楊酸溶液,4℃浸取過夜;8 000 r·min-1離心10 min,殘渣用0.5 mL 5%磺基水楊酸溶液浸取2 h,離心后取上清液,合并兩次上清液,40℃氮氣吹干至不含有機相;加入0.5 mL 25 mmol·L-1HgCl2水溶液萃取脫色3次,棄去上層醚相,下層水相用5%NaClO-NaOH調節pH值至2.8,用等體積的乙酸乙酯萃取3次,有機相氮氣吹干;用甲醇定容至0.5 mL,取適量溶液用針頭式過濾器過濾于帶有內襯管的樣品瓶內待測。
1.3.6.3 脫落酸(ABA)液相色譜(liquid chromatogram, LC)分析條件 分析平臺:Rigol L3000高效液相色譜儀;色譜柱:Kromasil C18反相色譜柱(250 mm×4.6 mm, 5 μm);流動相:甲醇∶1%乙酸水=50∶50;進樣量:10 μL,流速:0.8 mL·min-1; 柱溫:35℃;運行時間:30 min;紫外檢測波長:254 nm。
1.3.6.4 赤霉素(GA3)LC 分析條件 分析平臺:Rigol L3000高效液相色譜儀;色譜柱:Kromasil C18反相色譜柱(250 mm×4.6 mm, 5 μm);流動相:甲醇∶1%乙酸水=35∶65;進樣量:10 μL,流速:1.0 mL·min-1; 柱溫:30℃;運行時間:30 min;紫外檢測波長:254 nm。
1.4 數據處理
數據采用Excel 2010軟件進行統計分析,采用Origin 2019軟件繪圖,試驗結果以平均值±標準誤差表示,采用SPSS 24.0軟件進行顯著性差異分析,P<0.05表示顯著差異。
2 結果與分析
2.1 不同發芽程度檳榔芋不同球莖部位淀粉含量變化
發芽檳榔芋球莖的不同部位淀粉含量變化如圖2所示。3種發芽程度檳榔芋越接近球莖中心淀粉含量越高;長芽生長消耗淀粉較多,因此長芽的發芽點部位(球莖頂部)以下1~2 cm的淀粉含量顯著低于中芽(P<0.05);短芽球莖頂端以下1 cm部位淀粉含量略高于長芽,顯著低于中芽(P<0.05),但在2 cm部位和中芽相近;在球莖頂端以下3 cm處不同發芽程度的檳榔芋淀粉含量相近。由此可見,貯藏期檳榔芋發芽程度與發芽點部位周圍淀粉含量密切相關,長芽生長所消耗的淀粉含量最高。

注:不同小寫字母表示差異顯著(P<0.05)。下同。Note: Different lowercase letters indicate significant difference at 0.05 level. The same as following.圖2 發芽檳榔芋球莖不同部位的淀粉含量變化Fig.2 Changes of starch content in different positions of corm of germinated Areca taro
2.2 不同發芽程度檳榔芋不同球莖部位蛋白質含量變化
檳榔芋萌發早期的蛋白質含量變化如圖3所示。從各芽點部位蛋白質含量隨其與球莖頂端的距離變化來看,未發芽、短芽及中芽組呈現下降趨勢,而長芽芋頭組呈先上升后下降再上升的波動變化。在距球莖頂端1 cm處,未發芽芋頭組蛋白質含量最高,為0.76 g·L-1,而長芽芋頭組蛋白質含量最低,為0.18 g·L-1。與之相反,在距球莖頂端5 cm處,長芽芋頭組蛋白質含量最高,為0.51 g·L-1,而未發芽芋頭組蛋白質含量最低,為0.12 g·L-1。由此可見,發芽可降低檳榔芋球莖頂部1 cm處的蛋白質含量,提高5 cm處的蛋白質含量。

注:每種發芽程度所示的不同小寫字母表示差異顯著(P<0.05)。下同。Note: The different lowercase letters for each degree of germination indicate significant differences at 0.05 level. The same as following.圖3 發芽檳榔芋球莖不同位置的蛋白質含量變化Fig.3 Changes of protein content in different positions of corm of germinated Areca taro
2.3 檳榔芋萌發早期水分遷移動態分析
2.3.1 不同發芽程度檳榔芋不同球莖部位水分含量變化 由圖4可知,不同發芽程度檳榔芋的不同芽點部位水分含量隨其與球莖頂端距離的增加整體呈現先下降后上升的趨勢。整體上,距球莖頂端2 cm處的水分含量與1 cm處相比顯著降低,距球莖頂端4 cm處的水分含量與5 cm處無顯著差異。從圖1-B可以看出,距球莖頂端2 cm處是根須生長最為旺盛的部位,因此此處水分含量的下降可能與根須生長有關。

圖4 發芽檳榔芋球莖不同部位的水分含量變化Fig.4 Changes of water content in different positions of corm of germinated Areca taro
2.3.2 不同發芽程度檳榔芋不同球莖部位水分遷移動態分析 橫向弛豫時間T2的范圍分別為結合水橫向馳豫時間T21(0.1~1 ms)、半結合水橫向弛豫時間T22(1~10 ms)和自由水橫向弛豫時間T23(>10 ms)[18]。在檳榔芋萌發早期發芽部位 LF-NMR測定結果(圖5)中,檳榔芋萌發早期發芽部位主要有3種水分組成,即結合水(T21)、半結合水(T22)及自由水(T23),而圖中在距球莖頂端3~5 cm處的T22與T23之間出現第4個波峰,此處定義為與淀粉相結合的自由水T23'[19-20]。表1中隨著發芽程度增加,距球莖頂端 3 cm 處的與淀粉相結合的自由水峰,即T23'峰面積逐漸下降,由短芽芋頭的583.93降至中芽芋頭的445.10,至長芽芋頭處完全消失,表明發芽對淀粉含量的消耗逐漸后移。此外,檳榔芋萌發早期水分遷移是動態變化的,這是由于蛋白質和淀粉等大分子物質參與水解[21-22],整體上橫向馳豫時間逐漸右移,圖5中T23峰結束的橫向馳豫時間由1 cm 處的351.12 ms到 5 cm 處已右移至613.59 ms,說明越靠近芋頭中心部位水分活躍度越高。圖中與球莖頂端距離2 cm處的T23波峰與1 cm處相比呈下降趨勢,與圖4所測的水分含量相對應。由表1可知,整體上結合水T21峰面積隨著芋頭早期萌芽長度的增加而減少,半結合水T22峰面積的變化與之相反,表明隨著檳榔芋萌芽長度的增加,結合水會逐漸向半結合水轉變。
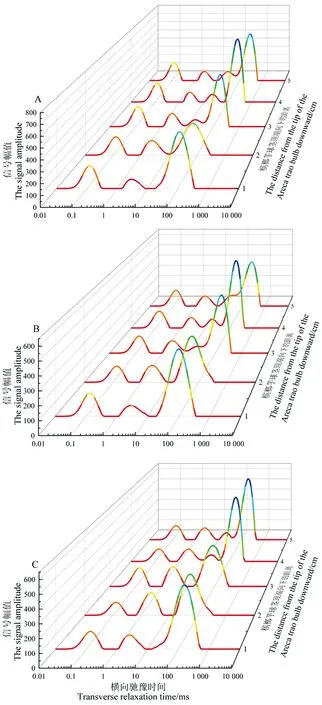
圖5 短芽(A)、中芽(B)及長芽(C)檳榔芋的T2馳豫圖譜Fig.5 Spectra of T2 relaxation of short bud (A), medium bud (B) and long bud (C) Areca taro
2.3.3 不同發芽程度檳榔芋的不同球莖部位核磁共振成像結果 食品各水分的分布及變化情況可以通過無損的核磁共振成像技術進行檢測[23-24]。圖6為3種不同發芽程度檳榔芋發芽部位核磁共振成像圖,圖片經調色后,能夠更直觀看出檳榔芋發芽部位的水分分布。根據 T2加權成像原則,含水率高的部分信號區域顯亮,含水率低的部分信號區域顯暗[25],經過調色后,圖中含水率越高的部分紅色信號越明顯,黃色信號表示含水率較低,綠色信號地方含水率最低。
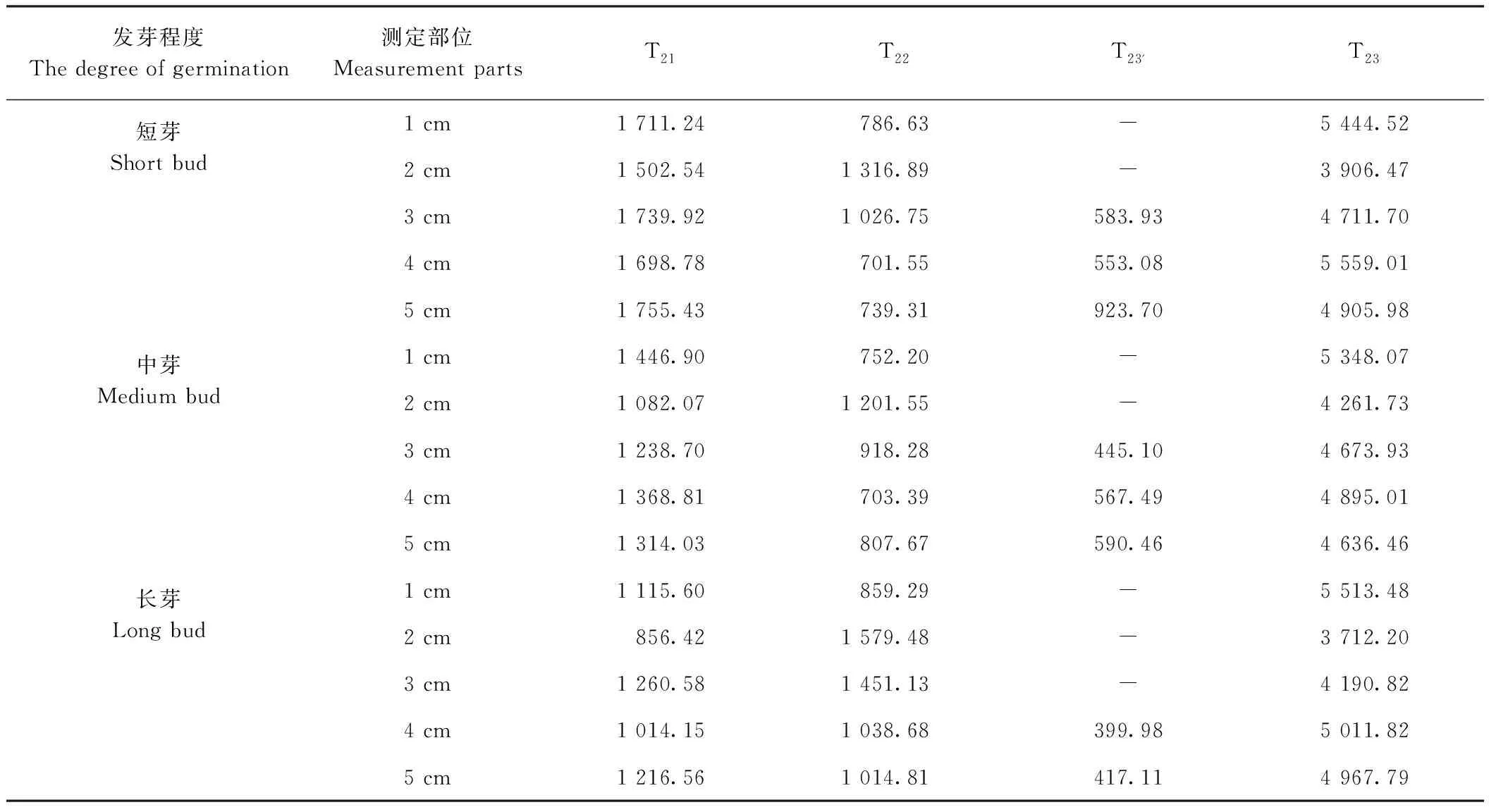
表1 T2馳豫圖譜峰面積表Table 1 Peark area of spectra of T2 relaxation
如圖6所示,檳榔芋組織中的粗纖維主要為黃色區域,表明樣品組織中粗纖維含水率較低。圖中樣品邊緣的紅色區域較大,表明邊緣含水率較高,主要原因是對樣品切分導致水分向邊緣富集。整體而言,圖中3種不同發芽程度檳榔芋距球莖頂端2 cm處均表現為紅色區域面積較小,表明在整個芋頭發芽部位處距球莖頂端2 cm處含水率最低,與圖4及圖5的結果一致。短芽中所觀察到的紅色區域最多(圖6-A),而長芽觀察到的紅色區域最少(圖6-C),說明3種發芽長度檳榔芋中短芽芋頭的含水率最高。

圖6 短芽(A)、中芽(B)及長芽(C)檳榔芋的核磁成像圖Fig.6 Magnetic resonance images of short bud (A), medium bud (B) and long bud (C) Areca taro
2.4 不同發芽程度檳榔芋不同部位的激素含量變化
不同發芽程度檳榔芋距球莖頂端1~2 cm處的塊莖、芽及根須的內源ABA及GA3含量變化如圖7所示。結果表明,不同發芽程度檳榔芋不同部位的ABA及GA3含量有所不同,ABA含量與GA3含量的動態平衡可促進貯藏期檳榔芋早期萌發。大量研究證實,ABA可誘導種子休眠并延遲萌發[26-27]。由圖7-A可知,短芽及中芽芋頭組2個部位的ABA激素均為芽部位含量最低,分別為0.65、0.76 μg·g-1,均與根須部位呈顯著性差異,而與塊莖部位差異不顯著。短芽及中芽芋頭組3個部位的ABA含量變化規律基本一致。長芽組3個部位的ABA含量呈現輕微波動,均無顯著差異。GA3能解除休眠,促進萌發[28]。由圖7-B可知,短芽芋頭組3個部位的GA3含量無顯著差異,表明短芽芋頭組3個部位的生長趨勢一致。中芽芋頭組根須部位的GA3含量最低,為1.10 μg·g-1,芽部位GA3含量最高,為2.61 μg·g-1,兩者呈現顯著性差異(P<0.05),表明中芽芋頭組芽部位為生長優勢部位。長芽芋頭組頂端塊莖部位GA3含量最低,為1.34 μg·g-1, 芽部位GA3含量最高,為2.53 μg·g-1,兩者呈現顯著性差異(P<0.05),表明長芽芋頭組芽部位為生長優勢部位。

圖7 發芽檳榔芋不同部位的ABA、GA3含量變化Fig.7 Changes of ABA and GA3 content in different positions of germinated Areca taro
3 討論
本研究分析3種不同發芽程度檳榔芋的淀粉、蛋白質、水分含量及遷移狀態與激素水平變化等指標,發現檳榔芋球莖頂端淀粉及蛋白質含量隨發芽程度的增加而減少,表明檳榔芋早期萌發會降解接近球莖頂部的營養物質,且對淀粉及蛋白質的降解按頂端至中心的方向進行。Jia等[29]研究發現發芽會使馬鈴薯的淀粉及蛋白質含量損失。Elbaloula等[30]研究表明隨著高粱種子發芽時間的延長,高粱面粉的淀粉、蛋白質濃度下降,其原因是淀粉和蛋白質在萌發過程中分別被降解為可溶性糖和氨基酸。因此,檳榔芋發芽過程中的淀粉及蛋白質可能被降解為低分子量的可溶性糖及氨基酸,為芽的生長提供能量。
檳榔芋萌芽早期的水分含量及水分狀態是不斷變化的,可以從外部環境中吸水,且在萌發時存在著復雜的化學反應,3種不同發芽程度檳榔芋距球莖頂端2 cm處的水分含量與1 cm處相比均顯著降低,通過LF-NMR檢驗及核磁共振成像均顯示出相同的結果。通過LF-NMR檢驗發現檳榔芋發芽芽點部位主要存在3種水分:自由水、半結合水、結合水,距球莖頂端3~5 cm處存在第4種水分,即與淀粉相結合的自由水,這部分水隨發芽程度增加而后移,與發芽過程中的淀粉降解密切相關[31];橫向弛豫時間T2反映了樣品內部氫質子的自由度及其所受耦合力的大小[32]。橫向弛豫時間T2越長,與樣品內部其他成分相互作用力越弱[33]。隨著檳榔芋發芽長度增加,結合水峰面積減少,半結合水峰面積增加,結合水向半結合水轉變。通過核磁共振成像結果發現,短芽芋頭組紅色信號最強,長芽芋頭組紅色信號最弱,表明短芽芋頭組含水率最高,長芽芋頭組含水率最低,說明檳榔芋萌芽會使不同芽點部位的含水率下降。水分是種子萌發的首要條件,自由水的存在是種子生命活躍度提升的必要條件[34]。劉素軍[35]研究表明,土壤相對含水量為55%和40%時,馬鈴薯發芽較70%土壤相對含水率晚一周左右。以上結果表明,檳榔芋萌發需要消耗水分,因此在實際種植中需要保持較高的環境濕度。
ABA含量與GA3含量的動態平衡可促進檳榔芋早期萌發。在植物激素水平上,隨著ABA積累,種子發育過程中種子的休眠開始建立和維持,而休眠期種子控制GA3生物合成的基因是否下調目前尚不清楚[36]。在根發育過程中,植物通過生長素和脫落酸的平衡來控制根的發育,生長素誘導根的生長和延伸,而ABA則在一定程度上抑制根系發育[37]。Eren等[38]采用茄子種子進行內源激素分析表明,萌發率高的種子ABA含量降低。短芽與長芽檳榔芋根須部位的GA3含量顯著高于ABA含量,可誘導根須的生長及延伸。3種發芽長度檳榔芋的芽部位ABA含量表現為根須部位含量最高,芽部位最低,而GA3含量變化與之相反,表現為芽部位含量最高,塊莖部位較低,根須部位最低,呈現芽部位的生長優勢,利于芽的延伸。除ABA和GA3外,種子的休眠和萌發還受生長素(auxin, IAA)、乙烯(ethylene, ETH)、細胞分裂素(cytokinin, CTK)等激素影響[39]。因此,需要進一步研究各種激素調控檳榔芋早期萌發的分子機制,以期更好地了解檳榔芋萌發機理。
4 結論
本研究結果表明,檳榔芋主要通過消耗球莖頂部淀粉、蛋白質及水分等營養物質實現早期的萌芽與生長,并隨萌芽長度的增加,球莖頂部的結合水逐漸向半結合水轉變;同時通過上調GA3含量,使GA3含量高于ABA,從而實現芽、塊莖、根須這3個部位的生長,達到促進檳榔芋早期萌發生長的效果。

