晚期早產(chǎn)新生兒呼吸窘迫綜合征臨床特征分析*
何金孝 宋燁 樊蕊 李敬嫻
(空軍軍醫(yī)大學(xué)第一附屬醫(yī)院兒科,陜西 西安 710032)
新生兒呼吸窘迫綜合癥(Neonatal respiratory distress syndrome,NRDS)是由于肺表面活性物質(zhì)(Pulmonary surfactant,PS)缺乏或伴結(jié)構(gòu)不成熟所致的進(jìn)行性呼吸困難,多發(fā)生于早產(chǎn)兒,嚴(yán)重者會發(fā)生進(jìn)行性低氧血癥和呼吸衰竭,甚至死亡,是影響早產(chǎn)兒死亡率和致殘率的主要病因[1]。晚期早產(chǎn)兒(Late preterm infants,LPI)指胎齡為≧34周出生的新生兒,而由于LPI胎齡、體重相對大,并被認(rèn)為“肺發(fā)育基本成熟”,其呼吸窘迫被部分兒科醫(yī)師忽略[2]。經(jīng)典的外源性PS替代治療并不能達(dá)到很好的效果,根據(jù)相關(guān)報道及數(shù)據(jù)統(tǒng)計顯示,患有呼吸窘迫綜合征的LPI死亡率在40%~50%,成為造成早產(chǎn)兒死亡和神經(jīng)系統(tǒng)后遺癥的另一主要因素[3]。國內(nèi)外大量流行病學(xué)統(tǒng)計發(fā)現(xiàn)胎齡≧34周LPI在新生兒監(jiān)護(hù)室中的住院率逐年增加,也是近年來早產(chǎn)兒出生率增加的主要構(gòu)成因素,占全部早產(chǎn)兒的60%[4-5]。LPI和早期早產(chǎn)兒(Early preterm infant,EPI)RDS在發(fā)病高危因素、臨床表現(xiàn)、治療效果及并發(fā)癥方面等存在明顯差異,目前LPI高危因素研究和治療上還需要進(jìn)一步分析總結(jié),以滿足當(dāng)前的救治需要。因此,本研究回顧性分析了本院娩出并與新生兒監(jiān)護(hù)室治療的早產(chǎn)兒RDS的臨床資料,分析其臨床特征,現(xiàn)報告如下。
1 資料與方法
1.1 對象及分組 將2017年9月~2018年9月在我院出生的出現(xiàn)呼吸窘迫的早產(chǎn)兒,按出生胎齡分為早期早產(chǎn)兒(EPI)組(<34周)171例和晚期早產(chǎn)兒(LPI)組(34~37周)76例。納入標(biāo)準(zhǔn):均符合RDS診斷標(biāo)準(zhǔn)[6],為生后不久出現(xiàn)呼吸急促、呼氣性呻吟 、吸氣性三凹征,并進(jìn)行性加重,出現(xiàn)低氧血癥、呼吸衰竭不能完全由心力衰竭來解釋,胸部X線片提示雙肺彌漫性透光度減低。 排除標(biāo)準(zhǔn):存在嚴(yán)重先天性心臟病 、新生兒胎糞吸入、先天性遺傳代謝疾病或其他嚴(yán)重的先天畸形者。
1.2 嚴(yán)重度和機(jī)械通氣標(biāo)準(zhǔn) 臨床嚴(yán)重度根據(jù)生后6小時內(nèi)初次胸片結(jié)果,分為輕度(Ⅰ-Ⅱ級)和中重度(Ⅲ-Ⅳ級)[6]。 需要氣管插管機(jī)械通氣及重復(fù)應(yīng)用PS指征:經(jīng)無創(chuàng)持續(xù)正壓通氣(nCPAP)治療病情改善不明顯或繼續(xù)加重,F(xiàn)iO2≥0.6時,PaO2/FiO2<300 mm Hg,或血氣分析動脈PaO2<50 mm Hg(或SpO2< 85%);PaCO2>70 mm Hg伴 pH<7.2;反復(fù)呼吸暫停發(fā)作;符合應(yīng)用氣管插管行機(jī)械通氣治療的其他情況。
1.3 方法 收集并分析研究對象的一般情況、孕母高危因素、分娩方式、臨床診療經(jīng)過、并發(fā)癥及預(yù)后轉(zhuǎn)歸等情況。
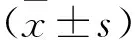
2 結(jié)果
2.1 兩組早產(chǎn)兒一般情況 RDS發(fā)生率仍以EPI占多數(shù),男嬰RDS發(fā)病率高達(dá)68%,這一性別差異在LPI組中尤其明顯(P<0.05);與EPI組極低出生體重不同,LPI出生體重>1500 g者多見(87%),差異具有統(tǒng)計學(xué)意義(P<0.05);而產(chǎn)前是否足療程應(yīng)用地塞米松兩組間無顯著差異(P>0.05),見表1。

表1 兩組早產(chǎn)兒一般情況比較(n)Table 1 Clinical variables in groups EPI and LPI
2.2 兩組早產(chǎn)兒RDS高危因素 EPI組以妊娠期高血壓致早產(chǎn)發(fā)病比率高(37.4%),LPI組以孕母妊娠期糖尿病(31.5%)、宮內(nèi)感染(40.7%)所致早產(chǎn)發(fā)病比率高,差異有統(tǒng)計學(xué)意義(P<0.05)。而LPI組以急診剖宮產(chǎn)娩出(71%)為主,剖宮產(chǎn)率較EPI組高,差異有統(tǒng)計學(xué)意義(P<0.05)。兩組在胎膜早破、胎盤異常、雙胎妊娠、高齡產(chǎn)婦及不明原因早產(chǎn)等方面,無明顯統(tǒng)計學(xué)差異(P>0.05),見表2。

表2 兩組早產(chǎn)高危因素比較(n)Table 2 Comparison of high risk factors for preterm labor between two groups
2.3 兩組早產(chǎn)兒RDS臨床特點及并發(fā)癥 與EPI組生后盡早預(yù)防性PS給藥不同,LPI組RDS發(fā)生時間晚,首次PS應(yīng)用時間明顯晚于EPI組,且PS、nCPAP治療效果差,需要重復(fù)應(yīng)用PS、機(jī)械通氣和抗生素,延長使用比例增高,差異有統(tǒng)計學(xué)意義(P<0.05)。在并發(fā)癥方面,EPI組易發(fā)生呼吸暫停,LPI組肺動脈高壓、氣胸、PDA持續(xù)開放等發(fā)生率均高于EPI組,差異有統(tǒng)計學(xué)意義(P<0.05)。見表3。
表3 兩組早產(chǎn)兒臨床特點及并發(fā)癥比較Table 3 Comparison of clinical characteristics and complications between two groups
2.4 兩組早產(chǎn)兒呼吸支持 與EPI組比較,LPI組開始nCPAP治療的時間晚、失敗率高,機(jī)械通氣開始時間早、持續(xù)時間長,高頻震蕩使用率高,差異有統(tǒng)計學(xué)意義(P<0.05)。而EPI組需要nCPAP支持治療時間更長,加脫機(jī)常壓氧療,總用氧時間明顯長于LPI組,差異有統(tǒng)計學(xué)意義(P<0.05),見表4。
表4 兩組早產(chǎn)兒呼吸支持比較Table 4 Comparison of respiratory support between two groups
2.5 轉(zhuǎn)歸 LPI組76例均治愈出院,平均住院時間(16 ± 7.6)d;EPI組治愈168例,放棄2例,死亡1例,18 例合并慢性支氣管肺發(fā)育不良。
3 討論
PS缺乏是新生兒RDS發(fā)病根本病理基礎(chǔ),PS于胎齡24周左右開始合成,隨胎齡增長逐漸增多,直到胎齡35周左右迅速增多,所以胎齡越小,越易發(fā)生RDS[7]。以往,外源性PS替代治療是早產(chǎn)兒RDS的公認(rèn)最有效的治療方法。胎齡>34周后肺部基本成熟[8],近年LPI出生率逐漸增多,其RDS發(fā)生率也同期增加,造成早產(chǎn)兒死亡率和NRDS發(fā)病率不斷攀升[9-10]。
本研究中RDS發(fā)生率仍以EPI占多數(shù),男嬰RDS發(fā)病率高達(dá)68%,而這一性別差異在LPI組中尤其明顯(P<0.05)。男性嬰兒體內(nèi)雄性激素會抑制 PS的合成,而女性嬰兒體內(nèi)雄性激素水平極低,對PS的合成抑制作用顯然是微不足道的 。本研究顯示,相對于早產(chǎn)兒,男嬰的發(fā)病率比女嬰高,且LPI男嬰的影響程度更大,病情更危重。性別因素是晚期早產(chǎn)兒RDS的一個重要高危因素,其原因可能是過量雄性激素誘導(dǎo)肺泡Ⅱ型細(xì)胞的發(fā)育延遲及抑制PS 釋放,而雌激素有助于PS 的合成,雄激素?zé)o此功能[11]。
EPI因胎齡小,各器官發(fā)育均不成熟,因此出生體重大部分為極低出生體重兒甚至超低出生體重兒,圍生期醫(yī)務(wù)人員對其的早期復(fù)蘇、護(hù)理及呼吸支持都非常關(guān)注,而LPI出生體重>1500 g者多見(87%),這一部分新生兒有“體重達(dá)標(biāo)”的假象,使其容易被忽視。數(shù)據(jù)資料顯示LPI體重并不能完全作為其器官功能成熟度的標(biāo)準(zhǔn)。
本研究中EPI組產(chǎn)前使用地塞米松比例為74%,而LPI組僅為65.8%,差異無統(tǒng)計學(xué)意義(P>0.05)。2019版歐洲新生兒呼吸窘迫綜合征防治指南建議孕齡小于35周有早產(chǎn)風(fēng)險的孕婦產(chǎn)前應(yīng)用皮質(zhì)激素治療[12]。圍生期醫(yī)務(wù)人員通過評估孕母和胎兒各方面情況,很多高危早產(chǎn)兒通過產(chǎn)科醫(yī)生的積極措施可保胎治療到34周以后,甚至近足月,可能是目前擇期分娩的LPI產(chǎn)前地塞米松應(yīng)用率低于EPI無明顯差別的原因[13],這與我們的臨床研究數(shù)據(jù)一致,說明在現(xiàn)今醫(yī)療水平下產(chǎn)前激素應(yīng)用已作為早產(chǎn)兒產(chǎn)前管理的常規(guī)干預(yù)措施,但其對于防治早期早產(chǎn)兒呼吸窘迫綜合征發(fā)生有臨床意義,與晚期早產(chǎn)兒的相關(guān)性不大。
本研究顯示LPI組中合并宮內(nèi)感染者占40.7%,合并妊娠期糖尿病者31.5%,兩者均明顯高于EPI組(P<0.01),提示宮內(nèi)感染可能為LPI發(fā)生RDS的高危因素之一,且外源性PS替代治療效果欠佳,也可能與宮內(nèi)感染有關(guān),相關(guān)研究也闡述了這一觀點[14-15]。可能機(jī)制為發(fā)生感染后,炎癥因子破壞胎肺血管結(jié)構(gòu),使肺毛細(xì)血管通透性增加,肺液增加及肺泡磷脂雙分子層受損,導(dǎo)致PS合成減少、活性降低。目前有研究及臨床數(shù)據(jù)顯示,胰島素抵抗和與胎兒肺成熟度延遲可能有關(guān)[16]。研究指出,具有高胰島素水平的孕母可能通過胎盤代謝或者遺傳機(jī)制影響胎兒的胰島素水平,拮抗腎上腺皮質(zhì)激素,可抑制肺表面活性物質(zhì)的合成和分泌,導(dǎo)致肺膨脹不良[17]。本研究顯示,EPI組急診剖宮產(chǎn)率為57.3%,而LPI組高達(dá)71%。有研究表明,剖宮產(chǎn)胎兒發(fā)生RDS的風(fēng)險較陰道分娩新生兒要高,這是因為未發(fā)動產(chǎn)程的剖宮產(chǎn)術(shù),嬰兒未經(jīng)過孕婦子宮的規(guī)律收縮,沒有經(jīng)過應(yīng)激反應(yīng),兒茶酚胺和糖皮質(zhì)激素分泌,使肺液吸收延遲,PS分泌和活性受影響,最終導(dǎo)致肺泡塌陷及呼吸功能障礙,引發(fā)RDS[18]。同時剖宮產(chǎn)也成為再次妊娠醫(yī)源性早產(chǎn)及RDS的高危因素。
本研究中EPI組RDS發(fā)生時間、給予首劑PS替代治療和nCPAP的時間均早于LPI組,且聯(lián)合/單用PS+無創(chuàng)輔助通氣治療成功率高,而LPI組PS重復(fù)給藥率38.2%,nCPAP支持呼吸治療失敗率42.1%,均高于EPI組,且病情進(jìn)展快,需盡早使用常頻機(jī)械通氣,甚至高頻震蕩通氣支持治療。 LPI組機(jī)械通氣和抗生素使用時間長,其原因可能為LPI組出生胎齡、體重大,主管醫(yī)護(hù)人員重視程度不夠,且RDS起病晚,病情復(fù)雜、進(jìn)展極快,臨床觀察不及時,導(dǎo)致PS和呼吸支持給予時間較晚,錯過最佳干預(yù)時間,繼發(fā)重要臟器功能障礙,增加治療難度。
LPI組發(fā)生肺動脈高壓、氣胸和持續(xù)肺動脈導(dǎo)管(PDA)開放的比例高于EPI組。與EPI組不同,LPI組RDS常繼發(fā)肺動脈高壓,呼吸困難加重,治療難度加大,絕大部分需要機(jī)械通氣治療,同時部分患兒需要降低肺動脈壓治療。LPI組呼吸支持治療較晚,低氧血癥和酸中毒可能是其發(fā)生 PPHN 的病因,而呼吸暫停、肺出血等LPI組發(fā)生率并不高于EPI組,因此本研究認(rèn)為LPI因在常規(guī)nCPAP模式參數(shù)不能滿足氧合需求,需不斷調(diào)高參數(shù),反而可能增加呼吸機(jī)相關(guān)并發(fā)癥,此時應(yīng)積極給予機(jī)械通氣。根據(jù)早產(chǎn)兒RDS專家共識[19-20],生后即刻給予nCPAP治療及推薦采用氣管插管-PS-快速拔管(Intubation-surfactant-extubation,INSURE)策略是早期防治早產(chǎn)兒RDS的優(yōu)化方案。因此,多次重復(fù)使用PS替代治療促肺復(fù)膨,并早期持續(xù)機(jī)械通氣支持呼吸,是晚期早產(chǎn)兒RDS救治成功率的關(guān)鍵。
4 結(jié)論
LPI RDS以急診剖宮產(chǎn)為主,孕母妊娠期糖尿病、宮內(nèi)感染可能為其高危因素,不同于EPI PS原發(fā)合成不足,多重因素導(dǎo)致繼發(fā)性PS合成或結(jié)構(gòu)異常可能是LPI RDS的病理基礎(chǔ)。而出生體重越大不能代表肺成熟度越高,PS替代治療有效,但PS療效持續(xù)時間短,需及時重復(fù)使用。LPI生后密切觀察呼吸變化,及時機(jī)械通氣,減少肺出血、肺動脈高壓等并發(fā)癥的發(fā)生,可縮短總用氧時間、住院天數(shù)、住院總費用。臨床應(yīng)該更加重視LPI RDS的高危因素分析,密切觀察呼吸情況,積極施于更加合理的綜合治療措施,以提高早產(chǎn)兒救治及減少不良預(yù)后。

