初中化學(xué)計算題的解題策略教學(xué)分析
黃曉春
(江蘇省泰州市姜堰區(qū)實驗初級中學(xué) 225500)
計算題是初中化學(xué)教學(xué)中一類重要的題型,對初中生計算能力、思維能力具有較高要求,尤其是初中化學(xué)本身涉及到眾多的題型,不同題目涉及到不同求解思路與方法,甚至同一道化學(xué)題也可能會有不同種求解方法.但是不同求解方法的求解效率與準(zhǔn)確度卻各不相同,為了使學(xué)生可以游刃有余地應(yīng)對化學(xué)計算題,必須要注意切實將一些常用的解題策略傳授給他們,加強專項解題策略指導(dǎo)教學(xué)顯得尤為重要.
1 初中化學(xué)計算題的特征
計算題是初中化學(xué)考試中一種非常典型的類型題,是初中化學(xué)考試的必考內(nèi)容,其本身具有如下幾大基本特征:一是多樣化特性,即化學(xué)計算題具有眾多的種類,如溶液計算題、化合價計算題、化學(xué)式計算題、化學(xué)方程式計算題等等,不同類型計算題本身涉及到不同計算方法及技巧,所以必須要使學(xué)生掌握必要的解題技法.二是綜合性特征,化學(xué)計算題本身具有比較突出的綜合性特征,主要表現(xiàn)為各種化學(xué)計算題不單單是考查某一個化學(xué)知識點或者針對某一個化學(xué)問題,而是綜合了許多方面的化學(xué)知識點與問題,甚至需要學(xué)生本身強化學(xué)科融合理念,在求解化學(xué)計算題中充分地融入化學(xué)學(xué)科以外的相關(guān)學(xué)科知識.只有使學(xué)生掌握多學(xué)科理論知識,借助多樣化問題求解方法運用方可使他們快速求解問題.三是繁雜性,計算題常常作為初中化學(xué)考試的壓軸題存在,整體繁雜性強,對學(xué)生解題能力具有較高要求.
2 初中化學(xué)計算題的特征及解決思路
2.1 守恒法
守恒法是求解化學(xué)計算題中比較多用的一種方法,主要是以化學(xué)反應(yīng)為基礎(chǔ),根據(jù)反應(yīng)前后各種反應(yīng)物的“量”保持不變這一機理來列出求解問題的等式方程.其中的“量”主要體現(xiàn)在原子微粒數(shù)、電荷數(shù)、電子數(shù)、元素與質(zhì)量等方面,其中初中階段計算題求解中最為多用的是以質(zhì)量為指標(biāo)的守恒,即在化學(xué)反應(yīng)前后各種物質(zhì)的總質(zhì)量保持不變.同理,化學(xué)反應(yīng)前后元素、原子類別以及數(shù)目等也是維持不變的.但是要使初中生明確質(zhì)量守恒只能夠用來對化學(xué)變化進行解釋,不涉及分子個數(shù)、體積等方面守恒,也不涉及到那些沒有參與化學(xué)反應(yīng)的雜質(zhì)或物質(zhì)的質(zhì)量.
例1某一學(xué)生在氧氣制取過程中采用混合一定量的二氧化錳與氯酸鉀,之后借助共同加熱的方式來進行氧氣制取,在反應(yīng)之前已知二氧化錳在總混合物中所占比例為20%,試求反應(yīng)達到二氧化錳占總混合物質(zhì)量25%的時候氯酸鉀的分解率.
解析在上述這一氧氣制取反應(yīng)當(dāng)中,二氧化錳起到催化作用,本身不參與化學(xué)反應(yīng),所以可以確定其質(zhì)量在整個反應(yīng)中不會改變.假定加熱之前混合物的總質(zhì)量為a,那么其中二氧化錳質(zhì)量則是0.2a.假定化學(xué)反應(yīng)完畢后混合物的總質(zhì)量為b,那么這時候二氧化錳質(zhì)量則相應(yīng)地為0.25b.然后基于質(zhì)量守恒可知,0.2a=0.25b,即b=0.8a,在此基礎(chǔ)上可以繼續(xù)指導(dǎo)學(xué)生運用質(zhì)量守恒法來明確化學(xué)反應(yīng)生成O2的質(zhì)量實際上就是化學(xué)反應(yīng)前后混合物質(zhì)量之差,即:a-b=a-0.8a=0.2a,并假定此時分解氯酸鉀的質(zhì)量為x,則可以相應(yīng)地列出如下等式方程:
245 96
x0.2a

由此可知,反應(yīng)達到二氧化錳占總混合物質(zhì)量25%的時候氯酸鉀的分解率為:0.51a÷0.8a×100%=0.64×100%=64%.
2.2 差量法
差量法也是以化學(xué)反應(yīng)為基準(zhǔn),根據(jù)反應(yīng)前后有關(guān)反應(yīng)物或生成物等變化量和某些“差量”之間成正比例關(guān)系來構(gòu)建求解問題等式方程的一種解題方法.具體的應(yīng)用步驟如下:先將實際差量或者已知差量同其所對應(yīng)化學(xué)方程式當(dāng)中的理論差量來構(gòu)建正比例關(guān)系式,之后再結(jié)合列出的比例式進行問題求解.通過對整個解題流程進行逐步簡化,可以提高問題求解的準(zhǔn)確度.
例2在某一容器當(dāng)中裝有10 g由氧化銅粉末和銅構(gòu)成的混合物,在高溫條件下通入足量干燥氫氣,直至混合物的總質(zhì)量不再發(fā)生改變位置.在冷卻混合物之后發(fā)現(xiàn)剩余8.4 g殘余固體,試求原來容器中混合物當(dāng)中氧化銅成分的質(zhì)量.
解析針對本道化學(xué)計算題的求解,由于涉及到2個已知的數(shù)據(jù)10 g和8.4 g,而沒有其他相關(guān)的解題條件.為了可以更好地求解問題,此時可以指導(dǎo)學(xué)生靈活地應(yīng)用差量法來簡化問題求解過程,即:反應(yīng)之后減少的固體質(zhì)量理論差值實際上就是氧化銅中氧元素成分的減少值(理論差量為80-64=16),而實際的減少差值則是10 g-8.4 g=1.6 g.然后可以假設(shè)原有混合物當(dāng)中的氧化銅質(zhì)量為x,那么就可以結(jié)合如下的化學(xué)方程式來進行問題求解:

80 64 80-64=16(理論差值)
x10 g-8.4 g=1.6 g(實際差值)
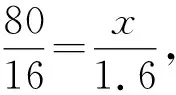
2.3 化學(xué)方程式法
化學(xué)方程式法也是求解化學(xué)計算題時比較多用的一種解題方法,其涉及到廣泛的應(yīng)用范圍,實際運用中需要通過認真分析來明確題干中所涉及到的純凈物,之后再開展轉(zhuǎn)化.假定相應(yīng)化學(xué)計算題中沒有直接給出純凈物參加反應(yīng)的質(zhì)量或者生成物的質(zhì)量,那么就需要結(jié)合已知條件來進行分析,將它們相應(yīng)地轉(zhuǎn)化為穩(wěn)定純凈物的質(zhì)量,之后再將它們帶入到有關(guān)反應(yīng)的化學(xué)方程式中進行求解.
例3現(xiàn)在有一種金屬物質(zhì),其化合價是+a,相對原子質(zhì)量是b,在其同稀鹽酸反應(yīng)之后生成的氫氣的量是1 g,試求該種金屬的質(zhì)量.
解析通過對題干信息進行剖析,可知其中涉及到一些相對較為抽象的內(nèi)容,許多學(xué)生可能求解中不知道如何下手.此時可以指導(dǎo)他們用化學(xué)方程式法求解問題,即借助設(shè)未知數(shù)的手段來解決問題.假設(shè)該種金屬為R,相應(yīng)的質(zhì)量為x,基于題干信息可以相應(yīng)地給出如下反應(yīng)化學(xué)方程式:
ba
xg 1 g

由此可知,該金屬的質(zhì)量為b/ag.
2.4 關(guān)系式法
在化學(xué)計算題求解過程中,關(guān)系式法主要用來對涉及到多個反應(yīng)步驟的化學(xué)反應(yīng)計算題求解當(dāng)中,具體就是緊密聯(lián)系化學(xué)反應(yīng)的本質(zhì),對有關(guān)物質(zhì)彼此之間的代數(shù)式或關(guān)系式進行確定,以此來將多步驟求解及計算進行簡化.
例4在充足的稀硫酸當(dāng)中加入一定量鋅,通過化學(xué)反應(yīng)會相應(yīng)地生成氫氣,這時候在二氧化錳作為催化劑的情況下對12.25 g氯酸鉀進行完全催化來生成氧氣,要想使得2個化學(xué)反應(yīng)中所生成的氧氣和氫氣彼此可以完全進行反應(yīng)來生成水,試求這時候總計需要加入的鋅的質(zhì)量.
解析通過指導(dǎo)學(xué)生對整個計算題的題干信息進行分析,可知其中主要涉及到3個化學(xué)反應(yīng):

在列出上述3個化學(xué)方程式之后,可以繼續(xù)指導(dǎo)學(xué)生明確已知量與未知量之間的相關(guān)性,之后即可對問題進行快速求解,具體關(guān)系式如下:2KClO3-3O2-6H2-6Zn.通過對其進行簡化之后可得:KClO3-3Zn.緊接著可以指導(dǎo)學(xué)生假設(shè)反應(yīng)中鋅的相應(yīng)使用量是x,那么結(jié)合上述關(guān)系式即可確定如下的比例式:
KClO3— 3Zn
122.5 3×65
12.25gx

故需要加入19.5 g鋅.
2.5 平均值法
例5已知有8 g某一金屬氧化物與氧化鎂共同構(gòu)成的混合物,經(jīng)過檢測發(fā)現(xiàn)其中包含有3.6 g氧元素,則該混合物中另一金屬氧化物是( ).
A.FeO3B.CuO C.CaO D.Al2O3
解析經(jīng)過推理及分析可知,氧化鎂中所包含的氧元素質(zhì)量占比是40%,假定8 g的混合物都是由氧化鎂構(gòu)成,那么這時候其中氧元素質(zhì)量則應(yīng)該是:8 g×40%=3.2 g<3.6 g,所以可知混合物中另一種混合物中所包含的氧質(zhì)量分數(shù)必然會比氧化鎂中氧質(zhì)量分數(shù)更大,即要大于40%.通過對上述4個選項中給出的金屬氧化物中氧元素質(zhì)量占比進行計算可知僅有選項D中Al2O3的氧元素質(zhì)量占比大于40.0%(47.0%),這樣就可以使學(xué)生快速確定本道題的正確答案是選項D.
2.6 特殊值法
針對那些不包含具體數(shù)據(jù)的化學(xué)計算題,學(xué)生求解起來常常不知道該如何下手.而本種類型計算題求解中一般主要是確定一個比值,但是不涉及到具體數(shù)據(jù),求解的關(guān)鍵是要使學(xué)生充分理解關(guān)鍵解題題意的基礎(chǔ)上,借助特殊值的導(dǎo)入來快速簡化問題求解流程,如數(shù)字“1”是比較常用的一種問題分析用特殊值,對簡化抽象計算題求解過程有積極意義,是簡化某些繁雜、抽象化學(xué)計算題中非常常用的一種求解問題的方法.
例6現(xiàn)有等質(zhì)量的三氧化硫與二氧化硫,試求二者氧原子數(shù)之比.
解析本道題沒有給出具體的質(zhì)量,所以學(xué)生從整體上進行剖析的過程中容易遇到問題,這時候可以將未給出的質(zhì)量相應(yīng)地假設(shè)為“1”,這樣就可以對兩種物質(zhì)中氧原子數(shù)質(zhì)量之比進行確定,即:2/64∶3/80=5/6.通過這種引入特殊值的方式可以將抽象、繁雜的化學(xué)計算題求解過程進行簡化,這樣可以幫助學(xué)生更加高效地理解及掌握所學(xué)的化學(xué)知識,促進了他們化學(xué)計算題求解能力.但是該種解題方法應(yīng)用的要點是要指導(dǎo)學(xué)生形成“靈變思維”,即可以在求解及分析化學(xué)計算題的過程中快速明確求解問題所必要的解題思路及突破口,保證可以快速簡化學(xué)生求解問題的過程,使他們解題能力不斷提升,避免因為解題思路不夠靈活或者解題方法選用不當(dāng)而直接影響了最終的化學(xué)計算題求解效果.

