GNA15對重型哮喘患兒預后的預測價值
李丹 范宇杭 李耕旭 陳新春 孫國華 李世峰
1唐山市人民醫院兒科(河北 唐山 063001);華北理工大學 2公共衛生學院,3臨床醫學院(河北 唐山 063210)
哮喘是一種以氣道阻塞為特征的慢性呼吸道疾病,在世界范圍內影響大約20%的兒童,低劑量吸入糖皮質激素通常能良好的控制哮喘癥狀。但是約5%的哮喘兒童需要大劑量吸入皮質類固醇或口服皮質類固醇以控制癥狀,或癥狀的發生持續和惡化,此類哮喘即為難治性哮喘(therapyresistant asthma)或重型哮喘(severe asthma,SA)[1]。重型哮喘患兒可能導致不良預后,極大影響患兒的身體和心理發育,甚至危及患兒生命[2]。然而,重型哮喘通常是由處方用藥劑量和癥狀的控制狀態來定義的,目前仍沒有較好的重型哮喘診斷標準,且不同重型哮喘患者的臨床表現和對藥物的反應存在較大的差異[3],因此積極探索重型哮喘的發病機制和診療靶點具有重要的意義。
研究者們認為,哮喘的急性發作與過度炎癥活動有關,其中CD4+的Th2 細胞及其標志性效應細胞因子白介素(interleukin,IL)-4、IL-13 水平升高,以及中性粒細胞活化釋放IL-17a 上調,在成人和兒童哮喘中較早被報道具有明確的致病作用,并導致氣道重塑[4-6]。然而,針對細胞因子阻斷的新藥物療法在臨床反應上存在不一致性。可見,哮喘可能代表一系列不同的病理生理亞表型[7]。針對哮喘的生物信息學研究也發現,輕度哮喘(mild asthma,MA)和重型哮喘患者的轉錄組基因集存在較大的差異。為篩選更適于臨床診斷和預后判定的標志物,本研究中筆者從GEO 數據庫下載了外周血單個核細胞轉錄組測序數據,通過多重生物信息學方法,將與重型哮喘有關的基因集進行系統的評價,篩選出GNA15 基因可能與重型哮喘關系最為密切。GNA15 基因編碼的Gα15 蛋白最早被報道為造血組織和肺組織特異性表達[8],GNA15 通過與G 蛋白偶聯受體(G Protein-Coupled Receptors,GPCRs)相互作用,調節細胞對微環境變化的響應和信號傳導,對免疫細胞功能的調控至關重要[9]。然而GNA15 在哮喘中的臨床價值尚不清楚。本研究旨在分析GNA15 在重型哮喘中的表達和對重型哮喘預后的預測效能,為重型哮喘的臨床診治提供理論依據。
1 資料與方法
1.1 數據集獲取和生信分析截止至2019年8月20日,在GEO 數據庫[10]里下載哮喘兒童外周血單個核細胞基因芯片數據集GSE27011,數據集為54例兒童樣本,分為對照組、輕度哮喘組和重型哮喘組。下載Affymetrix 公司GPL6244 平臺的芯片注釋文件。采用R 軟件對基因表達矩陣進行多組間差異分析、表達聚類分析、基因共表達網絡分析、臨床信息相關性分析。將重型哮喘組顯著升高的基因群與重型哮喘組相關性最高的基因模塊取交集,獲得關鍵基因GNA15。
1.2 病例資料選取2019年9月至2020年12月在唐山市人民醫院兒科確診為哮喘的兒童為研究對象,其中重型哮喘患兒48 例、輕度哮喘患兒34例,患者均符合《兒童支氣管哮喘診斷與防治指南(2016年版)》[3]診斷標準。排除標準:(1)急性感染性疾病;(2)先天性的心肺疾病、臟器功能不全;(3)其他過敏性疾病;(4)研究期內放棄治療;(5)臨床資料不完整;(6)隨訪失訪。選取同時期體檢的健康兒童為對照組30 例。本研究獲得兒童家屬的知情同意,經院內倫理委員會審核通過。
1.3 治療方法所有患兒入院時均采用吸人糖皮質激素(inhaled conicostemid,ICS)結合短效β2 受體激動劑治療,控制哮喘癥狀[3]。
1.4 肺功能指標檢測入院患兒次日清晨測定肺功能,測定前12 h 停止吸人β2 受體激動劑,記錄第1 秒用力呼氣容積占預計值百分比(FEV1%)和最大呼氣峰流速占預計值百分比(PEF%)。
1.5 血清炎癥介質檢測收集兒童晨起空腹血液樣本4 mL,其中2 mL 置于非抗凝管,4 ℃放置2 h,1 000 r/min 離心15 min,獲得血清。采用酶聯免疫吸附試驗(enzyme linked immunosorbent assay,ELISA)試劑盒檢測兒童血清中IL-4 和L-17A(南京建成生物工程研究所)操作步驟參照試劑盒說明書。
1.6 RT-PCR 檢測兒童外周血GNA15 的表達另外2 mL 血液樣本置于乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA)抗凝管,密度梯度離心法分離單個核細胞。采用RT-PCR 檢測兒童外周血單個核細胞GNA15 的表達,總RNA 提取參照TRIzol?(美國Invitrogen 公司)說明書。用第一鏈cDNA 合成試劑盒逆轉錄合成cDNA(北京寶日醫TaKaRa 生物技術有限公司)。PCR 體系參照實時熒光定量PCR 檢測試劑盒(美國賽默飛公司)說明書。GNA15-正向引物:5'-CTA CCA GAA CAT CTT CGT GTC CAT-3';GNA15-反向引物:5'-GCT GAA TCG AGC AGG TGG AA-3'。反應條件如下:94 ℃反應15 s、55~65 ℃反應30 s、72 ℃反應30 s。進行40 個循環,根據ΔΔCt 法計算GAPDH 與GNA15的相對表達。
1.7 重癥哮喘組患兒隨訪所有住院兒童采用復查或電話咨詢的方式每個月隨訪1 次,共均隨訪1年,填哮喘控制測試ATC 評分表。將出現過1 次及以上ATC 評分<20 的患者,記錄為預后較差,反之為預后良好。
1.8 統計學方法采用SPSS 22.0 軟件對數據進行統計學分析,計量資料采用均數± 標準差表示,組間比較采用單因素方差分析,用Levene 法行方差齊性檢驗;計數資料采用例數表示,組間采用χ2檢驗;采用多因素二元logistic 回歸分析重型哮喘患兒預后相關因素;采用受試者工作特征曲線(ROC)評估血液中GNA15 水平預測重型哮喘患兒預后的效能。以P<0.05 表示差異有統計學意義。
2 結果
2.1 三組兒童基本資料比較對照組、輕度哮喘組和重型哮喘組兒童的性別、年齡、體質指數差異均無統計學意義(P>0.05)。重型哮喘組母乳喂養水平與對照組和輕度哮喘組兒童均降低,差異有統計學意義(P<0.05)。與對照組相比,輕度哮喘組兒童的肺功能指標顯著降低,炎癥介質IL-4 和IL-17的含量顯著上調(P<0.05);與輕度哮喘組相比,難治哮喘組兒童的FEV1%指標顯著降低(P<0.05),而PEF%、炎癥介質IL-4 和IL-17 的含量在輕度哮喘組與難治哮喘組之間差異無統計學意義(P>0.05。重度哮喘組有15 例兒童出現預后不良。見表1。
表1 三組兒童基本資料比較Tab.1 General information of subjects in three groups ±s
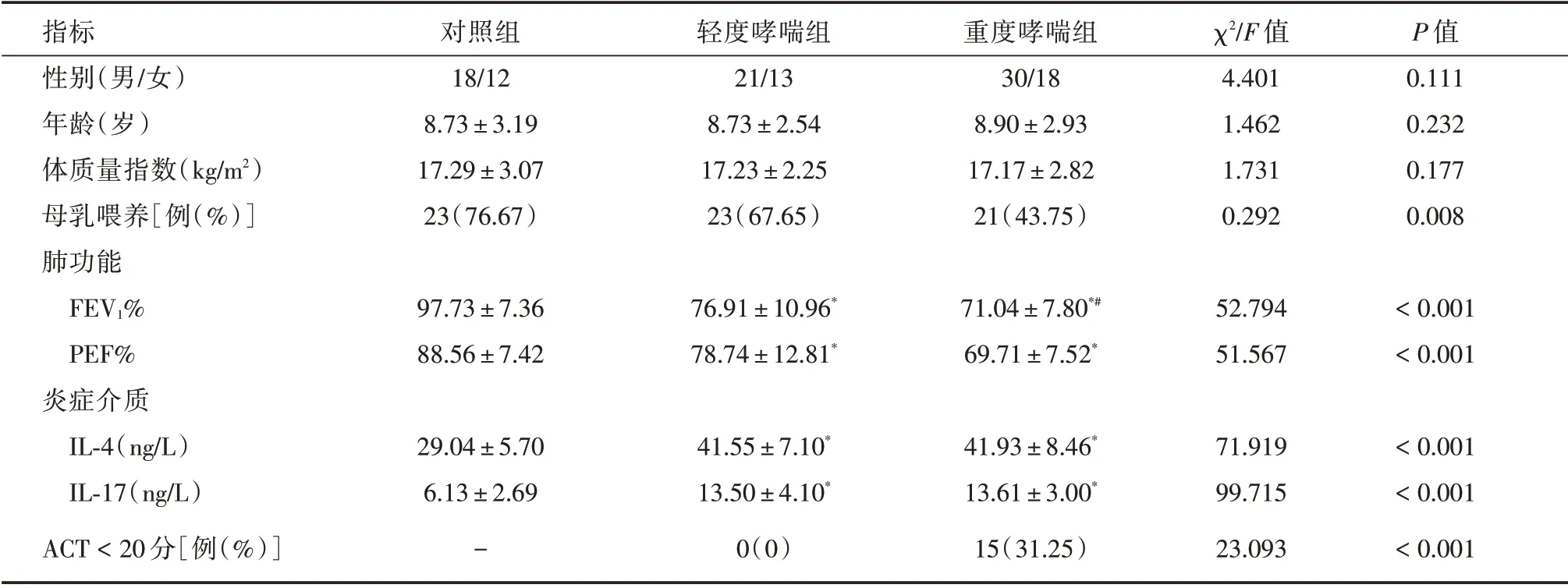
表1 三組兒童基本資料比較Tab.1 General information of subjects in three groups ±s
注:與對照組相比,*P<0.05;與輕度哮喘組相比,#P<0.05
指標性別(男/女)年齡(歲)體質量指數(kg/m2)母乳喂養[例(%)]肺功能FEV1%PEF%炎癥介質IL-4(ng/L)IL-17(ng/L)ACT<20 分[例(%)]對照組18/12 8.73±3.19 17.29±3.07 23(76.67)輕度哮喘組21/13 8.73±2.54 17.23±2.25 23(67.65)重度哮喘組30/18 8.90±2.93 17.17±2.82 21(43.75)χ2/F 值4.401 1.462 1.731 0.292 P 值0.111 0.232 0.177 0.008 97.73±7.36 88.56±7.42 76.91±10.96*78.74±12.81*71.04±7.80*#69.71±7.52*52.794 51.567<0.001<0.001<0.001<0.001<0.001 29.04±5.70 6.13±2.69-41.55±7.10*13.50±4.10*0(0)41.93±8.46*13.61±3.00*15(31.25)71.919 99.715 23.093
2.2 三組兒童血清GNA15 水平的比較與對照組相比,輕度和重度哮喘組兒童外周血GNA15 水平顯著上調(P<0.05);與輕度哮喘組相比,重度哮喘組兒童外周血GNA15 的含量顯著增高(P<0.05),差異均有統計學意義。如圖1。

圖1 三組兒童GNA15 表達水平的比較Fig.1 Comparison of GNA15 expression levels among three groups of children
2.3 重型哮喘患兒預后的單因素分析與預后良好組相比,預后不良組患兒母乳喂養率較低,且外周血中GNA15的含量顯著上調(P<0.05)。其他指標在兩組之間差異無統計學意義(P>0.05),見表2。
表2 重型哮喘患兒預后的單因素分析Tab.2 Univariate analysis of prognosis in SA children with different prognosis ±s
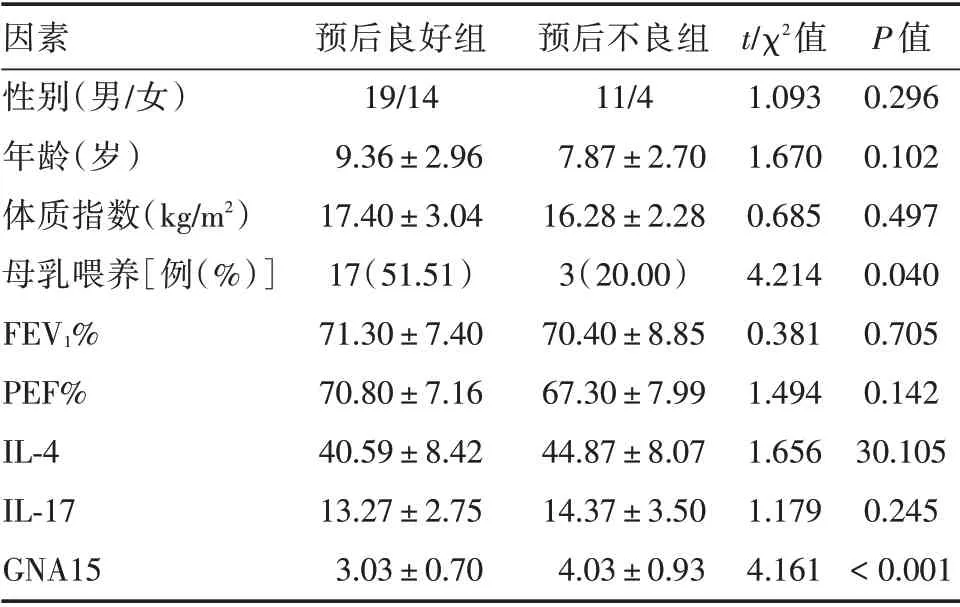
表2 重型哮喘患兒預后的單因素分析Tab.2 Univariate analysis of prognosis in SA children with different prognosis ±s
因素性別(男/女)年齡(歲)體質指數(kg/m2)母乳喂養[例(%)]FEV1%PEF%IL-4 IL-17 GNA15預后良好組19/14 9.36±2.96 17.40±3.04 17(51.51)71.30±7.40 70.80±7.16 40.59±8.42 13.27±2.75 3.03±0.70預后不良組11/4 7.87±2.70 16.28±2.28 3(20.00)70.40±8.85 67.30±7.99 44.87±8.07 14.37±3.50 4.03±0.93 t/χ2值1.093 1.670 0.685 4.214 0.381 1.494 1.656 1.179 4.161 P 值0.296 0.102 0.497 0.040 0.705 0.142 30.105 0.245<0.001
2.4 重型哮喘患兒預后相關因素的logistic 回歸分析將單因素分析中差異有統計學意義的因素納入二分類logistic 回歸分析,GNA15 是預后不良的危險因素(OR=5.117,P<0.05)。見表3。
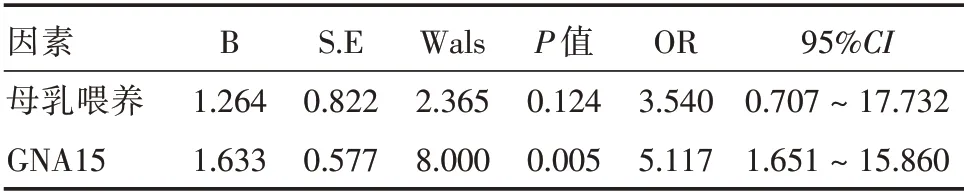
表3 重型哮喘患兒預后相關因素的多因素Logistic 回歸分析Tab.3 Multivariate Logistic regression analysis of prognostic factors in SA children
2.5 血液中GNA15 水平預測重型哮喘患兒預后的效能ROC 曲線分析顯示,GNA15 預測兒童重型哮喘的曲線下面積(AUC)為0.820,靈敏度為0.733,特異性為0.879(P<0.05),見圖2。
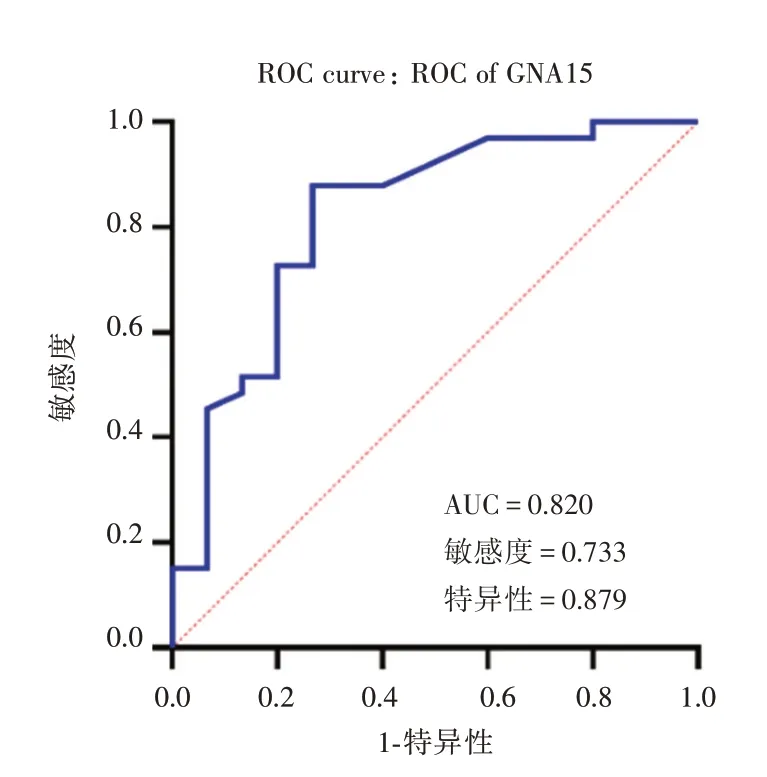
圖2 血液GNA15 預測重型哮喘兒童預后的ROC 曲線圖Fig.2 ROC curve of blood GNA15 predicting prognosis in children with SA
3 討論
哮喘是一種氣道異質炎癥性疾病,GPCRs 在哮喘病理生理學中發揮著重要作用,這一點從臨床上GPCRs 靶向藥物的廣泛應用和臨床開發中GPCRs 靶向藥物候選藥物的數量上得到了證實,如β2-腎上腺素能受體、毒蕈堿乙酰膽堿受體、白三烯和PG 受體、趨化因子受體和腺苷受體激動劑等[11]。雖然目前的哮喘治療方法對大多數哮喘患者有效,但仍有大量哮喘患者控制不良,可能出現哮喘加重。這與哮喘內源性致病因素多樣化和其復雜的生理機制有關。在兒童重型哮喘中,免疫細胞成分存在較大的變異性,有學者認為,重型哮喘患兒不同的炎癥譜背后的機制可能是復雜、多樣的,并與皮質類固醇敏感性有關[12]。隊列研究顯示,炎癥細胞表型是區分輕度哮喘和重型哮喘的重要標準之一[13],本研究通過對外周血單個核細胞基因表達聚類分析,并通過加權基因共表達網絡分析建立了與重型哮喘表型關聯最密切的基因模塊,最終獲得了關鍵基因GNA15,即該基因符合在重型哮喘患兒中特異性高表達的特點,也與重型哮喘具有相關性。
GNA15 編碼的Gα15 蛋白的表達水平受限,主要局限于造血細胞。關于GNA15 的研究國內外文獻報道僅30 余篇,近期在多種疾病臨床樣本的生物信息學分析的關鍵基因中發現存在GNA15,可見GNA15 對人類健康的重要作用[14-15],然而GNA15 的作用機制和相關的臨床驗證數據較少。本研究首次在哮喘患兒外周血中驗證了GNA15 表達上調,并初步分析證實了GNA15 具有一定的預測重癥哮喘患兒預后的效能。有研究[16]顯示,GNA15 與免疫調控關系密切,Gα15 的活化可逃逸β-抑制素(β-arrestin)的監控,可以通過競爭性結合GPCRs 激活Ca2+信號,其基因缺失顯著降低了巨噬細胞中補體C5a 誘導的Ca2+釋放[17]。在肥大細胞中,Ca2+貯存量降低可改變線粒體膜電位,引起細胞脫顆粒,并促進哮喘[18]。急性髓細胞白血病(acute myeloid leukemia,AML)中研究顯示,GNA15 在CD34+造血干細胞中上調,隨著細胞成熟而降低[19],GNA15 在胰腺導管腺癌[20]、肝癌[21]、和食管鱗狀細胞癌[22]以及I 型糖尿病、膿毒病中表達升高,與患者總體生存期較差相關。這與Gα15 調節細胞外信號調節激酶(extracellular signal-regulated kinase,ERK)、核因子(nuclear factor,NF)-κB等信號活化,促進細胞增殖并抑制細胞凋亡有關[19]。Gα15 效應物可靶向ras、p53 等基因,調控細胞活性。本研究也發現GNA15 與患兒FEV1%、PEF%負相關,然而,GNA15 是否可調控氣道重構,以及GNA15 高表達患兒糖皮質激素敏感性降低的原因仍需要更多的基礎和臨床研究探索。

