全球新型冠狀病毒肺炎治療藥物研發態勢分析*
陳 娟,楊瀟逸,嚴 舒,盧 巖,歐陽昭連
(中國醫學科學院醫學信息研究所,北京 100020)
新型冠狀病毒肺炎(簡稱新冠肺炎,COVID-19)疫情仍在全球蔓延,截至2022年5月11日,全球累計確診新冠肺炎病例超5.18億,死亡人數超625萬,累計確診病例超百萬例的國家超過40個。僅2021年12月首周,全球合計新增確診病例就已超450萬例[1]。德爾塔和奧密克戎等新型冠狀病毒(簡稱新冠病毒,SARS-CoV-2)變異毒株的出現,進一步增加了全球疫情發展的不確定性。應對新冠肺炎全球大流行的干預措施主要包括非藥物干預和藥物干預[2]。疫情發生初期,各國廣泛采取檢測、追蹤、隔離、防護等非藥物干預措施控制新冠病毒的傳播,壓平感染曲線,避免醫療資源耗竭[2-4]。新冠病毒疫苗研發成功后,各國陸續啟動免疫接種以構建人群免疫屏障[5-6]。近期,隨著多款治療性藥物臨床試驗的陸續成功,以新冠肺炎治療藥物作為干預措施變得更加重要[7-8]。本研究中全面分析了全球及我國新冠肺炎治療藥物的研發進展,旨在為我國研究機構和企業參與新冠肺炎治療藥物開發,以及我國科技管理部門和藥品監管部門對新冠肺炎藥物的管理提供參考。現報道如下。
1 資料與方法
1.1 數據來源和檢索策略
在Cortellis數據庫中檢索全球及我國新冠肺炎治療藥物的相關記錄,檢索限定適應證為“Coronavirus disease 19 infection”的記錄,且包含“COVID-19”“COVID19”等多種表述方式。檢索日期為2021年12月10日。采用上述檢索策略可檢索出治療性藥物和疫苗,本研究中僅關注治療性藥物,重點關注已上市或進入臨床后期的治療藥物。
1.2 數據分析
采集篩選出的新冠肺炎治療藥物的藥品名、靶點屬性、藥品分類/作用對象、給藥途徑、原研機構、參研機構、既往適應證、新冠肺炎適應證開發階段和開發地點等信息,形成數據集。基于全球數據分析全球新冠肺炎治療藥物研發階段分布,識別主要原研機構,分析在研藥物的主要技術路線、適應證和給藥途徑,給出在主流市場上市的新冠肺炎治療藥物的詳細信息。基于中國數據分析我國新冠肺炎治療藥物的研發階段分布,給出上市藥物及處于Ⅱ期和Ⅲ期臨床試驗在研藥物的技術路線、適應證和開發機構等信息。對于部分重點關注藥物,通過檢索文獻數據庫獲取其療效數據。
2 結果
2.1 全球研發概況
藥物研發階段:共檢索得到871個新冠肺炎治療藥物,其中24個已在至少1個國家/地區上市使用(包括通過正式批準、緊急使用授權、特例審批、應急審批、納入臨床指南推薦等多種途徑上市使用),另有114個處于Ⅲ期臨床試驗階段。24個已上市使用的藥物中,13個在美國、歐盟、日本、英國或中國上市使用(見表1),另外11個在其他地區上市使用(印度4個,Virafin、ZyCoV-D、2-脫氧-D-葡萄糖、伊利組單抗;巴拉圭1個,普克魯胺;波蘭1個,地塞米松磷酸鈉;以色列、巴林和新西蘭1個,一氧化氮鼻噴劑;阿根廷1個,INM-005;俄羅斯1個,樂維利單抗;瑞典1個,地塞米松口溶膜劑;格魯吉亞1個,阿肽地爾)。114個處于Ⅲ期臨床試驗的藥物中,試驗地點在美國、歐洲和日本的分別有62個、17個和8個。同時在美國和歐洲開展Ⅲ期臨床試驗的藥物有12個,詳見表2。
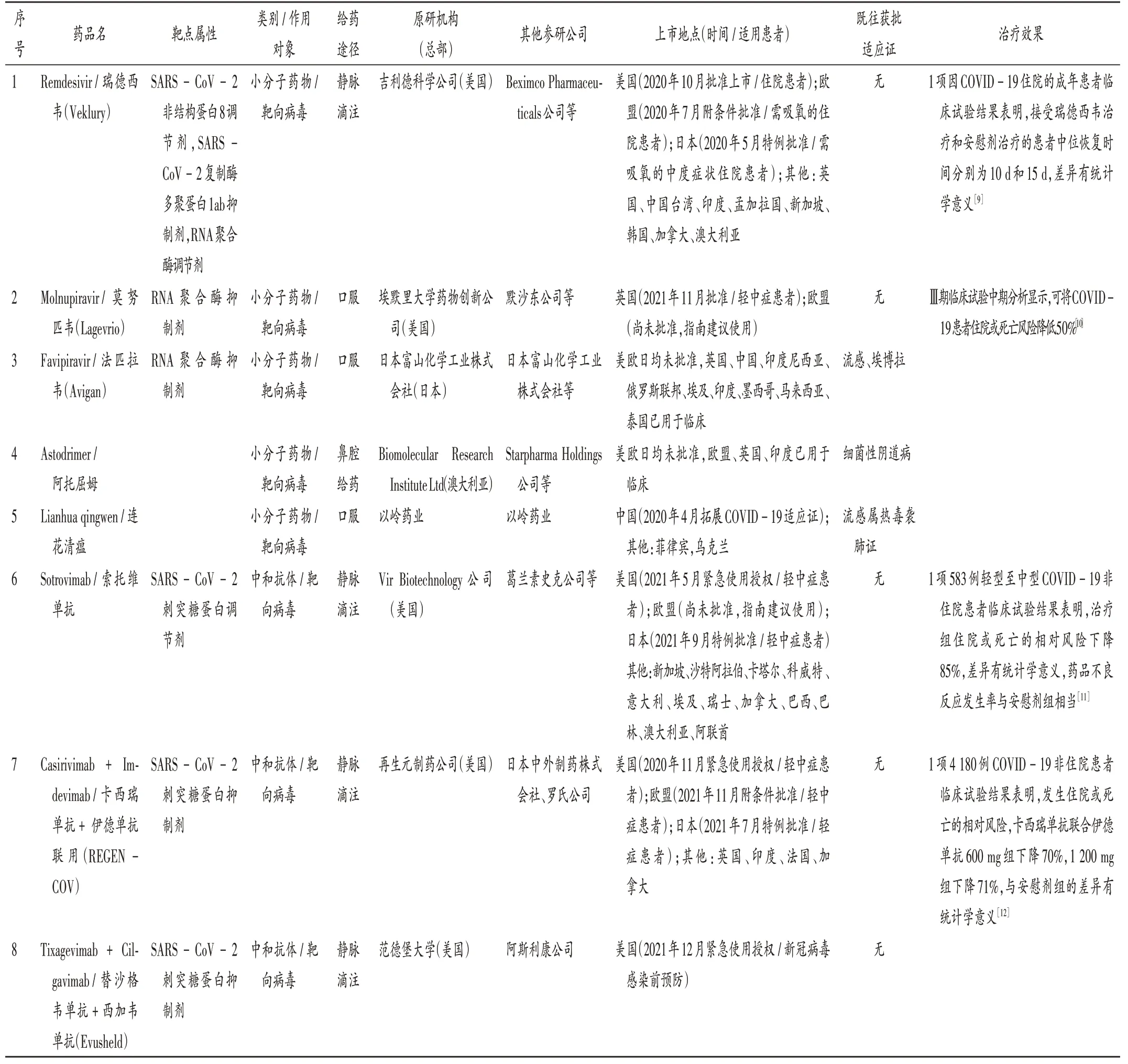
表1 已在美國、歐盟、日本、英國、中國上市的新冠肺炎治療藥物Tab.1 Anti-COVID-19 drugs launched in the United States,the European Union,Japan,the United Kingdom and China
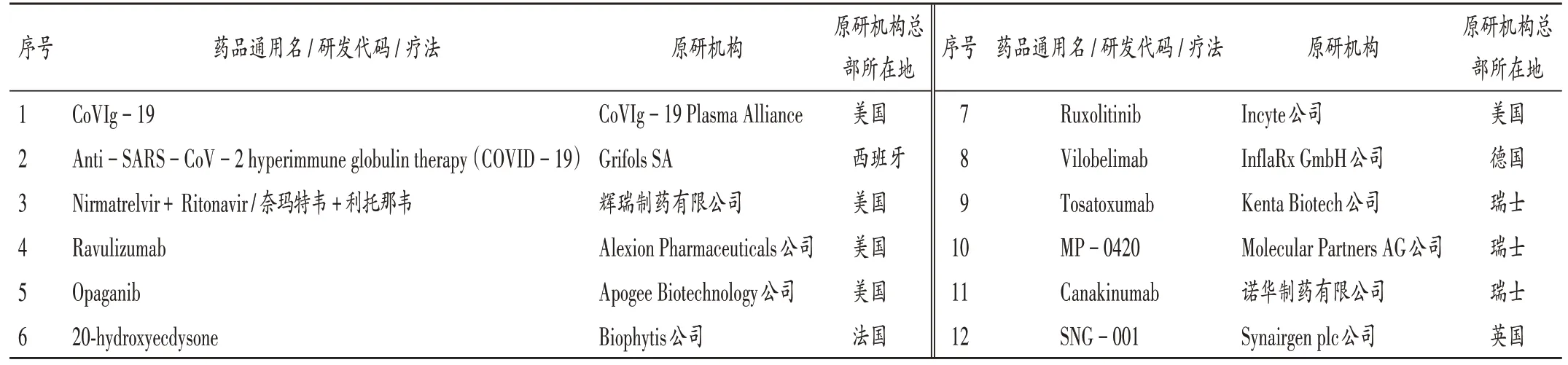
表2 同時在美國和歐洲開展Ⅲ期臨床試驗的新冠肺炎治療藥物Tab.2 Anti-COVID-19 drugs in phaseⅢclinical trials in the United States and Europe at the same time
原研機構分布:全球共29家機構的原研新冠肺炎治療藥物數多于3個(不限研發階段),其中美國Sorrento Therapeutics公司、輝瑞制藥有限公司、NeuroActiva公司及英國阿斯利康公司原研數多于5個。29家原研機構大多分布在美國,中國有2家;22家機構為公司,另外7家為高校或研究所。詳見圖1。
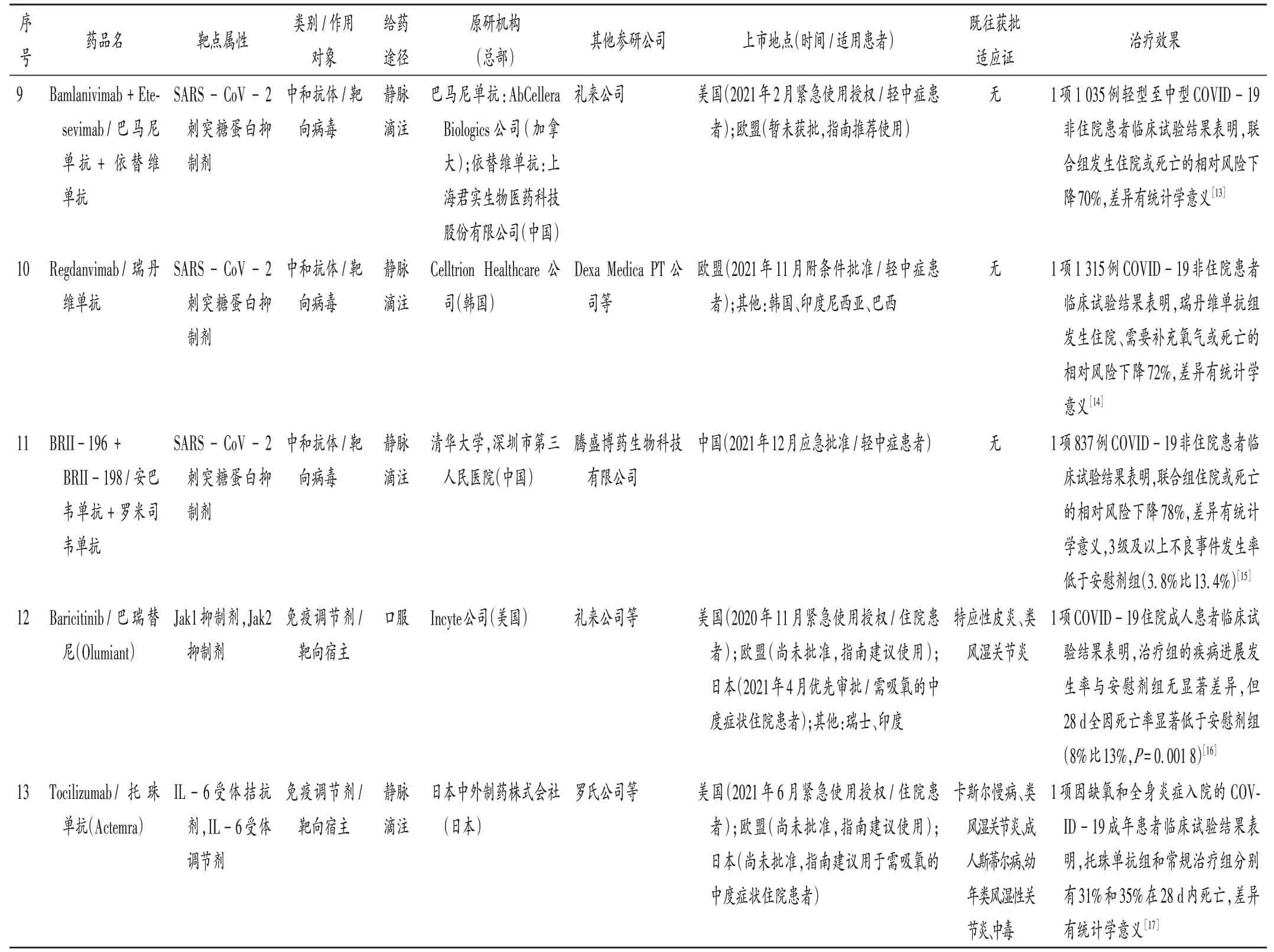
續表1 已在美國、歐盟、日本、英國、中國上市的新冠肺炎治療藥物Continued Tab.1 Anti-COVID-19 drugs launched in the United States,the European Union,Japan,the United Kingdom and China
技術路線:新冠肺炎治療藥物主要包括中和抗體、小分子藥物和免疫調節劑3類,前2類均靶向病毒,第3類靶向宿主。中和抗體主要是通過作用于刺突蛋白抑制病毒入侵,索托維單抗、卡西瑞單抗+伊德單抗(雞尾酒療法)、Evusheld、巴馬尼單抗+依替維單抗(雞尾酒療法)、瑞丹維單抗、安巴韋單抗+羅米司韋單抗(BRII-196+BRII-198,聯合療法)均屬此類。小分子藥物主要靶向病毒復制酶和蛋白酶,瑞德西韋、莫努匹韋和法匹拉韋均屬此類。免疫調節劑以酪氨酸激酶抑制劑(Jak1)和白細胞介素6(IL-6)受體拮抗劑為代表,巴瑞替尼和托珠單抗均屬此類。詳見表1。
適應證、給藥途徑和治療效果:新冠肺炎治療策略主要包括預防感染、減少輕中癥患者住院風險和住院患者死亡風險,部分藥物的療效數據已公開披露。靶向病毒的中和抗體均通過靜脈滴注給藥,Evusheld是目前唯一獲批用于預防新冠病毒感染的藥物,其余中和抗體主要用于輕中癥患者,臨床數據顯示此類藥物可顯著降低住院風險。靶向病毒的小分子抗病毒藥物中,通過靜脈滴注給藥的瑞德西韋用于住院患者可明顯縮短恢復時間,通過口服給藥的莫努匹韋是全球首個靶向病毒的口服治療藥物,可使輕中癥患者住院或死亡風險降低約50%[10],另一個口服治療藥物奈瑪特韋+利托那韋(商品名Paxlovid)可使輕中癥患者的住院或死亡風險降低89%。靶向宿主的免疫調節劑主要用于住院患者,臨床試驗顯示該類藥物可顯著降低患者的死亡率[18]。詳見表1。
2.2 我國研發概況
我國在小分子藥物、中和抗體和免疫調節劑3條技術路線上均進行了布局。目前已有多個藥物進入臨床試驗階段,其中進入Ⅱ期臨床試驗后的藥物有15個,4個在至少1個國家上市,7個處于Ⅲ期臨床試驗階段,另外4個處于Ⅱ期臨床試驗階段。詳見表3。
上市藥物概況:國家藥品監督管理局于2021年12月8日批準安巴韋單抗+羅米司韋單抗聯合用藥。其為中和抗體注射劑,由清華大學、深圳市第三人民醫院和騰盛博藥生物科技有限公司共同研發,可用于輕型和普通型新冠肺炎的治療。臨床試驗結果顯示,該組合療法可使患者住院或死亡的相對風險降低78%[15]。此外,以嶺藥業的老藥連花清瘟已在我國獲批拓展新冠肺炎適應證,用于輕型、普通型新冠肺炎引起的發熱、咳嗽和乏力等癥狀。上海君實生物醫藥科技股份有限公司研發的中和抗體依替維單抗在美國獲批用于輕中癥患者的聯合治療,蘇州開拓藥業股份有限公司研發的雄激素受體拮抗劑普克魯胺在巴拉圭獲緊急使用授權用于住院患者治療。詳見表3。

表3 我國機構原研且進入Ⅱ期臨床試驗階段后的新冠肺炎治療藥物Tab.3 Anti-COVID-19 drugs originally developed by Chinese institutions and have been in the phaseⅡclinical trials
在研藥物概況:我國機構研發的處于Ⅲ期臨床試驗階段的藥物包括中和抗體、小分子藥物和免疫調節劑各2個,處于Ⅱ期臨床試驗階段的藥物包括3個中和抗體和1個小分子藥物。高校、科研院所和企業共同推進相關藥物研發。進度較快的高校和科研院所包括空軍軍醫大學、鄭州大學、中國醫學科學院醫藥生物技術所等,進度較快的企業包括神州細胞工程有限公司、真實生物科技有限公司、沈陽同聯集團有限公司等。
3 討論
新冠肺炎治療藥物的臨床價值在于提高正向結局(如康復、住院天數縮短)發生率或加快正向結局出現時間,或減少負向結局(如重癥或死亡減少、疾病進展時間延長等)[19-20]發生率或推遲負向結局出現時間。對于新冠肺炎高風險人群和密切接觸者,預防性給藥可阻斷病毒進入細胞或復制,避免感染。對于輕中癥非住院患者,通過抗病毒治療可降低病毒載量,縮短疾病進程,降低重癥和住院風險。對于中重度住院患者,在標準支持治療基礎上加用抗病毒和免疫調節劑治療可降低死亡風險[20]。
中和抗體的作用機制在于阻止病毒進入細胞,多用于輕中癥的治療,防止進展為重癥[21-23]。輕中癥患者人群體量大,市場需求突出,目前已有6種中和抗體藥物在美國、歐盟、日本或中國上市。然而,由于中和抗體需經靜脈滴注給藥,故患者用藥高度依賴醫療場所和醫護人員,便利性較低。此外,新冠病毒刺突糖蛋白是中和抗體的主要靶點,其發生突變可能導致耐藥問題出現[24]。
小分子藥物的作用機制在于阻斷病毒在細胞內的復制,其成本較低、穩定性較高,并且因可口服給藥而大大提高了給藥便利性[25]。小分子藥物可用于輕中癥患者人群,目前研發進展較快的包括2021年11月在英國上市的莫努匹韋(默沙東公司)[26]和目前已向FDA遞交緊急使用授權申請的Paxlovid(輝瑞公司),后者雖未上市,但臨床試驗結果顯示其可降低89%的重癥風險,被寄予厚望[18]。此外,小分子藥物還可用于住院患者,最早獲批的瑞德西韋即是通過靜脈滴注給藥用于住院患者治療[27]。
免疫調節劑的作用對象是宿主,其作用機制在于調節患者免疫系統,因此可以基于已有的免疫系統疾病治療藥物進行適應證拓展。目前已上市使用的巴瑞替尼和托珠單抗均屬老藥新用[28]。此類藥物的目標人群是重癥患者,該人群在整個感染人群中占比較低,因此從整個社會角度推測,免疫調節劑的潛在獲益較低。從巴瑞替尼的臨床試驗結果來看,該藥用于重癥住院患者可顯著降低死亡風險,但仍有較大比例患者的死亡結局無法避免,且該藥并不能明顯加速癥狀改善,針對眾多患者的臨床價值較為有限[29]。
我國新冠肺炎治療藥物研發進展相對全球多數國家較快。如我國多年前上市的老藥連花清瘟,在2020年獲批拓展新冠肺炎適應證,用于輕型、普通型新型冠狀病毒性肺炎引起的發熱、咳嗽和乏力等癥狀。我國自主研發的中和抗體——安巴韋單抗+羅米司韋單抗,由清華大學、深圳市第三人民醫院和騰盛博藥生物科技有限公司合作研發,于2021年12月獲得應急批準,主要用于重癥發生風險高的輕型和普通型患者,通過靜脈滴注給藥[30]。此外,我國研發的其他新冠肺炎治療藥物尚未獲批,缺乏療效明確的口服藥上市。我國蘇州開拓藥業股份有限公司研發的老藥普克魯胺已在巴拉圭獲得授權,上海君實生物醫藥科技股份有限公司研發的依替維單抗已在美國獲得授權,另有多個藥物處于Ⅲ期臨床試驗。建議相關企業和管理部門協作推進相關藥物研發和上市進程,早日為我國新冠肺炎患者提供更多選擇。

