基于DWI和FLAIR的機器學習預測急性腦卒中發病時間的研究
郭靜麗,彭明洋,王同興,陳國中,殷信道,劉浩
作者單位:南京醫科大學附屬南京醫院(南京市第一醫院)醫學影像科,南京210006
醒后卒中是指入睡前無明顯異常而起床后發現神經功能缺損癥狀的卒中,是缺血性卒中的一個亞型,約占缺血性卒中的14%~25%[1-2]。由于發病時間不確定,目前大多數醒后卒中被排除在靜脈溶栓治療之外。因此,準確預測卒中發病時間對患者的治療至關重要。以往的研究認為彌散加權成像(diffusion weighted imaging,DWI)和液體衰減反轉恢復序列(fluid attenuated inversion recovery,FLAIR)不匹配可顯示缺血組織的發展情況,進而選擇可能受益于溶栓治療的醒后卒中患者[3-4]。然而,DWI-FLAIR 不匹配敏感度低、主觀性強,可能會高估實際發病時間,因此排除了太多可能從溶栓治療中獲益的患者。近年來,影像組學和機器學習的發展為醒后卒中發病時間的預測提供了新的方法。影像組學可從圖像中提取高維的定量特征(包括人類肉眼看不見的特征)[5],機器學習能夠從數據集中自動學習這些特征,進而構建預測模型,實現精準診斷及預測[6]。以往的研究顯示醒后卒中患者的早期影像學特征與已知發病時間的腦卒中患者相似。因此,本研究基于發病時間明確的急性腦卒中患者的DWI 和FLAIR 圖像,利用影像組學和機器學習方法構建預測卒中發病時間的預測模型,為醒后卒中發病時間預測提供指導。
1 資料與方法
1.1 研究對象
本研究經過南京醫科大學倫理委員會批準[批準文號:(2019-664)],免除受試者知情同意。回顧性分析2017 年1 月至2020 年12 月在南京市第一醫院就診的急性腦卒中患者的臨床及影像資料。入組標準:(1)發病時間明確;(2)發病24 h以內;(3)治療前行MRI檢查。排除標準:(1)存在腦出血、腫瘤、外傷或手術史;(2)參與其他研究,接受額外藥物或治療;(3)圖像偽影或其他因素影響圖像評估。最終共有188 例患者納入本次研究,其中男109 例,女79 例,年齡(74.15±13.28)歲。根據發病至圖像采集時間,將患者分為發病時間≤4.5 h 組(91 例)和>4.5 h 組(97例)[7]。采用隨機分層抽樣法將患者隨機分為訓練集131例,測試集57例。
1.2 檢查方法
采用Philips Ingenia 3.0 T MRI 掃描設備。掃描參數如下:DWI采用自旋回波序列:TR=2501 ms,TE=98 ms,FA=90°,視野=230 mm×230 mm,矩陣=152×122,層厚6 mm,18 層,層間距1.3 mm,b=0、1000 s/mm2;FLAIR 采用反轉恢復序列:TR=9000 ms,TE =120 ms,TI=2600 ms,矩陣=356×151,視野=230 mm×230 mm,FA=90°,層厚6 mm,層間距1.3 mm。
1.3 影像分析
DWI-FLAIR不匹配定義為DWI圖像上責任血管供血區高信號且ADC 為低信號區域在FLAIR 圖像相應區域未表現為高信號。由2 名具有6 年工作經驗的神經放射學診斷醫師采用雙盲法進行評估,意見不一致時與另一位具有10年工作經驗的神經放射學診斷醫師共同商定。
1.4 影像組學特征提取及篩選
影像組學特征提取及篩選分為感興趣區分割、特征提取及特征篩選三個步驟,具體步驟如下:(1)感興趣區分割:使用ITK-SNAP 軟件(版本3.4.0,http://www.itksnap.org)手動分割DWI 高信號急性腦梗死區和對應的FLAIR 急性梗死區作為感興趣區(region of interest,ROI) (圖1)。由1 名有10 年神經影像診斷經驗的放射科醫師進行ROI 的勾畫。(2)特征提取:使用人工智能應用平臺(artificial intelligent kit,A.K.) (人工智能工具包V3.0.0.R,GE Healthcare)對圖像進行圖像插值、強度歸一化和灰度級離散化預處理。再分別對DWI和FLAIR的ROI進行特征提取,包含一階特征(First Order)、灰度共生矩陣特征(gray-level co-occurrence matrix,GLCM)、灰度相關矩陣(gray-level dependence matrix,GLDM)、灰度游程矩陣(gray-level run length matrix,GLRLM)、灰度尺寸區域矩陣(gray-level size zone matrix,GLSZM)、相鄰灰度差分矩陣(neighboring gray tone difference matrix,NGTDM)等共396 個特征。(3)特征篩選:使用方差分析、Spearman 相關性檢驗及最小絕對收縮與選擇算子算法(least absolute shrinkage and selection operator,LASSO)逐步進行特征篩選,通過構造懲罰函數得到一個較為精練的模型,壓縮一些回歸系數,并設定一些回歸系數為零,同時采用十折交叉驗證對模型參數進行最優化。
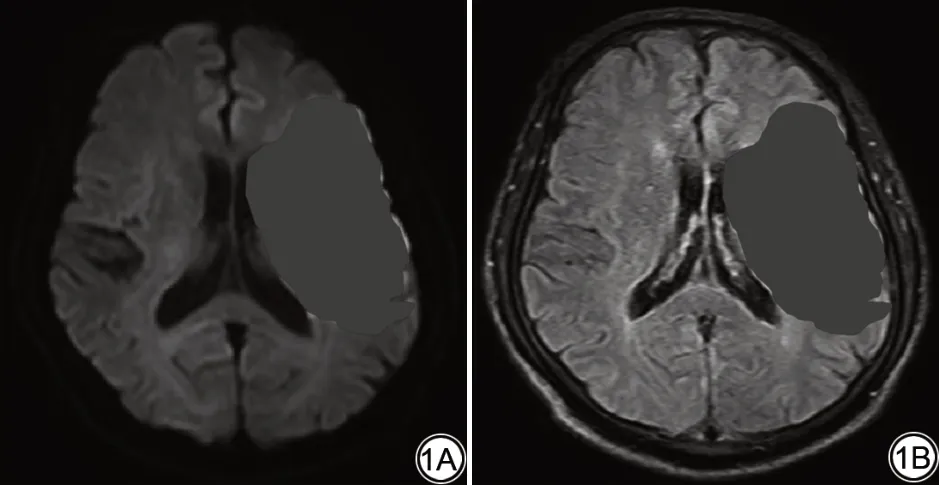
圖1 DWI和FLAIR感興趣區分割示意圖。Fig.1 Schematic diagram of region of interest segmentation on DWI and FLAIR images.
1.5 模型構建
應用支持向量機(support vector machine,SVM)分類器,對篩選的特征進行機器學習,構建模型。SVM采用線性核,應用五折交叉驗證進行模型訓練。
1.6 統計學方法
臨床數據應用SPSS 26.0軟件進行統計學分析。應用Kolmogorov-Smimov 檢驗計量資料是否符合正態分布,正態分布的計量資料以均數±標準差表示并用獨立t檢驗分析;計數資料采用例數(百分率)表示并用卡方檢驗分析。P<0.05 為差異有統計學意義。應用Kappa 檢驗進行觀察者間一致性分析,Kappa 值大于0.75 表示一致性好。應用ROC 曲線評估DWI-FLAIR預測發病時間的準確度。LASSO回歸模型、SVM 分類器分別基于“glmnet”、“e1071”程序包完成。應用Sklearn (http://scikit.learn.org/stable/) 機器學習模塊的受試者操作特征(receiver operating characteristic,ROC)曲線分析評估模型預測卒中發病時間的預測效能。獲得受試者工作特征曲線下面積(area under curve,AUC)、準確度、敏感度、特異度、陽性預測值、陰性預測值等模型評價指標。人工識別與機器學習模型效能間比較采用Delong檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 人工識別DWI-FLAIR不匹配預測發病時間結果
共188例患者納入分析,發病時間≤4.5 h組患者共91例,其中45例(49.45%)患者表現為FLAIR高信號,DWI-FLAIR 不匹配46 例(50.55%),觀察者間一致性為k=0.95 (95%CI:0.92~0.99)。發病時間>4.5 h組患者97例,其中74例(76.29%)患者表現為FLAIR高信號,DWI-FLAIR不匹配23例(23.71%),觀察者間一致性為k=0.93 (95%CI:0.91~0.97)。發病時間≤4.5 h組與發病時間>4.5 h組患者間性別、年齡、入院時美國國立衛生院卒中量表(National Institute of Health Stroke Scale,NIHSS)評分、閉塞血管情況、高血壓、糖尿病、高脂血癥及高同型半胱氨酸差異均無統計學意義(P>0.05) (表1)。ROC 分析顯示人工識別DWI-FLAIR 不匹配預測急性腦卒中發病時間的AUC 為0.634,敏感度和特異度分別為0.667、0.622 (表2)。

表1 發病時間≤4.5 h組和發病時間>4.5 h組的臨床基線資料比較Tab.1 Comparison of basic clinical data between onset time ≤4.5 h and onset time >4.5 h

表2 人工識別及機器學習方法預測急性卒中發病時間的效能Tab.2 Efficacy of human readings and machine learning methods in predicting onset time of acute stroke
2.2 機器學習模型預測發病時間結果
DWI 和FLAIR 分別提取了396 個特征,通過方差分析+秩和檢驗后剩下168 個特征,Spearman 相關性檢驗后剩下56 個特征,最后使用LASSO 降維后選擇的特征數為10 個,包含7 個DWI 特征(3 個GLCM、1 個GLRLM、2 個GLSZM、1 個First Order)和3 個FLAIR 特征(1 個GLCM、1 個GLRLM、1 個First Order)。影像組學特征的LASSO 系數分布圖見圖2,篩選的最佳影像組學特征熱圖見圖3。基于所得的最佳影像組學特征構建急性卒中發病時間的預測模型。ROC 曲線分析顯示訓練集患者預測發病時間的AUC 為0.975,敏感度和特異度分別為0.932、0.950,準確度為0.939;測試集患者預測發病時間的AUC 為0.915,敏感度和特異度分別為0.868、0.852,準確度為0.862 (圖4)。人工識別與機器學習模型間比較差異有統計學意義(人工識別vs.訓練集:Z=0.771,P=0.001;人工識別vs.測試集:Z=1.336,P=0.003)。

圖2 影像組學特征降維LASSO 系數收斂圖。每條曲線代表了不同懲罰系數對應的自變量系數的變化軌跡,虛線為最小懲罰系數。LASSO:最小絕對收縮與選擇算子算法。Fig. 2 The distribution of LASSO coefficients of radiomics. Each curve represents the change track of independent variable coefficients corresponding to different penalty coefficients, and the dotted line is the minimum penalty coefficient. LASSO: least absolute shrinkage and selection operator.

圖3 最佳篩選的10 個特征的相關性熱圖。每個小方塊代表第j 列患者對應第i 行特征的權重值經過Z-score 轉換后的值對應的顏色大小,其中紅色代表高,綠色代表低。Fig. 3 The correlation heatmap of the best screened 10 features. Each small square represents the color size corresponding to the weight value of the characteristic of row i corresponding to the patient in column j after Z-score conversion,in which red represents high and green represents low.
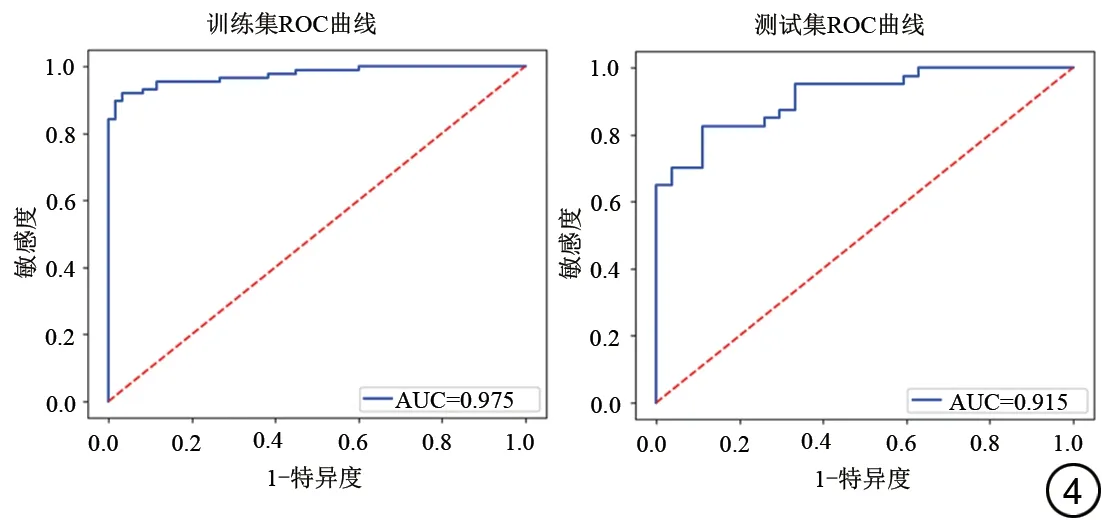
圖4 訓練集和測試集用于急性腦卒中發病時間預測的ROC曲線。Fig. 4 Receiver operating characteristic curve of training set and test set for predicting onset time of acute stroke.
3 討論
本研究對188例DWI和FLAIR的影像組學特征進行篩選、降維,共篩選出與醒后卒中發病時間密切相關的10 個影像組學特征,包含7 個DWI 特征(3 個GLCM、1個GLRLM、2個GLSZM、1個First Order)和3個FLAIR 特征(1 個GLCM、1 個GLRLM、1 個First Order)。經機器學習建模后,結果顯示該模型預測醒后卒中時間窗的效能明顯優于傳統人工識別。本研究結果可有效克服由于人工識別的主觀性及可變性帶來的主觀誤差及低敏感性。通過構建的模型可使臨床醫生能夠通過模型快速準確地判斷醒后卒中的發病時間,指導臨床個性化的溶栓治療。
3.1 醒后卒中發病時間傳統預測方法
醒后卒中患者常不能提供準確的發病時間,給溶栓治療帶來了困難。影像學檢查在患者發病時間的評估和治療中具有重要的作用。DWI 對細胞源性水腫敏感,而FLAIR 對血管源性水腫敏感[8-9]。腦卒中發生的幾分鐘內便可檢測到病變區域的表觀擴散系數降低,即DWI 信號增強,隨著卒中的發展,血管源性水腫在1~4 h 內發生,隨后可觀察到FLAIR 增強[10]。因此,目前研究推薦采用DWI 和FLAIR 不匹配征象識別發病時間≤4.5 h 的患者,從而指導臨床治療[11]。
以往已有較多研究顯示DWI-FLAIR 不匹配可預測急性腦卒中發病時間[12-14]。耿文等[15]研究顯示DWI-FLAIR 不匹配預測卒中發病時間(<180 min、180~270 min、≥270 min)的AUC 為0.753,當臨界值為181.5 min 時,其預測敏感度和特異度分別為84.6%、55.1%。Emeriau 等[16]發現DWI-FLAIR 不匹配雖然可預測卒中發病4.5 h以內的患者,但其敏感度較低(0.55),特異度較低(0.60)。本研究結果顯示DWI-FLAIR 預測卒中發病時間的AUC 為0.634,敏感度和特異度分別為0.667、0.622。與以往的研究結果一致。人工識別的敏感度和特異度較低的原因可能為DWI-FLAIR評估方法僅通過DWI和FLAIR匹配與否,而不考慮病灶的其他特征。Emeriau 等[16]的研究中約有44.5%的患者在4.5 h內FLAIR信號可發生變化,而本研究中約49.45%患者在4.5 h內FLAIR表現為高信號,這就嚴重影響了DWI-FLAIR不匹配的預測效果。此外,Duchaussoy等[17]發現T2弛豫時間差異、比率、絕對T2 弛豫時間及FLAIR 信號強度比與卒中發病時間相關,T2指標可能成為具有輕微FLAIR高信號的醒后卒中發病時間評估工具。以往的研究顯示病變攝水率是一種基于CT 的成像生物標志物,可反映血管源性水腫,可在一定程度上評估卒中的發病時間[18-19]。然而,這些評估方法仍存在敏感度低、參數不統一、主觀性強等不足,臨床上應用這些指標篩選受益于溶栓治療的卒中患者仍十分謹慎。
3.2 醒后卒中發病時間機器學習預測方法
近年來,影像組學的發展為急性腦卒中發病時間的預測提供了新的契機。它可挖掘圖像中肉眼無法感知的信息,提取高通量的紋理特征,從而促進疾病的識別和分類[20]。目前在急性腦卒中的診斷、治療及預后評估中已有較多研究[7,21-22]。本研究基于DWI和FLAIR 的影像組學特征提取和篩選,最終篩選出10 個與發病時間密切相關的特征,包含7 個DWI 特征和3 個FLAIR 特征。一階特征可以定量的方式描述圖像中體素分布;灰度共生矩陣特征可反映病變的同、異質性;灰度游程矩陣特征可反映圖像紋理的方向性和粗糙程度等信息[23]。這些特征可為預測急性卒中發病時間提供更多肉眼無法識別的信息。
機器學習模型能夠利用和學習數據來進行預測,因其較好的分類效能已廣泛應用于醫療領域。本研究基于以上篩選的最佳影像組學特征進行機器學習構建模型,結果顯示其預測效能明顯優于人工識別的結果。Lee 等[24]利用DWI 和FLAIR 每個序列的89 個影像組學特征進行機器學習預測發病時間,結果顯示機器學習方法同樣優于人工識別。但本研究較Lee等研究提取了更多的影像組學特征,較多的特征可能為預測發病時間提供更多的信息。Ho 等[25]基于FLAIR、DWI 和灌注成像進行深度學習預測發病時間,敏感度為79%,特異度為61%。該模型需要完整的MRI 序列(包括灌注成像序列)。然而,大部分患者由于癥狀較重或基層醫院條件受限,可能無法完成灌注成像。本研究的模型僅使用了常規的FLAIR和DWI序列來預測發病時間,具有更普遍的適用性。
3.3 局限性分析
本研究仍存在一定的局限性。首先,本研究為單中心回顧性研究,為確保兩組樣本均衡,在樣本選擇時可能存在偏倚。其次,本研究僅以4.5 h為分界預測卒中患者發病時間,但有研究認為靜脈溶栓的時間窗可延長至6 h。因此本研究模型會使部分發病時間在4.5~6 h并可進行靜脈溶栓的患者排除在外。此外,本研究未做外部驗證。
綜上所述,基于DWI 和FLAIR 影像組學的機器學習,能夠較為準確地預測急性腦卒中患者的發病時間,為臨床靜脈溶栓治療的選擇提供影像指導。
作者利益沖突聲明:全部作者均聲明無利益沖突。

