基于高通量測序的風濕性心臟病瓣膜組織mRNA差異分析*
陳星宇,盧創宏,吳曉丹,曾志羽△
(1.廣西醫科大學第一附屬醫院心內科,南寧 530021;2.廣西心腦血管疾病防治精準醫學重點實驗室,南寧 530021;3.廣西心腦血管疾病臨床醫學研究中心,南寧 530021)
風濕性心臟病(rheumatic heart disease,RHD)是指由于風濕熱活動,累及心臟瓣膜而造成的心臟病變,在低、中等收入國家及高收入國家貧困地區人群中高度流行[1]。目前我國仍有250 萬RHD 患者[2]。風濕熱患者咽喉部被A 組鏈球菌反復感染,或者某些易感人群因皮膚鏈球菌感染從而導致機體異常免疫反應[3],50%~75%的患者會進展為RHD[4-5],出現心律失常、心力衰竭等并發癥及永久性心臟瓣膜損傷[6-7]。自身免疫性和炎癥在瓣膜損傷中起著重要作用,但其分子機制尚未完全清楚[8]。對于晚期RHD患者,經皮或手術換瓣后可明顯改善預后,然而在疾病流行率最高的欠發達地區,換瓣手術受到了技術水平和社會經濟條件的雙重限制。
隨著測序技術的飛速發展,高通量測序(nextgeneration sequencing,NGS)技術已經被廣泛用于各種疾病中,有助于深入了解疾病發生的分子機制及其調控網絡。非RHD瓣膜病瓣膜標本較難收集,且目前沒有關于RHD瓣膜轉錄組的測序研究,僅有對RHD血清進行測序的基因組研究[9]。因此,本課題組通過NGS 對8 例RHD 患者的瓣膜組織和非RHD 患者的瓣膜組織進行mRNA 測序,探索RHD瓣膜損傷的分子機制,為RHD患者瓣膜病變的治療提供新的靶點。
1 資料與方法
1.1 一般資料 選取2020年1月至2021年12月在廣西醫科大學第一附屬醫院行二尖瓣置換術(mitral valve replacement,MVR)患者的瓣膜組織,其中RHD 患者(RHD 組)23 例,非RHD 患者(Con 組)10例。兩組性別、年齡、體重指數、血糖及心功能指標比較,差異均無統計學意義(均P>0.05),具有可比性。RHD 組納入標準:病例資料完整,通過心臟彩色多普勒超聲檢查確定是二尖瓣狹窄為主,結合臨床表現和術后病理檢查,確診為RHD。Con組納入標準:因其他原因導致需進行MVR 手術的患者。兩組均排除年齡<18歲,或合并感染性心內膜炎、自身免疫性疾病、腫瘤、心肌病、高血壓、糖尿病等患者。本研究已取得醫院倫理委員會批準。所有患者及其家屬均已簽署知情同意書。
1.2 基因測序 用Illumina HiSeq 測序儀進行測序,獲得原始數據。使用StringTie軟件計算并檢測兩組樣本的差異mRNA 表達并進行數據分析。再用DEseq2 軟件分析兩組間差異基因表達,對差異基因進行基因功能(GO)分析和京都基因與基因百科全書(KEGG)富集分析,并通過蛋白相互作用網絡(PPI)篩選出關鍵基因。
1.3 實時熒光定量PCR(RT-qPCR)驗證關鍵基因表達 取兩組瓣膜組織,提取組織RNA,使用Nanodrop 2000 檢測RNA 濃度和純度,逆轉錄為cDNA,行PCR 擴增。RT-qPCR 反應條件:95 ℃預變性10 min;95 ℃變性15 s,60 ℃退火、延伸30 s,共40 個循環。采用2-△△CT法計算目的基因相對表達量。引物序列見表1。

表1 引物序列(5’~3’)
1.4 統計學方法 使用SPSS 22.0統計軟件對數據進行分析,偏態分布的計量資料以中位數(四分位數間距)[M(P25~P75)]表示,組間比較采用非參數檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 差異基因表達 兩組間共有4 498個差異表達基因,其中上調2 315 個,下調2 183 個。顯著差異表達530個(表2),設置P<0.05且|log2Fold Change|>1.5,繪制火山圖(圖1)。
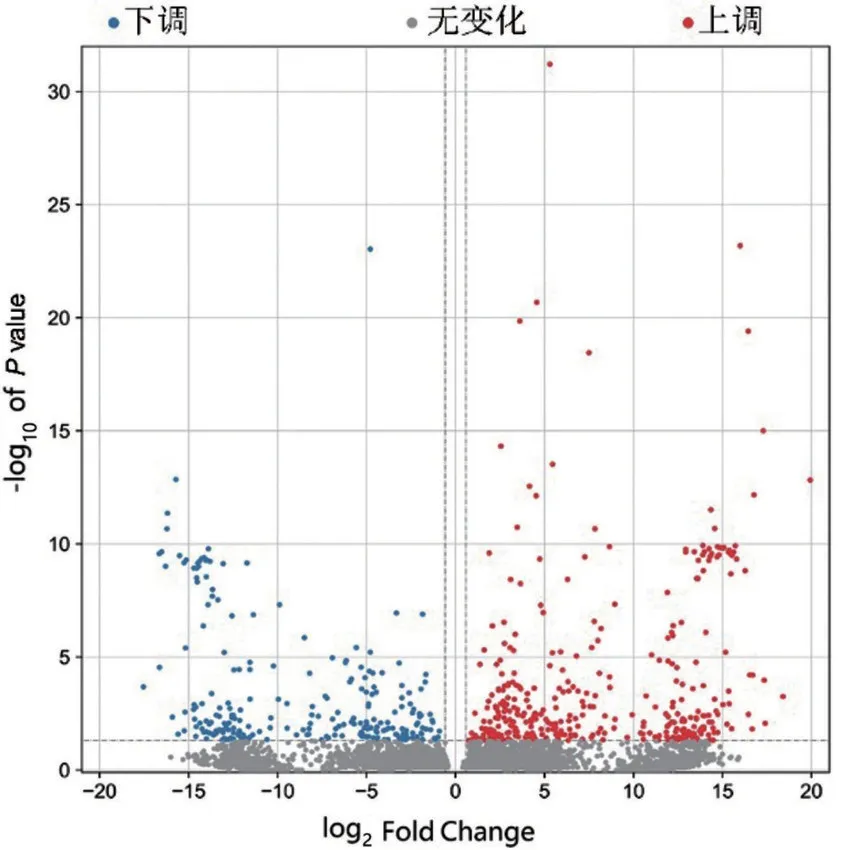
圖1 差異基因火山圖
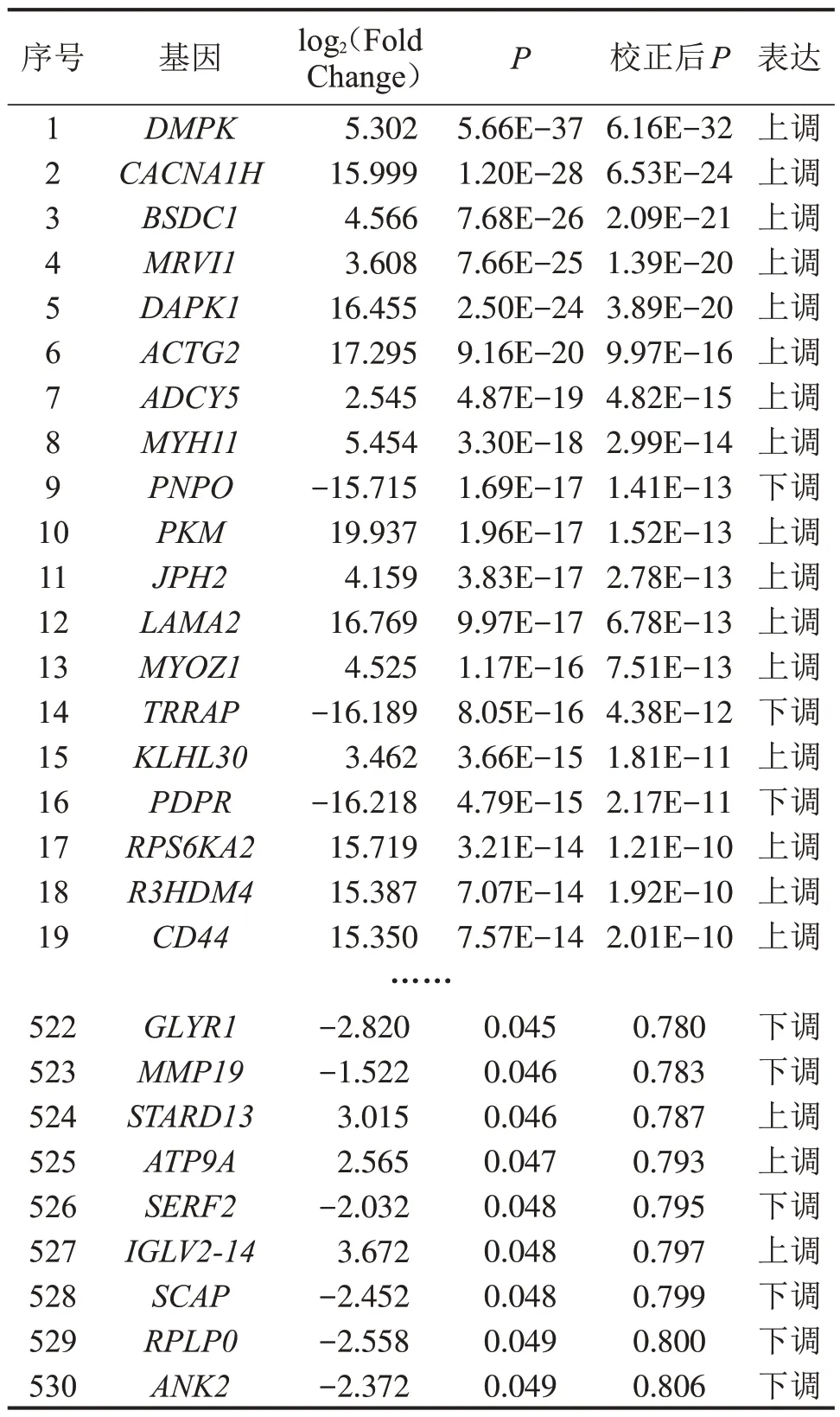
表2 兩組瓣膜組織的差異mRNA表達
2.2 聚類分析 通過繪制熱圖(圖2)顯示兩組間差異mRNA的相關性,顏色深淺表示基因表達量的高低。兩組間顯著差異的mRNA在本組基本聚集,表明差異mRNA 表達趨勢在兩組間差異有統計學意義。
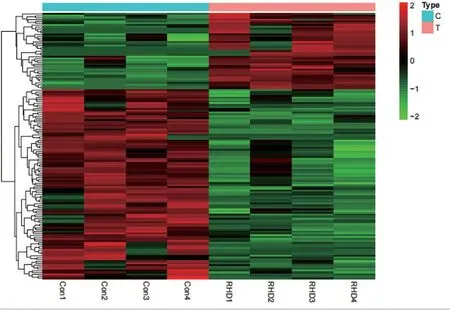
圖2 兩組瓣膜組織中顯著差異基因的分層聚類熱圖
2.3 GO功能富集分析結果 主要富集的生物學過程(BP)為細胞外基質(ECM)和結構的組裝和分解,主要的細胞成分(CC)為細胞外基質,顯著的分子功能(MF)為鈣黏著蛋白結合和肌動蛋白結合,見圖3。
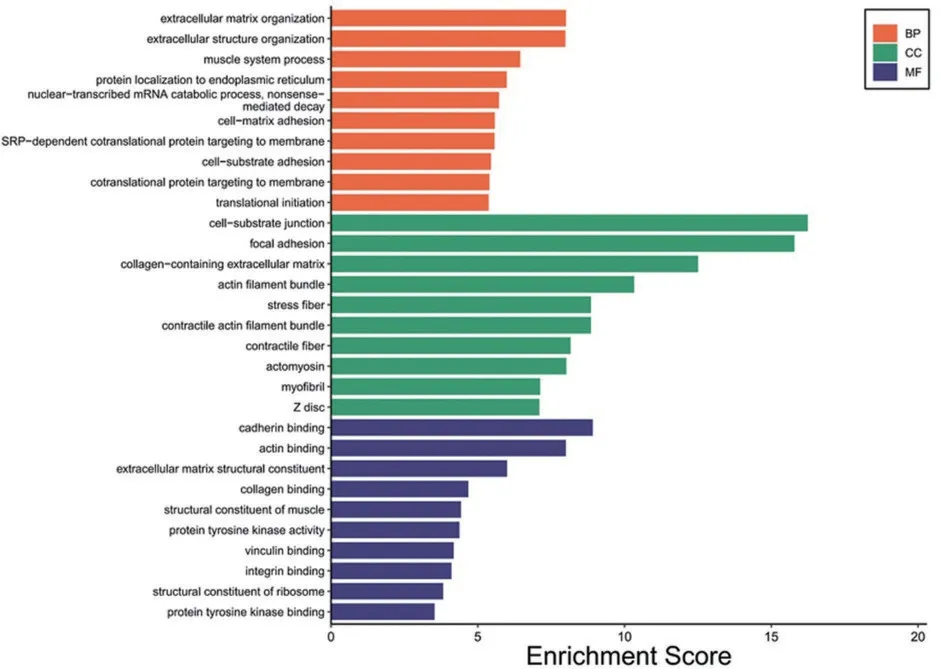
圖3 GO功能富集分析結果
2.4 KEGG分析 通過對530個顯著差異基因進行KEGG富集分析并繪制氣泡圖,結果顯示:差異基因主要富集于細胞基質黏著、白細胞跨內皮轉移、ECM 受體相互作用等信號通路中,見圖4。
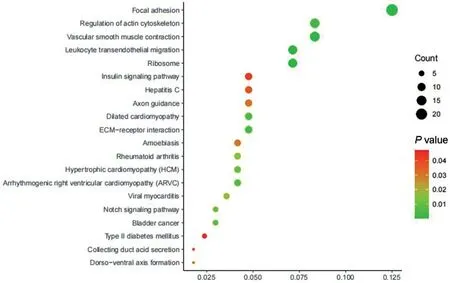
圖4 KEGG富集氣泡圖
2.5 PPI 分析結果 將530 個顯著差異基因使用String 數據庫進行數據分析得到PPI 圖(圖5),然后將PPI導入Cytoscape得到差異基因節點排序(圖6)。結合以往的研究和文獻,本組篩選了3 個關鍵基因進行RT-qPCR驗證。
圖5 基于顯著差異基因的PPI圖
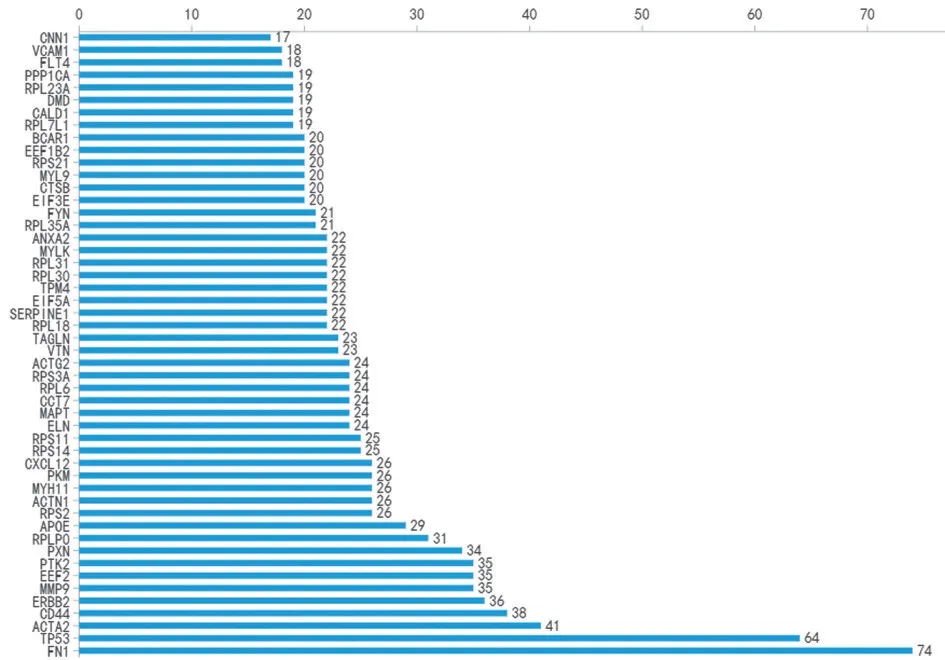
圖6 PPI圖中關鍵基因節點數量的排序
2.6 RT-qCR驗證結果 與Con組比較,FN1、CD44、VCAM-1在RHD組瓣膜組織中的表達均上調,見表3。
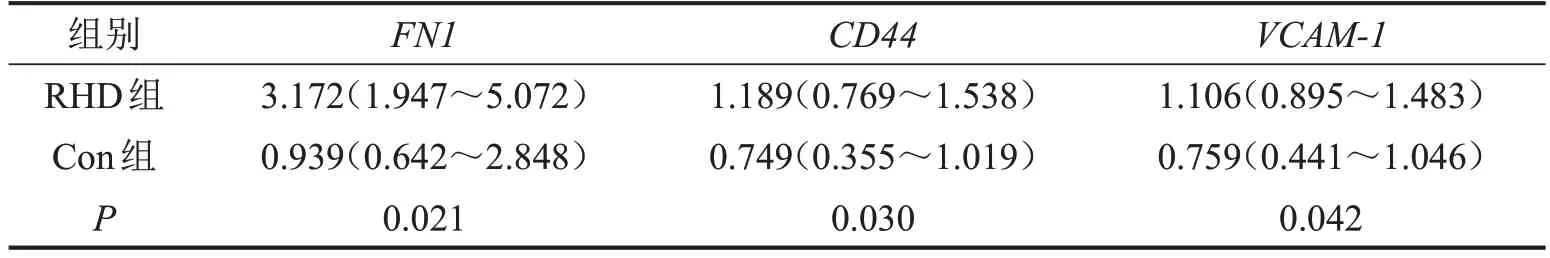
表3 兩組FN1、CD44、VCAM-1 mRNA表達水平比較
3 討論
本研究通過NGS 在RHD 患者與非RHD 患者中共篩選出530個顯著差異表達基因,其中上調326個,下調204個;通過KEGG分析得出其主要富集在細胞基質黏著、白細胞跨內皮轉移、ECM 受體相互作用等信號通路中,并且篩選出FN1、CD44、VCAM-13個關鍵基因,經RT-qPCR驗證為RHD瓣膜病變相關基因。
研究表明,心臟ECM 重構與心肌纖維化有關,ECM 也是治療心肌病變的一個潛在靶點[10]。且ECM受體相互作用在心臟重塑中起著重要的作用,ECM 蛋白的積累可導致心臟功能惡化[11]。本研究通過測序發現,ECM 受體相互作用信號通路在RHD中被大量富集。纖連蛋白(FN)是存在于動物細胞表面的細胞外大分子膜蛋白,是ECM和基底膜中的主要非膠原糖蛋白[12]。FN1 作為一種多功能ECM 蛋白分子,在細胞黏附中發揮重要的作用,也是ECM 受體相互作用和細胞基質黏著通路的主要信號分子,參與多種細胞生物學過程,并在纖維化疾病中發揮作用[13]。有研究顯示,纖維化蛋白FN1表達上調可加重腎臟纖維化,靶向調控FN1表達能減輕膀胱纖維化[14-15]。在RHD患者瓣膜中,ECM的大量沉積及FN1 的高表達與瓣膜纖維化高度相關。因此,ECM 及其相關通路在RHD 病變中發揮重要作用。本研究結果顯示,RHD患者瓣膜組織中FN1表達上調。
此外,CD44 也是一種廣泛表達的ECM 成分主要受體,在炎癥和血管損傷中起著重要作用[16]。心肌炎癥損傷時實質細胞和造血細胞CD44 表達上調。在哮喘和動脈粥樣硬化中,CD44 被證明在炎癥部位調節白細胞,包括巨噬菌體、T細胞和嗜酸性粒細胞[17]。CD44受體是透明質酸(HA),HA受多種細胞因子的調節,包括炎性細胞因子[18]。研究表明,HA 分解代謝通過CD44、HYAL-1 和HYAL-2 介導酶。炎癥部位的LMWHA 片段介導炎癥效應并刺激心臟成纖維細胞和肌成纖維細胞增殖,通過與CD44相互作用導致組織纖維化[19]。CD44與HA之間的相互作用會觸發細胞內信號傳導促進瓣膜纖維化,也會導致心臟重構。本研究發現,CD44在RHD患者瓣膜組織中的表達上調。
VCAM-1是一種90 kDa的糖蛋白,主要表達于內皮細胞[20],在白細胞跨內皮轉移通路中有著重要作用。白細胞上表達的A4P1整合素黏附在內皮細胞表面VCAM-1 上,激活內皮細胞的信號通路,從而導致白細胞的跨內皮細胞轉移[21]。研究顯示,在RHD 患者血清中VCAM-1 水平升高[22]。本研究RHD 患者瓣膜組織VCAM-1表達上調。表明內皮細胞被激活,進而使其更容易被免疫系統攻擊,從而導致瓣膜持續免疫反應,引起組織損傷。
綜上所述,FN1、CD44、VCAM-1基因在RHD瓣膜病變中的表達上調,可能在ECM受體相互作用和白細胞跨內皮轉移等信號通路中發揮重要作用。

