Dixon-MRI和BOLD-MRI對成年男性代謝綜合征早期腎損傷的定量對比研究
鐘俏玲,李師思,陳焱君,丁有斌,張曉東
作者單位:南方醫科大學第三附屬醫院影像科(廣東省骨科研究院),廣州 510630
代謝綜合征(metabolic syndrome,MetS)是以胰島素抵抗為核心,包括中樞型肥胖、空腹血糖升高、血壓升高和血脂異常的一組復雜代謝紊亂癥候群[1]。許多研究表明MetS 與慢性腎臟病(chronic kidney disease,CKD)風險增加有關。既往動物實驗研究表明,早期MetS豬腎組織出現脂質的異常沉積,進而損害腎功能[2]。腎臟中的血脂異常和過多的營養物質會損害線粒體功能,從而影響腎的氧合,導致腎臟細胞的損傷[2-3]。一旦CKD 發展為終末期腎臟病(endstage renal disease,ESRD),患者只能依靠腎臟替代治療來維持生命。終末期腎病不僅嚴重危害患者的健康,同時給患者家庭帶來巨大的經濟負擔[4]。而腎小球在CKD 的早期階段即CKD 1 期和CKD 2 期尚未發生不可逆損傷。因此早期檢測腎臟結構或功能改變,盡早進行臨床干預,可有效防止腎功能進一步損傷甚至扭轉腎功能[5-6]。
目前常用的無創評估腎臟損傷的方法如血清肌酐(serum creatinine,Scr)、蛋白尿和超聲等,存在檢測靈敏度低、不能評估潛在腎臟疾病病理特征等缺點。盡管腎活檢是目前臨床實踐中唯一評估腎臟損傷微結構的方法,但其具有侵入性、可重復性低以及不能常規取樣髓質等缺點[7-8]。
磁共振成像作為非侵入性、可重復性高的體內成像方法,已被廣泛應用于腎臟疾病的研究中。Dixon-MRI 被證實可無創定量測量腎臟脂肪含量,具有評估2 型糖尿病早期腎損害的潛力。血氧水平依賴磁共振成像(blood oxygenation level-dependent magnetic resonance imaging,BOLD-MRI)可用于檢測一系列腎臟疾病引起的細微改變[9-11]。已有研究使用BOLD-MRI 監測到早期MetS 豬腎髓質存在缺氧改變。但是,先前的研究從未比較過這兩種技術在評估MetS 引起的早期腎損傷方面的效果。因此,本研究旨在比較Dixon-MRI 和BOLD-MRI 定量參數在評估MetS 引起的早期腎損傷能力,為早期MetS 腎臟損傷提供客觀有效的無創定量檢測指標。
1 材料與方法
本研究經過南方醫科大學第三附屬醫院醫學倫理委員會批準,批準文號:201708011。于2017 年7 月至2019 年6 月在南方醫科大學第三附屬醫院招募了24 名成年男性MetS 患者和18 名非MetS 的患者進行腎臟MRI 檢查。所有受試者均知曉本研究的具體內容以及MRI檢查存在的風險,并簽署了書面知情同意書。在進行MRI 檢查前記錄研究對象年齡、性別、身高、體質量、腰圍及臀圍,計算體質量指數(body mass index,BMI)、腰臀圍的比值和腰圍身高比。所有研究對象在安靜休息5 min 后再進行血壓測量,記錄收縮壓和舒張壓。禁食10 h后,在服用任何藥物之前采集血液樣本,測量受試者總膽固醇、甘油三酯、高密度脂蛋白、腎小球濾過率(estimate glomerular filtration rate,eGFR)、Scr、空 腹 血糖、空腹血清胰島素和胰島素抵抗指數(homeostasis model assessment 2-IR,HOMA2-IR)等指標。
1.1 研究人群
根據2013 版CDS MetS 診斷標準,MetS 可定義為至少滿足以下標準中的三個:(1)男性腰圍≥90 cm,女性腰圍≥80 cm;(2)收縮壓≥130 mmHg (1 mmHg=0.1333 kPa)和/或舒張壓≥85 mmHg,或使用任何降壓藥;(3)空腹血糖≥5.5 mmol/L,或使用任何抗糖尿病藥;(4)甘油三酸酯水平≥1.7 mmol/L,或使用任何降低甘油三酸酯的試劑;(5)男性高密度脂蛋白(high density liptein cholesterol,HDL-C)水平<1.0 mmol/L,女性<1.3 mmol/L或使用任何藥物改善HDL-c水平[12]。
MetS組納入標準:(1)年齡18~70歲的男性;(2)腎功能正常至中度損傷[eGFR>60 mL·min-1·(1.73 m2)-1];(3)滿足2013 版CDS MetS 診斷標準中的其中三項。排除標準:(1)患有腎臟炎癥、占位等腎臟臟器疾病;(2)有腎臟外傷史、手術史等;(3) MR 圖像存在嚴重偽影;(4)幽閉恐懼癥。
非MetS 組納入標準:(1)年齡18~70 歲的男性;(2) eGFR>90 mL·min-1·(1.73 m2)-1;(3)不滿足2013 版CDS MetS 診斷標準中的其中三項。排除標準:(1)患有腎臟炎癥、占位等腎臟臟器疾病;(2)有腎臟外傷史、手術史等;(3) MR 圖像存在嚴重偽影;(4)幽閉恐懼癥。
1.2 MRI檢查
在3.0 T MR 系統(Philips,Achieva)上用腹部線圈采集腎臟冠位T2WI、Dixon-MRI和BOLD-MRI數據。所有受試者均采用仰臥位檢查。冠位mDixon-Quant 序列用于腎臟的脂肪定量,掃描參數如下:重復時間(TR)=5.6 ms,回波時間(TE)=0.97 ms、回波間隔(△TE)=0.7 ms,回波個數=4,翻轉角=3°,矩陣大小=144×144×30,體素大小=2.5 mm×2.5 mm×6.0 mm,掃描時間=15 s。冠位BOLD-MRI 序列掃描參數如下:TR=16.5 ms,TE=1.2 ms,△TE =0.9 ms,回波個數=16,矩陣大小=176×176,體素大小=2.0 mm×2.0 mm,層厚=5.0 mm,掃描時間=2 min 45 s。
1.3 成像分析
由具備兩年以上腎臟MRI 研究經驗的放射科中級醫師在Dixon-MRI 和BOLD-MRI 圖像上進行感興趣區(region of interest,ROI)的勾畫。
使用ITK-SNAP 看圖軟件對BOLD-MRI 數據算得的腎表觀自旋-自旋弛豫率(apparent relaxation rate,R2*)圖進行ROI勾畫。一側腎臟共畫12個ROI,分別選擇在經腎門及其上下層面的皮質、髓質區域,放置ROI 時要盡量選擇皮髓質分界清晰處(圖1)。注意避開皮髓質分界模糊區域、腎臟集合系統、腎內血管、囊腫及周圍組織。分別求得每個個體兩側腎臟皮質、髓質R2*的平均值。
腎臟Dixon-MRI 原始數據傳至圖像后處理工作站(v.7,Philips Healthcare),獲得腎臟脂肪分數(fat fraction,FF)圖。結合T2WI 及FF 偽彩圖在FF圖上手工放置ROI。在每側腎臟選取3 個層面,分別是經腎門層面及其相鄰的上下層面,在每個層面皮質和髓質分別勾畫2 個ROI,共畫12 個ROI (圖1)。注意避開腎臟集合系統、腎內血管、囊腫及周圍組織及偽影較重的區域。分別測量雙腎皮質和髓質的FF值,并計算各ROI 平均值作為腎臟皮質和髓質的FF值。

圖1 1A、1C、1E:38 歲男性非代謝綜合征患者,左腎T2WI (1A),FF 偽彩圖(1C)和R2*偽彩圖(1E),左腎皮質R2*值和髓質R2*值分別為15.58 s-1和27.27 s-1,左腎皮質FF值和髓質FF值分別為2.45%和1.88%。1B、1D、1F:39 歲男性代謝綜合征患者,左腎T2WI(1B),FF 偽彩圖(1D)和R2*偽彩圖(1F),左腎皮質R2*值和髓質R2*值分別為15.02 s-1和30.86 s-1,左腎皮質FF 值和髓質FF 值分別為4.02%和2.04%。Fig. 1 1A, 1C, 1E: A 38-year-old male patient without metabolic syndrome,T2WI (1A), FF color(1C) and R2* color (1E) maps of the left kidney.R2* values of the left renal cortex and medulla were 15.58 s-1 and 27.27 s-1, respectively. The FF values of left renal cortex and medulla were 2.45%and 1.88%, respectively. 1B, 1D, 1F: A 39-year-old male patient with metabolic syndrome,T2WI (1B),FF color (1D) and R2* color (1F) maps of the left kidney. The R2*values of the left renal cortex and medulla were 15.02 s-1 and 30.86 s-1, respectively.The FF values of left renal cortex and medulla were 4.02%and 2.04%,respectively.
采用組內相關系數(intraclass correlation coefficient,ICC)評估兩名醫師測得腎皮髓質定量指標的一致性。對一致性較好的結果,取兩名醫師測量結果平均值進行后續的統計分析。
1.4 統計分析
采用SPSS 22.0版統計軟件分析數據,結果采用均數±標準差表示。使用ICC 評估MRI 定量參數觀察者間的一致性。采用兩樣本獨立t檢驗分析非MetS組和MetS組人口統計學、身體測量、血生化指標的組間差異。由于兩組患者年齡差異有統計學意義,所以將年齡作為協變量,使用協方差分析比較兩組之間皮質FF值、髓質FF值、皮質R2*值及髓質R2*值的差異,采用偏相關分析研究皮質FF 值、髓質FF 值、皮質R2*值及髓質R2*值與eGFR、Scr和HOMA2-IR的相關性。采用受試者工作特征(receiver-operating characteristic,ROC)曲線分析評價兩種MRI 技術對早期輕度腎損傷的診斷效能。結果均以P<0.05 為差異有統計學差異。
2 結果
2.1 一般資料
本研究共納入24 例MetS 和18 例非MetS 志愿者,人口統計學和臨床特征見表1。所有研究對象均為男性,年齡為(33.88±8.30)歲,兩組間年齡差異具有統計學意義(P<0.001)。MetS所有組分(空腹血糖、HDL-C、甘油三酯、腰圍、收縮壓、舒張壓)在兩組間差異均具有統計學意義。除了身高以外,身體測量指標中腰圍、臀圍、腰臀比、腰圍身高比和BMI在兩組間差異均具有統計學意義(P均<0.05)。MetS 組Scr 和HOMA2-IR 均 高 于 非MetS 組(P均<0.05),非MetS 組eGFR 高于MetS 組[分別為(107.35±11.84) mL·min-1·(1.73 m2)-1和(88.35±20.19) mL·min-1·(1.73 m2)-1,P<0.001]。
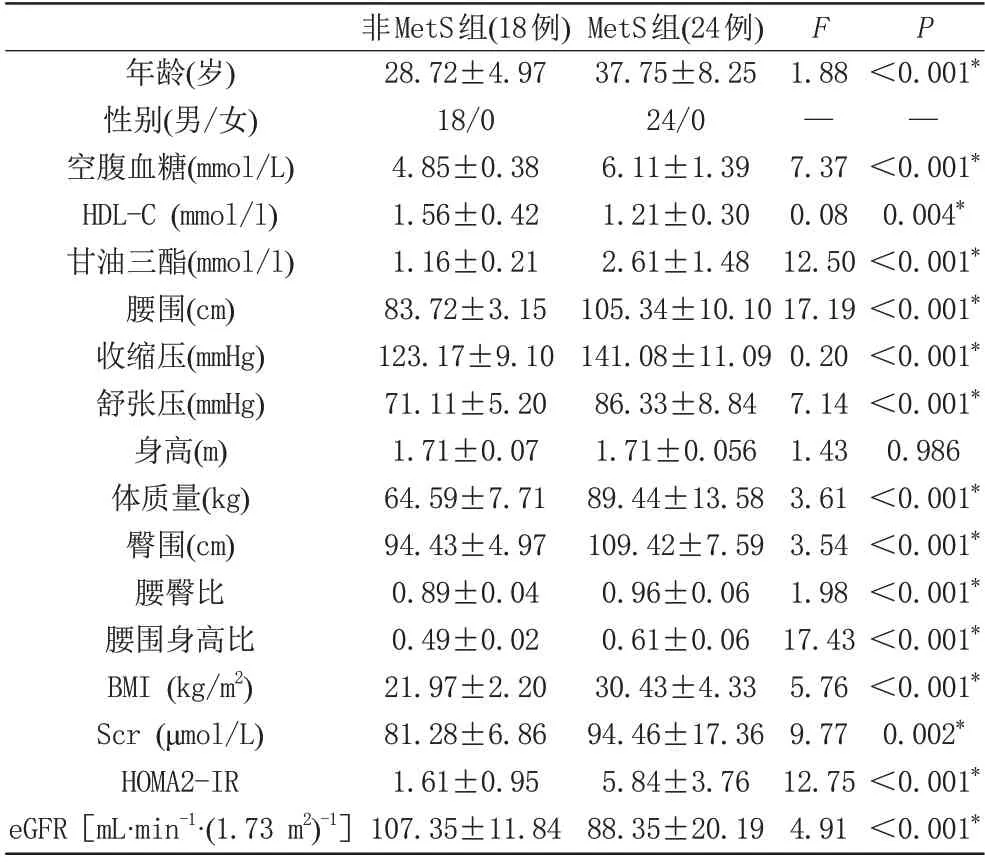
表1 研究對象的人口統計學、身體測量和血生化指標Tab.1 Demography,body measurement and blood biochemical indexes of the subjects
2.2 觀察者測量結果的一致性檢驗
兩名觀察者測得的腎臟皮質、髓質FF 的ICC 值分別為0.85 (95%CI:0.74~0.92)和0.78 (95%CI:0.62~0.87),而腎臟皮質、髓質R2*的ICC 值分別為0.80 (95%CI:0.67~0.88) 和0.65 (95%CI:0.45~0.79)。
2.3 定量參數的比較
2.3.1 Dixon-MRI測量腎臟FF值
MetS 組的皮質FF 值顯著高于非MetS 組(MetS組:4.21%±0.79%,非MetS 組:2.51%±0.75%,P<0.001),兩組間髓質FF 值差異無統計學意義(P=0.076)。校正年齡潛在的混雜因素后,腎皮質FF 值在MetS和非MetS組間差異仍然具有統計學意義(P<0.001),如表2所示。
2.3.2 BOLD-MRI測量腎臟R2*值
MetS 組與非MetS 組的腎髓質R2*值分別為(31.29±1.17) s-1、(27.02±1.38) s-1,兩組間差異有統計學意義(P=0.008),皮質R2*值差異無統計學意義(P>0.05)。校正年齡后,兩組間腎髓質R2*值差異仍有統計學意義(P=0.035),如表2所示。

表2 腎臟皮質和髓質FF值及R2*值在非MetS和MetS組間的比較Tab.2 Comparison of FF and R2*values of renal cortex and medulla between non-MetS and MetS groups
2.4 相關性分析
腎臟皮質FF 值與eGFR 呈負相關(r=-0.46,P=0.002),與Scr 和HOMA2-IR 呈 正 相 關(r=0.45,P=0.003;r=0.38,P=0.013)。控制年齡的影響因素后,腎臟皮質FF 值與eGFR 的偏相關性系數降至-0.37(P=0.017),與Scr 和HOMA2-IR 的偏相關性系數分別為0.39 (P=0.012)和r=0.34 (P=0.026),如表3、圖2所示。
圖2 腎皮質FF與eGFR、Scr及HOMA2-IR的相關性。圖3 ROC曲線評價Dixon-MRI和BOLD-MRI定量指標診斷輕度腎功能損傷。Fig. 2 Correlations between FF in renal cortex and eGFR, Scr, and HOMA2-IR. Fig. 3 ROC curve evaluation of Dixon-MRI and BOLD-MRI quantitative indicators for the diagnosis of mild renal injury.
腎臟髓質R2*值與eGFR 呈負相關(r=-0.32,P=0.037),與Scr呈正相關(r=0.33,P=0.036),而髓質R2*值與HOMA2-IR之間不存在相關性(P=0.053)。校正年齡因素后,髓質R2*值與eGFR、Scr 之間無相關性(r=-0.25,P=0.119;r=0.27,P=0.086),如表3所示。
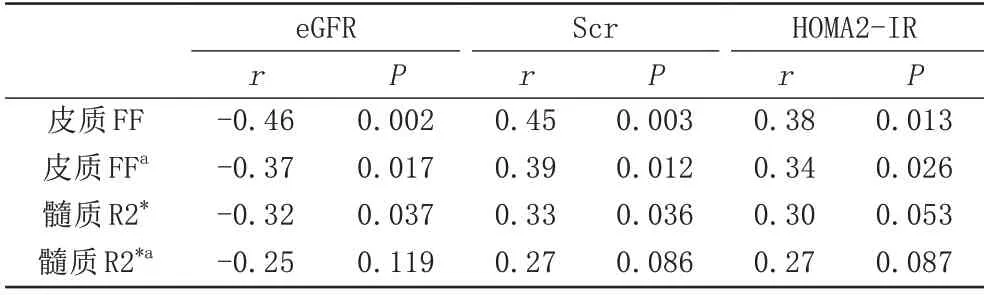
表3 腎臟皮質FF值和髓質R2*值與eGFR、Scr和HOMA2-IR間的相關性Tab.3 Correlation between renal cortex FF value and medulla R2*value and eGFR,Scr and HOMA2-IR
2.5 ROC曲線分析診斷效能
腎皮質FF鑒別腎功能正常和輕度腎功能損傷的曲線下面積(area under the curve,AUC)、敏感度和特異度分別為82.7%、85.7%和71.4%,髓質R2*鑒別腎功能正常和輕度腎功能損傷AUC、敏感度和特異度分別為74.2%、50.0%和89.3%,如圖3所示。
3 討論
本研究使用Dixon-MRI和BOLD-MRI分別對MetS患者和非MetS患者的腎臟脂肪沉積和氧合水平進行了定量檢測,結果顯示eGFR 正常或輕度下降的MetS患者腎臟皮質FF值和髓質R2*值均增高,但是皮質FF與腎功能相關的血生化指標具有更好的相關性,且在輕度腎損傷方面具有更高的診斷效能。我們發現與BOLD-MR 技術相比,Dixon-MRI 技術或許更有可能成為監測由MetS引起早期腎損傷的有效成像工具。
3.1 Dixon-MRI定量結果分析
本研究中,Dixon-MRI 檢測到MetS 患者處于CKD的早期階段[eGFR>60 mL·min-1·(1.73 m2)-1]時腎實質脂肪含量增加,且主要發生在腎皮質,這與以往動物實驗的基礎研究結果一致[2-3]。既往動物實驗研究表明早期MetS,即使在eGFR處于超濾過期,可觀察到腎臟脂肪沉積,而且會進一步損傷腎小球[3,13]。MetS 所致的腎脂肪積累的機制相當復雜,目前人們對之了解甚少。未來的研究可更多地關注MetS腎脂肪毒性機制的研究。在我們的研究中,Dixon-MRI 檢測到MetS 早期腎功能輕度損傷時皮質FF 增高,這提示了腎臟皮質FF值可能是潛在反映早期腎損傷的定量影像生物標記物,準確定量檢測腎臟脂質改變或許是發現潛在早期腎損傷的關鍵,這將可能有助于減少不可逆腎損傷的發生,降低透析的可能性和死亡風險。
3.2 BOLD-MRI定量結果分析
本研究觀察到當eGFR正常或輕度下降時,BOLD-MRI 檢測到髓質R2*值顯著升高,但是即使eGFR降至低于60 mL·min-1·(1.73 m2)-1時,皮質R2*值仍然沒有發生明顯改變。在本研究中早期MetS腎臟改變主要在髓質中,這表明腎臟對MetS 的易感性存在區域差異。這與既往研究報道的腎臟中髓質較皮質對缺氧損傷更敏感一致[14-15]。MetS 引起早期腎小球超濾和髓質缺氧變化與腎臟線粒體異常和功能障礙有關[2,14]。BOLD-MRI 通過監測人腎臟組織氧合來反映腎組織中的脫氧血紅蛋白水平,其中R2*值的增加代表著較高的脫氧血紅蛋白濃度,較低的氧合[16]。可見,髓質R2*值可以反映早期腎損傷引起的腎臟缺氧情況。
3.3 Dixon-MRI和BOLD-MRI的比較
與BOLD-MRI相比,Dixon-MRI在診斷MetS腎臟輕度腎損傷方面更具有潛力。首先,無論是否校正年齡的影響,腎臟皮質FF 值都與eGFR、Scr 和HOMA2-IR具有顯著的相關性;而腎臟髓質R2*值在校正年齡后,與eGFR 和Scr 不再存在相關性。由此提示與腎髓質R2*值相比,腎皮質FF 值與腎功能相關的血生化指標具有更好的相關性。以往有研究表明腎髓質R2*值與eGFR 顯著相關,而在本研究中,校正年齡前,腎髓質R2*值與eGFR 間呈弱相關,這可能與本研究僅納入腎功能正常及輕度受損的MetS患者有關[17-18]。其次,在鑒別腎功能正常和輕度腎功能損傷的診斷效能方面,腎皮質FF 比髓質R2*具有更高的敏感度(Dixon-MRI:85.7% vs. BOLD-MRI:50.0%)。而且腎皮質和腎髓質的R2*值容易受到很多因素的影響。水合作用狀態會影響BOLD-MRI信號,在短時間內飲用較多的水會洗去R2*值的差異。飲食中鹽的攝入量也會影響腎臟的R2*值[19]。
3.4 本研究的局限性
本研究也存在一些局限性:第一,樣本量偏少,這可能會影響研究結果的穩定性;第二,缺少病理對照分析;第三,選擇eGFR 來評估腎功能,不足以確定MRI 生物標志物的實用性。鑒于蛋白尿是腎臟損害的標志和CKD不良結局的獨立預測因子,后續研究應該將MRI 測量與蛋白尿的大小和蛋白尿隨時間的變化聯系起來[20];第四,沒有詳細記錄MR 掃描前飲食和進水情況,這些可能會影響到腎功能和R2*值的準確評估[21];第五,缺少女性受試者群體。
綜上所述,與BOLD-MRI 技術相比,Dixon-MRI 能更穩定地檢測出腎功能正常或輕度損傷的MetS患者的腎臟改變。在監測MetS引起的潛在或早期腎損傷方面,皮質FF 或許是一種更有前景的影像生物學標記物。
作者利益沖突聲明:全體作者均聲明無利益沖突。

