基于人工智能與全球上市藥物數據探尋抗垂體腺瘤藥物及體外實驗驗證
呂婷婷, 張子睿, 李尚, 孫嵐, 杜冠華
(中國醫學科學院北京協和醫學院藥物研究所藥物篩選中心,北京 100050)
垂體腺瘤約占所有顱內腫瘤的15%~25%,其發病率在顱內腫瘤中排名第二[1-2]。垂體腺瘤是一種罕見病,缺乏有效的治療藥物,因此目前的一線治療方式是手術切除。然而高達20%的垂體腺瘤,尤其是巨腺瘤在術后會出現腫瘤快速生長及腫瘤復發[3-4]。更嚴重的是,0.2%的垂體腺瘤很有可能發展為垂體癌[5]。Almutairi等[6]報道,垂體腺瘤的完全切除率僅為66%~78%。高復發率和低生存率成為垂體惡性腫瘤治療的主要障礙[5]。
目前已上市的垂體腺瘤治療藥物只能緩解激素異常分泌引起的部分癥狀,而不能抑制腫瘤生長,只能作為手術的輔助用藥或需長期服藥,對患者的生理和心理都造成極大的負擔。因此,本研究希望尋找可以在抑制激素分泌的同時能夠控制腫瘤生長甚至能殺滅腫瘤的藥物。
信號轉導與轉錄激活因子6(signal transducer and activator of transcription 6, STAT6)是轉錄因子家族,涉及多種生物過程,如免疫反應、細胞存活和細胞生長,且與多種癌癥的發展和進展有關[7]。STAT6蛋白高度參與了與致癌作用相關的炎癥過程的調節[8],例如,STAT6調節精氨酸酶1(Arg1)、甘露糖受體C型1(Mrc1)、Retnla(Fizz1)和chil3(Ym1)等巨噬細胞M2樣相關特定基因的表達[9-10]。STAT6在前列腺癌的發展和轉移中也起著關鍵作用[11]。此外,對68例垂體腺瘤患者的全基因組DNA甲基化和mRNA微陣列分析表明,STAT6的表達和甲基化與垂體腺瘤的侵襲性相關[12]。研究提示STAT6可能是垂體腺瘤的一個有希望的治療靶點。創新藥物的研發周期長、經濟投入大、風險高[13]。藥物重定位是指在現有藥物的原始醫學適應范圍之外尋找其新用途的過程,能夠大幅度降低藥物的總體開發成本,縮短研發周期[14]。因此,本研究聯合人工智能技術與基于STAT6靶點的藥物重定位策略,從全球上市藥物數據庫中尋找垂體腺瘤治療藥物,旨為垂體腺瘤的治療研究提供有力證據。
1 材料與方法
1.1 細胞
小鼠垂體腺瘤AtT-20細胞、大鼠垂體腺瘤GH3細胞均保存在中國醫學科學院藥物研究所篩選中心。AtT-20細胞培養于含體積分數10%胎牛血清,1%青鏈霉素(100 kU/L青霉素、0.1 g/L鏈霉素)的DMEM培養基中;GH3細胞培養于含體積分數15%馬血清,2.5%胎牛血清,1%青鏈霉素(100 kU/L青霉素、0.1 g/L鏈霉素)的Ham′s F-12K培養基中,均置于37 ℃、含體積分數5%的CO2細胞培養箱中常規培養。
1.2 主要藥品與試劑
他莫昔芬、吉非替尼購自上海皓元生物醫藥科技有限公司,細胞計數試劑盒-8(CCK8)、Annexin V-EGFP 細胞凋亡檢測試劑盒購自南京凱基生物公司。促腎上腺皮質激素(adreno corticotropic hormone, ACTH)和生長激素(growth hormone, GH)的ELISA試劑盒購自武漢華美生物工程有限公司。逆轉錄試劑盒購自莫納生物公司, qRT-PCR試劑盒購自Vazyme公司。qRT-PCR引物合成自北京奧科鼎盛生物科技有限公司,引物序列如下,β-肌動蛋白引物:上游5′-TCTGTGTGGATTGGTGGCTCTA-3′,下游5′-CTGCTTGCTGATCCACATCTG-3′;STAT6引物:上游5′-TTCTGCCAAAGACCTGTCCAT-3′,下游5′-CTGTCCTCTACCATAGTCACA-3′。RIPA裂解液、BCA蛋白定量試劑盒、ECL超敏發光液購自北京普利萊基因技術有限公司。磷脂酰肌醇3-激酶(PI3K)、磷酸化-PI3K、蛋白激酶B(AKT)、磷酸化-AKT、p53蛋白、Bcl-2相關X蛋白(Bax)等抗體購自美國Cell Signaling Technology公司。B淋巴細胞瘤-2基因(Bcl-2)和甘油醛-3-磷酸脫氫酶(GAPDH)抗體購自艾博抗(上海)貿易有限公司(英國Abcam公司)。
1.3 微陣列數據的獲取及分析
在基因表達數據庫(Gene Expression Omnibus,GEO)中通過檢索“pituitary adenoma”獲取垂體腺瘤相關基因表達譜,采用GEO2R在線分析工具對基因表達譜進行分析,篩選差異表達基因(differentially expressed genes, DEGs),篩選條件為|log2(fold change,FC)|>1,校正后P值<0.05。運用R語言實現垂體腺瘤基因表達譜的可視化。而后運用DAVID數據庫(the database for annotation, visualization and integrated discovery)對DEGs進行基因本體(Genome ontology, GO)及京都基因和基因組百科全書(Kyoto encyclopedia of genes and genomes, KEGG)信號通路富集分析,P值<0.05為差異有統計學意義。此外,運用STRING數據庫(search tool for the retrieval of interacting genes)對DEGs進行蛋白-蛋白相互作用(protein-protein interaction, PPI)網絡分析,相互作用得分(interaction score)>0.4為有統計學意義。
1.4 Hub基因的篩選與驗證
通過cyto-Hubba插件中的MCC算法篩選出PPI網絡中的前10個Hub基因,并運用qRT-PCR通過mRNA表達水平驗證Hub基因在巨腺瘤與微腺瘤組織中的差異表達。垂體腺瘤模型為本課題組前期構建,待腫瘤直徑達3~5 mm后,將模型動物隨機分為巨腺瘤與微腺瘤組。巨腺瘤組灌胃給予0.5% 羧甲基纖維素鈉(CMC-Na),微腺瘤組灌胃給予治療藥物蓓薩羅丁,給藥21 d后獲取瘤組織。
1.5 上市藥物的富集及相互作用驗證
1.5.1 基于靶點的藥物重定位 針對垂體腺瘤靶點的全球上市藥物從Drugbank數據庫 (https://www.Drugbank.ca/)和國家人口與健康科學數據共享平臺藥學數據中心的全球上市藥物數據庫(http://pharmdata. ncmi. cn/globaldrugs/index. asp)中富集。
1.5.2 基于人工智能平臺反向找靶 通過Pubchem化合物數據庫下載他莫昔芬(CAS:10540-29-1)的三維結構,并上傳至SwissTargetPrediction、TargetNet、PharmMapper、ChEMBL等多個靶點預測數據庫。通過人工智能算法識別、預測可與他莫昔芬結合的蛋白靶點。
1.5.3 分子對接驗證 將美國食品藥品監督管理局(FDA)批準的靶向“STAT6”的藥物他莫昔芬通過CDOCKER的分子對接分析得到確證。靶點蛋白STAT6的晶體結構來自PDB數據庫,為了保證分子對接的可靠性,選擇分辨率<2.5 ?且具有配體復合物的蛋白晶體結構(ID: 3ZEP)建立分子對接模型。對接程序使用Discovery Studio 2018(美國BIOVIA),化合物和靶點蛋白的制備均由小分子配體模塊完成。首先去除PDB結構中的水分子,對接的活性口袋由原始配體分子進行定義。設置對接參數后,將晶體結構中的配體分子抽取出來并重新對接至預先定義好的活性口袋,同時計算對接后的配體分子構象與晶體結構中的初始構象之間的均方根差值(root-mean square deviation, RMSD),若RMSD值<2.5,則認為分子對接結果可靠。
1.6 垂體腺瘤細胞實驗
1.6.1 CCK8檢測細胞存活率 將對數生長期的AtT-20細胞、GH3細胞以每孔1×104個的密度接種至96孔板,37 ℃培養至細胞貼壁后,用完全培養基稀釋他莫昔芬母液至1、4、8、12、15、20和30 μmol/L并分別加至各孔,并設置0.1%的二甲基亞砜為對照組。細胞培養箱中培養24 h后,根據說明書使用CCK8試劑盒檢測細胞存活率。
1.6.2 流式細胞儀檢測細胞凋亡 將AtT-20細胞、GH3細胞在含有0、5、10和15 μmol/L他莫昔芬的6孔板中培養24 h后,與Annexin V-EGFP和PI染液在室溫下孵育30 min。然后用流式細胞儀檢測細胞凋亡率。
1.6.3 ELISA檢測GH和ACTH的分泌 GH3和AtT-20細胞以5×105個細胞的密度接種于60 mm培養皿中,并與不同濃度(1、5、10 μmol/L)的他莫昔芬或10 μmol/L吉非替尼共同培養24 h。使用ELISA特定試劑盒檢測細胞上清液中GH和ACTH的水平。
1.6.4 蛋白質印跡法檢測PI3K-AKT通路相關蛋白 收集并提取吉非替尼或不同濃度他莫昔芬(1、5、10 μmol/L)處理24 h后的AtT-20細胞、GH3細胞中的蛋白,加入上樣緩沖液后,100 ℃處理10 min進行變性。采用SDS-PAGE電泳,電泳后將蛋白轉印至PVDF膜,室溫封閉2 h。分別加入特異性的一抗(PI3K 1 ∶1 000,p-PI3K 1 ∶500,AKT 1 ∶1 000,p-AKT 1 ∶500,p53 1 ∶1 000,Bax 1 ∶1 000,Bcl-2 1 ∶1 000,GAPDH 1 ∶1 000),4 ℃孵育過夜后,TBST洗膜4~5次,再加入HRP標記的二抗(1 ∶3 000)室溫孵育2 h,洗膜。ECL顯色,顯影,定量,使用Image J軟件分析蛋白條帶,以目的蛋白與內參GAPDH灰度值的比值表示蛋白的相對表達量。
1.7 統計學方法
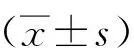
2 結果
2.1 垂體腺瘤基因表達譜分析
檢索得到垂體腺瘤數據集GSE 93825(GPL18281, Illumina HumanHT-12 WG-DASL V4.0 R2 expression beadchip),該數據集中共收集11例巨腺瘤患者和29例微腺瘤患者的新鮮神經內分泌組織標本。通過GEO2R在線工具篩選得到96個DEGs,其中,表達上調的基因25個,表達下調的基因71個。垂體腺瘤數據集的基因表達火山圖、熱圖如圖1所示。DEGs的GO功能和KEGG信號通路富集結果見圖2,其主要富集于調節酶催化活性、調節磷酸化和磷酸鹽代謝、細胞增殖、細胞生物合成和大分子代謝作用等相關的生物過程。此外,DEGs構建的PPI網絡如圖3所示。

圖1 巨腺瘤和微腺瘤差異表達基因的火山圖(A)和熱圖(B)

圖2 差異表達基因的GO功能和KEGG信號通路富集分析

圖3 差異表達基因的PPI網絡圖
2.2 STAT6是垂體腺瘤的潛在治療靶點
基于cyto-Hubba的MCC算法篩選出前10個Hub基因LEP、PTGS2、STAT6、CXCL12、ITPKB、CCR7、LPAR2、CXCR5、ADCY3和TAS2R14(表1),通過文獻檢索選擇其中已報道的6個癌癥相關基因并根據校正P值和log2(FC)進行排序(表2)。最終選擇差異倍數最大的STAT6基因進行進一步的mRNA表達水平量化驗證。結果表明(圖4),STAT6的表達水平與垂體腺瘤的大小相關,其可能成為垂體腺瘤的潛在治療靶點。

表1 PPI網絡中的前10位Hub基因

表2 基于校正P值和 log2(FC)值的基因排名

a: P<0.01,與巨腺瘤組比較
2.3 他莫昔芬是垂體腺瘤治療的候選藥物
將關鍵蛋白“STAT6”通過全球上市藥物數據庫進行藥物富集,如表3所示,他莫昔芬是STAT6的抑制劑,杜匹魯單抗是STAT6的拮抗劑。通過文獻調研發現,他莫昔芬目前用于乳腺癌、卵巢癌、胰腺導管腺癌等多種激素依賴性癌癥的治療,而杜匹魯單抗目前僅用于治療中重度特應性皮炎。因此,選取他莫昔芬作為候選藥物進行進一步研究。

表3 批準的靶向STAT6的化合物
2.4 他莫昔芬靶向STAT6的驗證
分子對接預測相互作用:首先,計算對接后配體—他莫昔芬與晶體中的原配體的空間坐標的RMSD值為0.319 9,小于2.5,表明此次分子對接計算結果可靠。其次,用CDOCKER精準分子對接方法驗證他莫昔芬與STAT6靶點蛋白的相互作用,CDOCKER energy指示配體與靶點蛋白間的結合能力,其值越高提示結合能力越強。結果顯示,他莫昔芬的CDOCKER energy值為14.392 1,原始配體的CDOCKER energy值為6.938 7,說明他莫昔芬與STAT6的結合能力超過該靶點蛋白的原配體。他莫昔芬可以通過氫鍵、Pi鍵、離子間的引力等多種方式與靶點蛋白結合(圖5),證明了他莫昔芬與STAT6靶點蛋白相互作用預測結果的可靠性。

A:他莫昔芬與STAT6相互結合;B:他莫昔芬與STAT6的相互作用方式
人工智能反向找靶:通過人工智能平臺對409個蛋白與他莫昔芬的結合進行預測,預測評分達到99.9分以上的靶點蛋白有19個(表4),其中STAT6排在第12位。因此,初步認為他莫昔芬通過靶向STAT6而發揮垂體腺瘤治療作用。

表4 預測的與他莫昔芬相互作用的前19個蛋白
2.5 他莫昔芬對垂體腺瘤細胞的作用
2.5.1 他莫昔芬抑制垂體腺瘤細胞增殖,促進細胞凋亡 CCK8檢測結果表明,他莫昔芬在培養24 h后能夠抑制垂體腺瘤細胞GH3和AtT-20的增殖(圖6)。流式分析結果表明,他莫昔芬劑量依賴性增加了GH3和AtT-20細胞的凋亡率(圖7)。

圖6 CCK8法測定他莫昔芬處理后AtT-20和GH3細胞的存活率

圖7 流式細胞術分析他莫昔芬處理后GH3和AtT-20細胞的凋亡率
2.5.2 他莫昔芬抑制垂體腺瘤細胞分泌ACTH和GH ELISA檢測結果表明,他莫昔芬處理后顯著降低了分別由垂體腺瘤細胞GH3和AtT-20分泌的GH和ACTH的水平(圖8),但吉非替尼治療并未顯著影響激素分泌。

a: P<0.05, b:P<0.001,與對照組比較
2.5.3 他莫昔芬對垂體腺瘤細胞PI3K/AKT信號通路及凋亡相關蛋白的影響 蛋白質印跡結果顯示,與未處理的對照組相比,他莫昔芬處理垂體腺瘤
GH3和AtT-20細胞24 h后,可以下調p-PI3K、p-AKT的活性,降低抗凋亡蛋白Bcl-2的表達,并上調促凋亡蛋白p53和Bax的表達(圖9)。而吉非替尼能下調AtT-20細胞中p-PI3K的活性,增加Bax蛋白的表達,并能降低GH3和AtT-20細胞中Bcl-2蛋白的表達;對兩種細胞中其他凋亡相關蛋白的表達水平沒有顯著影響。

a:P<0.05, b:P<0.01, c:P<0.001,與對照組比較
3 討論
雖然垂體腺瘤被定義為罕見病,但在中國人口基數龐大的情況下,我國每年確診的垂體腺瘤患者數量實際上并不少。然而,隨著確診人數的增多,不能接受手術或手術失敗的病例也逐漸增多。研究人員希望藥物不僅能起輔助作用,也能夠“獨當一面”成為一線治療方式,讓患者擺脫手術帶來的風險和精神壓力,同時也減輕垂體腺瘤對患者、家庭以及社會帶來的經濟負擔。為了節約藥物研發的時間成本和經濟成本,本研究選擇通過藥物重定位策略來尋找已上市藥物中有垂體腺瘤治療潛力的藥物,并對其進行藥效驗證以及機制的初步探索。
本研究首先通過生物信息學工具分析垂體腺瘤巨腺瘤與微腺瘤之間的差異基因表達譜,共篩選得到96個DEGs,包括25個表達上調的基因和71個下調基因。然后從DEGs的PPI網絡中篩選出得分最高的前10個Hub基因,結合文獻調研以及log2(FC)值,最終選擇表達倍數變化最大的STAT6基因進行mRNA水平驗證。qRT-PCR結果表明,STAT6的mRNA表達水平與垂體腺瘤的大小相關,其可能成為診斷和治療垂體腺瘤的潛在新靶點。

a:P<0.05, b:P<0.01, 與對照組比較
在藥物重定位中,基于網絡的重定位是最常用的方法之一,常用的網絡分為DTI (drug target interaction) 網絡、基因調控網絡、代謝網絡等[15],其中的集合包括PPI、藥物-疾病網絡、藥物-靶點-疾病網絡、疾病-基因網絡、疾病-蛋白質-基因網絡等[16]。本研究通過全球上市藥物數據庫對垂體腺瘤靶點“STAT6”進行藥物富集得到垂體腺瘤的潛在治療藥物他莫昔芬。他莫昔芬由英國的ICI制藥公司研制,在1977年由美國FDA批準上市用于晚期乳腺癌的治療。目前他莫昔芬已用于膠質瘤、肝癌、子宮內膜癌等多種癌癥的臨床試驗[17]。他莫昔芬不僅抑制細胞增殖,還能促進細胞周期停滯、細胞凋亡和抗血管生成[18]。值得注意的是,他莫昔芬也是一種具有免疫刺激特性的抗增殖藥物。例如,他莫昔芬通過阻斷M2型小膠質細胞的極化和增強免疫功能來抑制雌激素受體缺陷型乳腺癌的腦轉移[19]。研究還發現他莫昔芬減少了胰腺導管腺癌組織的纖維化,其作為炎癥和免疫反應的潛在調節劑來調控腫瘤相關巨噬細胞的極化[20]。近日有相關文獻報道他莫昔芬能夠抑制GH3細胞的增殖,但其作用靶點是雌激素受體[21]。然而本研究的分析結果表明STAT6可能是調控垂體腺瘤生長的潛在靶點,為了證實STAT6是他莫昔芬的作用靶點或靶點之一,本研究對STAT6對他莫昔芬功能的介導作用進行了驗證。
首先利用分子對接方法,驗證他莫昔芬與靶點蛋白STAT6的結合情況,從CDOCKER對接的結果來看,STAT6可與他莫昔芬結合,且STAT6蛋白與他莫昔芬結合的得分值超過了蛋白的原配體。然后,基于包含409個蛋白的靶點預測數據庫,通過人工智能算法將可與他莫昔芬結合的蛋白靶點進行排序,發現STAT6是他莫昔芬的高評分結合位點。最后體外實驗結果表明,他莫昔芬能夠抑制垂體腺瘤細胞的增殖和激素分泌,蛋白質印跡結果顯示他莫昔芬可抑制垂體腺瘤細胞中PI3K-AKT的活性,降低抗凋亡蛋白Bcl-2的表達,并上調促凋亡蛋白p53和Bax的表達,誘導垂體腺瘤細胞凋亡。PI3K-AKT信號轉導通路在細胞中廣泛存在,并在細胞生長、增殖、凋亡等過程中扮演重要角色。研究發現,在許多類型的癌癥中PI3K/AKT信號通路異常激活[22-23]。AKT是PI3K下游的關鍵信號分子,在腫瘤的發生發展過程中,AKT的磷酸化可以促進腫瘤的侵襲和遷移,并調節其下游靶基因p21、p27、Bax和Bcl-2的表達,促進腫瘤的生長[22,24]。腫瘤抑制因子p53是一種轉錄因子,AKT也可以磷酸化p53結合蛋白鼠雙微粒體2(murine double minute 2,MDM2),從而影響p53的活性[24]。
綜上所述,本研究通過人工智能技術和藥物重定位在全球上市藥物中尋找有垂體腺瘤治療潛力的候選藥物,并驗證了他莫昔芬在體外對垂體腺瘤細胞增殖和激素分泌有抑制作用,為垂體腺瘤的新藥研發與臨床用藥提供了新思路,也為其他上市藥物的重定位提供借鑒。

