慢性食物蛋白誘導性小腸結腸炎綜合征患兒的臨床特征與早期識別
龍云, 秦臻, 卓琳, 吳成
(安徽省兒童醫院消化內科,安徽 合肥 230051)
60%的兒童食物過敏累及消化系統[1],其中食物蛋白誘導性小腸結腸炎綜合征(food protein-induced enterocolitis syndrome,FPIES)多發生于嬰兒期,也有報道在出生后的數小時內即可出現,是非IgE介導的一種食物過敏性胃腸病[2]。FPIES患兒發病率逐年升高[3],多種食物都可能觸發FPIES,包括牛奶[4]、大豆[5]、雞蛋[6]、谷物[7]、魚類[8]及母乳[9]等,可以是一種或多種食物過敏。慢性FPIES臨床表現為間歇性嘔吐、腹瀉、脫水、低血壓、低血容量性休克等癥狀,其中低白蛋白血癥和體重增長不良是慢性型FPIES的獨立預測因素[10-11];臨床上常被誤診為病毒、細菌感染的胃腸炎、敗血癥,胃食管反流或腸旋轉不良等外科急腹癥,甚至是代謝、神經系統疾病[12],其診斷延遲中位時間可達4~7個月[13]。有學者對慢性FPIES患兒進行了回顧性分析,研究多探討發病率[13]、常見過敏食物[14]及FPIES持續存在可能的獨立危險因素[15]等,但缺乏對慢性FPIES患兒中炎性指標等相關研究。因此,本研究回顧分析安徽省兒童醫院消化內科13例慢性FPIES患兒的臨床資料,通過對臨床特征及炎性指標(中性粒細胞、CRP、IL-6等)的分析,探討慢性FPIES患兒的早期識別指標。
1 病例與方法
1.1 研究對象
選擇2017年9月至2020年7月在安徽省兒童醫院消化內科住院的慢性FPIES患兒13例,首次發病年齡為2~60 d,另選擇同期15例急性FPIES患兒作為對照,首次發病年齡為22~480 d。
本研究獲得安徽省兒童醫院倫理委員會審核批準(審批號:EYLL-2020-025)并獲得患兒父母知情同意。
1.2 納入與排除標準
參照2017年美國變態反應、哮喘和免疫學會頒布的FPIES診斷的共識指南[12],所有患兒均符合FPIES診斷標準。FPIES臨床表型依據發病年齡、病程以及是否伴發相應IgE介導的食物過敏反應等劃分。其中,急性FPIES主要標準:嘔吐發生在攝入可疑食物1~4 h后,并且缺乏典型的IgE介導的皮膚或呼吸道過敏癥狀;次要標準:在進食同樣的可疑食物后,第2次(或更多次)重復性嘔吐發作;進食不同的食物1~4 h后反復出現嘔吐;有極度嗜睡癥狀者;有面色蒼白癥狀者;發病時需要去急診科就診者;需要靜脈液體支持治療者;進食后24 h內出現腹瀉(通常為5~10 h);低血壓;低體溫。滿足主要標準和3個以上的次要標準即可臨床診斷為急性FPIES。慢性 FPIES診斷標準:患者規律進食致敏的食物,引起間歇性發作但逐漸加重的嘔吐和腹瀉癥狀,在剔除致敏食物后幾天內癥狀緩解,重新攝入致敏食物發生急性FPIES反應(攝入后1~4 h嘔吐,24 h內腹瀉),重癥者脫水、代謝性酸中毒和休克。排除標準:患感染性胃腸炎、胃食管反流、嗜酸細胞胃腸炎、炎癥性腸病、乳糜瀉等疾病。
1.3 研究方法
1.3.1 資料采集 收集慢性與急性FPIES兩組患兒的基本情況、治療前的臨床特征、常規實驗室檢查、內鏡及影像學檢查、組織病理分析、口服耐受年齡,并進行比較。
1.3.2 實驗室檢查 本院實驗室采用光檢測器法及流體聚焦法分析白細胞、紅細胞、血小板、血紅蛋白等的計數;采用化學發光法檢測IL-6、TNF-α水平。
1.3.3 口服耐受年齡 采用開放式口服食物激發試驗(oral food challenge testing, OFC)明確過敏原和口服耐受時間,其中所有牛奶蛋白過敏患兒均接受了針對牛奶蛋白的開放性OFC,以30 min間隔分別給予0.1、1、3、10、30、100 mL。留觀4~6 h,以觀察其臨床表現,并記錄牛奶口服耐受時間,確定口服耐受年齡;采用固體食物進行OFC時,則在30 min內分3次將激發食物平均分給患兒,總量約0.3 g/kg食物蛋白[12],記錄口服耐受時間。
1.3.4 治療方案 急、慢性FPIES患兒均回避過敏食物,部分患兒給予深度水解或氨基酸配方粉。對合并嚴重感染、中重度脫水的慢性FPIES患兒,給予抗生素、白蛋白、丙種球蛋白靜脈滴注和補液治療;對合并中重度脫水的急性FPIES患兒給予靜脈補液治療,合并輕度脫水的患兒采用口服補液糾正脫水。
1.4 隨訪
所有患兒均接受門診或電話隨訪,隨訪至2021年6月,隨訪時間13~42個月。出院后每隔1個月隨訪1次,3個月后改為每3~6個月隨訪1次,監測體重并根據開放性OFC記錄牛奶口服耐受年齡。
1.5 統計學方法
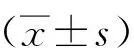
2 結果
2.1 急、慢性FPIES患兒一般情況比較
13例慢性FPIES患兒中,男7例,女6例;母乳喂養3例,人工喂養7例,混合喂養3例;特應性家族史陽性3例,其中1例父親過敏性鼻炎,1例姐姐牛奶蛋白過敏,1例母親芒果過敏;特應性疾病史4例,均為濕疹;順產6例,剖宮產7例;過敏原均為牛奶;均為早發型,重度9例,輕中度4例;不典型者(均為牛奶sIgE陽性)3例;5例先后誤診為敗血癥、化膿性腦膜腦炎、胃食管反流、急性壞死性小腸結腸炎。15例急性FPIES患兒中,男8例,女7例;母乳喂養5例,人工喂養6例,混合喂養4例;順產9例,剖宮產6例;2例過敏原為雞蛋,余13例為牛奶。
兩組患兒性別、出生方式、喂養方式、特應性疾病史、家族史及牛奶sIgE陽性比較,差異無統計學意義(P均>0.05);慢性FPIES患兒首次發作中位年齡與診斷時中位年齡明顯早于急性FPIES患兒(P均<0.05)。見表1。

表1 兩組FPIES患兒一般情況比較
2.2 急、慢性FPIES患兒臨床表現比較
根據Fisher精確檢驗的結果可知,與急性FPIES患兒比較,慢性FPIES患兒更多表現為腹瀉、血便、發熱、營養不良,差異有統計學意義(P均<0.05),而嘔吐、腹脹、嗜睡、低體溫、面色蒼白、低血壓、脫水差異無統計學意義(P均>0.05),見表2。

表2 兩組FPIES患兒臨床表現比較 例/%
2.3 急、慢性FPIES患兒治療前實驗室檢查數據比較
慢性FPIES患兒中,白細胞升高8例;中性粒細胞計數升高7例;嗜酸細胞絕對值升高5例;血紅蛋白下降7例;二氧化碳結合率下降6例;血清總IgE升高7例;CRP升高7例;總蛋白下降11例;白蛋白下降6例;4例低鈉血癥;5例代謝性酸中毒(重度2例);2例行骨髓細胞學檢查,示紅系增生活躍,外周血涂片未見寄生蟲;1例腰椎穿刺檢查,腦脊液常規和生化未見異常;1例染色體核型:47,XY,+21。急性FPIES患兒中,白細胞升高6例;中性粒細胞計數升高4例;嗜酸細胞絕對值升高5例;血紅蛋白下降4例;二氧化碳結合率下降2例;血清總IgE升高4例;CRP升高4例;總蛋白下降3例;白蛋白下降3例;1例低鈉血癥;2例代謝性酸中毒(輕度2例)。
與急性FPIES患兒比較,慢性FPIES患兒中性粒細胞計數及CRP、IL-6水平明顯升高(P均<0.05),血清總蛋白、白蛋白、二氧化碳結合率、血紅蛋白明顯降低(P均<0.05);而嗜酸細胞絕對值、血小板計數、總IgE、TNF-α水平兩組間差異無統計學意義(P均>0.05)。見表3。
2.4 急、慢性FPIES患兒內鏡、病理和影像學檢查
慢性FPIES患兒2例行胃鏡檢查,1例上消化道黏膜未見異常,1例十二指腸球部黏膜粗糙,顆粒樣隆起;1例行胃鏡聯合結腸鏡檢查示十二指腸球、降部黏膜紅斑、糜爛;降結腸、乙狀結腸黏膜可見淺凹潰瘍灶,觸之易出血。黏膜組織病理檢查示胃竇黏膜固有層內少量淋巴細胞和嗜酸性粒細胞浸潤,降結腸、乙狀結腸淺表黏膜活動性炎。2例心臟彩超,其中1例心包少量積液,1例心影臥位飽滿;6例行腹部立位片檢查,3例未見異常,3例腸管積氣擴張,其中2例可見多個小液平,部分腸管皺襞增厚。2例頭顱CT腦實質內未見異常密度影。4例上消化道造影未見異常。

表3 兩組FPIES患兒治療前實驗室數據比較
急性FPIES患兒1例行胃鏡檢查,上消化道黏膜未見異常;1例行胃鏡聯合結腸鏡檢查示十二指腸球部黏膜粗糙、乙狀結腸及直腸黏膜可見糜爛灶,黏膜組織病理檢查示乙狀結腸黏膜慢性活動性炎;5例行腹部立位片檢查,4例未見異常,1例腸管積氣明顯,可見多個小液平。
2.5 急、慢性FPIES患兒治療前外周血CRP與IL-6水平相關性分析
慢性FPIES患兒外周血CRP水平與IL-6水平呈正相關(r=0.90,P<0.001),見圖 1,而急性FPIES患兒無相關性。

圖1 慢性FPIES患兒外周血CRP水平與IL-6水平相關性分析
2.6 急、慢性FPIES患兒治療及轉歸
慢性FPIES組中2例母乳喂養患兒在乳母嚴格回避牛奶蛋白相關飲食后,癥狀緩解;其余11例均給予氨基酸配方治療,1例入院時接受了頭孢哌酮抗感染治療,1例入院時接受了亞胺培南抗感染治療,2例接受了白蛋白和人丙種球蛋白治療,出院時均臨床緩解,未再嘔吐,腹瀉緩解。所有患兒均接受了開放性OFC,慢性FPIES患兒中2例OFC目前仍陽性,其余11例牛奶口服耐受中位年齡為20(11~32)個月,其中2例在1歲內牛奶口服耐受,6例1至2歲內,3例2至3歲內。
急性FPIES組中4例母乳喂養患兒在乳母嚴格回避牛奶蛋白相關飲食后,癥狀緩解;4例予深度水解配方治療,5例給予氨基酸配方治療,2例雞蛋過敏患兒回避雞蛋類相關飲食;同時6例接受口服補液治療,5例給予靜脈補液治療。
3 討論
本研究結果顯示,慢性FPIES患兒首次發作中位年齡為28(2~60)d,均為早發型,與相關報道慢性FPIES患兒發病均小于4月齡一致[16]。研究發現,治療前慢性FPIES患兒血清白蛋白、二氧化碳結合率、血紅蛋白較急性FPIES明顯降低(P<0.05),且更多表現為腹瀉、血便。
目前研究表明,固有免疫參與FPIES的發病,而自主神經內分泌通路的激活可促進固有免疫穩態的破壞,導致單核細胞、嗜中性粒細胞、嗜酸性粒細胞和淋巴細胞活化[16];其中單核細胞產生的細胞因子如IL-6、TNF-α等促進腸道炎癥反應的發生,引起腸黏膜通透性增加,腸腔內液體滲出增加[17]。已經證實這些細胞因子可誘導中性粒細胞增多和血清CRP水平升高;CRP升高不僅與FPIES患兒癥狀的嚴重程度相關,也與疾病活動度、耐受性延遲相關[18-19]。本研究發現,與急性FPIES患兒相比,慢性FPIES患兒多表現為發熱,且CRP達(51.99±67.72) mg/L,但是與Lee等[20]研究顯示CRP僅有輕度升高(均<20 mg/dL)不同,相關差別機理尚待進一步研究。此外,本研究同時發現慢性FPIES患兒治療前IL-6水平與CRP 水平呈正相關(r=0.90,P<0.001),提示細胞促炎因子參與慢性FPIES的抗原特異性免疫反應。
研究報道,唐氏綜合征患者更易伴有FPIES,其免疫失調導致TNF-α水平增高和IL-10 水平降低,而IL-10水平降低與FPIES病程延長相關[21-22]。本研究中有1例系21-三體綜合征患兒,至23個月齡時牛奶口服耐受,是否延長病程還需更多樣本研究。
本研究中3例慢性FPIES患兒行內鏡檢查,鏡下見黏膜紅斑、糜爛、潰瘍,組織學檢查提示少量淋巴細胞浸潤、活動性炎。急性FPIES患兒內鏡表現無特異性,故內鏡檢查不建議作為常規檢查[23],但是對病程遷延、營養不良者,需與嗜酸細胞胃腸炎、炎癥性腸病、小腸淋巴管擴張癥、乳糜瀉等疾病相鑒別時,可行消化內鏡和組織學檢查。
OFC是診斷FPIES的金標準。如果病史典型可進行診斷,尤其是對于有兩次或多次 FPIES 反應的患者,則無需通過OFC確認。OFC更常用于評估過敏食物一段時間內的口服免疫耐受。本研究中慢性FPIES患兒過敏原均為牛奶,其中2例牛奶sIgE陽性的患兒牛奶蛋白OFC目前仍陽性。研究發現2%~25% FPIES 患兒同時存在IgE介導的過敏反應,也是FPIES持續存在且口服耐受時間延遲的獨立危險因素[24]。
FPIES的治療主要為嚴格回避過敏食物。對于牛奶誘導的慢性FPIES嬰兒,鼓勵母乳喂養或使用深度水解配方,對有生長遲緩和多種食物過敏的慢性FPIES患兒應考慮使用氨基酸配方[25]。慢性FPIES患兒中11例均接受了氨基酸配方的飲食治療,故建議早期使用氨基酸配方可以更迅速緩解癥狀,盡早改善低白蛋白血癥、體重增長不良和貧血。
總之,對有慢性腹瀉、間歇性嘔吐、血便的患兒伴外周血中性粒細胞計數、IL-6、CRP升高者,以及貧血、低白蛋白血癥、體重增長不良,應考慮慢性FPIES的可能。

