鼷鼠肉螨的形態學觀察和分子鑒定
劉 馨 , 田永路 , 王海良 , 李夏瑩 , 潘保良
(1.中國農業大學動物醫學院 , 北京 海淀 100193 ; 2.北京大學實驗動物中心 , 北京 海淀 100871 ;3.北京市獸藥監察所 , 北京 大興 102629)
寄生于皮毛上的螨蟲是實驗小鼠常見的病原體,常見的有鼷鼠肉螨(Myobiamusculi)、親近雷螨(Radfordiaaffinis)、鼠癬螨(Myocoptesmusculinis)[1]。其中,鼷鼠肉螨對小鼠的致病性最強。螨感染后會導致實驗小鼠出現潰瘍性皮炎[2-3]、全身免疫反應[4-5]、生殖指數下降[2],從而影響科學實驗的準確性。有數據表明,在北美洲實驗小鼠螨的感染率達到12%[6]。實驗小鼠被廣泛應用于科學研究當中,在我國實驗動物質量檢測中偶有發現鼷鼠肉螨的感染,但目前國內對鼷鼠肉螨感染的報道較少,鼷鼠肉螨的具體形態學觀察的文獻大多是模式圖,很少有鏡下形態學相關圖片,并且目前國內對于鼷鼠肉螨的分子鑒定方面尚未有報道。本試驗報道實驗小鼠感染鼷鼠肉螨的案例,收集整理了鼷鼠肉螨的鏡下形態學圖像,并建立了聚合酶鏈式反應(Polymerase chain reaction, PCR)分子鑒定方法,以期為從事實驗動物的工作人員提供參考。
1 材料與方法
1.1 實驗動物 普通級C57BL/6J小鼠,10周齡,飼養于獨立通風籠具(IVC)系統,感染小鼠撥開體表被毛后可見體表有毛屑樣物質,其他臨床癥狀不明顯。
1.2 儀器設備 倒置顯微鏡及成像系統,奧林巴斯有限公司產品;基因擴增儀,賽默飛世爾科技有限公司產品;電泳儀,北京六一生物科技有限公司產品;凝膠成像分析系統,上海天能科技有限公司產品。
1.3 試劑 丁香油、樹膠,均購自阿拉丁公司;乙醇,購自北京化工廠;通用基因組DNA提取試劑盒,購自北京索萊寶科技有限公司;2×TaqPCR Mix,購自北京匯天東方科技有限公司。
1.4 診斷方法
1.4.1 透明膠紙法 在小鼠清醒狀態下,固定小鼠,在每只小鼠的頭部、頸部、腹部、背部粘貼1條4 cm ×2 cm的透明膠帶。之后將膠帶粘貼到載玻片上,在光學顯微鏡下檢查是否存在螨蟲或螨蟲卵。
1.4.2 被毛采集法 小鼠進行輕微麻醉或安樂死后,立即將其置于解剖光學顯微鏡下進行全身毛皮檢查,用鑷子分開毛發,從口角開始到尾基部結束,重點檢查后頸部、腹部兩側和腹股溝區域,采集被毛觀察并收集螨蟲卵或成蟲,用于形態學詳細觀察和PCR檢測。
1.5 螨蟲封片的制作 用解剖針挑取小鼠皮膚上的螨蟲,或采集螨蟲感染部位的皮毛,將其放到載玻片上,分別于30%、40%、50%、60%、70%、80%、90%、95%和100%等不同濃度的酒精中浸泡脫水(各0.5~1 h),之后用1∶1無水乙醇和丁香油混合溶液、丁香油原液分別透明0.5~1 h,用樹膠封片后在顯微鏡下觀察。
1.6 PCR方法檢測并鑒定鼷鼠肉螨 建立鼷鼠肉螨PCR快速檢測方法,首先需要選取適合的基因。在大多數研究中,18S rRNA基因通常用于螨蟲系統發育分析,該基因也能用于螨的分子鑒定。本試驗選定18S rRNA基因(引物MC-18S-F1:5′-CTTGCTCAAAGATTAAGCCATGCA-3′,MC-18S-F2:5′-TGA TCCTTCCGCAGGTTCACCT-3′)進行擴增[7],應用于小鼠體表鼷鼠肉螨的檢測。首先采集皮毛通過顯微鏡進行觀察,選擇含有疑似鼷鼠肉螨和卵的樣品。之后篩選出陽性樣本,用組織DNA提取試劑盒提取DNA,于-20 ℃保存。未感染小鼠的毛發作為陰性對照。PCR檢測總反應體系為20 μL:10 μL 2×TaqPCR Mix,1 μL正向引物,1 μL反向引物,6 μL 模板DNA,2 μL Nuclease-free water。PCR反應條件:98 ℃ 10 s,1個循環;98 ℃ 10 s,60 ℃ 30 s,72 ℃ 2.5 min,40個循環;72 ℃ 5 min,1個循環。用瓊脂糖凝膠電泳檢測PCR擴增產物,產物由生工生物工程(上海)股份有限公司使用ABI 3730XL DNA分析儀進行測序,將得到的測序結果與NCBI數據庫進行序列比對分析。
2 結果
2.1 形態學鑒定 在顯微鏡下,所檢出的螨蟲大體形態特征如圖1~4所示:蟲體呈白色,長橢圓形,中央稍寬,前后兩端稍窄,與其他種類的螨蟲一樣,有4對足,第1對足壓縮變短,位于頭部頂端,螨用其抓附鼠毛,后3對足均由5節組成,且跗節末端各有1根爪樣的構造(爪間突爪),呈鐮刀狀[8]。螨蟲后3對足的體側緣有明顯外突的現象。口器小,有的蟲體伸出的口器較長,有小而簡單的須肢及匕首狀的螯肢。背部、腹部均分布有剛毛,其中尾端有2根特征性的后端毛,從尾乳突中長出。
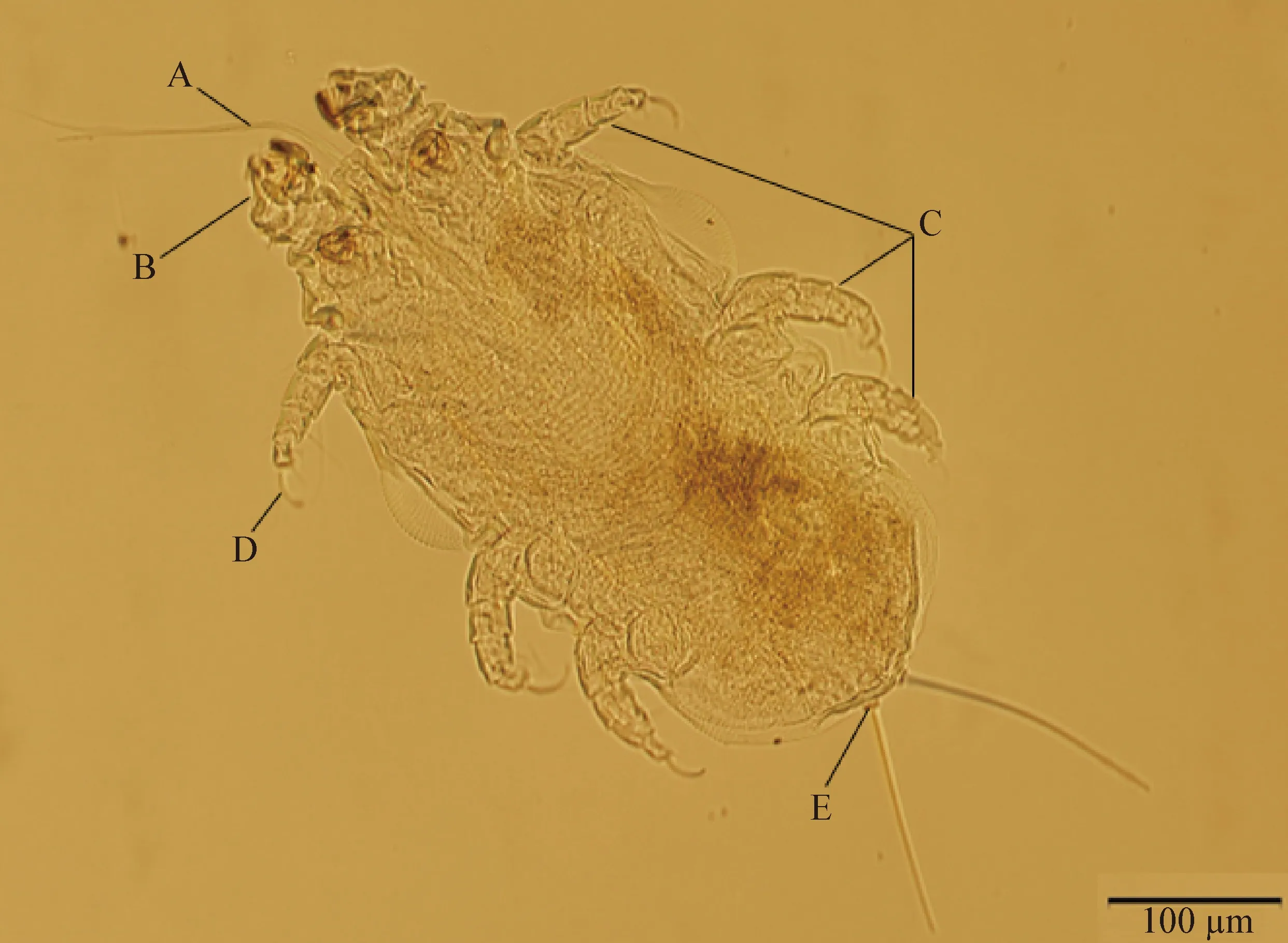
圖1 雄性鼷鼠肉螨(腹面)
經形態學鑒定,初步確定小鼠感染螨蟲為鼷鼠肉螨(M.musculi)。鼷鼠肉螨與另一種親近雷螨(Radfordiaaffinis)形態上非常相近,但其與鼷鼠肉螨的區別是第2對足有1對跗爪,而本試驗觀察到的蟲體只有1只跗爪,所以該螨很可能為鼷鼠肉螨。
2.1.1 鼷鼠肉螨雄蟲形態學 鼷鼠肉螨雄蟲大小為(0.325~0.479) mm×(0.186~0.217) mm(n=5),體型與雌蟲相比較小,有較長的口器,體表分布有剛毛,尾端有1對相互靠近的尾乳突,每個尾乳突上各有1根明顯的剛毛。雄螨的尾乳突相互靠近,依靠尾乳突之間的距離可以辨別雄螨和雌螨。體表有清晰的條紋狀紋路結構。背面和腹面結構無可清晰分辨的特殊性結構(圖1、圖2)。

圖2 雄性鼷鼠肉螨(背面)
2.1.2 鼷鼠肉螨雌蟲形態學 鼷鼠肉螨雌蟲大小為(0.404~0.529) mm×(0.211~0.233) mm(n=5),體表分布有剛毛,尾端的尾乳突與雄性相比相距較遠,2根剛毛從尾乳突中長出,長而明顯,肛門位于體后緣。雌螨體表紋路模糊,腹部可見大量圓形孕卵存在。背面和腹面結構無可清晰分辨的特殊性結構(圖3、圖4)。
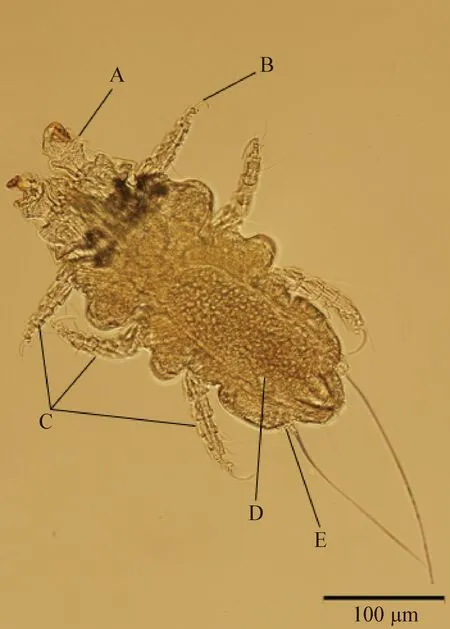
圖4 雌性鼷鼠肉螨(背面)
2.1.3 鼷鼠肉螨蟲卵形態學 鼷鼠肉螨的蟲卵形態如圖5所示:蟲卵呈寬橢圓形,大小約為0.196 mm×0.09 mm(n=5),緊密附著在小鼠的絨毛基部或中部。蟲卵黏著處有一層膠性物質,除去膠性物質后,光鏡下的蟲卵卵殼表面光滑,無特殊構造。
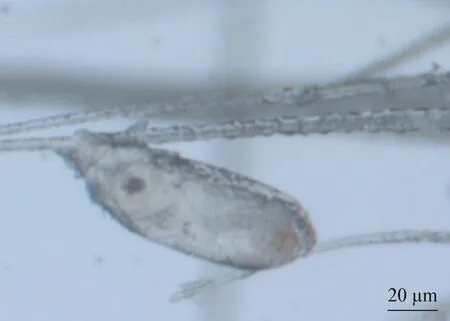
圖5 鼷鼠肉螨卵
2.2 鼷鼠肉螨的分子鑒定 對鏡檢螨陽性樣本所提取的DNA進行PCR檢測,結果如圖6所示,樣本均可檢出鼷鼠肉螨靶標基因特異性目的片段,大小約1 807 bp,與預期片段大小相符。將PCR產物進行測序得到基因序列。將獲得的鼷鼠肉螨基因序列提交至NCBI數據庫進行比對分析,結果顯示得到的DNA序列與國際上公布的鼷鼠肉螨18S rRNA序列(GenBank登錄號為JF934703.1)同源性達98.68%。本試驗中檢測出的鼷鼠肉螨18S rRNA基因與NCBI數據庫中已發表的部分蟲株18S rRNA序列構建的分子進化樹見圖7。PCR擴增和測序結果從分子水平證明了鼷鼠肉螨的感染。
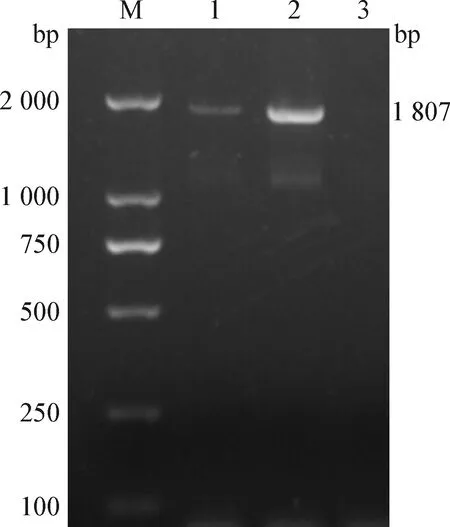
圖6 鼷鼠肉螨核酸瓊脂糖凝膠電泳
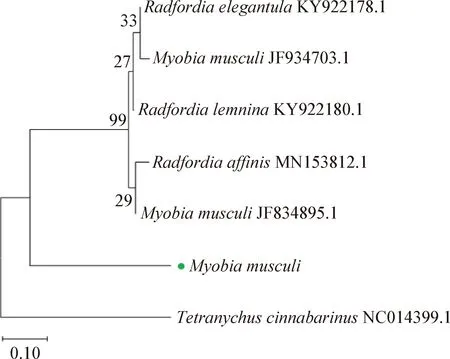
圖7 Myobia musculi 18S rRNA基因組序列遺傳進化分析
3 討論
實驗小鼠被廣泛應用于醫藥開發、教學實驗、藥品生產、生物檢定等方面,隨著國內科研水平的提高,國內外實驗動物機構間動物的交換日益頻繁,轉基因動物的使用數量日益增加,實驗小鼠寄生蟲感染問題日益凸顯。
鼷鼠肉螨是小鼠感染最常見的螨蟲之一,常寄生在小鼠的頭部、頸部和背部,通過直接接觸和間接接觸在種群中進行傳播。小鼠感染鼷鼠肉螨后會出現一系列臨床癥狀和生理學反應,這對科學實驗的準確性會造成不良影響。對鼷鼠肉螨易感程度最高的為野生鼷鼠,這一品種的小鼠即使是感染少數的鼷鼠肉螨,也會引起脫毛、皮膚紅斑、瘙癢、表皮剝脫、潰瘍、膿皮病等反應[9]。在本試驗觀察過程中,C57BL/6J小鼠未發生明顯的臨床癥狀,因為該品系小鼠是野生鼷鼠的變種,在馴化過程中可能會降低其對鼷鼠肉螨的易感性。但是如果長期不對患病小鼠進行治療處理,可能仍會導致小鼠出現嚴重的臨床癥狀。
有研究對鼷鼠肉螨成蟲大小進行了測量,雌螨體長400~500μm,雄螨體長280~320μm,體寬均在160~180μm[10]。本試驗對發現的螨蟲進行了體長和體寬的測量,雌螨大小為(0.404~0.529)mm×(0.211~0.233)mm(n=5),大小與文獻所報道的范圍基本一致;雄蟲大小為(0.325~0.479)mm×(0.186~0.217)mm(n=5),大小略大于文獻報道的大小范圍。由于鼷鼠肉螨的體型很小,正常情況下肉眼難以發現,當發現小鼠感染鼷鼠肉螨時,往往已經感染十分嚴重,所以需要尋找一種有效、快速的檢測方法,以便在感染初期就能檢測到鼷鼠肉螨,有利于早期對鼷鼠肉螨進行有效防控。
有多種方法可采集鼷鼠肉螨并進行檢測,如透明膠紙法、被毛采集法、皮膚刮擦法等。透明膠紙法操作最為簡便,所以在檢測初期,本試驗采用該方法對小鼠感染情況進行了檢測,但是在使用該方法過程中,陽性小鼠檢測結果出現了假陰性的情況,所以本試驗結合了多個部位采集毛發的方法對小鼠進行檢測,結合被毛采集法后,能有效提高檢出率。有研究報道,皮膚刮擦法是最有效的檢測方法,但該方法需要對小鼠進行麻醉或安樂死后方可進行,容易對實驗小鼠造成損傷,而且這種方法工作量大,檢出效率低,不利于快速對實驗動物的整體感染情況進行檢查[11]。PCR檢測方法能夠通過使用拭子對整個動物、籠舍、架子等進行全面采樣,從而減少工作量,提高檢出率[12],未來可作為鼷鼠肉螨的檢測方法之一。建立PCR檢測方法首先需要找到合適的檢測基因,本試驗選擇了鼷鼠肉螨18S rRNA基因對鏡檢陽性樣本進行了分子生物學鑒定,該PCR方法能有效擴增出鼷鼠肉螨的目的片段,與Lee等得出的結果一致,證明PCR檢測方法可用于鼷鼠肉螨的檢測[13]。

