不凍液凍結對鳙魚頭凍藏品質的影響研究
駱文燕徐夢意徐 霞張振宇周緒霞何光喜姚洪正劉書來
(1.浙江工業大學 食品科學與工程學院,浙江 杭州 310014;2.浙江省深藍漁業資源高效開發利用重點實驗室,浙江 杭州 310014;3.國家遠洋水產品加工技術研發分中心(杭州),浙江 杭州 310014;4.杭州千島湖發展集團有限公司,浙江 杭州 310014)
不凍液凍結又稱浸漬凍結,是利用載冷劑與食品直接或間接接觸,實現食品快速降溫的一種高效的冷凍方式[1]。目前,不凍液凍結中所用的載冷劑主要包括鹽類(氯化鈉、氯化鈣)、醇類(乙醇、乙二醇、丙二醇、丙三醇等)和糖類(蔗糖、玉米糖漿、葡萄糖、果糖等)。根據載冷劑的種類,可分為二元、三元和四元載冷劑,已被廣泛應用于水果、蔬菜、肉類和水產品的凍結保鮮。與其他冷凍方式相比,不凍液凍結具有較多優點:第一,不凍液凍結的凍結速率快,常溫下大部分液體的導熱系數為0.116~0.628 W/(m·K)[2]。Yamada[3]將豬肉進行不凍液凍結和鼓風凍結,發現從室溫到完全凍結,用鼓風式凍結所需時間為24 h,浸漬于-30~-50 ℃乙醇溶液中需要的時間僅為1.5~2 h。第二,不凍液凍結能耗低,可降低生產成本。Shaikh等[4]認為直接不凍液凍結的成本是機械制冷成本的1/4。不凍液凍結方式應用的載冷劑導熱系數大,-21.5 ℃的乙醇、氯化鈉與水構成的載冷劑中,其傳熱效率為700 W/m2K,不需要借助傳統空氣凍結中的冷空氣降溫,成本更低。第三,凍結產品品質較高。與將凍結原料置于低溫金屬凍結板之間進行熱交換的間接接觸式平板凍結技術[5]相比,不凍液快速凍結具有更高的傳熱系數,凍結產品冰晶較小,對細胞組織損傷較小。鄧敏等[6]將傳統空氣鼓風凍結與不凍液凍結進行比較,研究草魚塊凍藏過程中品質的變化,結果表明:直接浸漬凍結的凍結速率較快,凍藏過程中蛋白變性、汁液流失率均低于鼓風凍結。
千島湖盛產的千島湖魚頭體積較大,味道鮮美,多不飽和脂肪酸EPA、DHA及必需氨基酸含量高,雖然能滿足消費者的營養及保健需求,但是,宰殺后的新鮮魚頭會在微生物和酶的作用下發生復雜的生化反應而導致品質快速下降。低溫保鮮技術能有效抑制微生物的生長,降低各種生化反應的速率,被廣泛用于食品的長期保藏。筆者以千島湖鳙魚頭為研究對象,采用不凍液凍結和平板凍結兩種方式將鳙魚頭凍結至中心溫度為-18 ℃,研究了凍藏期間鳙魚頭品質變化,包括Ca2+-ATPase活性、總巰基、TBA、TVB-N以及揮發性風味物質、核苷酸類化合物等風味物質的變化,以期為千島湖鳙魚頭保鮮和不凍液凍結技術的應用提供理論支撐和技術指導。
1 材料與方法
1.1 材料與試劑
材料:千島湖鳙魚頭,由千島湖千發任天農業科技有限公司提供,平均魚頭質量(2.0±0.2) kg。流動水洗去表面沾污物,用機器對半均等切開,用聚乙烯保鮮袋包裹后置于室溫備用。
實驗試劑:磷酸二氫鈉、5-磺基水楊酸、腺苷三磷酸二鈉(ATP-Na2)等為分析純,上海麥克林生化科技有限公司;5’-鳥苷酸(GMP)、5’-肌苷酸(IMP)、腺苷三磷酸(ATP)、腺苷二磷酸(ADP)、腺苷一磷酸(AMP)、次黃嘌呤(Hx)、次黃嘌呤核苷(HxR)標準品,Sigma公司;甲醇(GR),Merck公司。
實驗室自制不凍液成分:主要由95%乙醇、乙二醇、NaCl和水等組分按照適當比例配制而成,不凍液凍結點約-48.2 ℃,各組分均為食品級。
1.2 儀器與設備
K9840自動式凱氏定氮儀,濟南市海能儀器股份公司;E2695型高效液相色譜儀,美國Waters公司;Biochrom 30+氨基酸自動分析儀,美國Aglient公司;7890A-5975C GC-MS聯用儀,美國Aglient公司。
1.3 實驗方法
1.3.1 千島湖鳙魚頭樣品制備
取一批大小質量相似且已對半切開的新鮮千島湖鳙魚頭,將溫度計探頭固定至幾何中心位置,套入保鮮袋中,分別通過不凍液和平板凍結方式進行凍結,凍結溫度均為-40 ℃,凍至中心溫度為-18 ℃后進行真空包裝,然后置于-18 ℃中環境中凍藏9個月。期間定期取樣,于4 ℃冰柜中解凍16 h后分析各指標。
1.3.2 Ca2+-ATPase活性測定
Ca2+-ATPase活性測定采用2~5 mg/mL肌原纖維蛋白。將2.5 mL 20 mmol/L Tris-HCl、1 mL 0.05 mol/L CaCl2、1 mL 4 mol/L氯化鉀、1.5 mL 6.67 mmol/L ATP-Na2和4 mL肌原纖維蛋白酶液加入試管中,保持在28 ℃水浴30 min,加入肌原纖維蛋白酶液開始反應,反應體積為10 mL,最后,加入1 mL質量分數為15%的三氯乙酸,結束反應。反應終止后并用濾紙過濾,濾液體積恒定為100 mL。采用鉬酸銨法[7]在640 nm下測量吸光值。
肌原纖維Ca2+-ATPase活性以每分鐘每毫克肌原纖維蛋白所釋放的無機磷的量表示,酶活性計算式為
Ca2+-ATPase=x/(t×c)
(1)
式中:x為1 mL反應液生成的磷酸量,mmol;t為反應所需要時間,min;c為酶蛋白質量,mg。
1.3.3 總巰基質量分數測定
總巰基質量分數測定采用Kobayashi[8]方法,并稍作修改。具體操作如下:取0.5 mL 4 mg/mL肌原纖維蛋白溶液,加入4.5 mL 0.2 mol/L Tris緩沖溶液中(pH 6.8)。取4.0 mL混合液,加入0.5 mL 0.2 mol/L Tris緩沖溶液(pH 8),于40 ℃下溫育25 min,在412 nm下測量其吸光值。
1.3.4 TBA質量分數測定
稱取剪碎魚肉5 g,加入50 mL三氯乙酸混合液,50 ℃恒溫振蕩30 min,取出冷卻至室溫過濾。取上述濾液和標準系列溶液各5 mL,另取5 mL三氯乙酸混合液作為樣片空白,分別加入5 mL硫代巴比妥酸水溶液置于90 ℃水浴反應30 min,再冷卻至室溫,然后在532 nm波長處測定吸光值。測定方法參照標準GB 5009.181—2016《食品安全國家標準 食品中丙二醛的測定》。
1.3.5 TVB-N質量分數測定
稱取10 g解凍后魚肉加90 mL 0.6 mol/L高氯酸勻漿,4 ℃下抽提30 min后過濾。取濾液,測定方法參照標準GB 5009.228—2016《食品安全國家標準 食品中揮發性鹽基氮的測定》。
1.3.6 核苷酸類化合物測定
核苷酸類化合物測定采用Veciana-Nogues等[9]的方法,并稍作修改。具體操作如下:將凍結3個月的魚頭解凍后,準確稱取5 g魚肉樣品于250 mL燒杯中,加入50 mL 1.2 mol/L 4 ℃萃取預冷的HClO4溶液勻漿2 min,4 ℃下靜置30 min,在3 000g(4 ℃)下離心20 min,收集上清液。殘渣加入30 mL 0.6 mol/L HClO4溶液,按上述方法離心,合并2次上清液,用10 mol/L KOH溶液中和至pH 6.5后過濾,濾液用蒸餾水定容至100 mL。經孔徑為0.45 mm的水系濾膜過后進液相色譜分析。
液相色譜條件如下,色譜柱:Xbridge C18色譜柱(4.6 mm×250 mm,5 mm);流動相:0.1 mol/L磷酸鹽緩沖液pH 7,流速0.75 mL/min,檢測波長254 nm,柱溫30 ℃,進樣量10 mL。
K值計算式為
K=[(HxR+Hx)/(ATP+ADP+AMP+
IMP+HxR+Hx)]×100%
(2)
1.3.7 揮發性風味物質測定
采用固相微萃取-氣相色譜-質譜聯用分析(SPME-GC-MS)測定鳙魚頭的揮發性風味物質。SPME條件:取魚頭解凍后,攪碎后取碎魚肉6 g于15 mL頂空樣品瓶中。將65 mm DVB -PDMS萃取頭插入樣品瓶頂空部位,60 ℃平衡20 min,頂空萃取30 min后取出萃取頭,迅速用氣質聯用儀進行分析鑒定。
GC-MS分析條件如下:色譜柱,DB-5MS彈性毛細管柱(60 m×0.32 mm×1 mm);起始溫度40 ℃,以5 ℃/min的速度升至100 ℃;以2 ℃/min的速度升至180 ℃;以5 ℃/min的速度升至240 ℃,保留5 min;氦氣流量為1.2 mL/min,進樣口的溫度為250 ℃。電子轟擊離子源:傳輸線的溫度為240 ℃,電子能為70 eV,離子源溫度為220 ℃,質量掃描范圍為35~450 Da。
1.4 數據處理
數據結果采用軟件SPSS 12.0和Origin 8.6進行分析。結果以平均值±標準差形式表示。不相同樣品間的比較方法采用最小顯著差異法,取95%置信度(P<0.05)。
2 結果與分析
2.1 凍藏期間鳙魚頭Ca2+-ATPase活性變化
Ca2+-ATPase活性與肌球蛋白的球狀頭部區域密切相關。凍藏期間鳙魚頭Ca2+-ATPase活性變化如圖1所示。由圖1可知:凍藏期間鳙魚頭Ca2+-ATPase活性呈不同程度的降低趨勢;兩種凍結方式在前180 d均有顯著性差異(P<0.05),隨后兩組的Ca2+-ATPase活性趨于平緩。在凍藏270 d時,不凍液凍結和平板凍結的千島湖魚頭Ca2+-ATPase活性分別為0.145,0.116 μmol/(mg·min),無顯著性差異(P>0.05)。這與高琪等[10]研究鳙魚頭在貯藏期間Ca2+-ATPase活性變化趨勢一致。Ca2+-ATPase活性越低,蛋白變性就越嚴重[11],在整個凍藏期間,不凍液凍結組的千島湖魚頭Ca2+-ATPase活性始終高于平板凍結組,說明不凍液凍結的鳙魚頭的新鮮度品質保持較好。
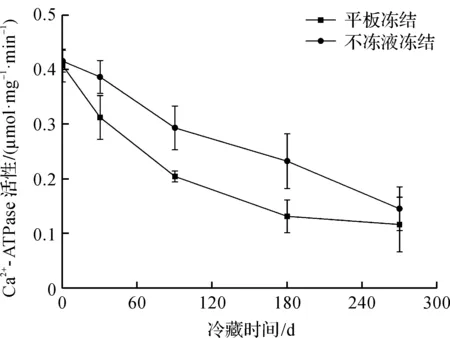
圖1 凍藏期間鳙魚頭Ca2+-ATPase活性變化Fig.1 Changes of Ca2+-ATPase activity in bighead carp head during frozen storage
2.2 凍藏期間鳙魚頭總巰基質量分數變化
總巰基質量分數可以表征蛋白質的變性和聚合程度[12-13]。錢攀等[14]在研究不同凍結溫度對鳙魚品質的影響時發現:凍結速率越快,凍藏期間魚肉中總巰基質量分數下降越緩慢,蛋白變性也越小。凍藏期間鳙魚頭總巰基質量分數變化如圖2所示。由圖2可知:隨著凍藏時間的延長,不同凍結方式下魚肉蛋白總巰基質量分數均呈下降趨勢,兩者之間有顯著性差異(P<0.05),不凍液凍結魚頭的總巰基質量分數始終高于平板凍結。凍藏270 d后,不凍液凍結和平板凍結的魚頭總巰基質量分數分別下降了42.6%和73.7%,并且不凍液凍結魚頭總巰基質量分數始終高于平板凍結,說明不凍液凍結方式速率較快,其能抑制巰基的氧化過程、二硫鍵的互換作用以及蛋白質的交聯作用,使蛋白質變性程度越低。
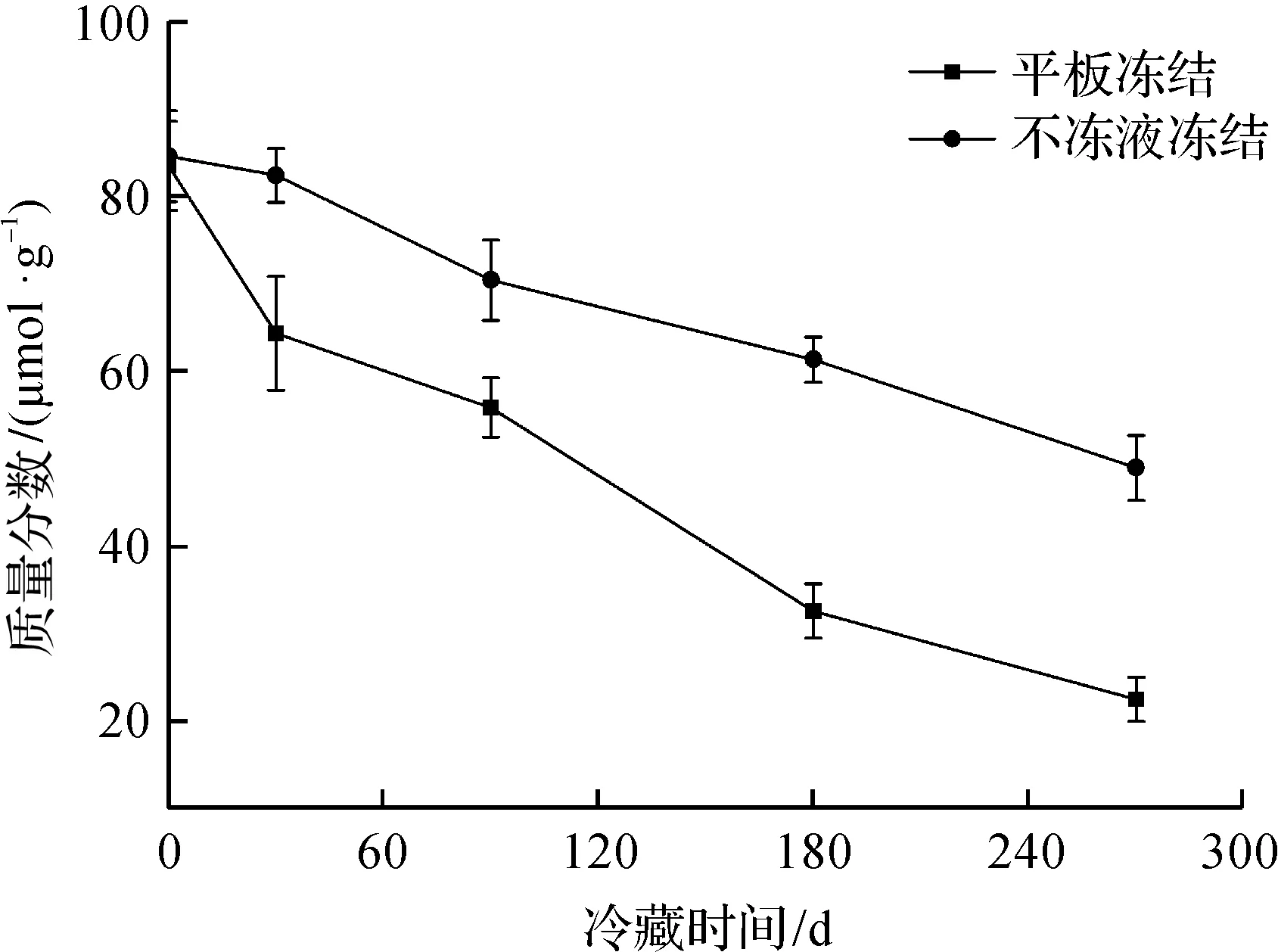
圖2 凍藏期間鳙魚頭總巰基質量分數變化Fig.2 Changes of total sulfhydryl content in bighead carp head during frozen storage
2.3 凍藏期間鳙魚頭TBA質量分數變化
TBA質量分數能反映凍藏過程中千島湖魚頭脂肪氧化程度。Hong等[15]研究了不同冷凍方式對鳙魚品質的影響,表明凍結速率越快,其凍藏期間TBA質量分數上升越緩慢。凍藏期間鳙魚頭TBA質量分數變化如圖3所示。由圖3可知:凍藏期間不凍液凍結和平板凍結的魚頭TBA質量分數均呈上升趨勢,且不凍液凍結魚頭TBA質量分數始終低于平板凍結。凍藏的前90 d,兩組凍結魚頭的TBA質量分數差異不明顯(P>0.05),但凍藏至270 d時,平板凍結和不凍液凍結魚頭的TBA質量分數由初始的MDA 0.312 mg/kg分別增加至0.645,0.529 mg/kg,即為新鮮魚頭的2.06倍和1.69倍。這可能是由于不同凍結速率形成的冰晶粒徑對魚肉組織細胞產生的機械損傷程度不一所致,魚體肌肉蛋白質變性對肌間脂肪的游離與凍藏期間的干耗在一定程度上會影響氧的接觸和氧化。由此可知:不凍液凍結形成的冰晶較小,對細胞損傷小,原有的產品品質保持也越好。
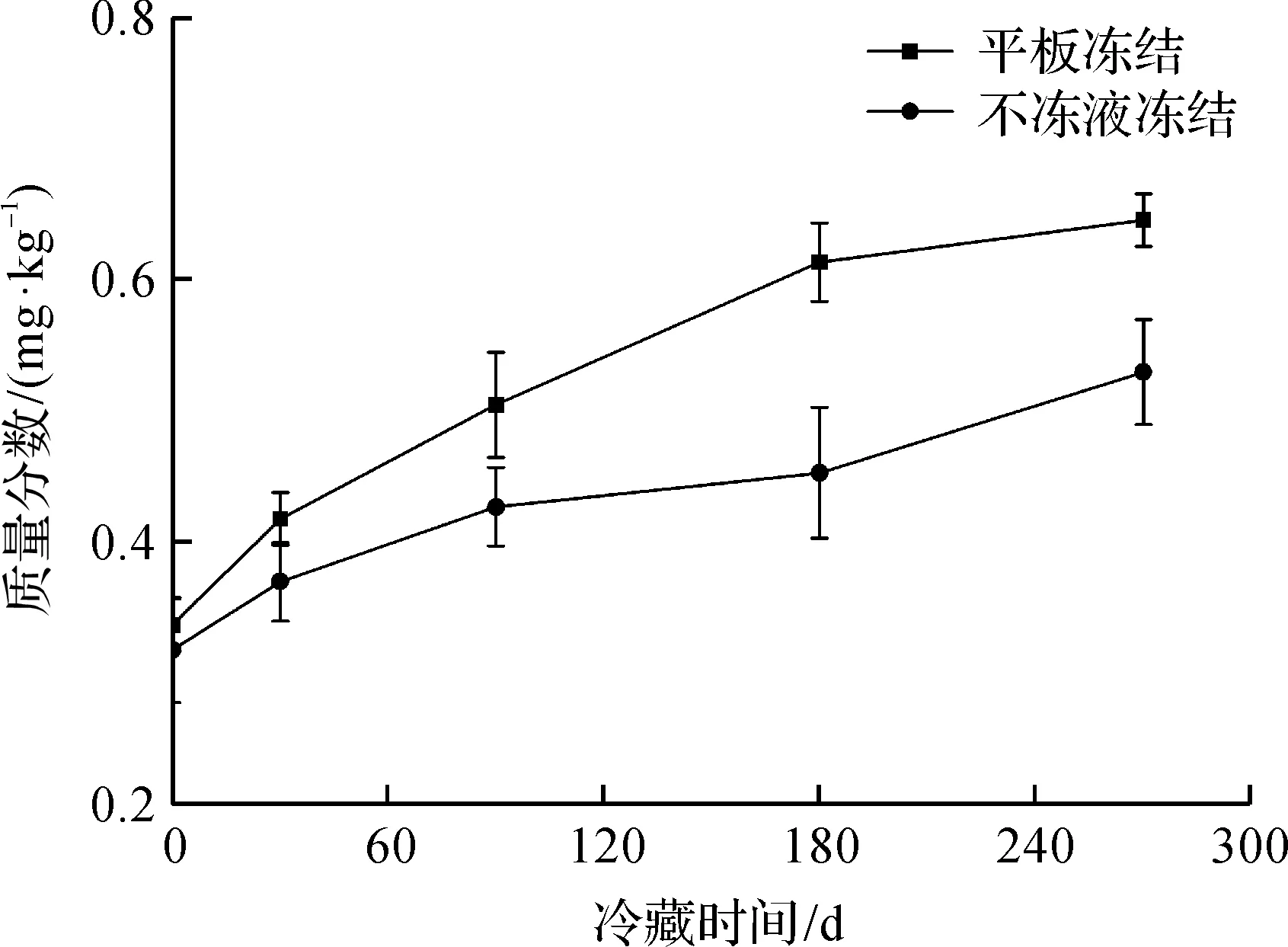
圖3 凍藏期間鳙魚頭TBA質量分數變化Fig.3 Changes of TBA values in bighead carp head during frozen storage
2.4 凍藏期間鳙魚頭TVB-N質量分數變化
TVB-N是指動物性食品在其肌肉中內源酶或細菌作用下,蛋白質分解產生的氨、胺類等堿性含氮揮發性物質,是評價水產品鮮度的重要指標。凍藏期間鳙魚頭TVB-N質量分數變化如圖4所示。由圖4可知:平板凍結和不凍液凍結的魚頭貯藏期間的TVB-N質量分數均呈上升趨勢,并且平板凍結魚頭的上升的速率明顯高于不凍液凍結的上升的速率。凍藏初期,平板凍結和不凍液凍結魚頭的TVB-N質量分數分別為49.2 μg/g和42.8 μg/g;凍藏時間至270 d時,平板凍結下魚肉TVB-N質量分數為211.4 μg/g,已超過淡水魚的食品衛生標準GB 2733—2015《食品安全國家標準 鮮、凍動物性水產品》限量規定(200 μg/g)。而不凍液凍結的千島湖魚頭TVB-N質量分數152.9 μg/g,依舊比淡水魚的標準水平低。究其原因,一是不凍液凍結方式的凍結的速度快,降低了魚肉中蛋白質的分解速度;二是不凍液凍結魚肉細胞生成的冰晶較小,組織細胞被破壞的程度較小,其原有品質保持也越好。
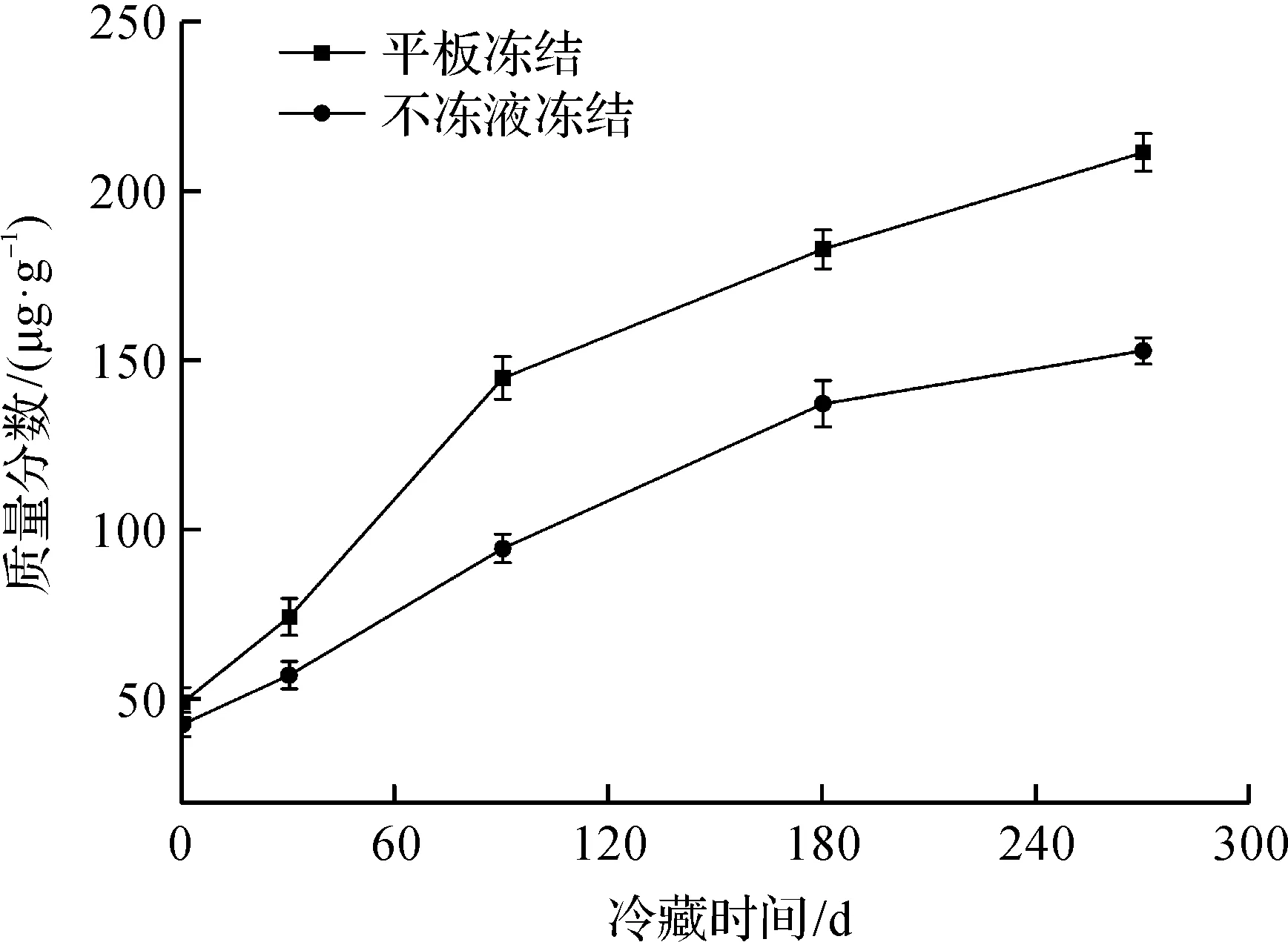
圖4 凍藏期間鳙魚頭TVB-N質量分數變化Fig.4 Changes of TVB-N values in bighead carp head during frozen storage
2.5 鳙魚頭中核苷酸類物質質量濃度及K值變化
魚類死后,肌肉中ATP降解途徑中依次生成ADP,AMP,HxR,Hx[15]。呈味核苷酸GMP和IMP閾值分別為125,250 μg/mL,是鳙魚頭中主要的滋味物質,不同凍結方式對千島湖魚頭核苷酸含量的影響如表1所示。由表1可知:在凍藏期間GMP和IMP含量下降,平板凍結下降速度高于不凍液凍結,鮮味較差。新鮮魚頭中ATP質量濃度為1 108.4 μg/mL,凍藏期間其含量迅速下降,說明ATP在魚肉死亡后積累周期極短,這可能是因為凍結和凍藏過程中形成了大量冰晶體,破壞了細胞表面結構,使酶和無機鹽濃度上升,從而使ATP降解反應速度加快[16]。新鮮魚肉中Hx 104.9 μg/mL,凍藏過程中其含量顯著上升;平板凍結和不凍液凍結的魚頭凍藏3個月后Hx質量濃度分別增加至802.6,504.5 μg/mL。K值反映了魚類死亡后從肌肉僵直階段至自溶階段的鮮度變化[17],是評定魚類鮮度的重要指標,K值越大表明水產品越不新鮮,品質降低[18]。筆者研究中新鮮樣魚頭的K值為6.09%,平板凍結和不凍液凍結3個月后魚頭的K值分別為43.82%和22.7%,平板凍結的魚頭新鮮度較差,這和TVB-N等其他指標變化規律一致。
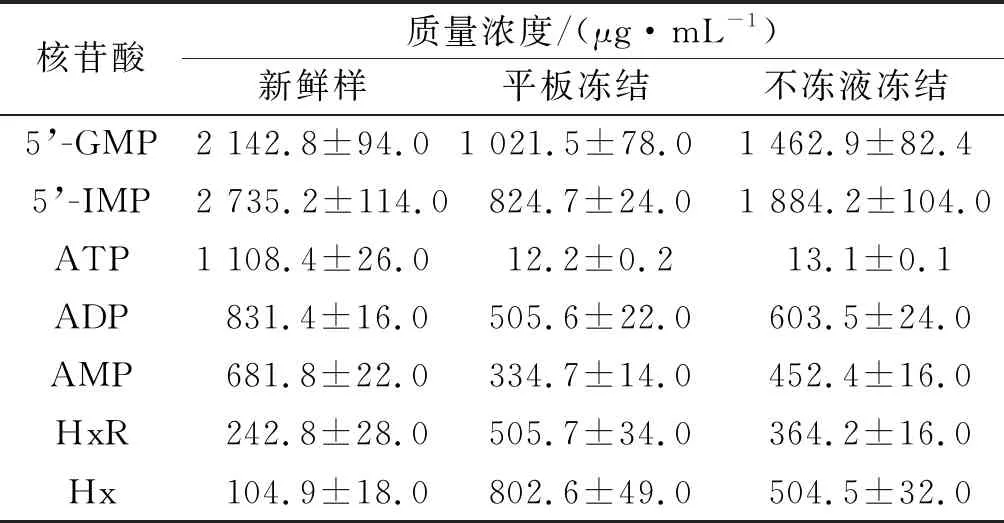
表1 不同凍結方式對千島湖魚頭核苷酸質量濃度的影響
2.6 鳙魚頭的揮發性風味物質分析
鳙魚頭中揮發性風味物質,經SPME-GC-MS檢測分析結果如表2所示。與新鮮魚頭相比,凍藏3個月后兩種凍結方式處理的魚頭中揮發性風味物質種類和質量濃度均有不同程度的下降。平板凍結鳙魚頭的醛類中呈腥味物質的質量分數明顯上升,酮類和烷烴類物質下降明顯,產生不愉快的氣味,品質較差。鳙魚頭中揮發性風味物質的質量分數如圖5所示。
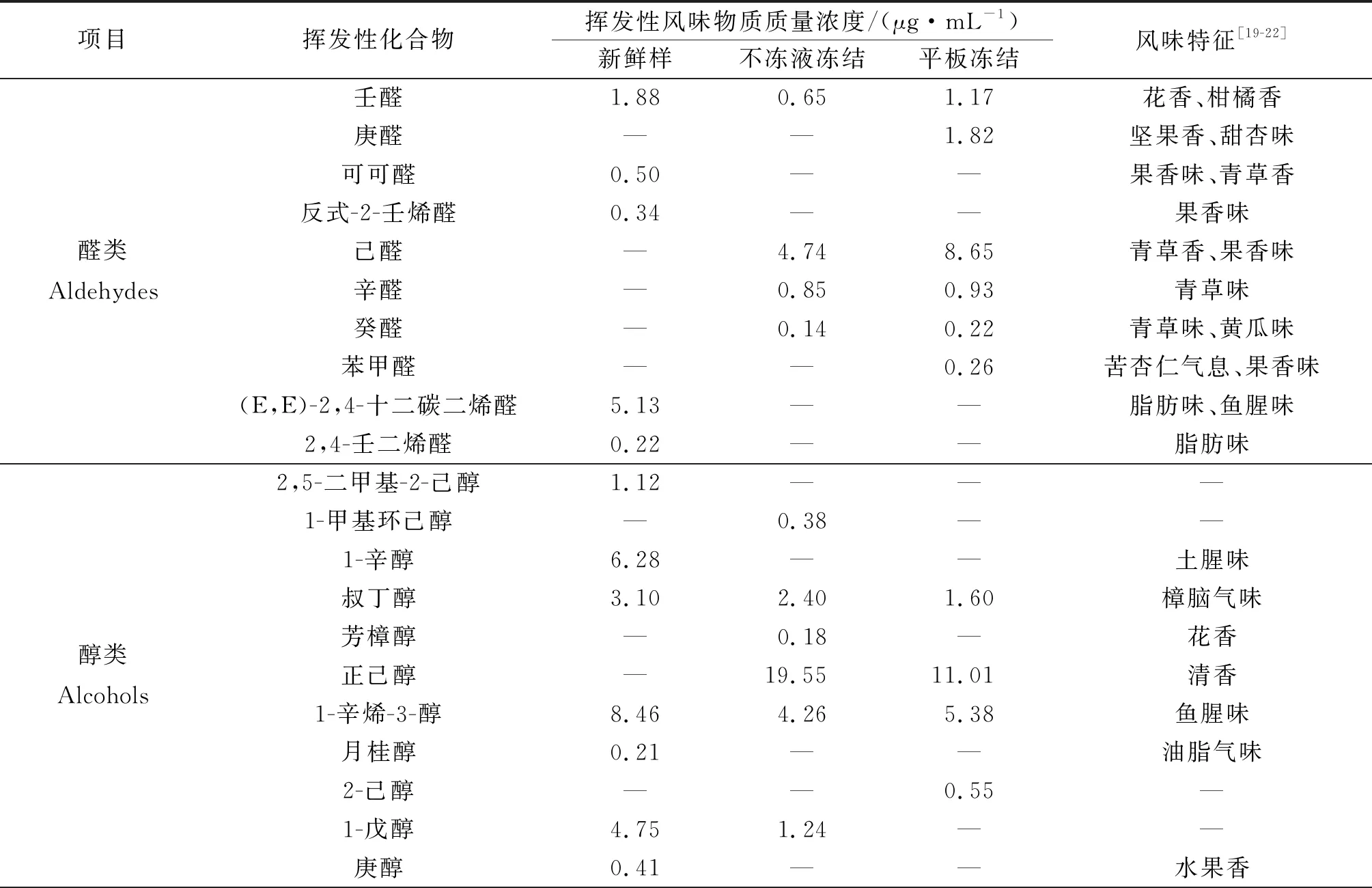
表2 鳙魚頭中揮發性風味物質組成及其相對質量濃度Table 2 The composition and relative content of volatile flavor components in bighead carp head
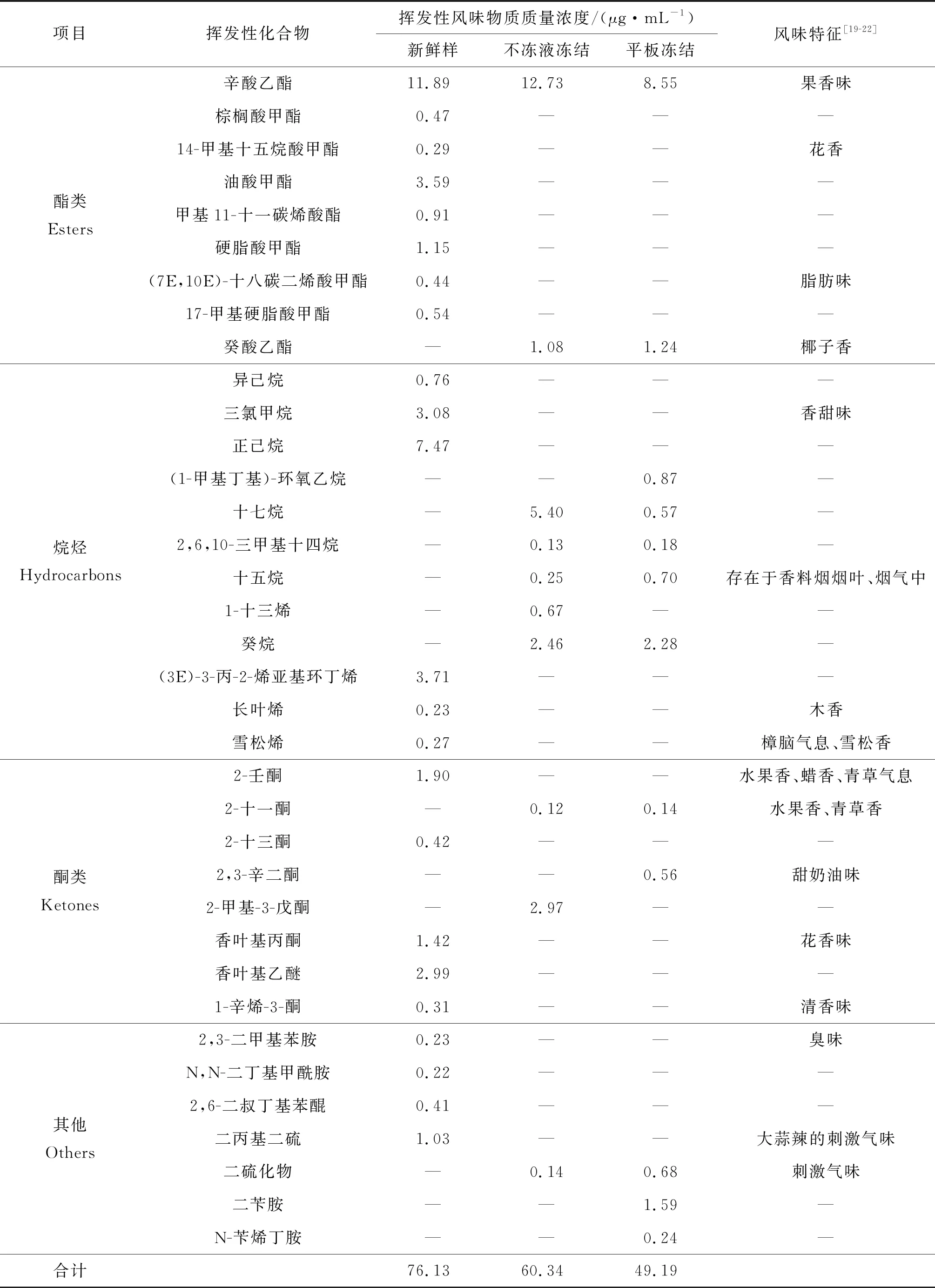
表2 (續)
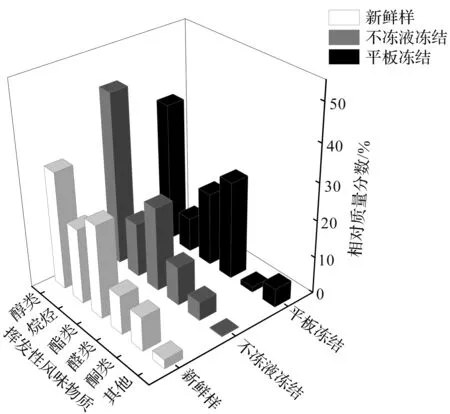
圖5 千島湖魚頭中揮發性風味物質質量分數Fig.5 Percentage of volatile flavor substances in bighead
醛類物質一般被認為是脂類的熱降解產物,閾值較低,因此較低質量分數即對魚肉風味有很大貢獻。新鮮樣魚頭中檢測到的可可醛和2,4-壬二烯醛具有果香味,閾值低,而壬醛質量分數為1.1 μg/kg,是魚肉產生不愉快土腥味來源之一。凍藏3個月后,產生刺激性氣味的醛類物質增加,略高于己醛質量分數(4.5 μg/kg),具有魚腥味、青草味等風味,可能由n-6不飽和脂肪酸的氧化產生,這是貯藏期間魚肉形成腥味的主要前體物質[23]。
醇類物質由脂質氧化分解生成。1-辛烯-3-醇質量分數為1.5 mg/kg,常存在于淡水魚和海水魚的揮發性風味物質中。施文正[24]研究發現草魚背部肉中1-辛烯-3-醇質量分數達到20%以上。1-辛醇被認為與新鮮淡水魚植物青草味有關,庚醇具有酒香味。
酯類是酸和醇酯化且縮合而成,是賦予肉制品特征香味的重要物質[25]。在新鮮鳙魚頭中共檢測出8種酯類物質,凍藏期間酯類揮發性物質種類和含量的大量減少可能是造成鳙魚頭風味品質下降的重要原因。
烷烴類是由脂肪酸的烷氧自由基均裂而得的[26],閾值較高,一般認為對風味形成的貢獻不大。正己烷具有清新味,在新鮮魚肉中檢測最多。烯烴、炔烴類還可進一步氧化,生成酮、醛類化合物,是風味物的潛在前體。
酮類通常由多不飽和脂肪酸的熱氧化或氨基酸的降解而成,對腥味有一定增強作用[27],但其閾值高,一般認為它們對氣味特征貢獻較小。新鮮魚頭中共檢測出5種酮類物質,其中具有清香味的香葉基乙醚較多,凍結3個月后魚頭中酮類物質減少至2種。
3 結 論
筆者以千島湖鳙魚頭為研究對象,分別采用不凍液凍結和平板凍結技術將鳙魚頭凍結至中心溫度為-18 ℃,研究了鳙魚頭凍藏期間Ca2+-ATPase活性、總巰基質量分數、TBA質量分數、TVB-N質量分數、核苷酸類化合物和揮發性風味物質等指標的變化規律。實驗結果表明:凍藏期間鳙魚頭Ca2+-ATPase活性和總巰基質量分數均呈逐漸降低趨勢,TBA質量分數和TVB-N質量分數則逐漸上升,不凍液凍結后的千島湖鳙魚頭凍藏期間各項指標均優于平板凍結。由千島湖鳙魚頭中呈味核苷酸類化合物的HPLC測定結果可知:GMP和IMP是魚頭中最主要的呈味核苷酸,平板凍結的鳙魚頭凍藏3個月后K值高于不凍液凍結。凍藏期間鳙魚頭酯類和烷烴類物質顯著下降,其中平板凍結鳙魚頭凍藏3個月后刺激性的醛類等物質增加,說明風味較差,品質下降較快。研究不凍液凍結技術對魚肉蛋白結構、鮮度和風味的影響,有助于從理論和生產實踐兩個方面來推進不凍液凍結技術的推廣與應用。

