赤水曬醋醋酸發酵過程原核微生物群落及理化因子相關性分析
魯梅,宋從從,石桂珍,楊青,李德青,竇祎凝
(濰坊工程職業學院 應用化學與食品藥品學院,山東 青州,262500)
中國傳統食醋是指以谷物為主要原料,經過多種微生物共同發酵,再經長時間陳釀而成的一種酸性液體調味料,在中國已經有3 000多年的歷史[1]。按照食醋的醋酸發酵工藝,可將食醋分為固態發酵食醋和液態發酵食醋。山西老陳醋、鎮江香醋、四川麩醋、赤水曬醋和天津獨流醋等中國傳統谷物醋都是典型的固態發酵食醋[2];固態發酵食醋的開放式發酵、多菌種協同、長時間陳釀、多代謝產物共存的特點賦予了食醋豐富的營養物質和風味物質,使食醋具有開胃、抗菌殺菌、抗氧化和減肥等功效[3]。
赤水曬醋是貴州省赤水市生產的一種極具地方特色的優質食醋產品,其工序繁多、選料考究、品質精良,在中國西南地區享有盛譽。傳統的赤水曬醋用中草藥制曲、經蒸煮、酒精發酵和醋酸發酵、曬醅、淋醋、陳釀、滅菌等幾十道工序精制而成[4]。目前有眾多的研究者對“中國四大名醋”的發酵機理、營養成分、風味形成和功能作用等各個方面進行了研究,但對赤水曬醋的研究較少。目前僅有盧葉等[5]研究了赤水曬醋的有機酸組成,發現除乙酸外,不揮發酸中琥珀酸和乳酸的含量最高;石慶疊等[6]從赤水曬醋中篩選了3株醋酸菌,并研究了其發酵特性,發現C6菌株能耐9%(體積分數)的乙醇、8 g/L的氯化鈉和40 g/L的乙酸;唐杰等[7]研究了赤水曬醋的香氣成分,從曬醋中共鑒定出39種主要香氣成分;吳震等[8]研究了赤水曬醋生產過程的理化指標和功能性指標的變化,揭示了發酵規律;何銀等[9]、楊新等[10-11]從赤水曬醋中篩選了腐敗微生物并研究了其發酵特性,主要包括地衣芽孢桿菌、解淀粉芽孢桿菌、索諾拉沙漠芽孢桿菌、酸居芽孢桿菌、耐熱芽孢桿菌、枯草芽孢桿菌等;李榮源等[12]研究了赤水曬醋各生產階段終點的微生物群落結構組成,其在曬醅階段檢測到194種真菌和400種細菌;但目前尚沒有針對赤水曬醋醋酸發酵過程原核微生物群落結構變化的相關研究。赤水曬醋醋酸發酵階段具有開放式和多菌協同的特點,因此研究赤水曬醋醋酸發酵過程原核微生物群落結構變化對解析赤水曬醋的發酵機理及通過微生物調控技術改善赤水曬醋的品質具有重要意義。
1 材料與方法
1.1 材料與試劑
醋醅樣品,貴州省赤水市某醋廠。
DNA抽提試劑盒,賽默飛世爾科技(中國)有限公司;瓊脂糖,上海阿拉丁生化科技股份有限公司;蛋白酶K,上海生物工程有限公司;Premix ET Taq聚合酶,寶生物工程(大連)有限公司。
1.2 儀器與設備
DW-25L262醫用低溫保存箱,青島海爾特種電器有限公司;5425R高速離心機,德國Eppendorf公司;NanoDrop 2000超微量分光光度計,美國Thermo Fisher Scientific公司;HiSeq測序儀,美國Illumina公司;ELx 800酶標儀,美國BioTek公司;QL-901旋渦混合器,海門其林貝爾儀器制造有限公司。
1.3 實驗方法
1.3.1 取樣方法
采用五點取樣法從貴州省赤水市某醋廠同一生產批次的3個不同的醋酸發酵池(A、B、C)中取樣,每隔3天取樣1次,每次取3個平行樣品,共采集18個樣品,將樣品置于-80 ℃冰箱中保存。
1.3.2 DNA提取
取50 g保存于冰箱中的醋醅樣品置于研缽中,添加液氮研磨5 min,然后使用DNA抽提試劑盒提取醋醅內含物微生物DNA,使用NanoDrop 2000超微量分光光度計檢測DNA濃度及質量。
1.3.3 PCR擴增及測序
通過擴增原核微生物16S rRNA V3~V4區研究醋醅的原核微生物群落結構,采用的上游引物為338F (5′-ACTCCTACGGGAGGCAGC-3′),下游引物為806R (5′-GGACTACNNGGGTATCTAAT-3′)。對指定測序范圍合成帶barcode的特異性引物進行PCR擴增及產物純化,構建PE文庫后進行Illumina HiSeq 2500平臺測序,由上海美吉生物醫藥科技有限公司完成。
1.3.4 理化指標的檢測
總酸、乙醇、還原糖和乳酸含量的檢測方法參考文獻[13]。
1.4 數據處理
利用QIIME 1.9對測序數據進行處理,使用Usearch去除嵌合體序列,并按照97%相似度對序列進行操作分類單元(operational taxonomic units,OTU)聚類劃分,選取最豐富序列(most abundant)為OTU代表序列。細菌采用GreenGenes數據庫(http://greengenes.secondgenome.com/)對OTU代表序列進行分類注釋。然后根據注釋結果,使用R 3.6、Graphpad Prism 7和Canoco 5等軟件進行后續分析繪圖。
2 結果與分析
2.1 α多樣性分析
赤水曬醋醋酸發酵過程中醋醅樣品原核微生物群落的測序情況見表1,18個醋醅樣品檢測到的有效序列數為41 713~47 029條,總序列數為794 635條。按97%的相似度對測序數據進行聚類劃分,18個樣品的OTU數為51~156個,共有213個OTU。且OTU數隨著醋酸發酵的不斷進行而逐漸下降。所有樣品文庫的覆蓋率均>99.9%,表明樣品中序列沒有被檢測出的概率極低。將測序數據置于GreenGenes數據庫中進行比對,得到各個樣品中的物種數,可見物種數與OTU數變化趨勢一致。
根據97%相似度水平下的OTU信息,采用表征α多樣性的ACE指數及Shannon指數對樣品微生物物種豐富度和多樣性進行評估[14],結果見表1。ACE指數用于評估樣本中OTU數目的多少,指數越大,表明OTU數越多;Shannon指數用于評估樣本中微生物的多樣性,Shannon指數越大,群落的多樣性越高。從表1可以看出,赤水曬醋醋酸發酵過程醋醅樣品的原核微生物群落OTU數和多樣性在第0~3天略微上升,在第3~15天逐漸下降。
基于97%相似度的OTU水平繪制的赤水曬醋醋酸發酵過程的原核微生物群落稀釋曲線如圖1所示,當檢測到的序列數>30 000以后,曲線趨于平緩,說明測序深度較好,測序數據量合理。
2.2 原核微生物群落組成分析
由圖2-a可知,赤水曬醋的醋酸發酵過程中醋醅的原核微生物群落在門水平上可分為變形菌門(Proteobacteria,41.7%)、厚壁菌門(Firmicutes,43.25%)、藍細菌門(Cyanobacteria,14.29%)、擬桿菌門(Bacteroidetes,0.48%)和放線菌門(Actiobacteria,0.28%)。由圖2-b可知,醋酸發酵第0天,變形菌門、厚壁菌門和藍細菌門的總相對豐度>98%,隨著醋酸發酵的進行,藍細菌門的相對豐度由42.11%下降至1.45%;而厚壁菌門的相對豐度由15.53%上升至62.43%;變形菌門的相對豐度由第0天的40.86%上升至第9天的48.83%,然后再下降至第15天的38.19%;擬桿菌門和放線菌門的相對豐度在第12天即下降至0.1%以下。
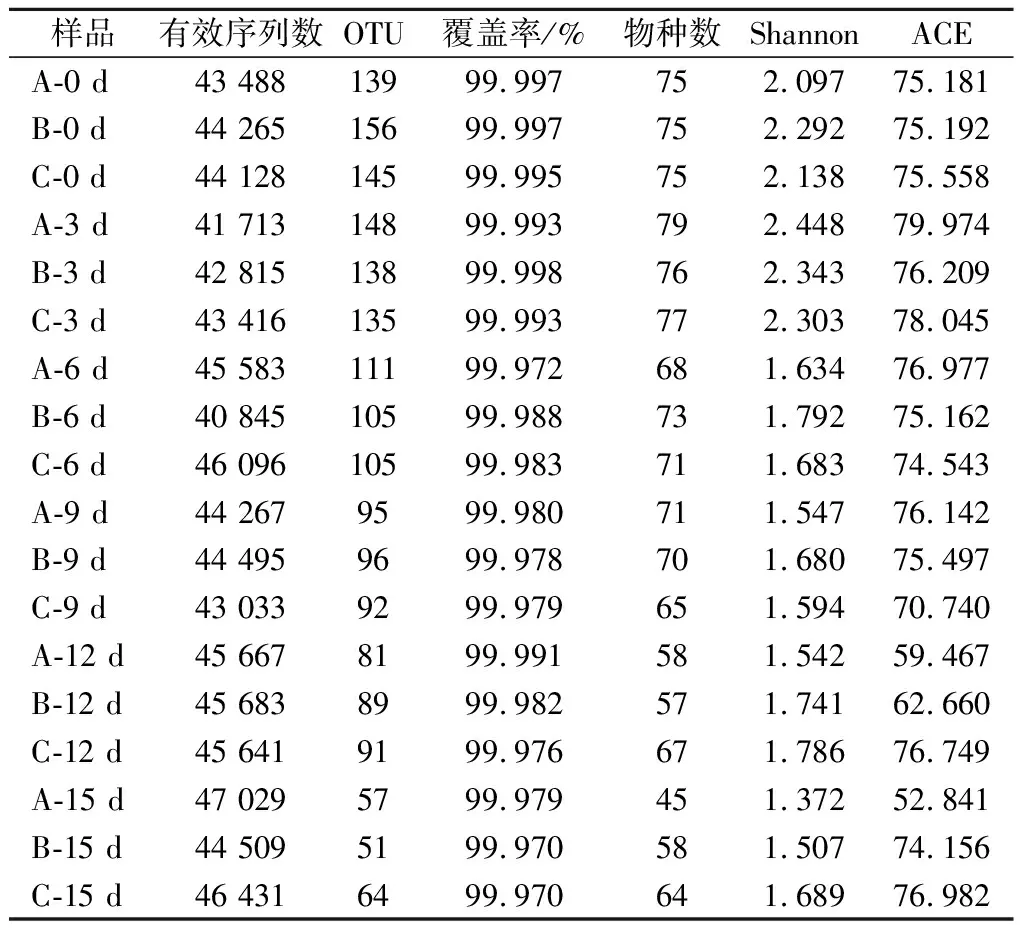
表1 醋醅中原核微生物群落α多樣性Table 1 Alpha diversity of prokaryotic microbial community in Cupei
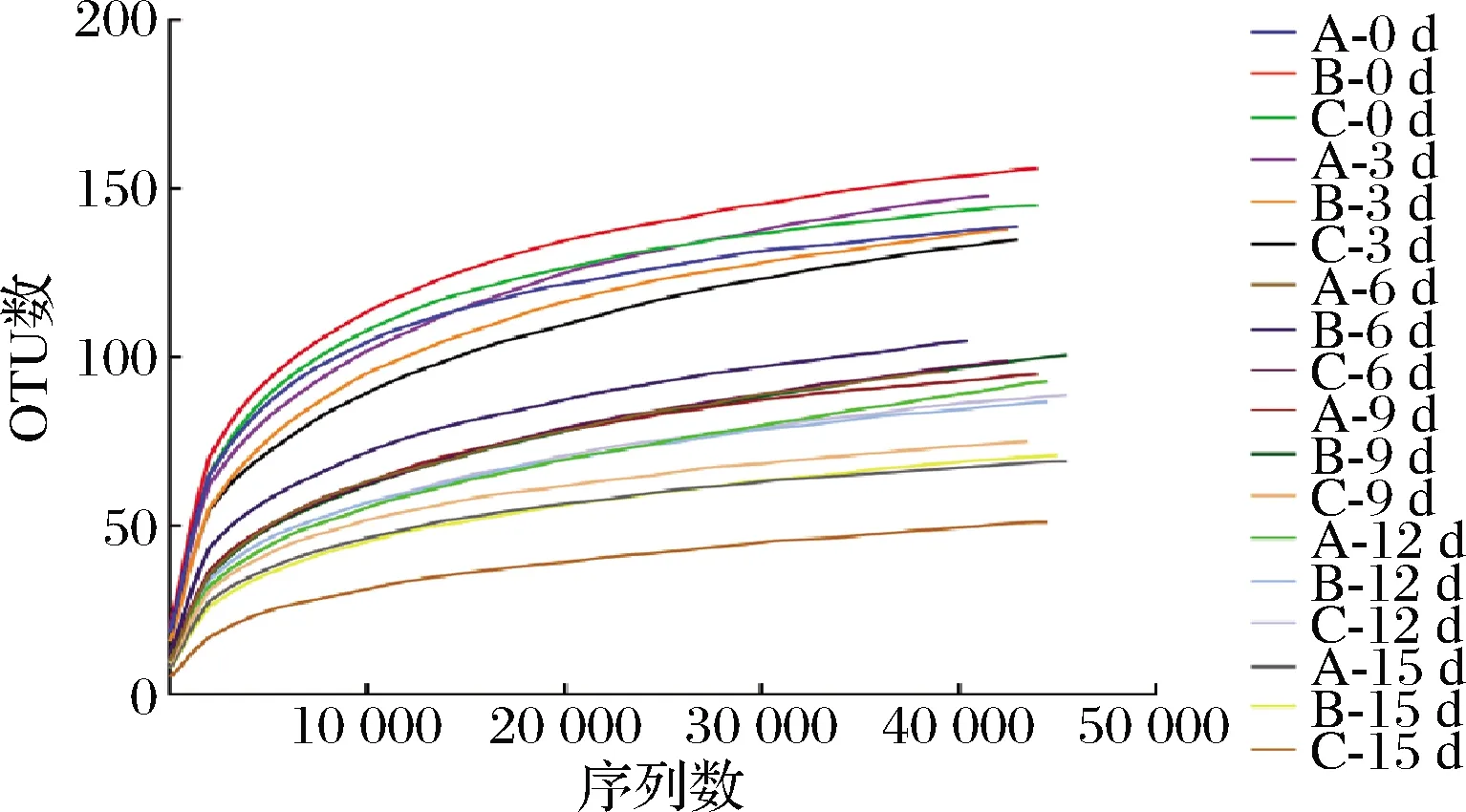
圖1 醋醅中原核微生物群落稀釋曲線Fig.1 Rarefaction curve of prokaryotic microbial community in Cupei
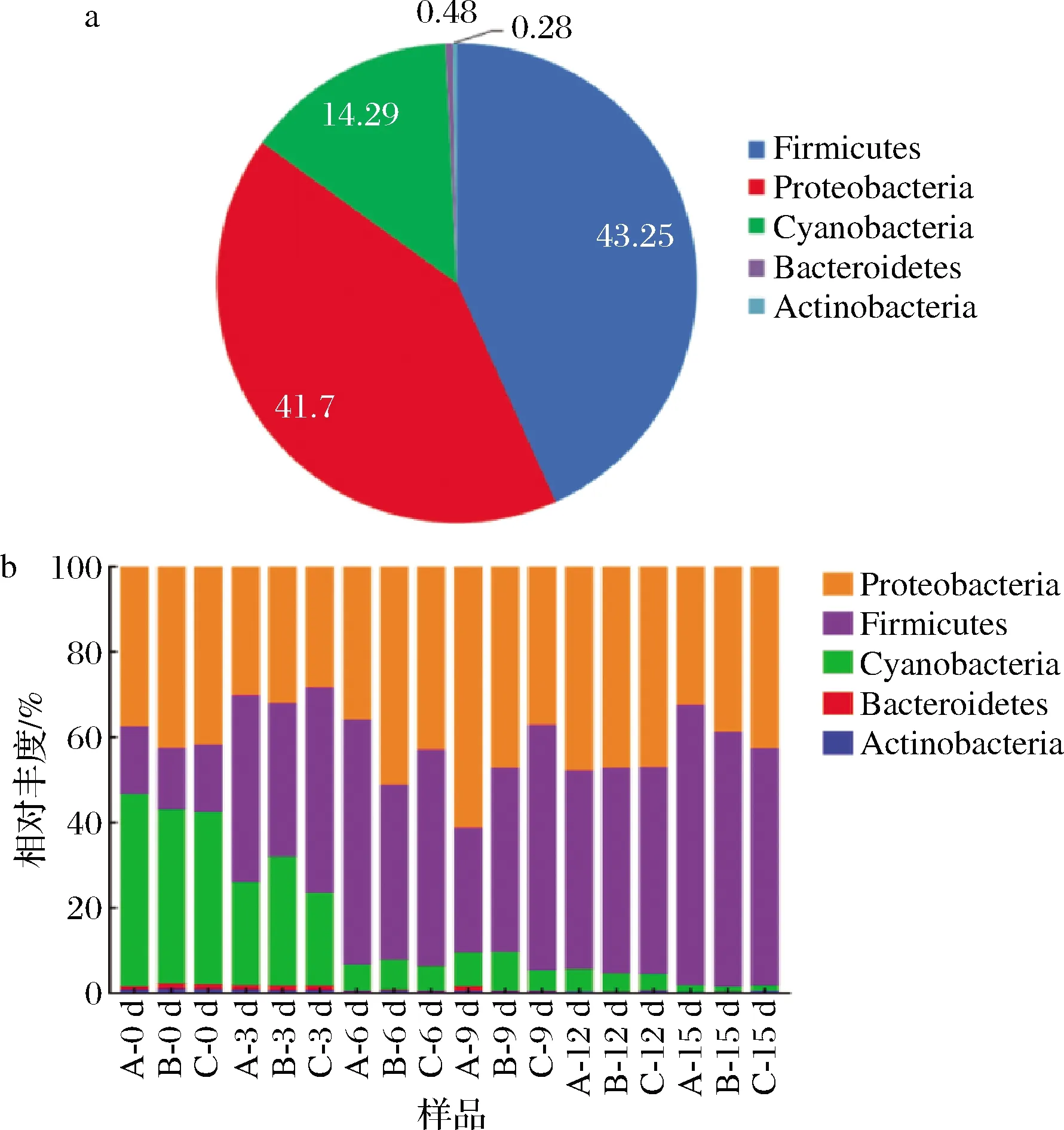
a-門水平的組成;b-相對豐度變化圖2 原核微生物群落在門水平的組成及相對豐度變化Fig.2 The composition and relative abundance changes of the prokaryotic microbial community at the phylum level 注:圖2-a中原核微生物群落在門水平所占的比例為所有 樣品的平均值
如圖3-a所示,18個醋醅樣品中的原核微生物屬主要為乳桿菌屬(Lactobacillus,33.88%)、醋桿菌屬(Acetobacter,28.19%)、藍藻細菌屬(Acaryochloris,14.21%)、醋酸乳桿菌屬(Acetilactobacillus,8.97%)、未分類的紅螺菌屬(Rhodospirillaceae_unclassified,4.84%)、農桿菌屬(Agrobacterium,1.98%)、鞘氨醇單胞菌屬(Sphingomonas,1.69%)和葡糖醋桿菌屬(Gluconacetobacter,1.23%)。由圖3-b可知,隨著醋酸發酵的進行,乳桿菌屬的相對豐度由第0天的15.03%上升至第6天的39.30%,然后下降至第15天的23.05%;醋桿菌屬在第0天時的相對豐度為0.32%,第3天時上升至8.85%,第6~12天相對豐度為43.77%,第15天又下降至32.28%;而醋酸乳桿菌屬和葡糖醋桿菌屬在第0~6天的相對豐度極低,在第9~15天相對豐度逐漸上升,到第15天時,醋酸乳桿菌屬和葡糖醋桿菌屬的相對豐度分別達36.78%和4.76%;藍藻細菌屬、未分類的紅螺菌屬、農桿菌屬、鞘氨醇單胞菌屬、未注釋到的菌屬(not_assigned)和黃單胞菌屬(Xanthomonas)、甲基桿菌屬(Methylobacterium)、寡養單胞菌屬(Stenotrophomonas)、假單胞菌屬(Pseudomonas)和泛菌屬(Pantoea)等菌屬的相對豐度隨著醋酸發酵過程的進行而下降;李榮源等[12]研究發現醋酸發酵結束的醋醅中主要的細菌屬為乳桿菌屬和醋桿菌屬,這可能是數據處理方式的區別導致醋酸乳桿菌屬未被注釋到。另外可以發現赤水曬醋醋酸發酵的細菌群落組成與鎮江香醋[15]、山西老陳醋[16]、涼州熏醋[17]等固態發酵食醋的細菌群落較為相似,而與浙江玫瑰醋[18]和永春老醋[19]等液態發酵食醋的細菌群落有較大差異,這表明醋酸發酵工藝對微生物群落結構有較大影響。由于醋酸發酵過程主要是微生物利用乙醇和糖類物質生成乙酸和其他有機酸并產生大量生物熱的過程,前期乳桿菌屬利用原料中的糖類繁殖代謝,相對豐度升高,隨后由于小分子糖被耗盡以及酸度的升高,乳桿菌屬逐漸死亡,相對豐度下降;醋桿菌屬前期利用乙醇大量生成乙酸,后期由于乙醇幾乎被耗盡且酸度升高,因此相對豐度下降;藍藻細菌屬、未分類的紅螺菌屬、農桿菌屬、鞘氨醇單胞菌屬、未注釋到的菌屬和黃單胞菌屬、甲基桿菌屬、寡養單胞菌屬、假單胞菌屬和泛菌屬等菌屬主要來自原料、空氣和生產工具[15],醋酸發酵體系的高乙醇、高乙酸和高溫度使其凋亡;而醋酸乳桿菌屬和葡糖醋桿菌屬由于具有耐酸的特性[20-22],因此在醋酸發酵后期其相對豐度逐漸升高。
2.3 β多樣性分析
基于Bray-Curtis距離算法,以18個醋醅樣品中的OTU組成為原始數據進行主坐標分析(principal coordinate analysis,PCoA)(圖4-a)和聚類分析(cluster analysis,CA)(圖4-b)。由圖4-a可以看出第一主坐標軸(PCoA1)和第二主坐標軸(PCoA2)對赤水曬醋醋酸發酵過程醋醅中的原核微生物群落的解釋度分別為75.9%和15.2%,不同醋醅樣品基本按照發酵天數聚在一起,并隨著發酵時間在PCoA1上逐漸移動。由圖4-b可以將赤水曬醋的醋酸發酵過程分為3個階段:發酵前期(第0~3天)、發酵中期(第6~12天)和發酵末期(第15天);另外平行樣品之間的距離小于不同時間樣品之間的距離,可以說明平行樣品之間的一致性較好。
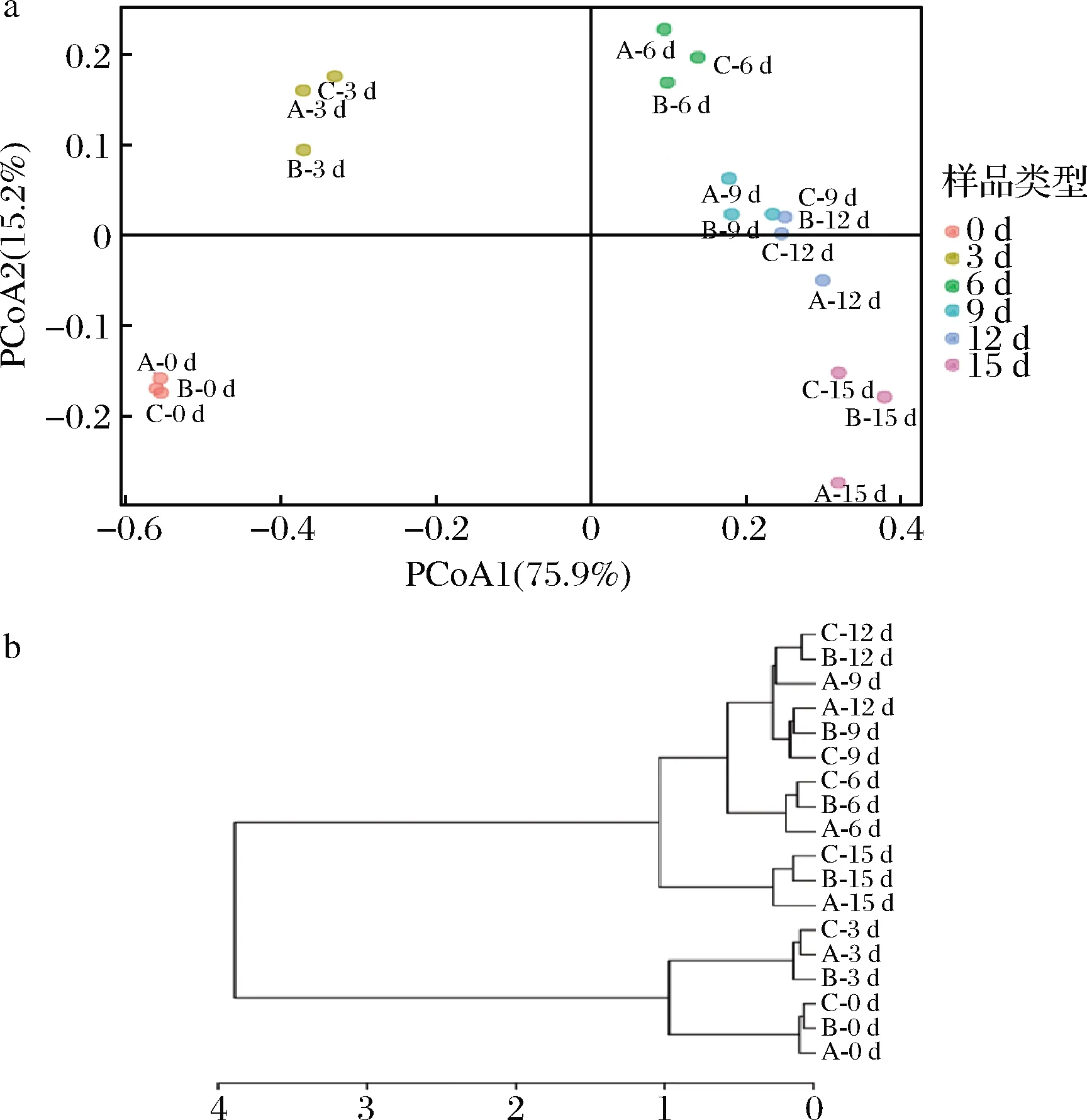
a-PCoA;b-CA圖4 醋醅中原核微生物群落的PCoA及CAFig.4 PCoA and CA of prokaryotic microbial community in Cupei
2.4 基礎理化指標變化
固態發酵食醋醋酸發酵過程中,醋酸菌將乙醇轉化為乙酸,乳酸菌將葡萄糖等小分子糖類轉化為乳酸,同時伴隨著一系列其他生化反應的發生,這些反應共同賦予了食醋獨特的風味[23]。從圖5可以看出,乙醇由5.78%下降到0.33%,而總酸由0.61%(以乙酸計)上升至5.35%(以乙酸計),兩者變化趨勢基本相反。而乳酸和還原糖含量的變化趨勢都是先上升后下降,前期麩皮中的部分大分子糖類由于酸水解作用導致還原糖含量上升,隨后由于乳酸菌等微生物利用還原糖轉化為其他物質而下降;另一方面,前期乳酸菌利用還原糖產生乳酸,但后期醋酸菌等能利用乳酸生成乙偶姻,導致乳酸含量下降[24]。
2.5 相關性分析
冗余分析(redundancy analysis,RDA)主要反映菌群與環境因子之間的關系,環境因子箭頭所處的象限表示環境因子與排序軸間的正負相關性,箭頭連線的長度代表著某個環境因子與群落分布和種類分布間相關程度的大小,連線越長,說有相關性越大,反之越小。箭頭連線和排序軸的夾角代表著某個環境因子與排序軸的相關性大小,夾角越小,相關性越高;反之越低[25]。由圖6可知,乳桿菌屬主要與乳酸和還原糖含量呈正相關,醋桿菌屬、檸檬乳桿菌屬(Limosilactobacillus)、葡糖醋桿菌屬和醋酸乳桿菌屬主要與酸度呈正相關,而農桿菌屬、黃單胞菌屬和甲基桿菌屬等菌屬主要與酸度呈負相關,且與乙醇含量呈正相關。
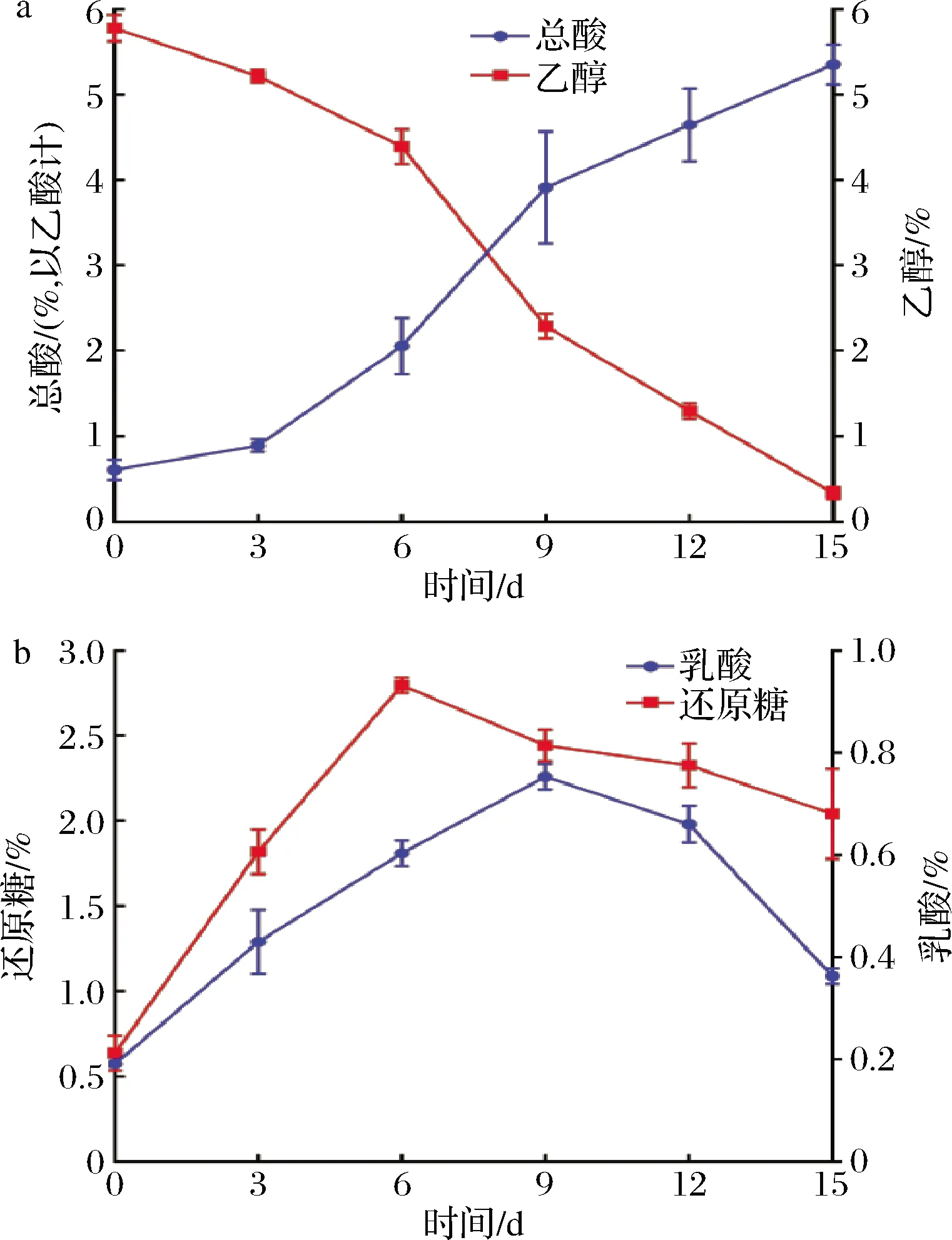
a-總酸、乙酸;b-還原糖、乳酸圖5 醋酸發酵過程理化指標變化Fig.5 Changes in physical and chemical indicators during acetic acid fermentation
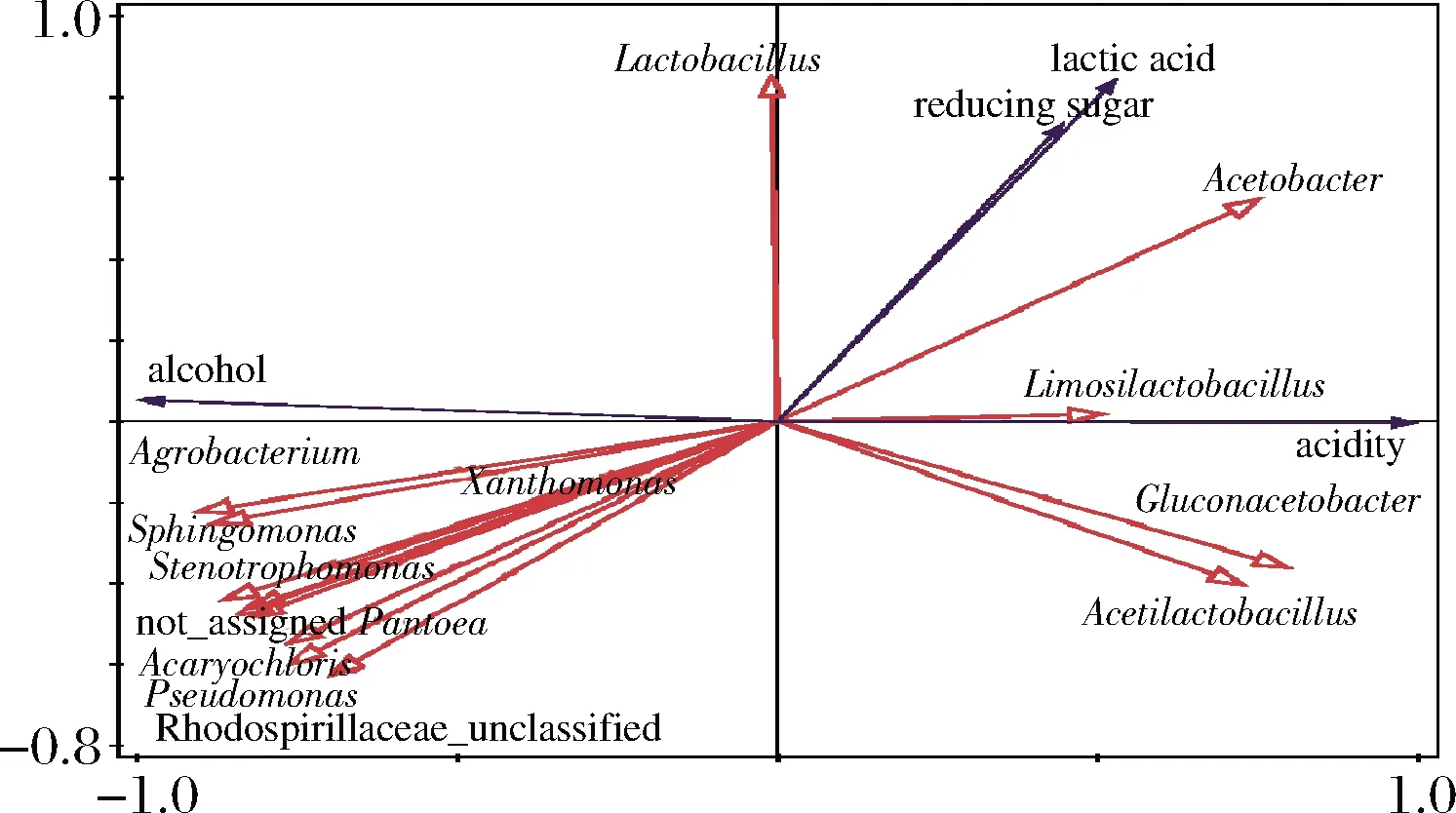
圖6 醋酸發酵過程原核微生物屬與環境因子的冗余分析Fig.6 Redundancy analysis of prokaryotic microbial genus and environmental factors during acetic acid fermentation
3 結論
赤水曬醋醋酸發酵過程的OTU數和物種數均呈先略微上升后下降的趨勢。原核微生物群落在門水平上可分為變形菌門(41.7%)、厚壁菌門(43.25%)、藍細菌門(14.29%)、擬桿菌門(0.48%)和放線菌門(0.28%);在屬水平上,醋酸乳桿菌屬和葡糖醋桿菌屬的相對豐度隨著醋酸發酵的進行一直上升,乳桿菌屬和醋桿菌屬相對豐度隨著醋酸發酵的進行先上升后下降;藍藻細菌屬、未分類的紅螺菌屬、農桿菌屬、鞘氨醇單胞菌屬等原核微生物屬的相對豐度隨著醋酸發酵的進行呈下降的趨勢。主坐標分析表明:醋醅樣品按照醋酸發酵天數聚在一起,并隨著發酵的進行在第一主坐標軸上移動;通過聚類分析可將醋酸發酵過程分為前期(第0~3天)、中期(第6~12天)和末期(第15天)這3個階段。總酸由0.61%(以乙酸計)上升至5.35%(以乙酸計),乙醇由5.78%下降至0.33%;還原糖和乳酸含量均呈先上升后下降的趨勢。此外,相關性分析表明乳桿菌屬主要與乳酸和還原糖含量呈正相關,醋桿菌屬、檸檬乳桿菌屬、葡糖醋桿菌屬和醋酸乳桿菌屬主要與酸度呈正相關,而農桿菌屬、黃單胞菌屬和甲基桿菌屬等菌屬主要與酸度呈負相關,且與乙醇含量呈正相關。

