抗菌肽AMP-17對黃曲霉抑制作用的初步研究
朱麗娟,國果,2*,田竺青,孫朝琴,楊隆兵,黃明嬌,劉鑒,彭建,3,石幫慧
1(貴州醫科大學 基礎醫學院,現代病原生物學重點特色實驗室,貴州 貴陽,550025)2(貴州醫科大學,轉化醫學研究中心, 貴州 貴陽,550025)3(貴州醫科大學 生物與工程學院,環境污染監測與疾病控制重點實驗室,貴州 貴陽,550025) 4(貴州醫科大學 公共衛生與健康學院,貴州 貴陽,550025)
近幾年來,食品中生物性污染問題一直被廣泛關注。真菌毒素與食品污染息息相關,其中黃曲霉毒素B1(aflatoxin B1,AFB1)是真菌毒素中較為常見的一種,主要由絲狀真菌黃曲霉產生[1]。1993年黃曲霉毒素(aflatoxins,AFs)被國際癌癥機構歸為I類致癌物質[2]。調查顯示,2015—2018年國家市場監督管理局報道我國因真菌毒素污染引起的事件高達602起;在此期間我國出口的食品及飼料中真菌毒素超標事件達241起[3]。食品經黃曲霉污染沒有簡便可行的脫毒措施[4],為延長食品的保質期,保障食品安全,人們主要采用生物脫毒法、物理法、化學法滅活有毒有害微生物,延緩或阻止它的生長[5]。添加防腐劑是最常見的方法,如常見的山梨酸鉀(potassium sorbate,PS)、苯甲酸鈉、雙乙酸鈉等,這些防腐劑或多或少都會對人體健康產生一定的副作用[6],因而使得許多科研人員對天然安全的抗菌物質更為關注。
抗菌肽(antimicrobial peptides,AMPs)是一類廣泛存在于微生物、動植物及人體內的小分子多肽,其抗菌譜廣,具有熱穩定性好、不易產生耐藥性、易被人體消化吸收、無毒等優點[7]。近年來抗菌肽在食品領域逐漸成為研究熱點并取得了一定的成果[8]。從魚類中分離的抗菌肽Pleurocidin和魚精蛋白,均對單核細胞增生李斯特菌和其他食品腐敗微生物具有抑制活性,可用于食品保藏[9]。TENEA等[10]從植物乳桿菌UTNGt2中提取的抗菌肽能抑制番茄中的沙門氏菌,延長番茄的保質期,顯示了其潛在的防腐潛力。國內外公認的天然防腐劑——乳酸菌素Nisin是食物防腐保鮮劑的最佳選擇之一[11]。這些都提示了抗菌肽在食品防腐保鮮中有較大的應用市場價值。
AMP-17是課題組采用原核表達體系獲得的重組蛋白,實驗證實其具有顯著的抗菌作用,特別是對白色念珠菌等真菌具有較強的抗菌活性,且熱穩定性強,耐反復凍融,安全性較好,對人和鼠紅細胞基本沒有溶血性[12-13]。另外還發現AMP-17能延長草莓的保質期,起到保鮮作用[14]。但AMP-17對黃曲霉的生長和產毒有無影響還不得而知。故本研究擬探討AMP-17對食源性真菌黃曲霉的抗菌效果,分析其對黃曲霉菌絲、孢子、產毒等方面的影響,研究結果為進一步了解AMP-17的功能,研發安全有效的抗菌肽類防腐劑提供一定的實驗依據。
1 材料與方法
1.1 實驗菌株
黃曲霉菌株(Aspergillusflavuslink)由貴州醫科大學食品科學學院微生物實驗室提供。
1.2 培養基
馬鈴薯葡萄糖液體(potato dextrose broth medium,PDB)培養基、馬鈴薯葡萄糖固體(potato dextrose agar,PDA)培養基,北京索萊寶科技有限公司。
1.3 試劑與儀器
磷酸鹽緩沖鹽溶液,北京索萊寶科技有限公司;細胞濾網(40 μm),安徽Biosharp公司;AFB1酶聯免疫檢測試劑盒,上海佑隆生物科技有限公司;PS(純度>99%)、吐溫-80,大連美侖生物技術有限公司。
HVE-50型滅菌鍋,日本ALR公司;X30R冷凍高速離心機,美國BECKMAN公司;SPX-150B-Z型生化培養箱,上海博訊醫療生物儀器股份有限公司;IMARK酶標儀,美國BIO-RAD公司;YS100普通光學顯微鏡,日本Nikon公司;SW-CJ-1D型超凈工作臺,江蘇凈化設備有限公司;AL104-IC電子天平,上海梅特勒拖利多儀器公司;HITACHI S-3400 N掃描電鏡,日本HITACHI公司。
1.4 實驗方法
1.4.1 黃曲霉孢子懸液制備
參照BEN TAHEUR等[15]方法并做適當修改。取出適量黃曲霉甘油菌,接種到PDA培養基上,于28 ℃溫箱培養7 d,吐溫-80洗脫固體培養基上的黃曲霉,200 r/min振蕩30 min,收集處理后的洗脫溶液,醫用紗布過濾,于冷凍離心機離心后,重復加入無菌水3~5次,得到孢子沉淀物,在將沉淀物重懸在無菌水中,于-80 ℃保存備用。
1.4.2 AMP-17的制備
參考楊隆兵等[16]方法操作獲得抗菌肽AMP-17。
1.4.3 AMP-17對黃曲霉最低抑菌濃度的測定
采用微量液體稀釋法檢測AMP-17對黃曲霉的最低抑菌濃度(minimum inhibitory concentration,MIC)[17]。在96孔板中加入100 μL黃曲霉孢子懸液(1.0×104CFU/mL),再加入一定濃度AMP-17,使其終質量濃度為6.25~100 μg/mL。同時以加等體積的無菌水為陰性對照組、100 μg/mL PS為陽性對照組,只加PDB培養液的為空白對照組(下同)。于28 ℃ 恒溫培養箱內放置2 d后,肉眼觀察清澈透明的孔所對應的藥物濃度即為MIC。
1.4.4 AMP-17對黃曲霉生長曲線的影響
于96孔板中加入孢子懸液及不同濃度AMP-17,置28 ℃培養箱中56 h,每隔8 h檢測630 nm的吸光度值。以時間為X軸,吸光度為Y軸,繪制黃曲霉生長曲線。
1.4.5 AMP-17對黃曲霉孢子萌發率的影響
將100 μL不同濃度 AMP-17與黃曲霉孢子懸浮液等體積加入96孔板,放置在28 ℃恒溫培養箱24 h后,取適量菌液充入血球計數板觀察并計算孢子萌發率。根據公式(1)計算孢子萌發率[18]。
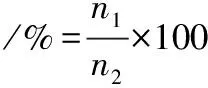
(1)
式中:n1為萌芽孢子數,n2總孢子數。
1.4.6 AMP-17對黃曲霉菌絲干重的測定
按照王同等[19]的方法,于20 mL PDB中加入黃曲霉孢子懸液,置28 ℃,150 r/min培養10 h,待孢子完全萌發后,加入不同濃度的AMP-17,同時加入適量吐溫-80,繼續培養5 d,紗布過濾,菌絲體烘干稱重,并按照公式(2)計算AMP-17對菌絲生長的抑制率。
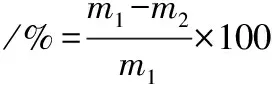
(2)
式中:m1為陰性組菌絲干重,g;m2為實驗組菌絲干重,g。
1.4.7 AMP-17對黃曲霉產AFB1的影響
參考徐楊玉等[20]的方法,將孢子懸液和AMP-17加到10 mL的PDB中,使APM-17終質量濃度為25~100 μg/mL。于28 ℃恒溫搖床中,180 r/min培養10 d。根據AFB1快速檢測試劑盒提供的方法,采用酶聯免疫法對其毒素積累進行定量分析,判斷AFB1積累量。
1.4.8 掃描電鏡觀察AMP-17對黃曲霉形態的影響
制備黃曲霉電鏡標本:將濃度為1×106CFU/mL黃曲霉孢子懸液與50 μg/mL AMP-17混合,取0.2 mL 混合液于PDA培養基上均勻涂布,無菌蓋玻片與培養基水平面45°角插入培養皿中;使得蓋破片與培養基平面接觸面積最大。將PDA培養基置于37 ℃ 恒溫培養箱培養48 h后。取爬滿黃曲霉菌絲的蓋破片,用2.5%戊二醛固定過夜[21]。經不同濃度的乙醇逐級脫水后,將樣品放入臨界點干燥器內,干燥后的標本置于高真空蒸發器中,離子噴濺儀噴金后,用S-3400 N掃描電鏡上機觀察。
1.4.9 數據處理及統計學分析
以上實驗每組均處理3個重復,實驗重復3次。應用GraphPad Prism 8.0統計軟件分析處理結果,計量資料以均數±標準差表示,組間差異比較采用單因素方差分析,Tukey′s多重比較分析統計學差異。P<0.05為差異有統計學意義。
2 結果與分析
2.1 最低抑菌濃度
本實驗以常用的防腐劑PS作陽性藥物,結果顯示,AMP-17質量濃度≥50 μg/mL的孔內清澈透明,即其對黃曲霉的MIC為50 μg/mL。而山梨酸鉀的MIC大于最高質量濃度100 μg/mL,提示抗菌肽AMP-17對黃曲霉的抑制效果比山梨酸鉀更為顯著。
2.2 生長曲線
前24 h各組黃曲霉生長速率都較慢,24 h后吸光度值逐漸增高,而低濃度的AMP-17組生長速度亦較快,12.5 μg/mL組與陰性對照生長曲線基本一致。當AMP-17質量濃度≥50 μg/mL后,生長曲線近乎一條直線,吸光度值無明顯增加,提示在此濃度下黃曲霉生長受到明顯抑制(圖1)。

圖1 黃曲霉生長曲線Fig.1 Growth curve of A.flavus
2.3 黃曲霉孢子萌發率
培養24 h后,鏡下觀察到對照組黃曲霉孢子萌發較好,萌發率達94%,經AMP-17作用后,各組萌發率均明顯降低,25 μg/mL AMP-17處理后萌發率為16.3%,50 μg/mL組萌發率僅為8%(圖2)。提示AMP-17對黃曲霉的孢子萌發具有較強的抑制作用。
2.4 對黃曲霉菌絲生長的影響
黃曲霉菌絲體干重可以反映黃曲霉的生長情況,與對照組相比,菌絲體干重越小,說明抑制作用越顯著。圖中對照組黃曲霉形成較多且體積較大的菌絲球,隨著AMP-17作用濃度的增大,菌絲球的數量越來越少,體積也逐漸減小(圖3-A),50 μg/mL AMP-17的菌絲體干重約為0.004 67 g,提示對菌絲體抑制率達72.5%(圖3-B)。令人驚奇的是,經PS干預5 d后反而促進了黃曲霉菌絲體的形成(P<0.01),但在24 h時山梨酸鉀對黃曲霉孢子萌發有明顯抑制作用,猜測山梨酸鉀主要是在前期抑制黃曲霉孢子的萌發,但隨著培養時間的延長,山梨酸鉀對黃曲霉的抑制能力下降并促進菌絲的生長發育。
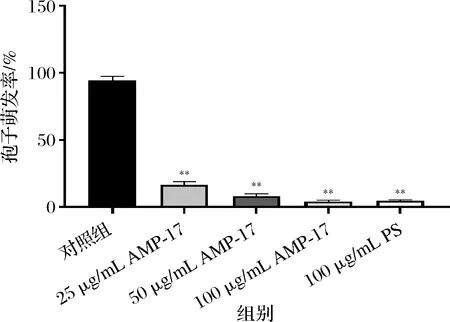
圖2 AMP-17對黃曲霉孢子萌發率的影響Fig.2 Effect of AMP-17 on spore germination rate of A.flavus 注:與對照組比較,*表示P<0.05,**表示P<0.01(下同)

A-AMP-17對黃曲霉菌絲球形成的影響;B-AMP-17對 黃曲霉菌體生長的影響圖3 AMP-17對黃曲霉菌絲生長的影響Fig.3 Effect of AMP-17 on the mycelium growth of A.flavus
2.5 對黃曲霉產AFB1的影響
對照組AFB1的量高達2.189 ng/mL,而25 μg/mL的AMP-17作用后產毒量顯著降低,只有0.056 ng/mL;質量濃度為100 μg/mL時,毒素僅有0.020 ng/mL。而PS則促進了黃曲霉產毒(圖4)。說明AMP-17能顯著抑制黃曲霉合成AFB1。
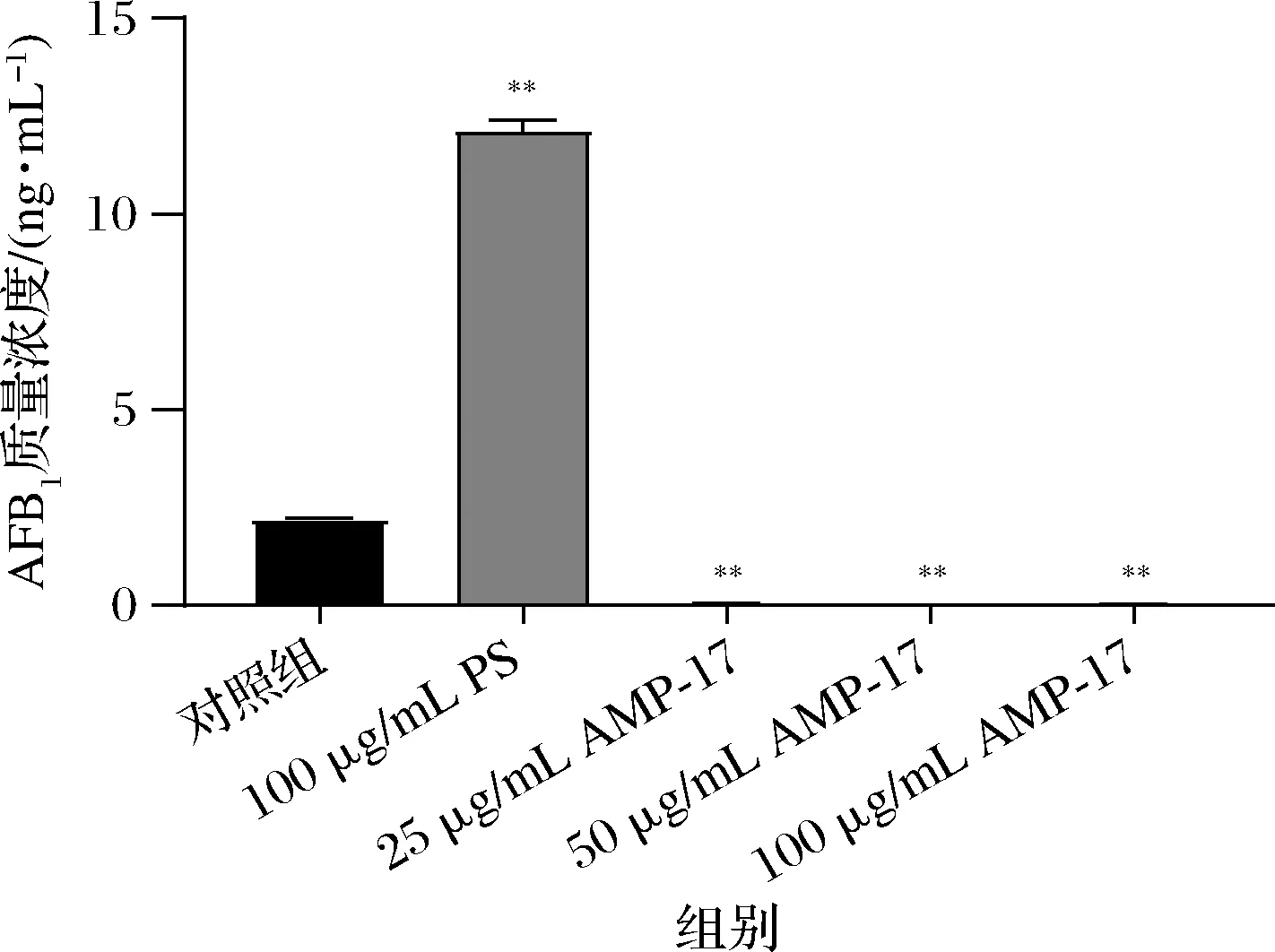
圖4 AMP-17對黃曲霉產AFB1的影響Fig.4 Effects of AMP-17 on AFB1 production by A.flavus
2.6 掃描電鏡觀察黃曲霉結構變化
鏡下觀察到,培養了24 h的正常黃曲菌體細胞形態完好且飽滿,孢子梗較多并形成了大量孢子,孢子呈球形,外部光滑,顏色清亮,細胞之間界限清晰(圖5-A~圖5-C)。經AMP-17作用后,黃曲霉不能形成完整的孢子梗,孢子脫離散落,同時表面出現了褶皺、凹陷、破裂、粗糙(圖5-D),甚至有些細胞出現碎片,內部物質流出、菌體形態發生部分扭曲變形(圖5-E),有些菌絲形態發生嚴重扭曲變形,斷裂成凝絮狀(圖5-F)。結果表明AMP-17能夠破壞黃曲霉的孢子,菌絲體結構。
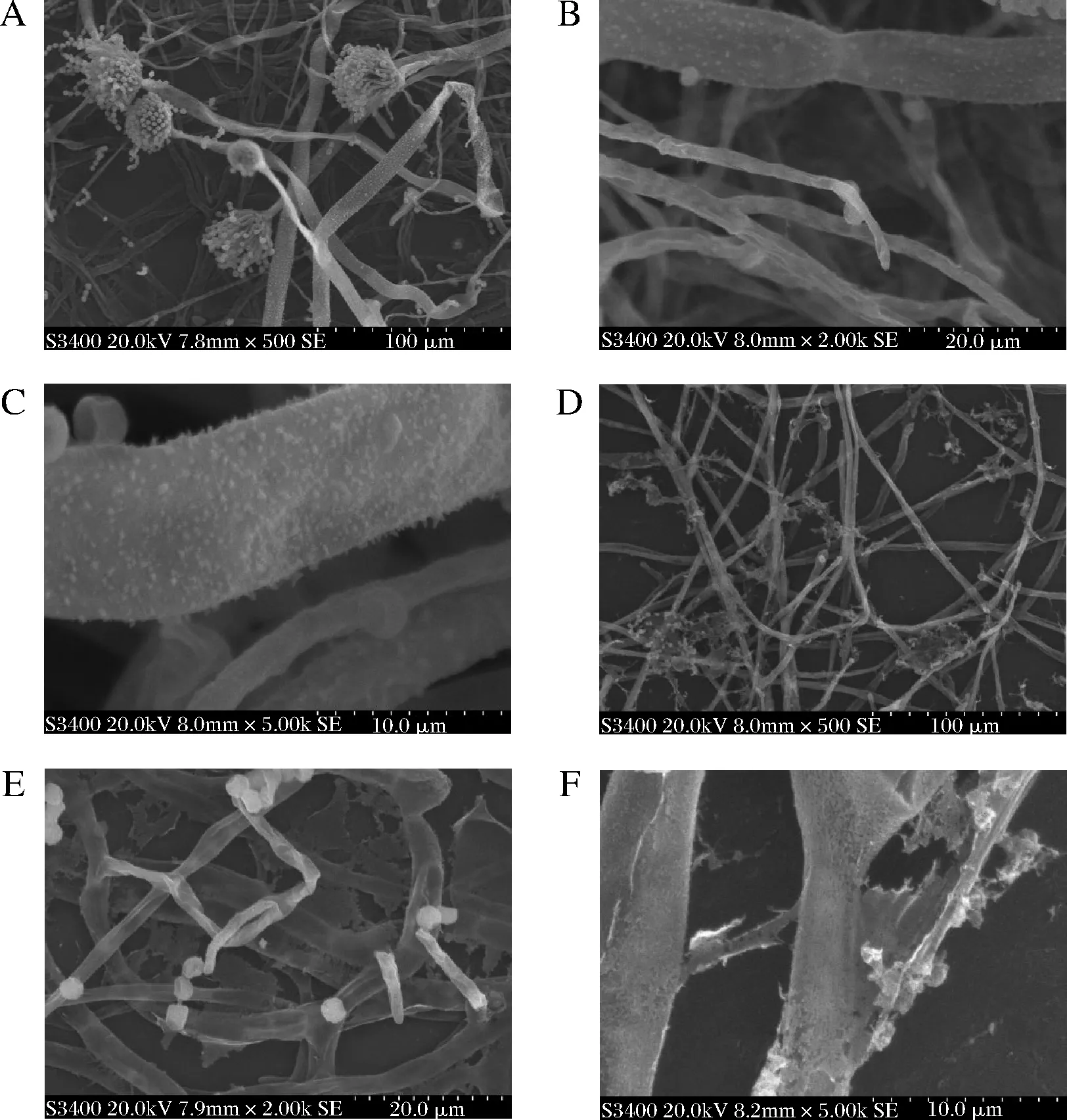
A-對照組×500;B-對照組×2 000;C-對照組×5 000; D-AMP-17組×500;E-AMP-17組×2 000;F- AMP-17組×5 000圖5 AMP-17作用于黃曲霉的掃描電鏡觀察Fig.5 SEM of AMP-17 against on A.flavus
3 討論
黃曲霉易污染大豆、花生和玉米等作物,是我國乃至全球谷物最重要的污染真菌之一[22]。黃曲霉菌體由許多復雜的菌絲構成,主要為營養菌絲和氣生菌絲。菌絲形成分生孢子梗從而產生孢子,可隨空氣傳播侵染宿主。菌絲在一定的環境下可產生黃曲霉毒素[23],黃曲霉毒素中AFB1對人的肝臟組織破壞作用最嚴重,可能導致肝癌甚至死亡[24]。
本實驗從黃曲霉孢子、菌絲及產AFB1等方面探索AMP-17對黃曲霉的抗菌功效。研究發現AMP-17對黃曲霉菌的MIC值僅為50 μg/mL,遠遠低于常用的防腐劑山梨酸鉀的抑菌濃度。結合黃曲霉生長曲線來看,證明AMP-17能顯著抑制黃曲霉的生長。研究結果與小麥PINA蛋白抑制黃曲霉生長是一致的[25]。蔣立科等[26]研究證實0.5 mg/L檸檬醛能使孢子抑制率達61.4%,本研究也發現黃曲霉萌發率隨AMP-17濃度升高而降低,當AMP-17質量濃度為50 μg/mL時,其萌發率僅為8%,孢子萌發受阻從而抑制了黃曲霉形態的轉換,進一步阻止黃曲霉形成新的孢子。最重要的是AMP-17通過抑制黃曲霉生長從而較少合成AFB1,這與枯草芽孢桿菌及其桿菌霉素D能有效抑制黃曲霉毒素的合成結果吻合[27]。
掃描電鏡結果顯示AMP-17可阻止黃曲霉分生孢子梗的形成,破壞孢子和菌絲結構完整性,提示其可能是通過損傷黃曲霉孢子及菌絲體細胞膜,使菌體形態結構改變、胞質外流,導致菌細胞破裂死亡,從而有效抑制黃曲霉生長發育。在前期研究中我們已證實AMP-17對真菌細胞膜麥角甾醇的合成有影響[28],趙欣宇等[12]發現AMP-17能顯著抑制白色念珠菌菌絲的形成并且能破壞已形成的菌絲結構。故我們推測AMP-17也可能通過影響黃曲霉孢子及菌絲細胞膜上的麥角甾醇的合成而導致細胞膜功能異常,但具體的抗菌機制還有待于進一步研究。
4 結論
本文研究了AMP-17對黃曲霉的生長發育和產毒的影響,發現其能抑制黃曲霉孢子萌發、破壞孢子及菌絲結構、降低黃曲霉AFB1的含量。提示AMP-17具有強效的防霉防腐效果,可應用于糧食作物的保鮮貯藏,延長保質期,為開發新天然防腐劑提供了一定的實驗支持。

