二維材料MXene在儲氫領域的應用研究*
胡帥成,程宏輝,韓興博,呂麗君
(1.中國科學院上海應用物理研究所,上海 201800;2.揚州大學 機械工程學院,江蘇 揚州 225127)
0 引 言
綠色能源技術是21世紀的關鍵技術[1]。現有的能源結構過于依賴一次能源,將會導致許多對環境不利的影響,首當其沖就是溫室效應。在1997年到2017年期間,中國因發電產生的二氧化碳排放量從9.35億噸增加到了3 511億噸[2]。考慮到未來的發展,人們需要一種真正意義上的清潔能源[3]。在各種可再生能源中,氫氣因其熱值高、重量輕、能量密度高[4],被認為是逐步替代化石燃料的較好選擇。氫氣在燃燒時不會直接排放二氧化碳等污染物,能夠有效緩解全球變暖問題,因此如何安全而高效地利用氫能成為了當今的重要研究方向[5]。
傳統的儲氫方式有高壓氣體儲氫和低溫液態儲氫兩種。高壓氣體儲氫,是一種成本較低、技術成熟的儲氫方式,主要是鋁內膽纖維纏繞瓶和塑料內膽纖維纏繞瓶,當壓力達到70 MPa,儲存4 kg左右的氫氣大約需要容積100 L的儲氫罐,該儲氫方式的能量密度很低并且高壓氣瓶也存在一定的安全問題。低溫液態儲氫是將氫氣液化后儲存在低溫絕熱的容器里,其能量密度大于高壓氣體儲氫,并且技術也很成熟,但在液化過程中需要消耗大量能源,是一種液化成本高、易蒸發的儲氫方式[6]。由于固體儲氫能量密度高、安全性強并且適合遠距離的穩定儲氫,因此相比傳統儲氫具有更廣闊的發展前景[7]。固體儲氫又分為物理吸附、化學吸附和一種介于物理和化學之間的吸附。在物理吸附的情況下,氫氣分子仍然是氫氣分子并且以較弱的結合能吸附在金屬的表面,如MOFs[8]和一些碳基材料[9];在化學吸附的情況下,氫氣分子分解成兩個氫原子并與表面原子相結合,并具有相當高的結合能,因此在釋放氫氣的時候需要較高的溫度,如NaAlH4[10]和Al(BH4)3[11]等一些氫化物;在第三種情況下,氫氣分子的結合鍵被拉長但不破壞,氫原子與表面原子的距離比物理吸附要近,大約0.25 nm,小于物理吸附的0.3 nm,稱為準分子成鍵,即Kubas吸附[12],如用Ti修飾碳納米管作為一種潛在的高容量儲氫介質[13]。十幾年前通過在氫氟酸刻蝕陶瓷剝離對應的MAX相[14],制備了一類新的類石墨烯的二維材料稱為MXene[15]。MAX相是一類三元碳化物或氮化物陶瓷,M代表過渡金屬元素,A代表Al、Si等主族元素, X代表C與/或N[16],結合了金屬和陶瓷的性能,具有良好的高溫穩定性[17]。MXene的命名基于其組成元素和類石墨烯結構,它既具有石墨烯的高比表面積和高導電率,也具有組分可調、層厚可控的優勢,常見的MXene有M2X、M3X2、M4X33種,并且已經在儲能、吸附、3D打印、生物醫藥等方面展現出前所未有的優勢。
1 MXene材料制備
1.1 氫氟酸刻蝕法
MXene材料的首次成功制備以及發展至今的最主要的制備方式仍然是氫氟酸刻蝕法[18]。過程示意圖如圖1所示,通過50%質量分數的HF對Ti3AlC2MAX相刻蝕處理2 h,鋁原子會從層間剝離得到Mn+1Xn,并與溶液中的F-結合形成AlF3。而裸露的配位不飽和鈦原子與氟化物或水中的氫氧根結合,形成-F或-OH官能團。其刻蝕原理主要如下所示:
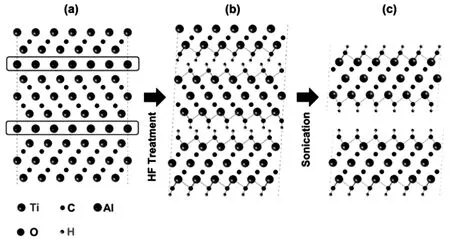
圖1 氫氟酸刻蝕Ti3AlC2過程示意圖:(a)Ti3AlC2結構;(b)HF刻蝕后產物結構;(c)刻蝕產物超聲后結構[18]
Mn+AlXn+3HF=Mn+1Xn+AlF3+3/2H2
(1)
Mn+1+2H2O=Mn+1Xn(OH)2+H2
(2)
Mn+1Xn+2HF=Mn+1XnF2+H2
(3)
通過氫氟酸刻蝕存在很多的弊端,如氫氟酸有毒有害、腐蝕性極強、刻蝕周期較長等。因此可以對這種氫氟酸法進行改進,得到一種原位氫氟酸刻蝕法[19]。此方法避免氫氟酸的直接使用,降低實驗風險,通過使用氟化物鹽和酸的混合物在制備過程中原位生成氫氟酸的方法來合成MXene,其刻蝕原理同上氫氟酸刻蝕方法,由于刻蝕劑腐蝕性的降低,因此制備周期增長[20]。
1.2 電化學刻蝕法
由于氫氟酸的腐蝕性及氟離子的有毒性,因此在MXene制備過程中無氟參與MXene合成策略也具有很大的研究價值。Yang等通過無氟電化學刻蝕方法成功制備MXene材料[21],制備過程中通過氫氧化銨輔助氯離子快速破壞Ti-Al鍵刻蝕Al原子,制備周期較短,刻蝕效果也很明顯,具體過程如圖2所示。
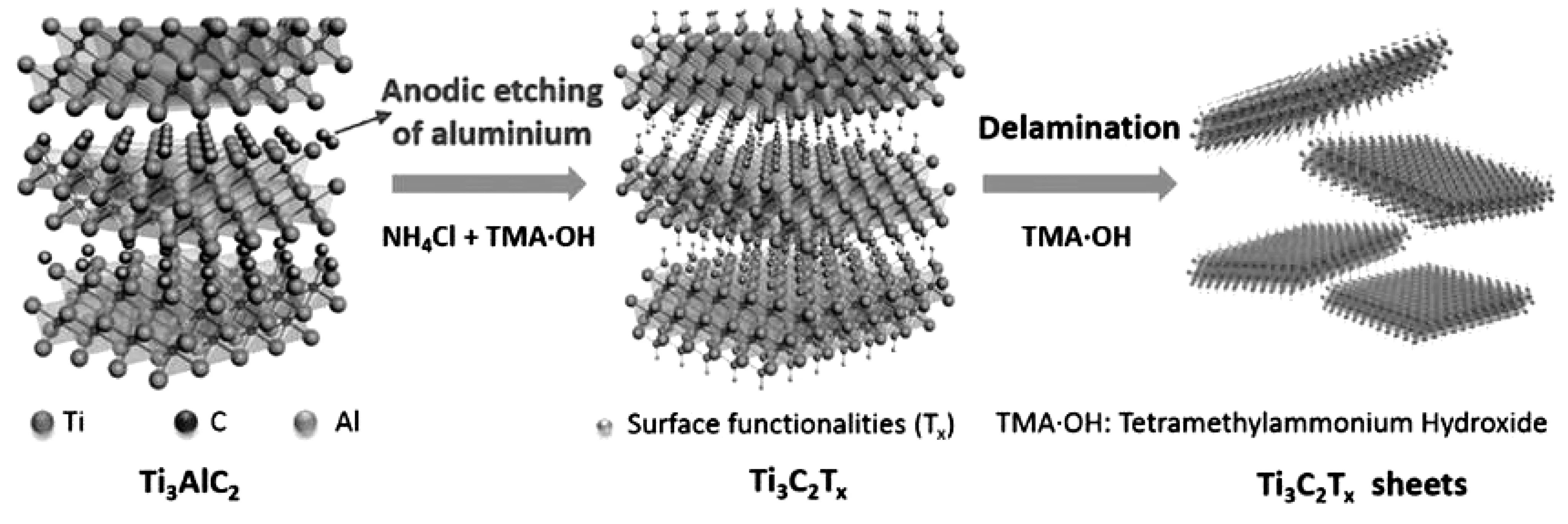
圖2 二元水溶液中對Ti3AlC2進行陽極刻蝕[21]
Pang等通過電化學刻蝕的方法安全且快速的制備了Ti2CTx、Cr2CTx、V2CTxMXene材料[22],其制備過程如圖3所示,通過熱輔助的三維導電電極來提高電化學刻蝕的效率。電化學刻蝕過程中的反應如公式(4)所示:
Ti2AlC+yCl-+(2x+z)H2O→Ti2C(OH)2xClyOz+Al++(x+z)H2+(y+3)e-
(4)
1.3 熔融鹽刻蝕法
Li等報道了一種更加安全而且周期明顯縮短的MXene材料制備策略[23],根據熔融鹽中陽離子和MAX相中A位元素的氧化還原電位的大小,路易斯酸鹽和MAX相材料發生A位元素置換反應得到MXene材料。以Ti3SiC2為例,實驗流程示意圖如圖4所示,Cu/Cu2+和Si/Si4+的氧化還原電位分別為-0.43和-1.38 eV。根據電位關系,在700 ℃的熔融態鹽床環境中,路易斯酸鹽刻蝕劑中的Cu2+能夠將MAX材料中的A位Si原子氧化成Si4+離子,而Si4+在高溫下形成SiCl4氣體逸出,Cu2+離子被還原成Cu單質,可使用過硫酸銨酸洗去除。

圖4 CuCl2路易斯酸鹽刻蝕Ti3SiC2示意圖:(a)750 ℃熔融鹽包覆Ti3SiC2,(b)-(c)CuCl2和Ti3SiC2反應過程,(d)過硫酸銨酸洗后產物結構[23]
文獻種將不同種類路易斯酸鹽的氧化電位整理如圖5(a)所示,根據MAX相中的A位元素和路易斯酸鹽陽離子之間的吉布斯自由能關系,能夠進行多路線的刻蝕,如圖5(b)所示為6種不同搭配得到的MXene材料掃描圖,刻蝕效果均很明顯,同時也說明了路易斯酸鹽刻蝕MXene材料的普適性。
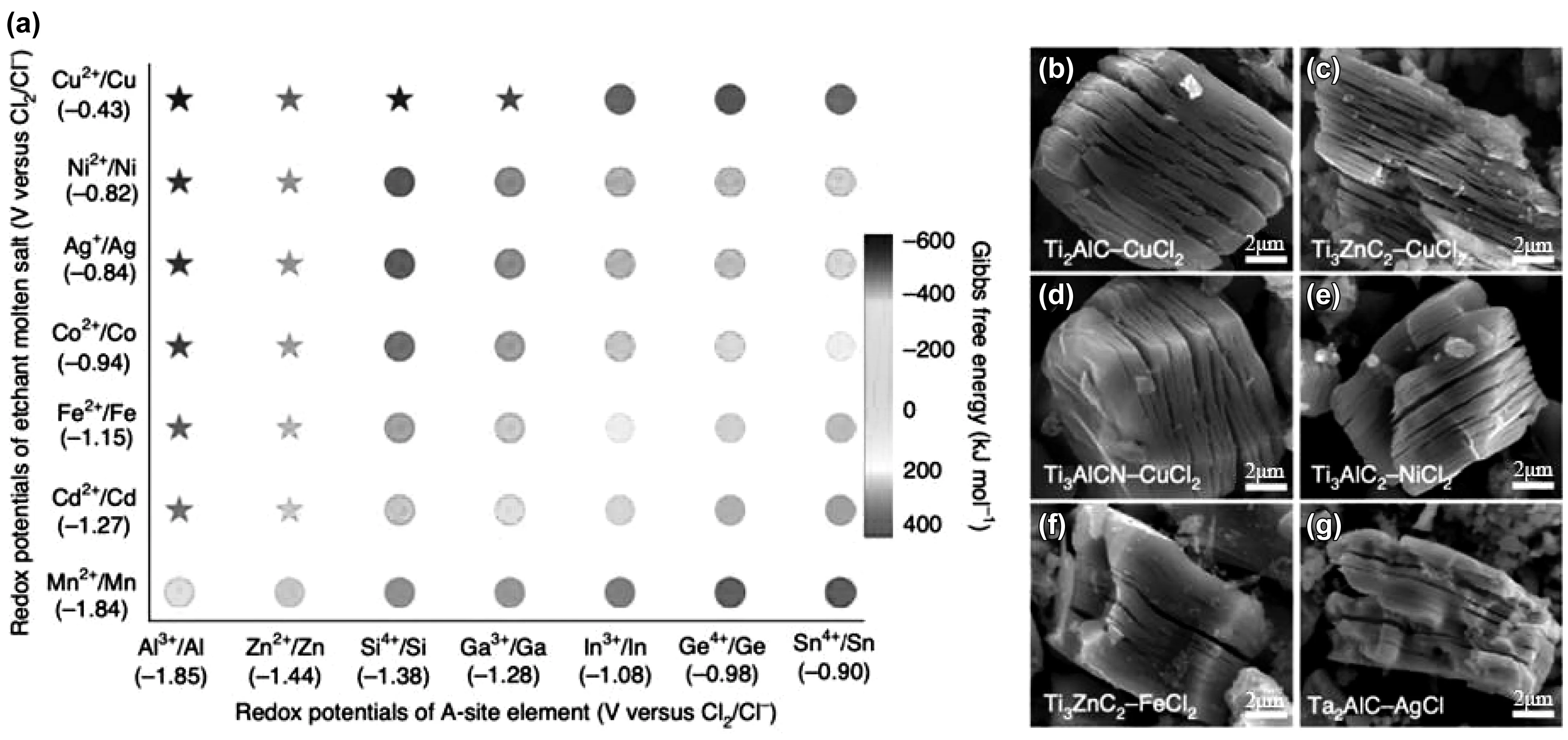
圖5 路易斯酸鹽刻蝕:(a)路易斯酸鹽刻蝕MAX相氧化還原電位,(b)-(g)部分MAX相搭配不同路易斯酸鹽刻蝕結果[23]
此外,Li等通過不同種類的路易斯酸鹽刻蝕Ti3C2TxMXene材料[24],探究了表面化學對儲能性能的影響,文章中通過陽離子均為Cu2+的不同鹵族元素陰離子的路易斯酸鹽刻蝕Ti3AlC2制備了分別帶有-Cl、-Br、-I、-BrI以及-ClBrI官能團的Ti3C2TxMXene材料。
1.4 其他合成方法
上述為主要的MXene相的制備方法,其他合成方法主要包括水熱堿刻蝕法[25]、鋰化-微爆合成法[26]、熱還原法[27]、碘輔助刻蝕法[28]、一鍋刻蝕法[29]等,可以根據自己對實驗樣品的不同需求選擇不同的合成方法。
2 MXene材料儲氫
2.1 理論研究
根據氫與主體材料相互作用的性質,固態存儲材料直觀的可分為兩類:解離氫原子的化學吸附和完整氫分子的物理吸附,兩種方法都有其缺點。對于化學吸附,氫原子與主體材料(主要是金屬氫化物或復雜的化學氫化物)之間的強化學鍵使其難以在中等溫度下釋放氫;對于物理吸附,又十分依賴材料的比表面積和與氫分子的結合能。但是如果采用金屬修飾來提高氫在吸附基上的結合能,通過Kubas吸附作用,使氫與過渡金屬的結合能介于物理吸附和化學吸附之間,從而達到一種理想的狀態。同時一些理論計算研究了金屬修飾物(包括堿金屬和過度金屬)的影響[30],證明了此種方法的可行性,尤其是過渡金屬[31]。
由于存在大量不飽和配位鍵和一定的層間距,MXene材料儲氫可直接應用于儲氫,采用常見的Ti2C模型來闡述其儲氫原理。選擇Ti2C作為MXene的代表是因為鈦是一種常用的修飾元素,已經被證明在碳基材料中有一定的儲氫能力,并且Ti2C具有相當高的單位質量表面積,從而獲得較高的儲氫量。Ti2C是通過去除母體Ti2AlC結構中的Al元素得到的。在層狀Ti2AlC結構中,Ti—Al鍵弱于Ti—C鍵,因此鋁原子層可以被氫氟酸選擇性地蝕刻,從而形成二維Ti2C薄片。隨著Ti—Al鍵的斷裂,Ti2C中所有Ti原子處于不飽和配位狀態,這是金屬原子發生Kubas相互作用的必要條件。二維Ti2C結構由邊緣的Ti6C八面體組成,其中C原子占據了近密集排列的Ti原子之間的八面體間隙位。一塊Ti2C薄片可以簡單地看作是一面涂有Ti原子薄片的石墨烯薄片。
Hu等通過第一性原理構建了Ti2C吸附氫原子和氫氣分子的模型,如圖6和圖7所示系統,研究了其作為儲氫介質的可能性[32]。計算表明,氫可以吸附在Ti2C層狀結構兩側的不同位置,所有被吸附的氫原子和氫氣分子的含量可達8.6%(質量分數),相應的氫吸附值(結合能)分別為1.7%(5.027 eV)、3.4%(0.272eV)和3.4%(0.109eV)。因此,在該環境條件下,由于化學吸附的結合能較高,強化學鍵合的氫原子不能被釋放,而通過物理吸附的氫分子與材料很難結合,只有被Kubas型相互作用束縛的氫才能被吸附和釋放,且結合能為0.272 eV。由此可知,Kubas型相互作用可獲得3.4%(質量分數)的可逆儲氫容量,具有實際應用價值。Wang等同樣基于密度泛函理論的第一性原理,研究了氫在含碳空穴和不含碳空穴的二維Ti2C單分子層上的吸附、解離和擴散[33]。對于端對構型,二維Ti2C單分子層對氫氣的吸附表現出較弱的物理吸附。而對于側位構型,氫氣分子自發解離。如圖8所示,對離解H原子的吸附提出了不同的構型模型。結果表明,兩個H原子都能較好地吸附在中空位置A上。同時進一步研究了氫在單層Ti2C表面和內部的擴散和滲透能力,圖9顯示了相對勢能作為擴散位點的函數。氫原子首先從中空位置A開始,通過勢能為0.54 eV的橋到達中空位置B,然后再次到達中空位置A,并伴隨著0.12 eV的能壘到達碳空位。通過在Ti2C單分子層上引入碳空位,能量勢壘降低到了0.72 eV,該擴散途徑顯示了更好的氫擴散性能。
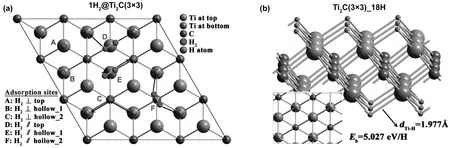
圖6 (a)單個氫分子在Ti2C(3×3)超胞不同位置的吸附(b)Ti2C(3×3)_18H模型[32]
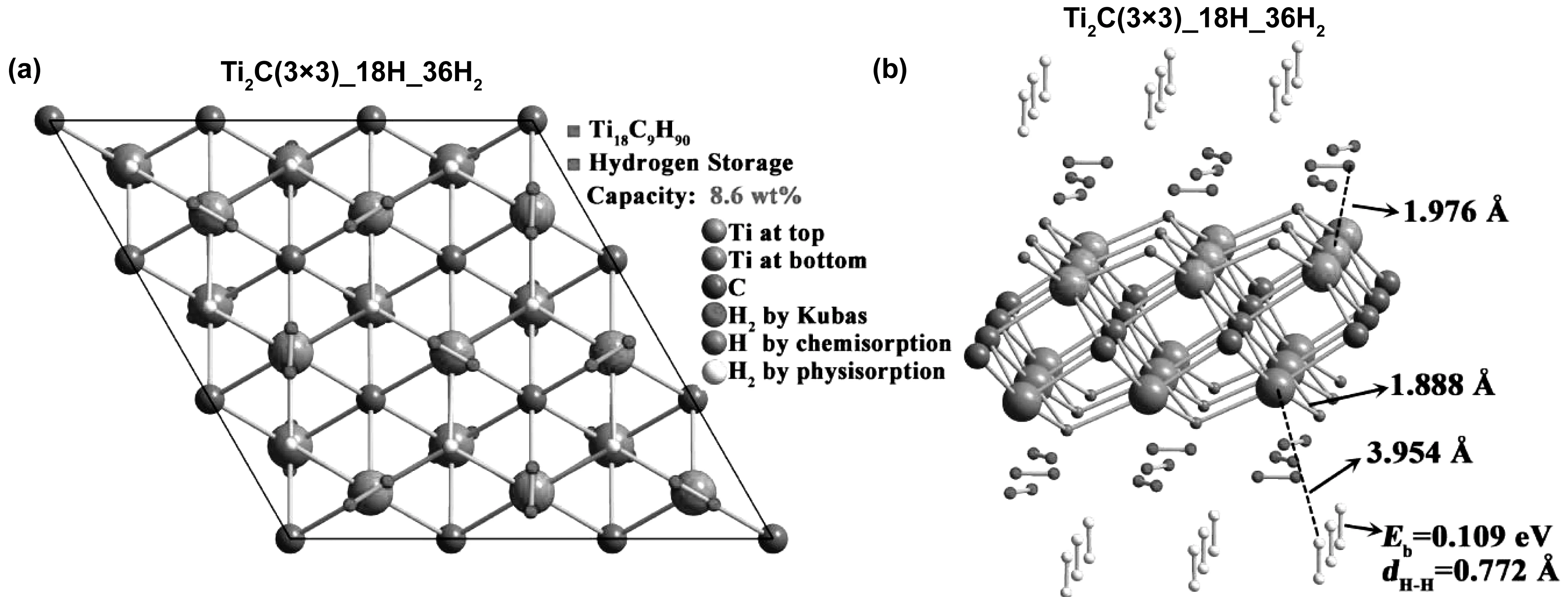
圖7 (a)儲氫容量最大的Ti2C(3×3)_18H_36H2模型的俯視圖和(b)側視圖[32]
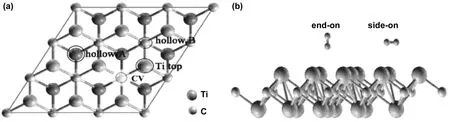
圖8 (a)氫的吸附位點的頂視圖(b)氫的吸附位點的側視圖[33]
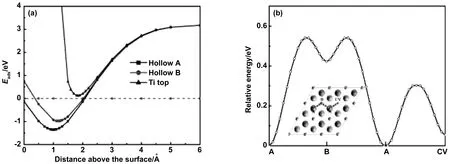
圖9 (a)吸附能是H原子在3個位置的垂直距離的函數(b)勢能路徑是H位置的函數[33]
與Ti2C類似,Hu等利用第一性原理的總能贗勢計算,系統地研究了二維Sc2C相的儲氫原理[34]。考慮到所有吸附的氫分子和原子,計算出儲氫容量為9.0%(質量分數)。同樣這些氫有3種吸附模式:化學吸附的H原子(1.8%(質量分數))、物理吸附的氫氣分子(3.6%(質量分數))和Kubas型吸附的氫氣分子(3.6%(質量分數)),其結合能是4.703、0.087和0.164 eV。然而Santhosh對此提出了疑問,他們認為Hu等計算的Sc2C和Ti2C MXene的氫吸附能比他們自己研究和Wang[33]研究的高得多[35]。氫吸附能的這種差異是由于不同方式來估算氫的總能,并且基于不同的DFT,最終Santhosh認為MXene相與氫氣之間的鍵合作用是弱物理吸附,從而得出Sc2C和Ti2C不適用于實際儲氫應用。Hu為了回答Santhosh,采用第一性原理總能贗勢計算了MXene和含氧基MXene對氫的吸附,除了前文使用的LDA,還使用了GGA作為交換關聯泛函來研究不同函數對氫吸附能的影響。根據氫吸附能的計算結果,認為純MXene(尤其是Ti2C)在比室溫低幾十攝氏度時適合作為儲氫材料,并且氫氣在純Ti2C表面的吸附能力比在含氧基團Ti2C表面要強[36]。
2.2 實驗研究
基于先前多層石墨烯結構的第一性原理計算顯示,兩個納米片之間6~7 nm的狹窄空間可能會產生納米泵效應,以增加層間空間內的氫氣壓力[37]。Liu等根據高角度環形暗場掃描透射電鏡(HAADF-STEM)顯示了兩個相鄰Ti2C薄片的原子圖像,如圖10和11所示,觀察發現從0.68 nm到0.90 nm,隨著層間距離的增加,Ti2C片層不再完全平行,而是呈喇叭形[38]。在有殘余鋁原子的區域附近,層間距離較窄,接近原始值0.68 nm。然而,由于Al的去除和官能團的插入,在標記為ii的遠端區域發生層間膨脹。這種喇叭形為氫氣的進出提供了快速通道,因此相鄰的兩片Ti2C納米片所產生的納米泵效應可以將氫氣引入Ti2CTx薄片中。需要指出的是,Ti2CTx有一個很大的表面積(理論上約230 m2/g)來吸附氫,盡管根據N2和CO2等溫線測量的BET表面積分別只有3.3和10.5m2/g,但這是因為N2或CO2無法進入狹窄的層間空間進行有效測量[39]。這一特性保證了被吸附的氫氣不會被地球大氣中存在的其他氣體(如O2、N2、H2O或CO2)所取代。
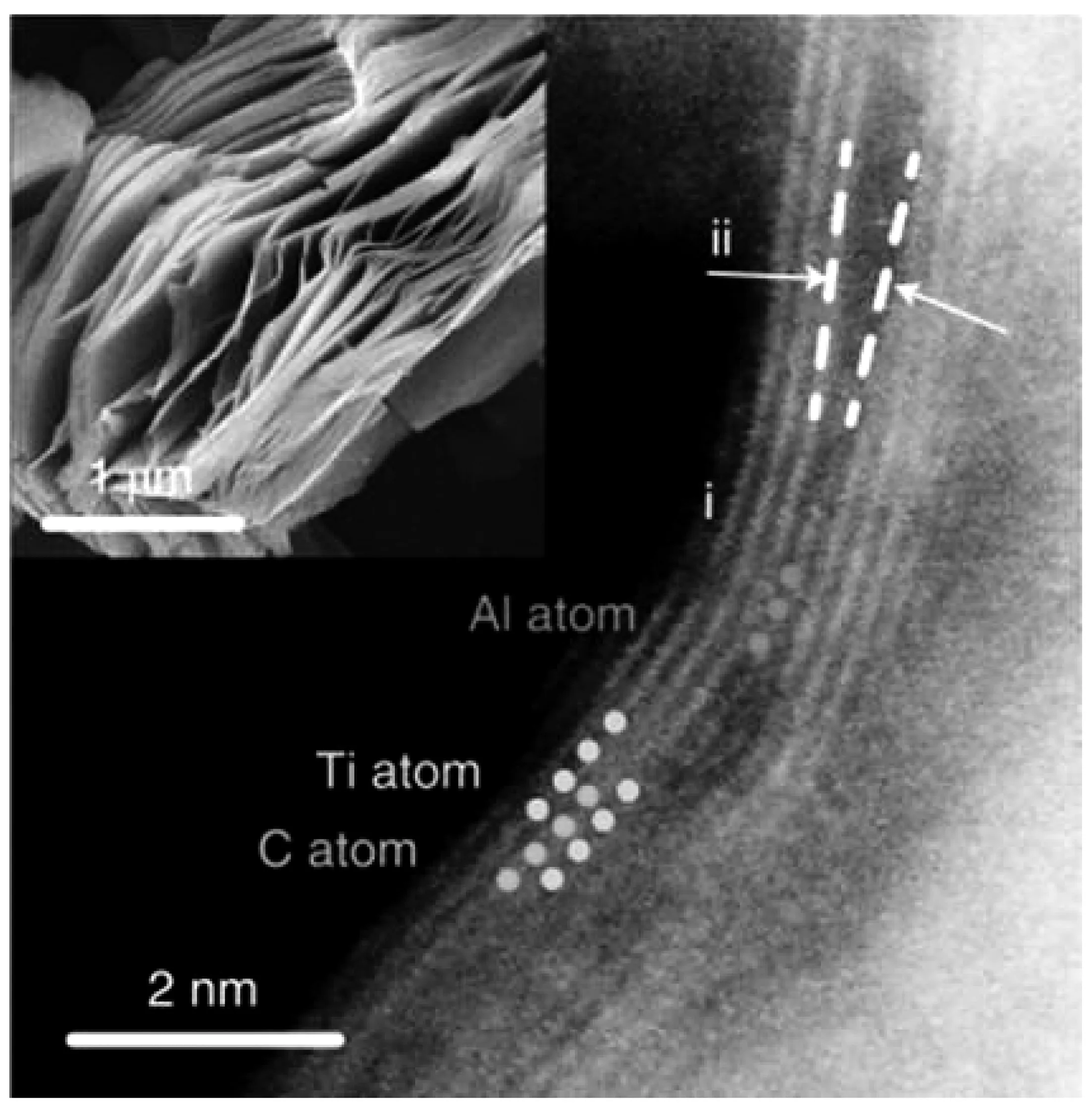
圖10 兩個相鄰的Ti2CTx納米片的HAADF-STEM圖像。插圖為SEM圖像[38]

圖11 多層Ti2CTx的HAADF-STEM圖像[38]
由于Ti2CTx納米片所展示的PCT曲線既不是平臺也不是精確的線性特征,如圖12所示,表明Ti2CTx不通過典型的化學吸附、物理吸附或Kubas型相互作用來儲氫。由于單層的Ti2CTx納米片幾乎沒有氫氣的儲存,說明多層結構對氫氣的儲存的必不可少的。而且后續的對比實驗說明了不同的層間距具有不同的吸氫量,證實了納米泵效應對MXene的層間距離非常敏感。除了層間距影響儲氫性能以外,另一方面就是官能團。同樣地,通過制備不含F和不含O的Ti2CTx來進行對比,結果發現F官能團是穩定的,負責Ti2CTx中可逆儲氫,而O官能團則主要負責Ti2CTx中不可逆儲氫。因此得出結論,窄的層間距離和F官能團是Ti2CTx儲氫的關鍵結構參數,它們誘導了納米效應輔助的弱化學吸附,在Ti2CTx片層間產生適當的相互作用,從而在近環境條件下使大量氫氣可逆地存儲在Ti2CTx片層間空間內。
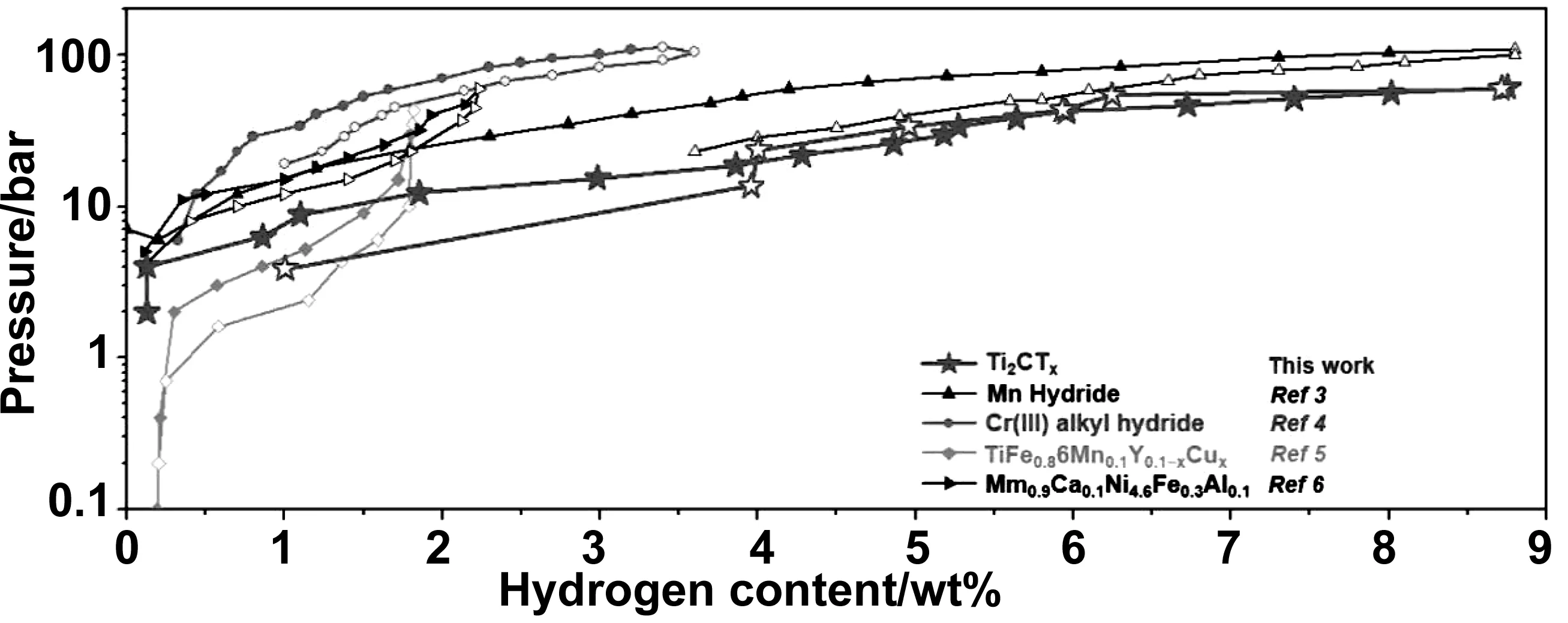
圖12 Ti2CTx和一些具有代表性的室溫儲氫材料的PCT曲線[38]
3 MXene材料用于儲氫材料改性
3.1 MgH2改性
雖然MXene自己本身可以儲氫,但更多的還是作為催化劑,目前常用的就是作為MgH2的催化劑。Li等通過在MgH2中添加Ti2C,發現了2D Ti2C MXene對MgH2脫氫具有良好的催化效果[40]。與純MgH2相比,MgH2-5%(質量分數)Ti2C的起始脫氫溫度、表觀活化能(Ea)和總焓變(ΔH)分別降低了37 ℃、36.5%和11%。與Ti2C類似,含有5%(質量分數)Ti3C2的MgH2起始脫氫溫度相比原始樣品降低了93 ℃,并且脫氫樣品可以在室溫下開始吸氫,在150 ℃下30 s內就可吸入6.2%(質量分數)的氫氣[41],如圖13所示。獨特的層狀結構和原位形成的金屬Ti可能是Ti3C2高催化活性的最重要原因。
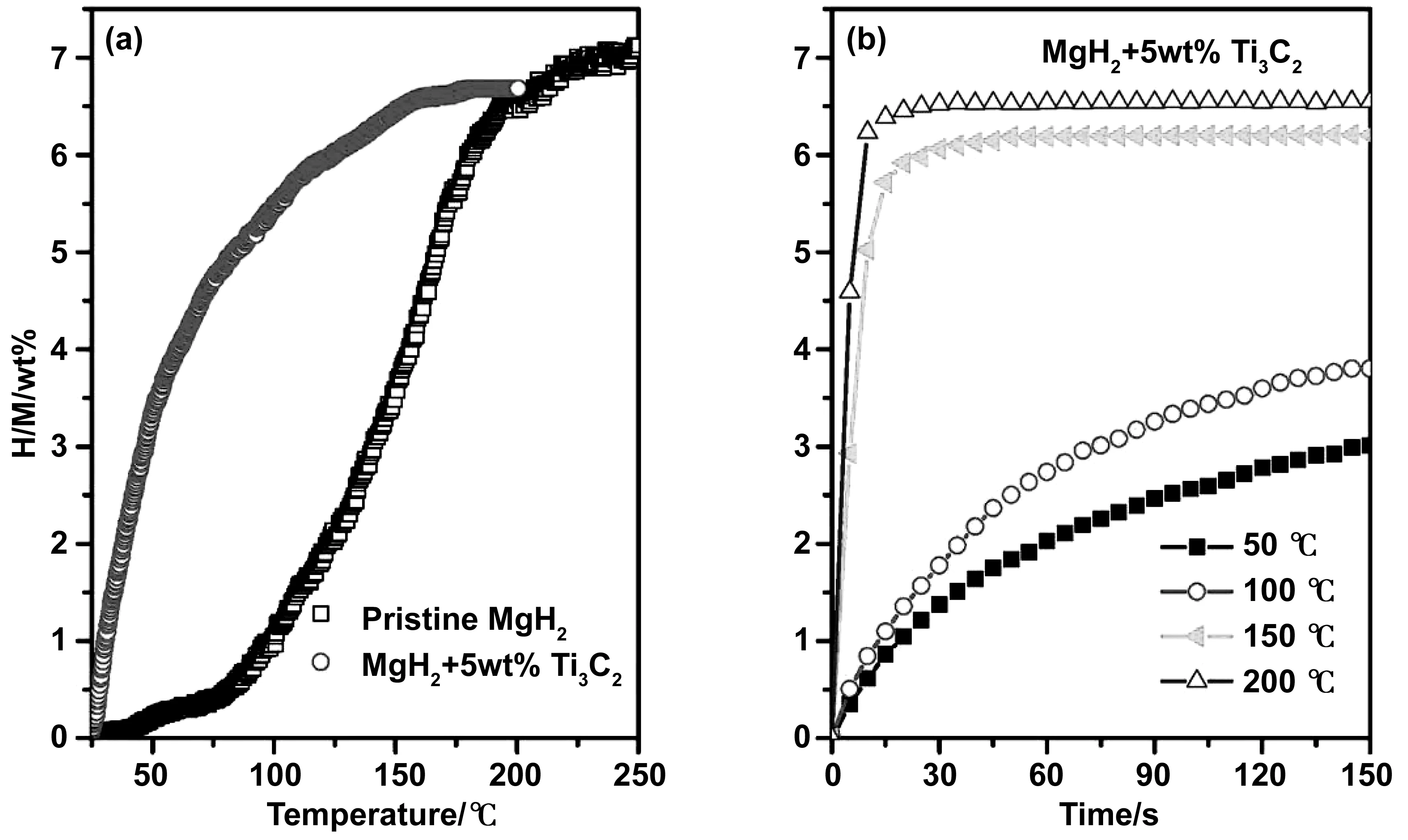
圖13 脫氫MgH2-5wt% Ti3C2樣品的非等溫(a)和等溫(b)加氫曲線[41]
除了Ti-C組成的MXene以外,還有一些其他MXene材料被證實對脫氫熱力學有一定的改善作用。Shen等通過剝離固溶MAX相(Ti0.5V0.5)3AlC2,成功合成了一種新型固溶MXene(Ti0.5V0.5)3C2[42]。實驗結果表明,加入少量的(Ti0.5V0.5)3C2可顯著降低Mg吸放氫的操作溫度,提高儲氫可逆性。如圖14所示,MgH2-10%(質量分數)(Ti0.5V0.5)3C2樣品在210 ℃解吸氫時表現出最佳的儲氫性能,與原始樣品相比降低了70 ℃。在120 ℃條件下,含10%(質量分數)(Ti0.5V0.5)3C2脫氫后的樣品 5 s內吸收了約4.8%(質量分數)的氫,與原始樣品相比有顯著提高。更重要的是,含(Ti0.5V0.5)3C2的樣品在循環10次后,有效氫容量保持在6.5%(質量分數),且具有良好的循環穩定性。Liu等將化學剝離法制備得到的二維Nb4C3Tx(MXene)摻入MgH2中,改善了MgH2的儲氫性能[43]。活化的MgH2-5%(質量分數)Nb4C3Tx復合材料的脫氫起始溫度從296.5 ℃(純MgH2)降低到了150.6 ℃,在250 ℃下800內完全釋放,并且脫氫后的樣品可以在溫度低至50 ℃時在2內吸收大約3.5%(質量分數)的氫氣。
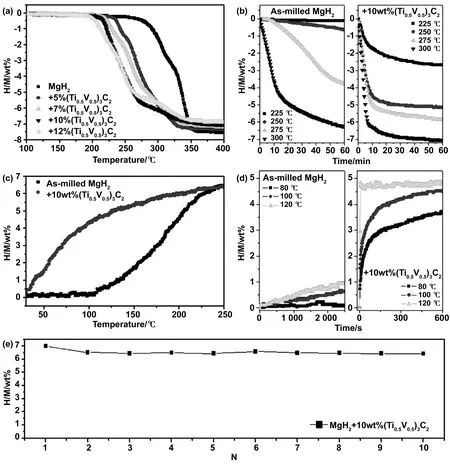
圖14 (a)MgH2-x%(質量分數)(Ti0.5V0.5)3C2樣品的體積釋放曲線;(b)MgH2和MgH2-10%(質量分數)(Ti0.5V0.5)3C2樣品的等溫脫氫曲線;脫氫MgH2和MgH2-10wt%(Ti0.5V0.5)3C2樣品的非等溫(c)和等溫(d)加氫曲線;(e)MgH2-10%(質量分數)(Ti0.5V0.5)3C2樣品的循環穩定性[42]
不僅是純MXene相,Zhu等發現了一種新型的Ti3C2MXene基催化劑(Ni@Ti-MX)催化效果顯著[44]。該催化劑是通過在脫落的Ti3C2納米片表面自組裝Ni納米顆粒來制備的,通過球磨將所合成的Ni@Ti-MX催化劑引入MgH2中,該催化劑的特點是超分散的Ni納米粒子被固定在單層Ti3C2薄片上。TEM測試結果表明,MgH2+Ni@Ti-MX復合材料中產生多相組分(Mg2Ni、TiO2、金屬Ti等)的協同催化作用顯著改善了MgH2的吸氫動力學。其中,MgH2+Ni@Ti-MX復合材料在125 ℃下25 s吸收氫氣可達5.4%(質量分數),在250 ℃下15 min釋放5.2%(質量分數)。最重要的是,即使在室溫下5 h也能吸收4%(質量分數)。MgH2+Ni@Ti-MX復合材料的脫氫峰溫度約為221 ℃,分別比MgH2+Ti-MX和純MgH2低50 ℃和122 ℃。MgH2+Ni@Ti-MX復合材料之所以具有優異的吸氫性能,主要歸因于其核殼納米結構的MgH2@Mg2NiH4雜化材料以及不同催化劑基體界面的界面耦合效應,如圖15所示。界面區域顯示為紅色,藍色粒子為Mg2Ni/Mg2NiH4相,黃色區域為MgH2基體,棕色粒子為TiO2相,綠色粒子為氫原子或分子。與氫誘導在Mg-Zr界面產生耦合效應導致Mg-Zr-H復合材料在低溫下具有快速吸氫動力學能力類似[45],多組分體系可以通過Mg-Ti-H體系產生這種界面耦合效應,從而為氫在Mg/MgH2界面的易解離和遷移提供額外的通道[46]。再加上氫化域區周圍彈性約束區的發展,兩相之間的晶格錯配可以強烈地影響相變過程,這些彈性約束區通過降低動能勢壘,對促進氫化物/金屬成核速率極為重要。因此,可以認為具有不同界面邊界的多相MgH2+Ni@Ti-MX體系通過提供足夠數量的活性催化位點和在低溫下加速氫擴散的不間斷通道,從而增強了氫吸附動力學。另外,Mg2Ni/Mg2NiH4體系的“氫泵”效應也不容忽視,從圖15可以看出,這種“氫泵”效應為氫的快速擴散提供了額外的通道。
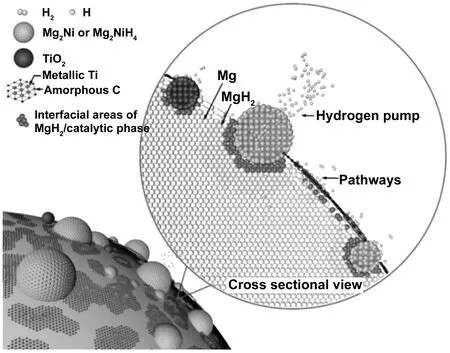
圖15 在MgH2+Ni@Ti-MX體系中,MgH2通過多相界面快速吸氫/解吸機理示意圖[44]
除此以外,Huang等在通過摻雜分散在單層MXene上的MOF衍生Ni納米顆粒來改善MgH2儲氫動力學時也發現了這種氫泵效應[47]。XRD和TEM分析表明,Ni在Mg2Ni和Mg2NiH4之間相互相變,使得MgH2/Mg更容易釋放和吸收氫。XPS和TEM分析表明,在連續的球磨、脫氫和再加氫過程中,MXene的含鈦物種逐漸轉變為Ti0,形成的Ti0保持穩定狀態,沒有發生相或價的變化。通過DFT計算揭示了原位形成的Ti0有利于Mg2Ni/Mg2NiH4相互轉化。因此,結合實驗表征和理論分析可知,Ti0對Mg2Ni/Mg2NiH4的協同效應有助于改善MgH2的動力學和循環穩定性。通過利用含Ti功能載體負載Ni納米粒子作為雙金屬催化劑以及Ti在Mg2Ni/Mg2NiH4氫泵中的協同效應,為改善Mg基材料的儲氫性能開辟了新的途徑。
3.2 NaAlH4改性
具有高重量和體積氫容量的絡合氫化物是最有希望滿足實際應用容量要求的氫化物[48],NaAlH4可以算是已知的輕金屬配位鋁氫化物中最能滿足實際應用的儲氫材料[49]。目前已經提出了一些可行的策略來調整NaAlH4中儲氫的熱力學和動力學性質,例如摻雜催化劑[50]、創造活性復合材料[51]、納米細化[52]。大量研究證明,催化劑摻雜是解決NaAlH4脫氫和再加載動力學問題最有效的方法之一。Bogdanovic等在催化反應的基礎上,提出了一種新的可逆儲氫體系,就是在堿金屬鋁氫化物中摻雜少量的Ti化合物來實現兩個方向上的催化加速[50]。
Wu等首次將2D Ti3C2MXene引入NaAlH4中,改善其儲氫性能[53]。Ti3C2的存在顯著降低了NaAlH4儲氫的操作溫度,氫化/脫氫動力學顯著增強。如圖16所示,含7%(質量分數)Ti3C2的NaAlH4樣品的脫氫起始溫度降至100 ℃,并且從50 ℃開始吸氫。在140 ℃下,NaAlH4-7% Ti3C2樣品在100 min內釋放出約4.7%(質量分數)的氫氣,在120 ℃下,脫氫樣品在60 min內吸收4.6%的氫。然而在相同的條件下,原始NaAlH4只吸收0.4%的氫氣。進一步的循環測量表明,含Ti3C2的NaAlH4的循環穩定性顯著提高,加氫/脫氫反應在10個循環后幾乎保持不變。Yuan等成功地合成了二維Ti3C2(C@TiO2/Ti3C2)負載的新型碳包覆二氧化鈦,并研究了其對NaAlH4脫氫行為的影響[54]。如圖17所示,加入C@TiO2/Ti3C2的NaAlH4的脫氫起始溫度降低到85 ℃,與原始NaAlH4相比降低了70 ℃,在第一個循環加熱到200 ℃時,氫氣的解吸能力約為4.97%。更重要的是,在140 ℃條件下,在13 min內快速釋放出4.0%(質量分數)以上的氫氣,在110 ℃條件下,在35 min內完成了第一階段脫氫。此外,所制備的樣品表現出良好的循環性能,在10次循環后,氫氣的容量保持在4.6%(質量分數),容量保留率為92.6%。
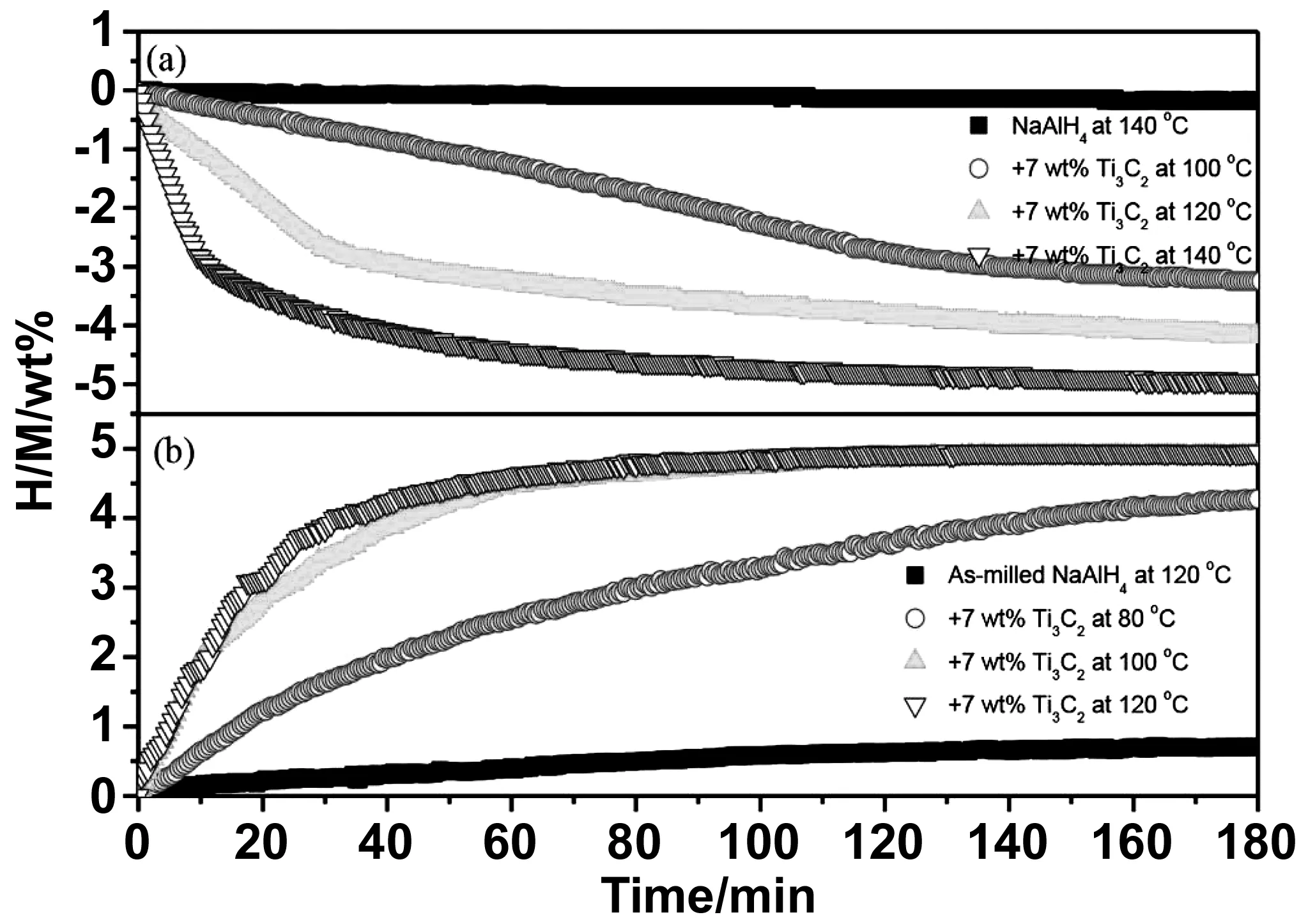
圖16 原始NaAlH4和NaAlH4-7%(質量分數)Ti3C2樣品在不同溫度下的等溫脫氫(a)和氫化(b)曲線[53]

圖17 (a)TPD曲線(b)100 ℃下的脫氫等溫曲線(c)不同溫度下的脫氫等溫曲線(d)不同循環下的TPD曲線[54]
為了闡明其催化機理,Fan等采用XRD測試了NaAlH4+10%(質量分數)MXene/A-TiO2的球磨、脫氫和再氫化樣品[55]。由圖18 可知,球磨樣品由NaAlH4、Na3AlH6、Al、TiH2、TiC組成,說明MXene/A-TiO2在球磨過程中向TiC和TiH2轉移。為了分析TiC與TiH2之間的相互作用,測試了NaAlH4+(9%(質量分數)TiH2+1%(質量分數)TiC)的脫氫性能。如圖19所示,與TiC和TiH2相比,9%(質量分數)TiH2+1%(質量分數)TiC添加劑表現出更好的催化性能,說明TiC和TiH2之間存在協同作用。類似地,CeF3/Ti3C2復合材料中Ti0與Ti-F-Ce結構之間同樣也具有協同效應,并且顯著增強了NaAlH4的儲氫性能[56]。
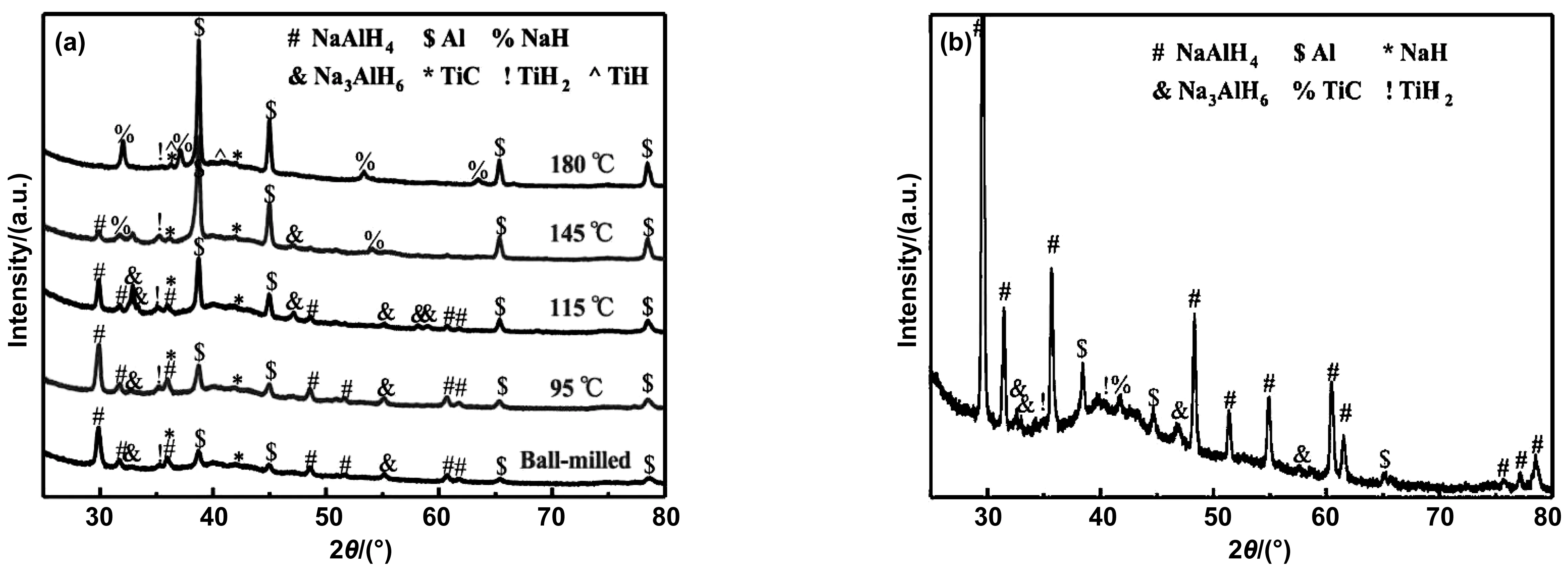
圖18 (a)不同溫度下TPD后的XRD譜圖(b)TPD后再加氫的XRD譜圖[55]
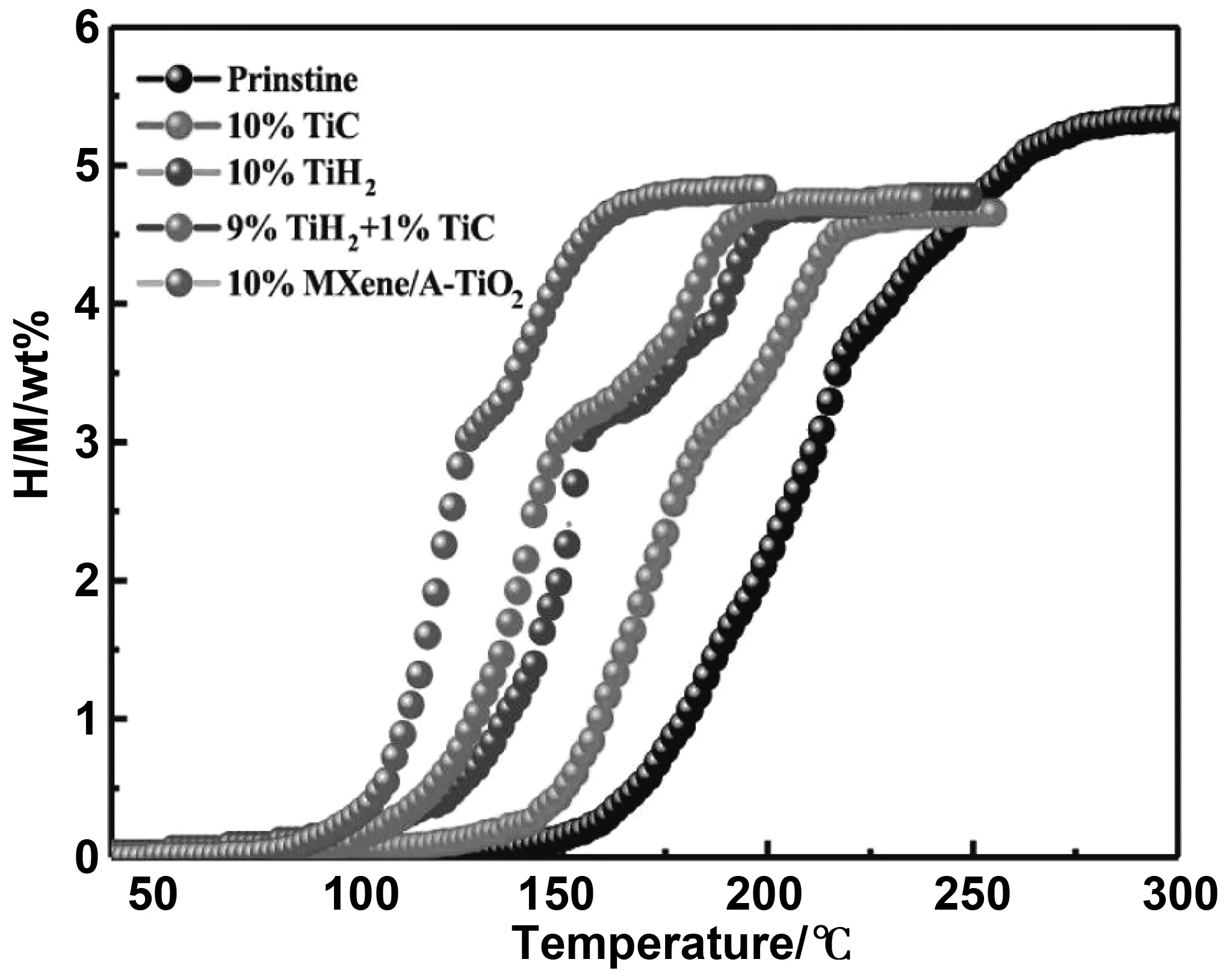
圖19 NaAlH4在不同添加劑作用下的TPD曲線[55]
與上述MgH2的氫泵效應類似,通過XRD、FTIR和XPS測試,我們推測Ti3C2在與NaH/Al球磨過程中生成了單質Ti和TiFx納米團簇,這可能就是實際的催化物質[57]。這些小顆粒的Ti和TiFx納米團簇均勻分布在球磨產物的表面,為吸放氫提供了快速通道,從而大大提高了NaAlH4的儲氫性能,如圖20所示。這些事實解釋了Ti3C2摻雜的NaH/Al復合材料具有優異的儲氫性能的原因。
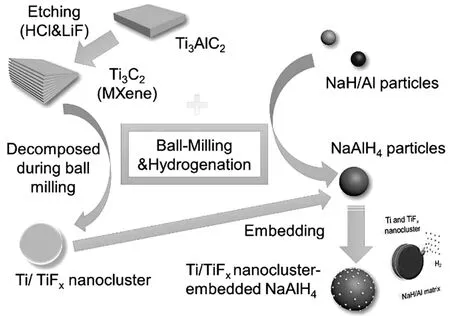
圖20 摻雜Ti3C2的NaH/Al復合材料示意圖[57]
3.3 其他材料改性
除了Mg基、Na基材料以外,Li基材料同樣可以用做儲氫材料[58]。Zang等采用簡單的浸漬方法將LiBH4加入到Ti3C2的層狀結構中,合成了LiBH4@Ti3C2雜化體[59]。LiBH4@Ti3C2雜化產物的初始解吸溫度降至172.6 ℃,與純LiBH4相比明顯降低。同時,這種樣品表現出良好的脫附動力學,在380 ℃下1h內從LiBH4中脫附出9.6%(質量分數)的氫氣,活化能與純LiBH4相比降低了約50%。從機理上看,納米LiBH4的儲氫性能的提高是由于局限于獨特的Ti3C2層狀結構的納米LiBH4和含鈦缺陷位點引起的失穩活性的協同作用。同樣的,Fan等在使用Ti3C2MXene提高LiBH4儲氫性能的時候也得到了類似的結論[60]。除了單一材料的改性,MXene還可以用于兩種材料混合物的改性。例如2LiH和MgB2,由于2LiH+MgB2/2LiBH4+MgH2反應性氫化物體系理論儲氫容量大,是一種極具潛力的儲氫材料[61]。但整個體系脫氫/氫化動力學緩慢,循環穩定性差。因此通過球磨將二維MXene Ti3C2加入到2LiH+MgB2混合物中,在400 ℃下,20 min內最多釋放9.0%(質量分數)的氫氣。究其機理是因為加入的2D Ti3C2不僅導致了在球磨和初始氫化過程中原位形成的超細的和分散性好的納米TiB2,為MgB2的脫氫產物提供了非均相成核位點,同時也有助于在球磨過程中降低體系的粒徑。因此,它們的協同作用顯著提高了儲氫動力學和體系的可逆性。進一步研究表明,將二維層狀Ti3C2摻入4MgH2-LiAlH4復合材料中,4MgH2-LiAlH4-Ti3C2復合材料的脫氫起始溫度比4MgH2-LiAlH4和MgH2的脫氫起始溫度分別降低64和274 ℃[62],如圖21所示。并且脫氫活化能由4MgH2-LiAlH4的176.2 kJ/mol降低到了47.8 kJ/mol。其機理也可以解釋為Ti3C2在球磨過程中部分分解,在脫氫過程中完全轉化為金屬Ti和C,TiH1.942的析出表明原位形成的Ti應與4MgH2-LiAlH4體系發生反應,使體系輕微失穩。
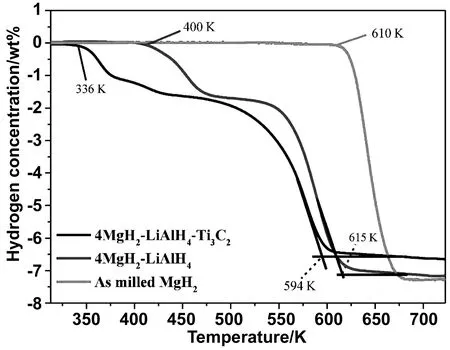
圖21 4MgH2-LiAlH4-Ti3C2、4MgH2-LiAlH4和MgH2的釋放曲線[62]
4 結 論
主要闡述了MXene對材料儲氫方面性能提升的研究,MXene的發展促進了儲氫材料的變革。若直接用于儲氫,則氫原子和氫氣分子在MXene表面的相互作用是通過多種途徑來獲得最佳氫吸附,同時MXene上的官能團和摻雜的金屬對氫的吸附性能同樣起著至關重要的作用。再加上其二維的特性,不同的層間距對氫原子的吸附能力也大不相同。若添加MXene對傳統儲氫材料進行改性,則可以實現大容量的儲氫和可逆的儲氫,這種性能的顯著提升證明了MXene在儲氫應用方面具有相當大的優勢。由于目前第一性原理的理論計算大多都是Ti-C元素組成的MXene,因此可以嘗試對其他MXene相進行理論計算,尋找是否存在性能更好的材料。同時制備的方法也可以進行改進,甚至可以摻雜其他金屬以改善對氫的吸附能力。由此可見,MXene還有很大的發展空間,是未來儲氫技術的理想選擇。

