耐低溫降解纖維素菌株的篩選及復合菌系構建
路垚 劉雅輝 孫建平 何宗均 趙琳娜 戴相林 趙子婧

摘要 [目的]篩選適合我國北方冬春季秸稈降解的高效低溫纖維素降解菌株。[方法]在低溫地區采集土壤,10 ℃初篩耐低溫菌株,通過剛果紅染色液法進行復篩,利用DNS法測定CMC酶活性。將篩得菌株和實驗室自存菌株結合拮抗試驗構建復合菌系,測定復合菌系CMC酶活性,測定秸稈降解率,并對代表性菌株進行產酶條件優化,對最終確定的復合菌系中的菌株進行分子生物學鑒定。[結果]10 ℃低溫培養初篩得到55株耐低溫菌株,剛果紅染色法復篩得到8株具有明顯水解圈的單菌株,其中包括細菌3株、真菌2株、放線菌3株,其中纖維素酶活性最高達到47.0 U/mL;根據拮抗試驗構建了2個復合菌系,其纖維素酶活性分別達到31.0和53.0 U/mL;秸稈降解試驗中,實驗室和沙袋法的復合菌系2對秸稈的降解率分別達31.8%和45.1%,顯著高于復合菌系1和對照組;對JGDZTX3進行產酶條件優化,確定最佳氮源為牛肉膏,培養溫度為10 ℃,培養時間為4 d,初始pH為7,在此條件下CMC酶活性達到66.5 U/mL,這4個條件對產酶均有顯著影響(P<0.05);對復合菌系2的4個未知菌株進行鑒定,鑒定結果分別為白蟻菌、葡萄球菌、長柄木霉、芬萊氏鏈霉菌。[結論]通過該試驗篩選得到的耐低溫可降解纖維素復合菌系有較強的纖維素分解能力,在北方低溫地區有良好的應用前景。
關鍵詞 纖維素降解菌;復合菌系;低溫;纖維素酶;篩選;菌株鑒定
中圖分類號 S182? 文獻標識碼 A? 文章編號 0517-6611(2022)10-0006-05
doi:10.3969/j.issn.0517-6611.2022.10.002
Screening of Low Temperature Cellulose Degradation Strains and Construction of Complex Microbial System
LU Yao1,LIU Ya-hui2,SUN Jian-ping2 et al
(1.Institute of Agricultural Resources and Environment Sciences,Tianjin Academy of Agricultural Sciences,Tianjin 300384;2.Institute of Coastal Agriculture, Hebei Academy of Agriculture and Forestry Sciences,Tangshan,Hebei 063299)
Abstract [Objective] In order to screen the high efficiency low temperature cellulose degradation strains suitable for winter and spring straw degradation in north China. [Method]Soil samples were collected in low temperature area, low temperature strains were screened at 10 ℃, the isolated strains were screened by Congo red staining solution, and CMC enzyme activity was determined by DNS method. The complex microbial system was constructed by combining the screened strain and the laboratory self-existing strain with antagonistic test. CMC enzyme activity of the complex microbial system was determined, and the straw degradation rate was determined. The enzyme production conditions of the representative strain was optimized, and the strains in the final determined complex microbial system were identified by molecular biology. [Result]A total of 55 low temperature strains were obtained by initial screening at 10 ℃, and 8 strains were obtained by Congo red staining after screening, including 3 strains of bacteria, 2 strains of fungi and 3 strains of actinomycetes with obvious hydrolytic circles. The highest cellulase activity reached 47.0 U/mL. According to the antagonistic test, the cellulase activity of two complex microbial systems reached 31.0 and 53.0 U/mL, respectively. In the straw degradation test, the degradation rates of the compound strain 2 in the laboratory and the sandbag method were 31.8% and 45.1%, respectively, which were significantly higher than those of the compound strain 1 and the control group.The optimum conditions for JGDZTX3 enzyme production were optimized, and the optimal nitrogen source was beef paste, culture temperature was 10 ℃, culture time was 4 d, and initial pH was 7. Under the optimum conditions, CMC enzyme activity reached 66.5 U/mL ,all the four conditions had significant effects on enzyme production (P< 0.05).The four unknown strains of the complex microbial system were identified, and the identification results were Isoptericola sp., Staphylococcus sp., Trichoderma longibrachiatum and Streptomyces finlayi.[Conclusion]The low temperature cellulose-degradable complex microbial system screened by this experiment has strong cellulose-decomposing ability, and has a good application prospect in the low temperature area of north China.
Key words Cellulose degradation strains;Complex microbial system;Low temperature;Cellulase;Screening;Strain identification
基金項目 河北省省級科技計劃項目(19227307D);天津市農業科技成果轉化與推廣項目(201701090)。
作者簡介 路垚(1989—),女,山東臨沂人,助理研究員,碩士,從事農業微生物研究。通信作者,副研究員,從事農業微生物研究。
收稿日期 2021-12-06;修回日期 2022-01-18
我國有大量秸稈,每年各類秸稈產生量高達8 億t,如果能合理利用,將會是很重要的生物資源[1-2]。秸稈的資源化處理有多種方式,其中微生物降解的方法具有安全性高、能耗低等優點被廣泛應用[3]。但是自然條件下土壤中纖維素分解菌的數量較少,降解效率低,秸稈直接還田后不能被快速分解,因此通常人工添加一些纖維素分解菌加快秸稈的腐解[4-5]。已發現的纖維素分解菌有很多種,涵蓋了細菌、真菌、放線菌等各類菌株[6],國內外也有很多人在自然界中進行了纖維素分解菌菌株的篩選和應用。
鄭麗等[7]在木薯生境里分離篩選得到57株纖維素分解菌株;姜立春等[8]從綿陽濕地朽木和土樣中,篩選得到28株產纖維素酶的細菌菌株;趙旭等[9]在土壤中篩選的Penicillium sp.D5菌株,以玉米秸稈為碳源發酵10 d,可使玉米秸稈減重29.8%;Selvam等[10]研究表明纖維素降解是菌株間相互協同作用產生的結果;王天生等[11]研究發現復合菌系的纖維素分解能力好于單一菌株;王垚等[12]研究表明 H57.1 和 H08.1菌株復合后具有較高的秸稈分解能力,其秸稈降解率可達到55.7%。
微生物降解受環境影響較大,很多纖維素分解菌在低溫環境下不能生長代謝,不能正常發揮降解作用。我國北方地區冬春季溫度低,常溫條件下篩選的纖維素分解菌難以發揮作用。目前,對纖維素分解菌的研究主要集中在常溫環境的篩選,對低溫環境下纖維素分解菌的研究相對較少[13-14]。該研究通過從河北濱海區低溫土壤中分離篩選纖維素酶活性較高的菌株,構建復合菌系,以期為北方低溫地區秸稈的資源化利用提供菌種資源。
1 材料與方法
1.1 樣品和培養基
1.1.1 樣品來源。
河北省唐山市曹妃甸區河北省農林科學院研究基地土樣,分別為水稻田秸稈還田2年土、水稻田秸稈還田3年土、水稻秸稈還田咸水土、秸稈堆置土。存放于自封袋中,封口,于4 ℃保存備用。
1.1.2 培養基。
(1)CMC分離培養基。CMC-Na 10 g,(NH4)2SO4 4 g,K2HPO4 1 g,MgSO4·7H2O 0.5 g,KH2PO4 1 g,蛋白胨1 g,酵母膏1 g,H2O 1 000 mL,pH 7.0~7.2。
(2)種子培養基。(NH4)2SO4 3.0 g,KH2PO4 1.0 g,FeSO4·7H2O 5.0 mg,MnSO4·H2O 1.6 mg,CaCl2 0.1 g,ZnSO4·7H2O 1.7 mg,MgSO4·7H2O 0.5 g,CoCl2 2.0 mg,NaCl 0.1 g,葡萄糖 20 g,蛋白胨5 g,酵母膏1 g,H2O 1 000 mL,pH 7.0~7.2。
(3)牛肉膏蛋白胨培養基。牛肉膏5 g,蛋白胨10 g,NaCl 5 g,瓊脂15~20 g,H2O 1 000 mL,pH 7.0~7.2。
(4)PDA培養基。馬鈴薯200 g,葡萄糖20 g,瓊脂15~20 g,H2O 1 000 mL,pH自然。
(5)高氏一號培養基。可溶性淀粉20 g,KNO3 1 g,MgSO4·7H2O 0.5 g,K2HPO4 0.5 g,FeSO4·7H2O 0.01 g,NaCl 0.5 g,瓊脂 20 g,H2O 1 000 mL,pH 7.4~7.6。
(6)秸稈降解培養基。秸稈3 g,CMC-Na 10 g,(NH4)2SO4 4 g,K2HPO4 1 g,MgSO4· 7H2O 0.5 g,KH2PO4 1 g,蛋白胨1 g,酵母膏1 g,H2O 1 000 mL,pH 7.0~7.2。
1.2 菌株分離篩選
1.2.1 菌株的初篩。
將采集到的土壤樣品用無菌水制成10-4、10-5、10-6稀釋度的菌懸液,在CMC培養基上涂布,放置生化培養箱10 ℃培養5 d。將初篩得到的菌株在固體平板上分別編號,并分別劃線純化,然后每個平板倒入15 mL剛果紅溶液(1 mL/mg)染色30 min,用1 mol/L氯化鈉溶液脫色2~3次,只保留有透明圈的對應標號菌株,將得到的細菌保存至牛肉膏蛋白胨試管斜面培養基,真菌保存至 PDA 試管斜面培養基,放線菌存放至高氏一號試管斜面培養基,放置 4 ℃冰箱保存。
1.2.2 菌株的復篩。
將保存的菌株接種于CMC培養基,放至搖床10 ℃恒溫振蕩培養5 d,在CMC固體平板上放置牛津杯,在牛津杯中加入100? μL菌液,10 ℃恒溫培養箱培養5 d,取出牛津杯,測量菌落直徑(d),每個平板倒入15 mL 剛果紅溶液(1 mL/mg)染色30 min,然后用 1 mol/L氯化鈉溶液清洗脫色 2~3次,測量透明圈的直徑(D),每個菌株做3個重復。
1.3 DNS法測定酶活
1.3.1 原樣酶液的制備。
將待測菌株接種到種子培養基,10 ℃恒溫振蕩培養3 d,轉接至CMC分離培養基培養5 d,取菌液10 mL,3 000 r/min離心10 min,離心后的上清液即為原樣酶液,供測試用。
1.3.2 測定步驟。
每個樣品取2支大試管,1支作為空白對照。樣品管中加1.0 mL原樣酶液,然后2支試管中分別加入4.0 mL已預熱至60 ℃的CMC緩沖液,在60 ℃的水浴鍋中反應20 min取出,每管立即加入3.0 mL DNS顯色液,搖勻后在對照管中再加入1.0 mL原樣酶液。將2支試管放入沸水浴中,顯色5 min后立即取出,流水冷卻,用分光光度計于490 nm處測其OD值,與標準葡萄糖曲線對照,計算出樣品和對照的葡萄糖量,通過公式計算酶活性:U=k(m1-m0)/20,式中,U為樣品的酶活,1個酶活單位代表1 mL原樣酶液1 min產生1 μg葡萄糖;k為樣品稀釋倍數;m1為樣品葡萄糖量;m0為對照葡萄糖量;20為酶與底物反應時間。
1.4 耐低溫復合菌系的構建
將篩選得到的菌株與天津市農業科學院農業資源與環境研究所土壤微生物研究室自存可低溫降解纖維素的菌株(枯草芽孢桿菌KC、膠胨樣芽孢桿菌GSY),根據細菌、真菌、放線菌的合理搭配以及各菌株間的拮抗作用,構建2組復合菌系。
1.5 實驗室秸稈降解率測定
在250 mL三角瓶中加入90 mL秸稈降解培養基,玉米秸稈的處理方法為粉碎過40目篩,50 ℃烘干至恒重,滅菌后,2個試驗組每個三角瓶中加入10 mL復合菌劑,對照組加入10 mL滅菌蒸餾水,10 ℃恒溫振蕩培養,15 d后用濾紙過濾收集秸稈,用蒸餾水清洗3次,80 ℃烘干至恒重,計算失重率,每個處理設置3次重復。
1.6 沙袋法秸稈降解率測定
試驗在2019年11—12月進行,開始前先稱取3份1 kg的秸稈,切割成3~5 cm 段狀,85 ℃烘干至恒重并稱量記錄。稱取1 kg秸稈,切割成3~5 cm 段狀,試驗組加入10 mL復合菌劑混合均勻,對照組加入10 mL滅菌蒸餾水,裝入長110 cm、寬60 cm、孔徑為0.18 mm的尼龍袋中,埋入土壤25~35 cm的土層中,溫度6~10 ℃,60 d后取出尼龍袋,用自來水將秸稈沖洗干凈,然后85 ℃烘干至恒重并稱量記錄。計算失重率,每個處理設置3次重復。
1.7 菌株的產酶條件優化
選取最具代表性的菌株,即纖維素酶活性最高的菌株,將菌株以接種量10%接種到種子培養基中,分別設置不同的氮源(硫酸銨、酵母膏、牛肉膏)、不同的培養溫度(4、10、15、20、30 ℃)、不同的培養時間(2、3、4、5 d)、不同的初始pH(6、7、8),測定菌株的CMC酶活性,以確定菌株最佳的產酶條件。在最佳產酶條件下進行優化試驗,測定菌株CMC酶活性。
1.8 菌株的分子生物學鑒定
將秸稈降解效果較好的復合菌劑的各菌株進行分子生物學的鑒定。鑒定方法為用引物27F/1492R或ITS1/ITS4進行PCR 擴增,然后將PCR 產物切膠純化回收,用引物27F/1492R 或ITS1/ITS4 測序,將測序結果序列在NCBI 上Blast 比對完成菌種鑒定。
2 結果與分析
2.1 纖維素降解菌的篩選
初步篩選得到可以10 ℃低溫生長的菌株55株,進一步通過透明圈在秸稈堆置土中篩選得到低溫纖維素降解細菌3株、低溫纖維素降解真菌2株,水稻田秸稈還田土中篩選得到低溫纖維素降解放線菌3株。3株細菌分別編號JGDZTX1、JGDZTX2、JGDZTX3,2株真菌分別編號JGDZTZ2、JGDZTZ3,3株放線菌分別編號SDT2NF1、SDT2NF2、SDT2NF3。
2.2 透明圈直徑
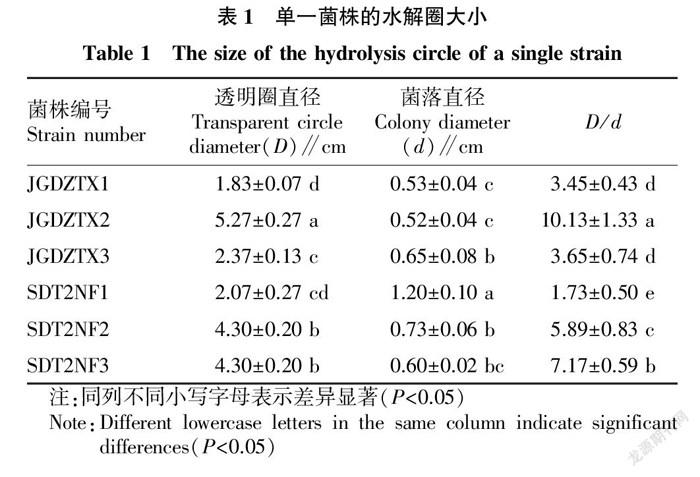
3株細菌和3株放線菌均測得透明圈直徑,2株真菌因長得過大,未測出透明圈直徑。透明圈結果見表1和圖1。
從表1可以看出,JGDZTX2的透明圈直徑最大,達5.27 cm,JGDZTX1、JGDZTX2、JGDZTX3、SDT2NF2、SDT2NF3的D/d值均大于2.00,均具有較強的纖維素分解能力。
2.3 CMC酶活性
對JGDZTX1、JGDZTX2、JGDZTX3、JGDZTZ2、JGDZTZ3、SDT2NF1、SDT2NF2和SDT2NF3共8株篩選菌株進行CMC酶活性測定,結果發現,其CMC酶活性分別為17.5、31.5、47.0、34.0、13.5、4.0、2.0、33.0 U/mL。其中JGDZTX2、JGDZTX3、JGDZTZ2、SDT2NF3的CMC酶活性均大于30.0 U/mL,有較好的纖維素分解能力。實驗室自存菌株枯草芽孢桿菌(KC)、膠胨樣芽孢桿菌(GSY)的CMC酶活性分別為28.0、25.0 U/mL。
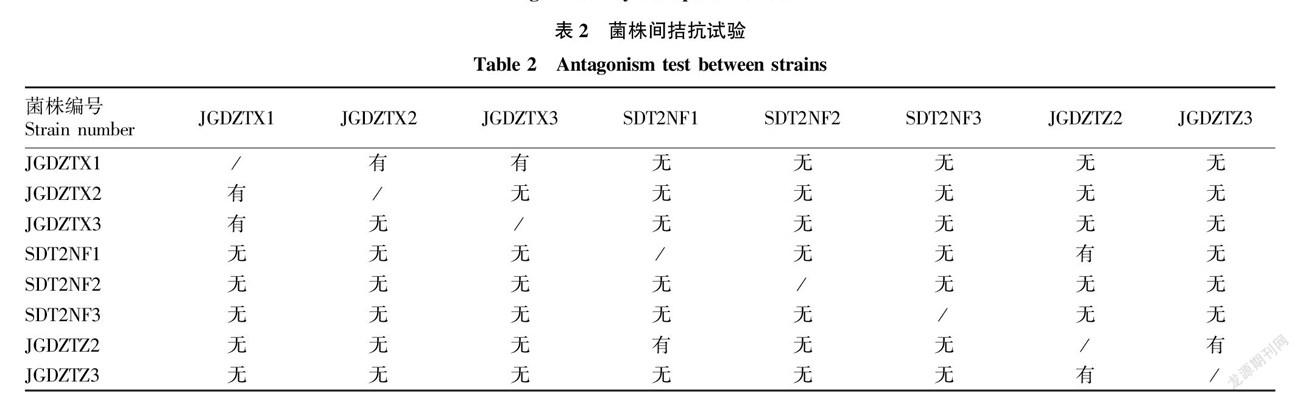
2.4 復合菌系構建
綜合考慮篩選得到的8株菌的CMC酶活性和拮抗作用(表2),將這8個菌株分為2組,分別與天津市農業科學院農業資源與環境研究所土壤微生物研究室自存的2株菌株混合,構建2組復合菌系。各菌株均按照菌∶鋯石=1∶2的比例吸附于鋯石上。其中復合菌系1的復合方法為JGDZTX1∶JGDZTZ3∶SDT2NF1∶SDT2NF2∶KC∶GSY=3∶3∶3∶3∶2∶1,復合菌系2的復合方法為JGDZTX3∶JGDZTZ2∶SDT2NF3∶JGDZTX2∶KC∶GSY=3∶3∶3∶3∶2∶1。2組復合菌系的CMC酶活性分別達到31.0和53.0 U/mL,均高于單一菌CMC酶活性。
2.5 實驗室秸稈降解率測定
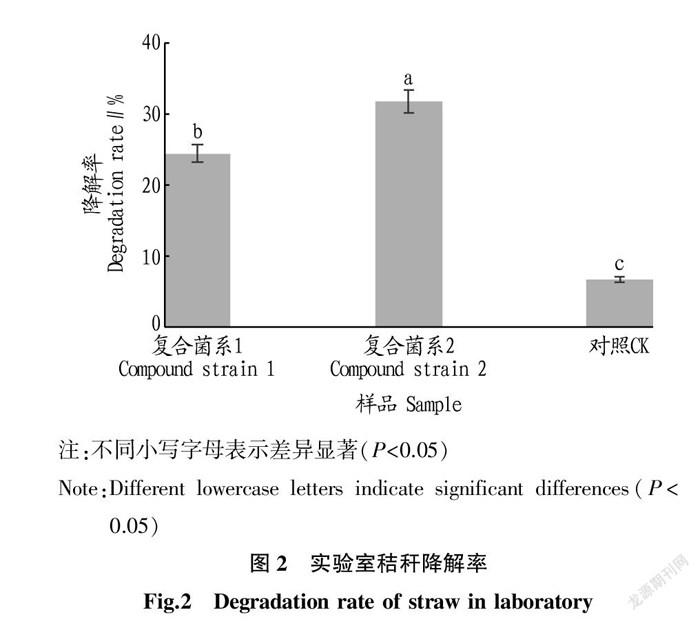
為了得到秸稈降解能力強的復合菌系,進一步在實驗室培養條件下測定了2組復合菌系對秸稈的降解率。由圖2可知,復合菌系1對秸稈的降解率為24.4%,復合菌系2對秸稈的降解率為31.8%,與空白對照相比,2個復合菌系在低溫條件下的秸稈降解率均顯著高于對照(P<0.05),2個復合菌系相比于對照組的增幅分別達264.18%和374.63%;復合菌系2的降解率也顯著高于復合菌系1。說明2組復合菌系對秸稈的降解能力都較強,并且復合菌系2的降解效果更好。
2.6 沙袋法秸稈降解率測定
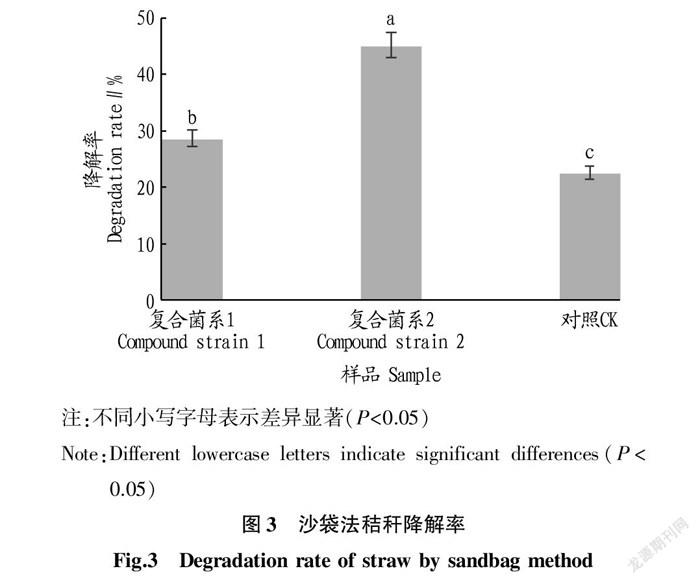
為了更接近于田間應用效果,通過沙袋法模擬田間試驗條件,測定2組復合菌系對秸稈的降解率。由圖3可知,復合菌系1對秸稈的降解率為28.7%,復合菌系2對秸稈的降解率為45.1%,空白對照組雖然沒有添加菌劑,但是土壤環境中也存在纖維素分解菌,會有一定的秸稈降解作用,秸稈降解率為22.6%。2個復合菌系的秸稈降解率均顯著高于對照(P<0.05),2個復合菌系相比于對照組的增幅分別達26.99%和99.56%;復合菌系2的降解率也顯著高于復合菌系1。說明2組復合菌系對秸稈的降解能力都較強,并且復合菌系2的降解效果更好。該試驗結果與實驗室秸稈降解試驗結果相一致,復合菌系2的秸稈降解能
力更強。
2.7 菌株的產酶條件優化
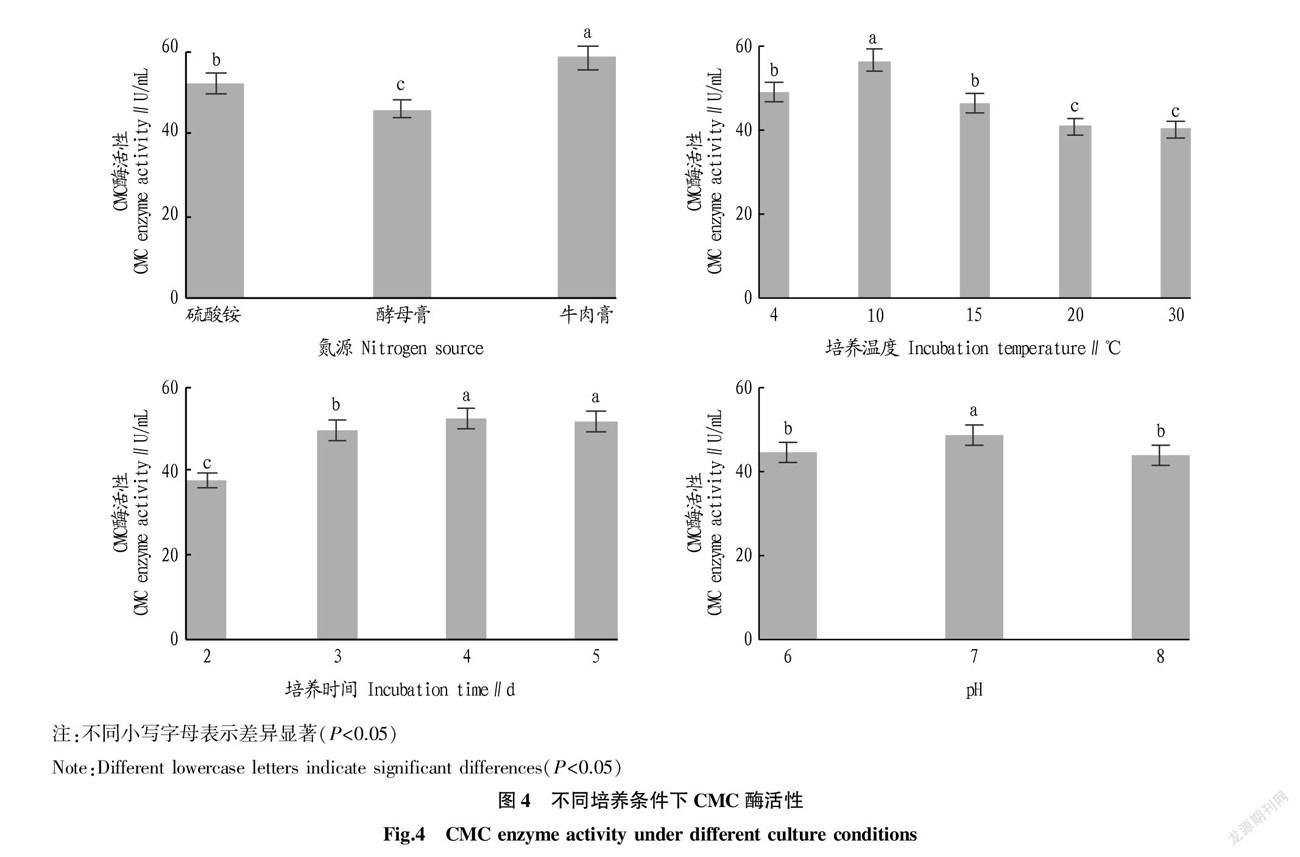
篩選菌株中JGDZTX3的CMC酶活性最強,以JGDZTX3為代表進行產酶條件優化,通過試驗可以看出不同氮源、溫度、培養時間、pH對該菌株產酶均具有較大影響,結果如圖4所示。
在不同氮源的試驗中,設置培養溫度為10 ℃,培養時間為3 d,初始pH為7,結果顯示,以牛肉膏作為唯一氮源時CMC酶活性最高,可達到58.5 U/mL,該試驗條件下CMC酶活性顯著高于硫酸銨和酵母膏。
在不同溫度的試驗中,設置氮源為硫酸銨3 g和酵母膏1 g,培養時間為3 d,初始pH為7,結果顯示,隨著溫度升高CMC酶活性呈現出先增后降的趨勢,溫度為10 ℃時CMC酶活性達到最大值(56.5 U/mL),該溫度下CMC酶活性顯著高于其他溫度水平。
在不同培養時間的試驗中,設置氮源為硫酸銨3 g和酵母膏1 g,培養溫度為10 ℃,初始pH為7,結果顯示,隨著培養天數增加CMC酶活性呈現逐漸增高后趨于平穩的趨勢,2~3 d的增長較快,3~4 d的增長較緩,4 d時CMC酶活性達到最大值(52.6 U/mL),該時間下CMC酶活性顯著高于2 d和3 d時的值。
在不同初始pH的試驗中,設置氮源為硫酸銨3 g和酵母膏1 g,培養溫度為10 ℃,培養時間為3 d,結果顯示,隨著pH增加CMC酶活性呈現出先增后降的趨勢,pH為7時CMC酶活性達到最大值(48.5 U/mL),該pH水平下CMC酶活性顯著高于其他pH水平。
綜上所述,通過單因素試驗確定了最佳氮源為牛肉膏,最適培養溫度為10 ℃,最佳培養時間為4 d,最佳初始pH為7。以此條件對菌株JGDZTX3進行了一次優化培養,得到CMC酶活性為66.5 U/mL。
2.8 菌株的鑒定
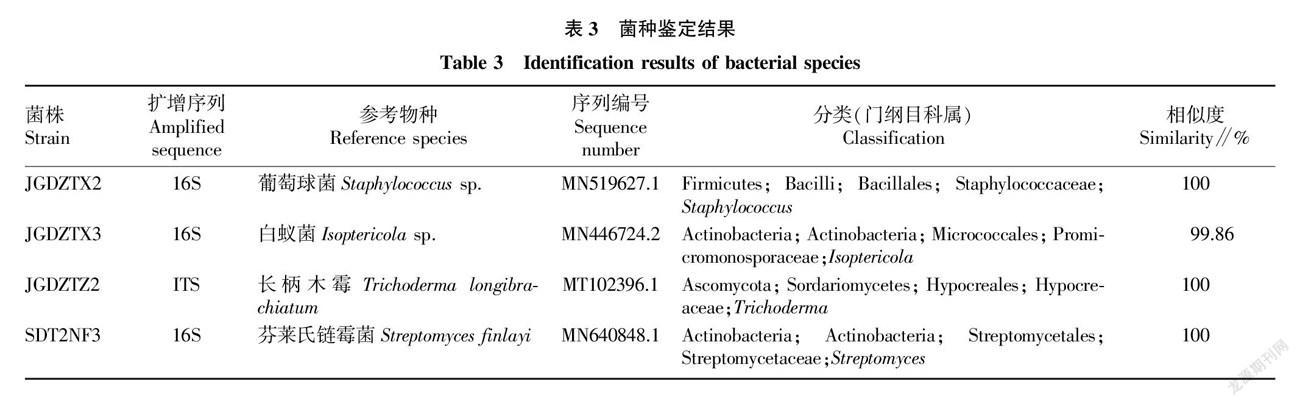
通過前面試驗,復合菌劑2的實驗室秸稈降解效果和沙袋法秸稈降解效果均較好,因此對復合菌系2中未知的4個菌株進行分子生物學鑒定。鑒定結果(表3)顯示,JGDZTX2是葡萄球菌(Staphylococcus sp.),JGDZTX3是白蟻菌(Isoptericola sp.),JGDZTZ2是長柄木霉(Trichoderma longibrachiatum),SDT2NF3是芬萊氏鏈霉菌(Streptomyces finlayi)。
3 討論與結論
利用纖維素降解微生物處理秸稈是一種安全高效的秸稈資源化處理方式[15]。楊娜等[16]從自然發酵堆肥中篩選得到一株高效降解纖維素的菌株SC2,其濾紙酶活性為17.70 U/mL,對玉米秸稈的降解率可達到33.07%。孟建宇等[17]從內蒙古西部地區篩選得到23株常溫纖維素降解菌,纖維素酶活性在4~88 U/mL。這些篩選得到的常溫菌株均有較強的纖維素分解能力,但是在低溫環境下就很難發揮作用。我國北方地區冬春季溫度低,低溫纖維素分解菌將有更廣的適用范圍。然而,目前國內外的研究多集中在常溫菌株,對于土壤中低溫纖維素降解菌的研究很少[18],且低溫篩選的條件一般是在15 ℃以上,不適用于北方冬春季10 ℃以下的土壤環境。張必周等[19]為篩選低溫菌株,在15 ℃下篩選得到11株具有纖維素分解能力的菌株。黃亞麗等[20]為了篩選適用于黃淮海北部秋冬季節的菌株,在16 ℃下進行了秸稈降解真菌的篩選,篩選得到一株長枝木霉,接種45 d的秸稈降解率可達到56.73%。以上篩選出的低溫菌株,在15 ℃左右可以發揮出較好的降解能力,但不一定能適用于更低的溫度條件。該研究在10 ℃條件下篩選得到55株耐低溫菌株,進一步從中篩選出8株有明顯透明圈的菌株并測定了纖維素酶活性,最高可達47.0 U/mL,所有的培養條件均是在10 ℃進行,保證了所篩菌株在10 ℃條件下具有較強的CMC酶活性,能夠在低溫環境發揮較好的秸稈降解效果。
單一菌株的纖維素酶也相對單一,多種纖維素分解菌株復配在一起,纖維素酶也相對豐富,并且菌株之間協同作用有利于纖維素酶活性的提高[21-22]。該研究篩選出8株低溫纖維素降解菌株,加上實驗室自存的2株纖維素降解菌株,共同進行復配。第一組為JGDZTX1(17.5 U/mL)、JGDZTZ3(13.5 U/mL)、SDT2NF1(4.0 U/mL)、SDT2NF2(2.0 U/mL)、KC(28.0 U/mL)、GSY(25.0 U/mL),復合菌劑的CMC酶活性為31.0 U/mL;第二組為JGDZTX3(47.0 U/mL)、JGDZTZ2(34.0 U/mL)、SDT2NF3(33.0 U/mL)、JGDZTX2(31.5 U/mL)、KC(28.0 U/mL)、GSY(25.0 U/mL),復合菌劑的CMC酶活性為53.0 U/mL。此次試驗中復合菌劑CMC酶活性均高于單一菌株,說明沒有拮抗作用的纖維素分解菌菌株復配后,有助于CMC酶活性的提高。
菌株在生長代謝過程中會產生一些具有特定作用的代謝產物,在不同的生長條件刺激下,代謝產物的量會有較大差異。為了獲得需要的特定產物,要對菌株的生長條件進行優化。邢慧珍等[14]篩選出一株纖維素降解的真菌,并進行了產酶條件優化,證明接種量、初始pH、培養溫度菌對產酶量具有顯著影響。孟建宇等[17]篩選了59株纖維素分解細菌,并對代表性菌株進行了產酶條件優化,結果表明培養溫度、氮源、培養時間和初始pH均對菌株產酶有顯著影響。此次試驗中,共篩選出包括高效低溫纖維素分解菌8株,包括細菌3株、真菌2株、放線菌3株,其中CMC酶活性最高的菌株為JGDZTX3,酶活達到47.0 U/mL。對該菌株進行產酶條件優化,測定了不同氮源、不同培養溫度、不同培養時間、不同初始pH對其產酶量的影響,最終確定最佳氮源為牛肉膏,培養溫度為10 ℃,培養時間為4 d,初始pH為7,試驗證明這4個條件對產酶均有顯著影響(P<0.05),在最佳產酶條件下CMC酶活性值達到66.5 U/mL。
綜上所述,該研究在河北濱海區低溫土壤中篩選出低溫纖維素分解菌,并與實驗室自存菌株進行復配,最終得到了一組復合菌劑,具有較高的CMC酶活性,并已在實驗室秸稈降解試驗和低溫田間試驗中,證明其具有高效加快秸稈腐解的作用,為北方低溫地區秸稈的資源化利用提供了菌種來源。但是由于微生物是活體,菌株發揮作用受到多方面條件的制約,作用效果不穩定,在提高纖維素分解菌對秸稈降解的穩定性方面還有待進一步深入研究。
參考文獻
[1] 劉曉永,李書田.中國秸稈養分資源及還田的時空分布特征[J].農業工程學報,2017,33(21):1-19.
[2] 張海艷,王文磊,韓錳.纖維素分解菌的篩選與鑒定[J].安徽農業科學,2020,48(15):1-3,8.
[3] 王偉,鄭大浩,楊超博,等.高效纖維素分解菌的分離及秸稈降解生物效應[J].中國農業科技導報,2019,21(8):36-46.
[4] 于慧娟,郭夏麗.秸稈降解菌的篩選及其纖維素降解性能的研究[J].生物技術通報,2019,35(2):58-63.
[5] 李海燕,蘇媛,齊永志,等.多功能土壤添加劑對小麥土傳病害的防效及對玉米秸稈的腐解作用[J].河南農業科學,2015,44(6):84-89.
[6] 高星愛,王鑫,解嬌,等.低溫秸稈降解復合微生物菌劑的研究進展[J].生物技術通報,2020,36(4):144-150.
[7] 鄭麗,張海鵬,宋艷培,等.纖維素降解菌的篩選、鑒定和糖化水平研究[J].廣東農業科學,2017,44(2):104-111.
[8] 姜立春,趙麗萍,林壽露,等.纖維素降解菌的篩選、鑒定與產酶條件優化試驗[J].黑龍江畜牧獸醫,2017(11):166-172.
[9] 趙旭,王文麗,李娟.玉米秸稈低溫降解菌的分離篩選及鑒定[J].土壤與作物,2017,6(3):192-198.
[10] SELVAM K,SENBAGAM D,SELVANKUMAR T,et al.Cellulase enzyme:Homology modeling,binding site identification and molecular docking[J].Journal of molecular structure,2017,1150:61-67.
[11] 王天生,李傳博,王寧,等.纖維素降解菌的篩選與復合菌系的初步構建[J].中國微生態學雜志,2018,30(1):19-21.
[12] 王垚,韓燕峰,梁宗琦.兩株戴氏霉對水稻秸稈的降解及產酶研究[J].菌物學報,2017,36(5):598-603.
[13] 趙欣.耐低溫稻稈降解復合菌系的培養基組分優化及產酶分析[D].哈爾濱:東北農業大學,2017.
[14] 邢慧珍,宋水山,黃媛媛,等.一株低溫玉米秸稈降解真菌的篩選、鑒定及降解特性[J].微生物學通報,2020,47(9):2923-2933.
[15] 尹蕾,王偉舵,陳子璇,等.水稻秸稈高效降解菌株的篩選鑒定及其降解產物分析[J].江蘇農業科學,2018,46(19):292-296,305.
[16] 楊娜,何鑫,杜春梅.一株纖維素降解菌的篩選與鑒定[J].中國農學通報,2021,37(17):26-31.
[17] 孟建宇,陳勿力吉瑪,郭慧琴,等.常溫和低溫纖維素降解菌的分離及其降解特性[J].農業生物技術學報,2021,29(1):73-84.
[18] 胡海紅,孫繼穎,高聚林,等.低溫高效降解玉米秸稈復合菌系發酵條件優化及腐解菌劑的研究[J].農業環境科學學報,2016,35(8):1602-1609.
[19] 張必周,高聚林,于曉芳,等.玉米秸稈低溫降解菌的分離與鑒定及復配菌降解效果研究[J].玉米科學,2020,28(6):168-175.
[20] 黃亞麗,黃媛媛,馬慧媛,等.低溫秸稈降解真菌的篩選及在秸稈還田中的應用[J].中國農學通報,2020,36(21):53-60.
[21] 閆敏,李磊,龐金梅,等.玉米秸稈分解復合系的構建[J].山西農業科學,2014,42(3):257-259.
[22] 劉青海,潘虎,朱兆靜,等.高效纖維素降解復合菌系M6的構建及堆肥效果初探[J].河南農業科學,2019,48(12):56-62.

