程序性死亡受體配體1在乳腺癌組織中的表達及與患者臨床特征的關系
徐瑾,周霞,楊玉珍,李世鳳,余靜
信陽市中心醫院1腫瘤外科,2放射治療科,3腫瘤內科,河南 信陽 464000
乳腺癌是一種發生于乳腺上皮組織且嚴重影響女性身心健康甚至危及生命的惡性腫瘤,其發病率和病死率在女性惡性腫瘤中均排名靠前[1]。目前乳腺癌常見的治療方案為手術、放化療、激素治療等[2]。盡管相關治療方法很多,但侵襲性乳腺癌患者的10年遠處轉移率超過50%,臨床治療效果不能令人滿意[3]。研究指出,乳腺癌具有一定的免疫原性,尤其是增殖性乳腺癌的免疫原性較高[4-5]。近年來乳腺癌的免疫治療發展迅速,通過靶向抑制乳腺癌免疫檢查點,能夠抑制腫瘤細胞發生免疫逃逸,臨床效果較好[6-7]。研究表明,T細胞中程序性死亡受體配體1(programmed cell death 1 ligand 1,PDCD1LG1,也稱PD-L1)高表達能夠促使T細胞的免疫作用減弱或誘導其凋亡進而引起免疫抑制,使腫瘤細胞發生免疫逃逸[8-9]。另有研究指出,PD-L1表達情況與乳腺癌的病情進展相關[10]。盡管有關PD-L1在乳腺癌中表達情況的研究很多,但是PD-L1表達與患者臨床特征(如分化程度、腫瘤分期、腫瘤大小、淋巴結轉移等)關系的研究結論不一致,PD-L1高表達與乳腺癌不良結局是否有關仍存在爭議[11-12]。本研究探討PD-L1在乳腺癌中的表達及與患者臨床特征的關系,旨在揭示PD-L1表達對乳腺癌發生發展的影響,現報道如下。
1 資料與方法
1.1 一般資料
選擇2018年7月至2019年7月信陽市中心醫院收治的乳腺癌患者。納入標準:①年齡≥18歲;②經病理檢查確診為乳腺癌,根據國際抗癌聯盟(Union for International Cancer Control,UICC)及美國癌癥聯合會(American Joint Committee on Cancer,AJCC)乳腺癌TNM分期標準[13],臨床分期為Ⅰ~Ⅲ期;③根據Bloom-Richardson分級標準[14],組織學分級為Ⅰ~Ⅲ級;④術前無放療或化療史。排除標準:①合并嚴重免疫系統疾病;②非原發性乳腺癌;③合并其他嚴重器質性疾病。依據納入和排除標準,本研究共納入70例患者,收集70例乳腺癌組織和70例癌旁組織(距乳腺癌病灶3 cm)。本研究經醫院倫理委員會審批通過,所有患者均知情同意并簽署知情同意書。
1.2 免疫組織化學染色法檢測PD-Ll的表達情況
制作乳腺癌組織和癌旁組織切片,切片厚度為2.5 μm,采用免疫組織化學染色法進行染色。將組織切片置于3%H2O2中室溫浸泡12 min,采用檸檬酸鈉伴高溫促進抗原修復,冷卻10 min后清洗,使用封閉液封閉乳腺癌和癌旁組織,采用鼠抗人PD-L1單克隆抗體(1∶100稀釋)4℃孵育過夜。清洗后37℃孵育二抗30 min。然后采用鏈霉親和素-生物素復合物孵育30 min,二氨基聯苯胺顯色,蘇木素復染,然后脫水、封閉切片并觀察。
1.3 免疫組織化學染色結果判定
PD-L1陽性表達主要位于細胞質及細胞膜,鏡下呈棕褐色。依據陽性細胞比例及染色強度進行半定量分析并計分。染色強度評分:無色為0分,淡黃色為1分,棕黃色為2分,棕褐色為3分。陽性細胞比例評分:<5%為0分,5%~25%為1分,26%~50%為2分,51%~75%為3分,>75%為4分。染色強度評分與陽性細胞比例評分乘積≤1分為陰性,反之為陽性[15]。
1.4 統計學方法
采用SPSS 18.0軟件對數據進行統計分析,計數資料以例數和率(%)表示,組間比較采用χ2檢驗;計量資料以均數±標準差(±s)表示,組間比較采用t檢驗;采用非條件Logistic回歸模型進行多因素分析;以P<0.05為差異有統計學意義。
2 結果
2.1 乳腺癌組織與癌旁組織中PD-L1陽性表達率的比較
乳腺癌組織中PD-L1陽性表達率為25.71%(18/70),明顯高于癌旁組織的8.57%(6/70),差異有統計學意義(χ2=7.241,P=0.007)。
2.2 不同臨床特征乳腺癌患者乳腺癌組織中PD-L1表達情況的比較
不同年齡、手術方式、乳腺癌家族史、絕經情況乳腺癌患者乳腺癌組織中PD-L1陽性表達率比較,差異均無統計學意義(P>0.05)。組織學分級為Ⅲ級、TNM分期為Ⅲ期、腫瘤直徑>2 cm、有淋巴結轉移乳腺癌患者乳腺癌組織中PD-L1陽性表達率分別高于組織學分級為Ⅰ~Ⅱ級、TNM分期為Ⅰ~Ⅱ期、腫瘤直徑≤2 cm、無淋巴結轉移的乳腺癌患者,差異均有統計學意義(P<0.05)。(表1)

表1 不同臨床特征乳腺癌患者乳腺癌組織中PD-L1表達情況的比較
2.3 乳腺癌患者乳腺癌組織中PD-L1表達情況影響因素的多因素分析
多因素分析結果顯示,組織學分級為Ⅲ級、TNM分期為Ⅲ期、有淋巴結轉移均是乳腺癌患者乳腺癌組織中PD-L1陽性表達的獨立危險因素(P<0.05)。(表2)
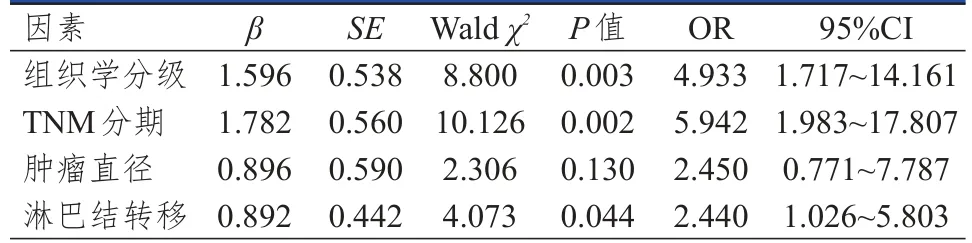
表2 乳腺癌患者乳腺癌組織中PD-L1表達情況影響因素的多因素分析
3 討論
乳腺癌是女性發病率最高的惡性腫瘤,其病死率也較高。乳腺癌的發病與遺傳因素密切相關[16-17]。乳腺癌的發病年齡主要集中于40~60歲,絕經期前后女性乳腺癌的發病率較高[18-19]。乳腺癌早期通常無明顯臨床表現,發展至中晚期常出現乳房持續性疼痛和淋巴結轉移,對患者的生活質量和心理健康造成不良影響,而化療對乳腺癌轉移的控制效果欠佳,因此深入研究乳腺癌轉移的相關機制對控制乳腺癌進展及開發高效新療法至關重要[20]。研究指出乳腺癌具有免疫原性,T細胞中PD-L1通過抑制T細胞發揮免疫作用或誘導T細胞凋亡,從而引起免疫抑制,腫瘤細胞由于發生免疫逃逸可迅速增殖并發生轉移,加速病情進展[21]。PD-L1來自CD28家族,通過在T細胞、自然殺傷(natural killer,NK)細胞表面表達,調節其生長和凋亡[22]。PD-L1高表達可能與乳腺癌轉移和進展有關,現階段PD-L1抑制劑已用于乳腺癌患者的臨床治療中。
本研究結果顯示,PD-L1在乳腺癌患者乳腺癌組織中的陽性表達率明顯高于癌旁組織(P<0.01)。正常細胞生長和凋亡處于動態平衡,達到一定的分裂次數就會出現衰老和凋亡,但腫瘤細胞卻可以無限制地復制、增殖、分化而不凋亡,主要原因是發生了免疫逃逸,即免疫反應被削弱,使免疫系統不能及時發現腫瘤細胞的異常增殖和分化,從而使腫瘤細胞迅速增殖和轉移。PD-L1過表達能夠促進免疫細胞凋亡,抑制免疫系統對腫瘤細胞的監視作用,促進腫瘤細胞增殖和分化,因此乳腺癌組織中PD-L1陽性表達率明顯高于癌旁組織。
本研究結果顯示,組織學分級為Ⅲ級、TNM分期為Ⅲ期、有淋巴結轉移乳腺癌患者乳腺癌組織中PD-L1陽性表達率分別高于組織學分級為Ⅰ~Ⅱ級、TNM分期為Ⅰ~Ⅱ期、無淋巴結轉移的乳腺癌患者,差異均有統計學意義(P<0.05)。可能是因為PD-L1過表達使腫瘤細胞失去了免疫系統的調控,從而導致腫瘤細胞迅速增殖和分化,進而促進腫瘤進展和淋巴結轉移。本研究中腫瘤直徑>2 cm乳腺癌患者乳腺癌組織中PD-L1陽性表達率高于腫瘤直徑≤2 cm的患者,與王立東等[23]的研究結果一致。本研究結果還顯示,乳腺癌患者乳腺癌組織中PD-L1陽性表達率與乳腺癌家族史無關,與既往研究顯示乳腺癌具有遺傳易感性的結論不一致,可能是因為本研究中具有乳腺癌家族史的患者比例較少[24]。多因素分析結果顯示,組織學分級為Ⅲ級、TNM分期為Ⅲ期、有淋巴結轉移均是乳腺癌患者乳腺癌組織中PD-L1陽性表達的獨立危險因素(P<0.05),與邱志敏[15]的研究結果相似,說明PD-L1表達情況與乳腺癌的發生發展有關。
綜上所述,PD-L1在乳腺癌組織中高表達,且與乳腺癌患者的臨床特征密切相關。

