基于酯酶和ISSR技術的平菇單核菌株遺傳多樣性分析
劉曉雪 王強 張彬彬 王春霞 郭金英 鄭素月

摘要:應用酯酶同工酶和ISSR分子標記技術對69個野生平菇單核菌進行遺傳多樣性研究。結果表明,69個單核菌株的酯酶同工酶酶譜共檢出6條酶帶,多態性帶型占83.3%;ISSR分子標記技術從7個ISSR引物中擴增出56條清晰的DNA片段,多態性位點占87.5%;2種方法的聚類結果顯示,當GS值為0.67左右時,根據樣本量的多少均可將69個單核菌株依此劃分為A、B、C、D等4個類群;將交配型、酯酶同工酶和ISSR分子標記3種分類結果進行對比后發現,交配型為A2B2的P11、P12、P34、P59、P73、P85和P90這7個單核菌株均同屬于一類,分類結果并沒有嚴格按照交配型來進行歸類。說明酯酶同工酶和ISSR分子標記技術可用于平菇單核菌株的遺傳多樣性研究,并可作為交配型鑒定的輔助手段,為平菇雜交育種過程中優良親本單核體的選擇提供理論依據。
關鍵詞:平菇;單核菌株;酯酶同工酶;ISSR分子標記
中圖分類號:S646.1+40.3 ??文獻標志碼: A
文章編號:1002-1302(2022)09-0027-06
平菇(Pleurotus ostreatus)是一種物美價廉、高蛋白低脂肪的健康食品,因其栽培技術簡單、適應性強而成為擔子菌中廣泛栽培的品種之一[1-2]。研究表明,平菇是標準的四極性異宗結合菌,同一菌株產生的擔孢子有4種交配型即AxBx、AyBy、AxBy、AyBx[3],而目前食用菌的交配型鑒定通常采用單核體兩兩交配后鏡檢觀察鎖狀聯合的方式進行,該方法工作量大、耗時長,且易產生人為誤檢。因此,尋找一種更快速、準確地挑選出優良的單核菌株并鑒定出其交配型因子類型的方法尤為必要。
酯酶同工酶是從蛋白質水平上研究生物群體遺傳差異的重要方法之一[4-5],在食用菌種類遺傳多樣性分析方面應用廣泛[6-10]。但同工酶譜的差異是由編碼同工酶基因決定的,不能直接反映出菌種在DNA水平上的差別,另一方面,同工酶試驗容易受到培養方式、時間等因素影響[11-12]。因此,在酯酶同工酶分析的基礎上結合更加穩定的遺傳標記方法去分析植株的遺傳多樣性是非常必要的。簡單重復間序列(ISSR)是DNA分子標記方法之一,呈孟德爾式遺傳,能從基因水平揭示菌株間的親緣關系和遺傳差異,具有良好的穩定性和多態性[13-14],其檢測手段簡單、高效,已經大量應用于不同品種和食用菌菌株間的遺傳差異分析中[15-19]。宋小亞等以黑木耳單核菌株為試驗材料分析了ISSR標記在其育種過程中的應用價值[20];努爾孜亞·亞力買買提等通過ISSR標記技術對15株野生平菇菌株的遺傳多樣性進行了分析,當遺傳相似系數在0.60水平上時,將供試菌株分為了5個類群[21];陳小敏等利用ISSR技術鑒別了從全國年各地收集的75份香菇種質資源的遺傳多樣性[22];葉海丹研究了ISSR分子標記技術在桑黃、黑木耳遺傳分析上的應用[23]。本研究在1個野生平菇單核菌株交配型已確定的基礎上(已另文發表),通過酯酶同工酶和ISSR分子標記技術對該平菇的69個孢子單核菌株進行遺傳分析和分類鑒定,探討單核菌株的遺傳差異和交配型之間的關系,以期為育種時親本單核體的篩選提供重要的基礎。
1 材料與方法
1.1 供試菌株
本試驗于2021年3月5日至6月20日在河北工程大學食用菌研究室完成。試驗所需野生平菇4種交配型孢子單核體(A 1B 1、A 2B 2、A 1B 2、A 2B 1),由河北工程大學食用菌研究室鑒定、保藏(表1)。
1.2 試驗方法
1.2.1 菌絲體培養
將供試平菇單核菌株活化后,轉接至鋪有玻璃紙的培養基上隔膜培養,菌絲長滿平板后刮取菌絲備用。
1.2.2 酯酶同工酶分析
取0.5 g樣品用液氮研磨之后加入700 μL磷酸緩沖液(pH值=7.5),4 ℃ 12 000 r/min 離心10 min后取上清液備用。試驗采用聚丙烯酰胺凝膠垂直電泳法[24-25],電泳設備為DYC2-24EN型雙垂直電泳儀(北京六一生物科技有限公司),試驗具體步驟參照文獻[26]。
1.2.3 ISSR分子鑒定
采用植物基因組DNA提取試劑盒(天根生化科技有限公司)提取單核菌株DNA。采用1%瓊脂糖凝膠檢測DNA的質量和濃度。所用ISSR引物均由生工生物工程(上海)股份有限公司合成,ISSR擴增結合李輝平等的方法[27-28]篩選出最佳程序及電泳條件,ISSR電泳設備采用DYY-6C電泳儀(北京六一生物科技有限公司)。擴增體系(20 μL):2×Taq PCR Mix 10 μL,引物1 μL,DNA模板1 μL,ddH 2O 8 μL。
1.3 數據處理
電泳結果均采用凝膠成像分析系統(北京君意東方電泳設備有限公司)拍照記錄并進行條帶分析。采取0/1賦值記帶,構建數據矩陣,用聚類分析軟件NTSYSpc Version 2.10e計算菌株間的遺傳相似系數,并根據結果采用SAHN程序,以不加權算數平均組對法(UPGMA)進行聚類分析。
2 結果與分析
2.1 酯酶同工酶結果
2.1.1 酯酶同工酶酶譜
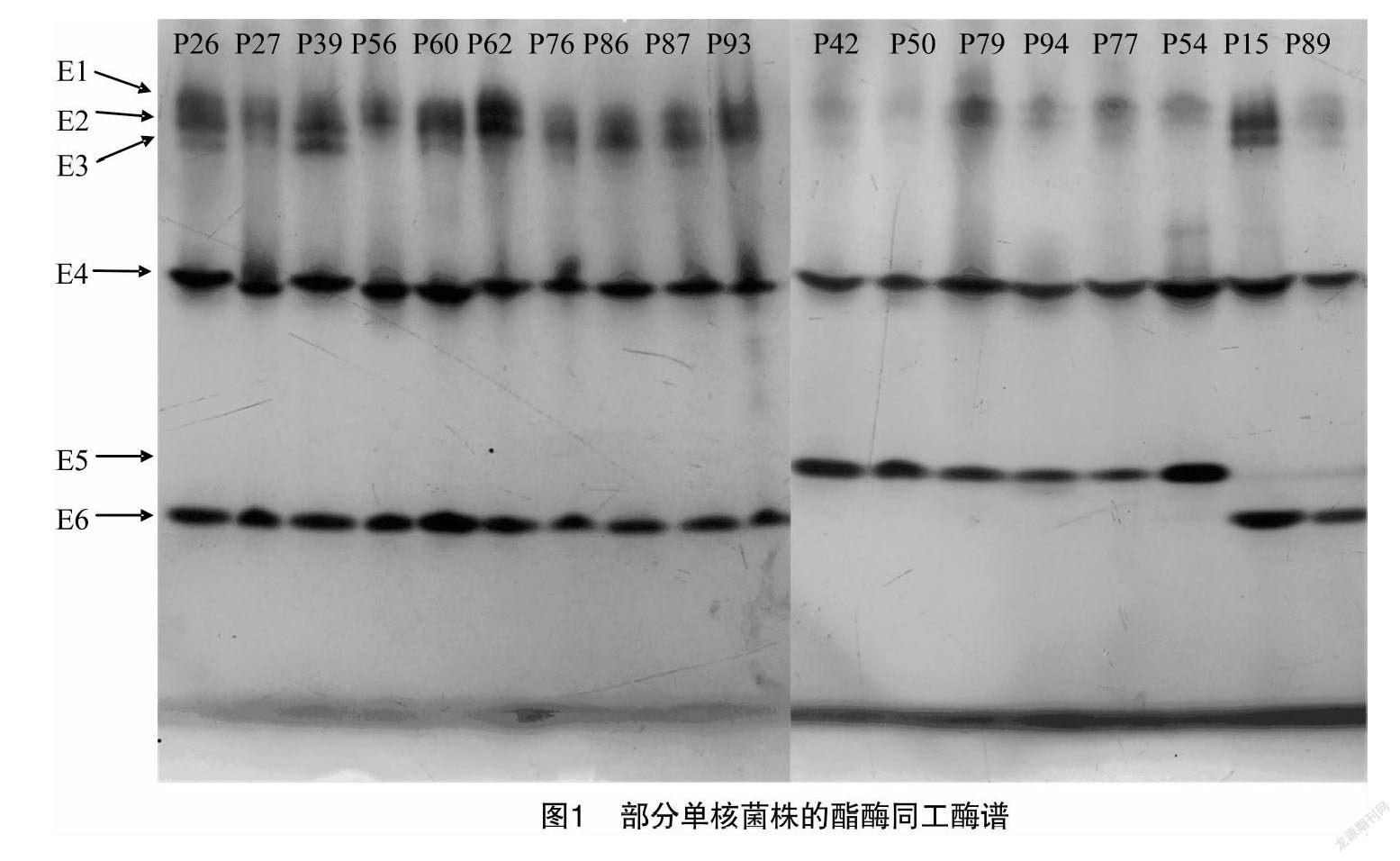
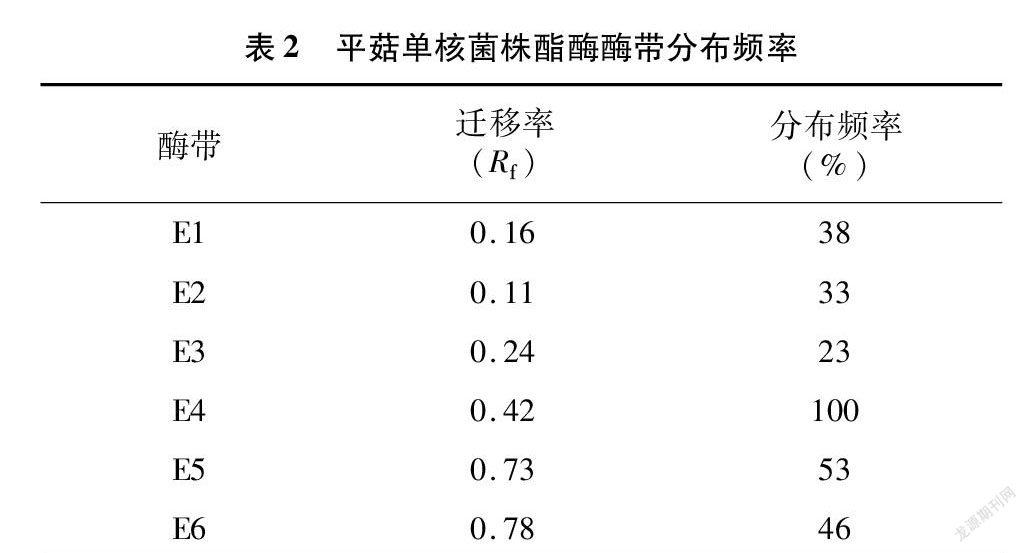
部分孢子單核菌株酯酶同工酶電泳圖見圖1。由圖1可知,根據酯酶同工酶的電泳結果顯示,69個平菇孢子單核菌株共檢測到6條酶帶;各菌株酶帶數目為3~5條;遷移率(R f)在 0.16~0.78之間,多態性帶型占83.3%(表2)。其中,E4、E5、E6顏色最深,最為明顯,并且R f為0.42的E4酶帶為69個單核菌株所共有,可認為是野生平菇單核體的特征譜帶。
2.1.2 酯酶同工酶聚類分析
聚類分析樹狀圖見圖2。由圖2可知,69個孢子單核菌株間的遺傳相似系數(GS)變化范圍為0.38~1.00。當GS值約為0.665時,可將菌株分為4組。根據組內樣本量依此分為A、B、C、D等4個類群, A組為P1、P2等31個菌株;B組為P14、P15等21個菌株;C組為P17、P28等10個菌株;D組為P9、P38等7個菌株。DBF325F8-402B-4818-AB45-ED577340AA49
2.2 ISSR引物篩選及聚類分析
2.2.1 DNA質量檢測
部分DNA電泳檢測結果見圖3。由圖3可知,在凝膠成像儀下呈現的DNA條帶清晰,雜質較少,純度高,可用于后續PCR擴增。
2.2.2 ISSR擴增圖譜
本試驗從28個ISSR引物中篩選出7個對野生平菇孢子單核體擴增條帶清晰、多態性豐富、重復性好的引物,分別是P2、P5、P7、P11、P19、P24、P26,部分引物擴增圖譜見圖4、圖5。由圖4、圖5可知,7個引物共擴增出56條條帶,條帶擴增最多的是引物P2、P19和P26,均擴增出10條;最少的為引物P5和P11,均擴增出6條。平均每個ISSR引物擴增出8條,其中多態性位點49個,占87.5%。
此外,試驗根據單核菌株的4種交配類型,每個類型隨機抽取1個單核體進行ISSR擴增(圖6-A、圖6-B)中分別代表引物P7、P24對4種交配型的擴增圖譜,可明顯看出每個交配類型擴增出來的條帶均不同,如圖6-A中T 2擴增出的第3條ISSR條帶是不同于T 1、T 3和T 4的特異性條帶。因此,ISSR分子標記技術可作為該孢子單核體交配型鑒定的有效工具。
2.2.3 ISSR聚類分析
利用ISSR標記計算供試菌株之間的GS值矩陣,采用UPGMA法構建了野生平菇單核菌株的遺傳關系聚類圖(圖7)。由圖7可知,69個菌株間的GS值變化范圍為0.60~0.88。其中,單核P8和P35、P59和P75間的GS值最大,遺傳相似程度最高,遺傳距離最近,GS值達到0.88。
由圖7可知,當GS值約為0.648時,將可將菌株分為4類。再依據樣本量依此劃分為A、B、C、D 4個類群,其中,A組由P10、P11等35個菌株組成;B組由P1、P8等22個菌株組成;C組由P9、P21等8個菌株組成;D組由P2、P14等4個菌株組成。
3 結論與討論
筆者所在課題組前期采集到1株野生平菇菌株,經過ITS鑒定和交配型分析后,將獲得的69株可用孢子單核體的交配型進行了準確鑒定(已另文發表)。本試驗在此基礎上采用酯酶同工酶和ISSR分子標記技術對其進行進一步分析,探討單核菌株的交配型和遺傳差異之間的聯系,以便更快捷、準確地挑選交配型相配的優良單核菌株用于育種工作。本試驗單從聚類圖的分類趨勢看來, 這2種聚類圖大致呈一種趨勢,研究表明,酯酶同工酶試驗在69個單核菌株中檢測出6條酶帶,多態性帶型占83.3%,GS值為0.665時將其歸為4個類群,A組為P1、P2等31個菌株,B組為P14、P15等21個菌株,C組為P17、P28等10個菌株,D組為P9、P38等7個菌株;ISSR分子標記技術用篩選出的7條引物對69個野生平菇單核菌株的DNA進行ISSR擴增,共擴增出56條條帶,多態性位點占87.5%,當GS值為0.684時分為4個類群,A組由P10、P11等35個菌株組成;B組由P1、P8等22個菌株組成;C組由P9、P21等8個菌株組成;D組由P2、P14等4個菌株組成。所以本研究表明,酯酶同工酶和ISSR分子標記技術可用于平菇單核菌株的遺傳多態性研究,并可作為交配型鑒定的輔助手段,為其優良菌株的篩選及交配型鑒定提供參考。
觀察相同交配型間的單核菌株可發現,相同交配型間單核菌株遺傳多態性較低。例如數量居多、占優勢的交配型A2B2的37個單核菌株與酯酶聚類A組對比,有P8、P11、P12等16個菌株同屬一類;與ISSR聚類A組對比,有P11、P12、P19等20個菌株同屬一類。與酯酶同工酶和ISSR聚類結果同時對比后發現,有P11、P12、P34、P59、P73、P85、P90這7個交配型相同的單核菌株同屬為一類[20],這與譚琦等對香菇同種交配型孢子單核體的研究結果[29]相符。宋小亞等以黑木耳單核體為材料,研究了ISSR分子標記技術在其遺傳分析中的應用,試驗中F 1代的33個孢子單核菌株中有24個菌株與T 1聚為一類,剩余9個與T 2聚為一類。徐凱等更是采用了SRAP、ISSR和RAPD等3種方法對37個靈芝的單核體多態性進行了研究,結果表明,試驗菌株130-29、130-33等7株交配型為A 2B 2的單核體聚為一類,其余29個既有A 1B 1也有A 2B 2的單核體聚為一類[30]。
但以上結果均未嚴格按照交配型來進行歸類,造成此現象原因極有可能與交配型的控制因子A、B有關。張美彥在對香菇135菌株的遺傳規律研究中發現,特異SCAR標記與交配因子A和B均不存在連鎖關系,標記是隨機的,這是基因組內部減數分裂結果,并且交配型因子在其基因組中所占比例極小,所以即使其交配型因子相同,也不能代表其它核苷酸序列相同[31]。因此,若要準確鑒定某種食用菌的交配型還需與其他方法聯合使用。
參考文獻:
[1]El-Batal A I,Mosallam F M,Ghorab M M,et al. Factorial design-optimized and gamma irradiation-assisted fabrication of selenium nanoparticles by chitosan and Pleurotus ostreatus fermented fenugreek for a vigorous in vitro effect against carcinoma cells[J]. International Journal of Biological Macromolecules,2020,156:1584-1599.
[2]Kumar K. Nutraceutical potential and processing aspects of oyster mushrooms (Pleurotus Species)[J]. Current Nutrition & Food Science,2020,16(1):3-14.DBF325F8-402B-4818-AB45-ED577340AA49
[3]程 莉. 平菇交配型因子組合的準確鑒定[D]. 武漢:華中農業大學,2007:8.
[4]傅安濤,宋愛榮,田雪梅,等. 同工酶技術及其在我國食用菌研究中的應用[J]. 菌物研究,2006,4(4):57-61.
[5]孔祥會,姚方杰,王 鵬. 食用菌種質資源評價方法及在品種選育上的應用實踐[J]. 中國食用菌,2019,38(12):8-10.
[6]隋玉龍,宋 慧,杜 金,等. 靈芝栽培菌株酯酶同工酶的酶譜多樣性[J]. 菌物研究,2013,11(2):136-140.
[7]張欣倪,王鴻磊,丁 強,等. 國外引進雙孢菇菌種與國內栽培菌種的RAPD和酯酶同工酶指紋圖譜分析[J]. 江蘇農業科學,2015,43(7):254-256.
[8]高 鋒,何明霞,劉 靜,等. 基于酯酶同工酶的暗褐網柄牛肝菌遺傳多樣性分析[J]. 中國食用菌,2021,40(2):47-53,61.
[9]錢雪婷,陳文強,彭 浩,等. 秦巴山區黑木耳菌株酯酶同工酶的分析[J]. 江蘇農業科學,2016,44(6):269-272.
[10]Wang H C,Wang Z S. The prediction of strain characteristics of Agaricus bisporus by the application of isozyme electrophoresis[J]. Mushroom Science,1989,12(1):87-100.
[11]梁建光,楊立紅,王曉潔,等. 不同條件對食用菌酯酶同工酶譜多態性的影響[J]. 西南農業大學學報(自然科學版),2005,27(4):500-504.
[12]李守勉,李 明,田景花. 不同培養時間對杏鮑菇酯酶同工酶酶譜的影響[J]. 北方園藝,2014(14):98-100
[13]Fang D Q,Roose M L. Identification of closely related Citrus cultivars with inter-simple sequence repeat markers[J]. Theoretical and Applied Genetics,1997,95(3):408-417.
[14]史靈燕,劉保衛,顧新穎,等. 生化和ISSR分子標記在黑木耳品種鑒定中的應用[J]. 北方園藝,2019(9):136-141.
[15]Sudupak M A.Inter and intra-species Inter Simple Sequence Repeat (ISSR) variations in the genus Cicer[J]. Euphytica,2004,135(2):229-238.
[16]孟 虎,孫國琴,睢 韡,等. ISSR技術在食用菌研究上的應用[J]. 北方園藝,2016(5):207-210.
[17]劉志曦,李志強,魏海蓮,等. 平菇ISSR遺傳多樣性分析[J]. 北方園藝,2014(12):94-99.
[18]Nazrul M I,Bian Y B. ISSR as new markers for identification of homokaryotic protoclones of Agaricus bisporus[J]. Current Microbiology,2010,60(2):92-98.
[19]張金霞,黃晨陽,管桂萍,等. 白黃側耳Pleurotus cornucopiae微衛星間區(ISSR)分析[J]. 菌物學報,2007,26(1):115-121.
[20]宋小亞,肖 揚,邊銀丙. ISSR標記在黑木耳單核體遺傳分析中的應用[J]. 菌物學報,2007,26(4):528-533.
[21]努爾孜亞·亞力買買提,賈文捷,郝敬喆,等. 野生平菇菌株的培養特征及遺傳多樣性分析[J]. 新疆農業科學,2021,58(1):143-150.
[22]陳小敏,吳海冰,辜運富. 香菇種質資源遺傳多樣性研究[J]. 四川農業科技,2019(12):40-44.
[23]葉海丹. ISSR分子標記技術在桑黃、黑木耳遺傳分析上的應用研究[D]. 杭州:浙江農林大學,2017:55.
[24]胡能書,萬賢國. 同工酶技術及其應用[M]. 長沙:湖南科學技術出版社,1985:84-88.
[25]郭堯君. 蛋白質電泳試驗技術[M]. 北京:科學出版社,2001:3.
[26]史靈燕. 不同黑木耳品種種質鑒定及優良菌株篩選研究[D]. 邯鄲:河北工程大學,2019:21-23.
[27]李輝平. ISSR在食用菌遺傳多樣性研究中的應用[D]. 北京:中國農業科學院,2007:26-27.
[28]鄭 偉. 平菇優良菌株的選育及評價[D]. 邯鄲:河北工程大學,2017:14-16.
[29]譚 琦,楊建明,陳明杰,等. 香菇孢子單核體與原生質體單核體遺傳差異分析[J]. 中國食用菌,2001,20(6):3-5,25.
[30]徐 凱,唐傳紅,王天嬌,等. 基于SRAP、ISSR和RAPD分析靈芝G0130菌株單核體多態性[J]. 工業微生物,2014,44(4):39-45.
[31]張美彥. 香菇135菌株特異SCAR標記的遺傳規律[D]. 南京:南京農業大學,2007:5-6,40.DBF325F8-402B-4818-AB45-ED577340AA49

