棗癭蚊圖爾病毒(DjTV-2a)衣殼蛋白生物信息學分析及抗原表位預測
張來斌 馬光皇 劉語涵 賀鵬鵬 肖海兵 楊明祿


摘要:分析棗癭蚊圖爾病毒(DjTV-2a)衣殼蛋白的理化性質、蛋白結構及抗原表位。從UniProt數據庫中得到DjTV-2a衣殼蛋白的氨基酸序列,利用Expasy、TMHMM、DNAStar、SignalP 5.0、TMHMM、NetPhos 3.1、NET CGlyc 1.0、SOPMA、SWISS-MODEL等生物信息學軟件,預測DjTV-2a衣殼蛋白的理化性質、氨基酸組成、親疏水性、信號肽、跨膜結構、磷酸化位點、糖基化位點、二級結構、三級結構和抗原表位等。結果表明,DjTV-2a衣殼蛋白是由449個氨基酸構成的親水蛋白,分子式為C 2 337H 3 607N 601O 689S 15,分子量為51.6 ku,理論等電點為5.98;主要二級結構是無規則卷曲,存在82個磷酸化位點和1個糖基化位點,無信號肽和跨膜結構;該蛋白有21個B細胞優勢抗原表位和10個T細胞優勢抗原表位。DjTV-2a衣殼蛋白屬親水蛋白,具有多個抗原表位,預測其具有免疫原性,是可用作建立血清學檢測技術的潛在抗原。
關鍵詞:棗癭蚊;圖爾病毒;衣殼蛋白;生物信息學;抗原表位
中圖分類號:S433.89;S186 ??文獻標志碼: A
文章編號:1002-1302(2022)09-0033-04
棗癭蚊屬雙翅目癭蚊科,是棗樹等果樹的重要害蟲之一。棗樹在發芽過程中,棗癭蚊吸吮葉汁,破壞幼芽和新葉,最終導致果實產量減少[1-2]。隨著新疆大面積推廣和發展矮化密植棗園的生產方式以及不合理使用農藥導致傳統棗園的生態條件發生了改變,致使棗癭蚊的危害日益加重。因此,必須對其進行有效防治[3]。
圖爾病毒屬是囊泡病毒科的第2個屬,目前僅記錄了2個毒株,美雙緣姬蜂圖爾病毒(Diadromus pulchellus toursvirus 1,DpTV-1a)和棗癭蚊圖爾病毒(Dasineura jujubifolia toursvirus 2,DjTV-2a)[4-5]。2018年,首次在棗癭蚊體內發現圖爾病毒[6],這為棗癭蚊的防控提供了新思路。DjTV-2a 是大型的單鏈DNA病毒,這種病毒的衣殼是由病毒衣殼蛋白亞基形成的寡聚體,也稱殼體[6-7]。衣殼包裹著DjTV-2a的遺傳物質,具有免疫原性的作用,在DjTV-2a的侵染和運動中起著重要作用[7]。本研究對棗癭蚊圖爾病毒衣殼蛋白進行生物信息學分析,以期為進一步研究致病機制奠定基礎,同時為開發DjTV-2a血清學檢測技術提供理論支撐。
1 材料與方法
1.1 試驗材料
登錄UniProt(https://sparql.uniprot.org/)網站并查找DjTV-2a的登錄信息,得到該病毒衣殼蛋白氨基酸序列,登錄號為A0A6G6ZQ66。
1.2 試驗方法
1.2.1 理化性質分析
使用Expasy(https://www.expasy.org/)中的ProtParam預測蛋白質的理化性質,如分子式、氨基酸數量、分子量、理論等電點和不穩定系數;使用Expasy(https://www.expasy.org/)中的ProtScale預測蛋白質的親水性[8]。
1.2.2 信號肽和跨膜結構域分析
使用SignalP 5.0軟件(http://www.cbs.dtu.dk/services/SignalP/)預測蛋白質的信號肽;使用TMHMM軟件(http://www.cbs.dtu.dk/services/TMHMM/)預測蛋白質的跨膜結構[9]。
1.2.3 磷酸化位點和糖基化位點分析
使用NetPhos 3.1軟件(http://www.cbs.dtu.dk/services/NetPhos/)預測蛋白質的磷酸化位點;使用NET CGlyc 1.0軟件(http://www.cbs.dtu.dk/services/NetCGlyc/)預測蛋白質的糖基化位點[10]。
1.2.4 二級結構和三級結構分析
使用SOPMA軟件(https://npsa-prabi.ibcp.fr/cgi-bin)預測蛋白質的二級結構;使用SWISS-MODEL軟件(https://swissmodel.expasy.org)預測蛋白質的三級結構[11]。
1.2.5 抗原表位預測
使用DNAStar中的Protean軟件,利用Jameson-Wolf法和AMPHI法預測蛋白質的B細胞抗原位點和T細胞抗原位點[12]。
2 結果與分析
2.1 DjTV-2a衣殼蛋白理化性質分析
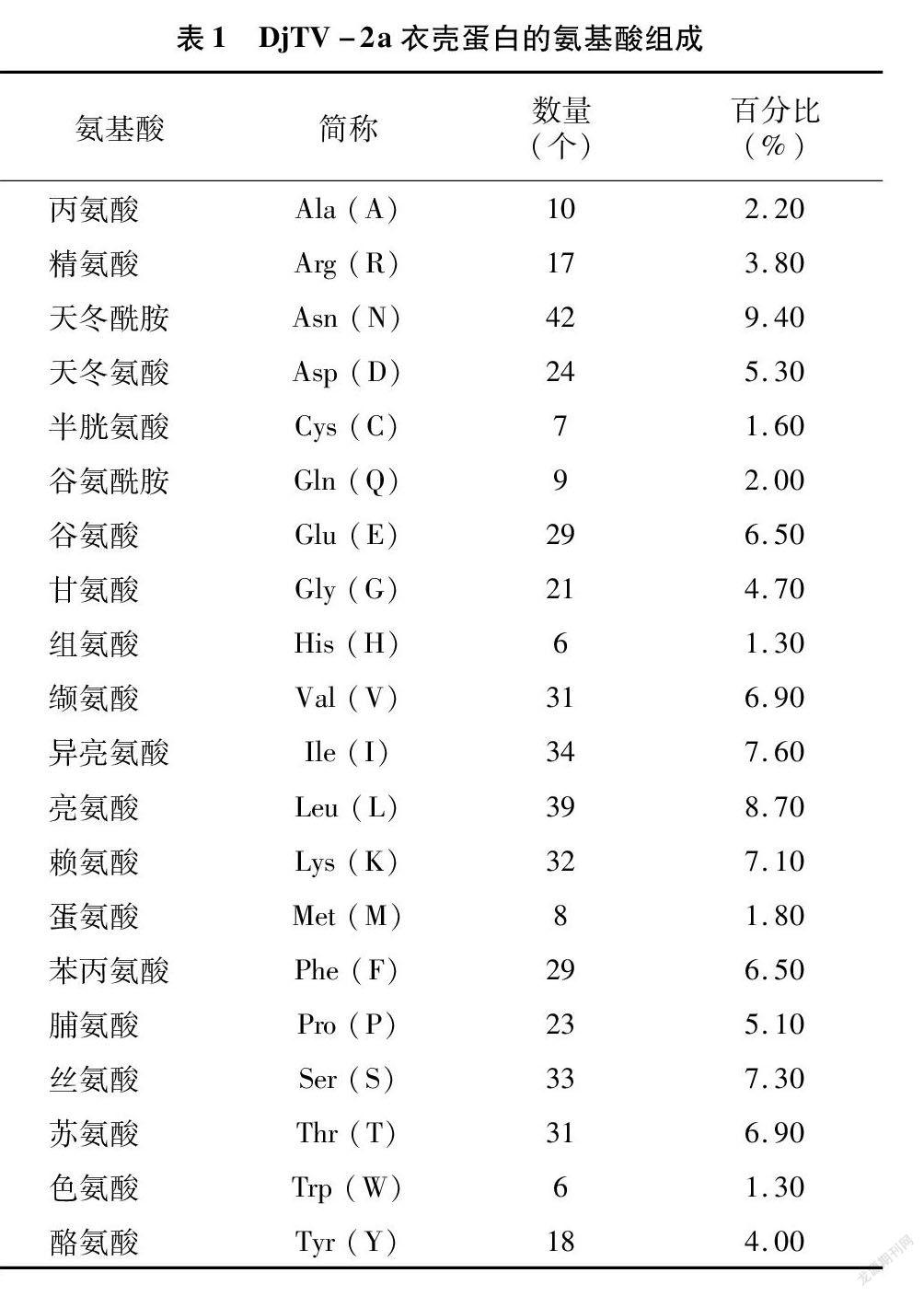
ProtParam軟件分析結果表明,DjTV-2a衣殼蛋白的分子量為51.6 ku,分子式為 C 2 337H 3 607N 601O 689S 15,原子總數為7 249,理論等電點(pI)為5.98,脂肪系數為85.66。DjTV-2a衣殼蛋白由449個氨基酸構成(表1),其中帶負電荷的氨基酸殘基(Asp+Glu)有53個,帶正電荷的氨基酸殘基(Arg+Lys)有49個。不穩定指數為47.40,親水性平均系數為-0.319,屬不穩定的親水蛋白(圖1)。
2.2 DjTV-2a衣殼蛋白信號肽和跨膜結構域分析
使用SignalP 5.0軟件和TMHMM軟件對該蛋白進行分析,發現DjTV-2a衣殼蛋白無信號肽(圖2),無信號識別功能,且無跨膜結構域(圖3),預測其為非分泌蛋白。
2.3 DjTV-2a衣殼蛋白磷酸化位點和糖基化位點分析
使用NetPhos 3.1軟件和NET CGlyc 1.0軟件對該蛋白進行分析,發現DjTV-2a衣殼蛋白具有33個絲氨酸磷酸化位點,31個蘇氨酸磷酸化位點,18個酪氨酸磷酸化位點(圖4),且在370位點存在1個糖基化位點。A994FED6-A6C1-432E-85EC-58668DDCE5D0
2.4 DjTV-2a衣殼蛋白二級結構和三級結構分析
使用SOPMA軟件預測蛋白質的二級結構,發現DjTV-2a衣殼蛋白有100個α-螺旋(Hh),占22.27%;109個β-折疊(Ee),占24.28%;18個 β-轉角(Tt),占4.01%;222個無規則卷曲(Cc),占49.44%(圖5)。使用SWISS-MODEL軟件建立DjTV-2a衣殼蛋白的三級結構模型,序列一致性為32.71%,全局模型質量評估(GMQE)和QMEAN評分分別為0.65、0.63(圖6)。
2.5 DjTV-2a衣殼蛋白抗原表位預測
使用DNAStar中的Protean軟件預測DjTV-2a衣殼蛋白的抗原表位。以Jameson-Wolf法,結合親水性、柔韌性和可及性,綜合分析預測DjTV-2a衣殼蛋白的優勢B細胞抗原表位有21個,分別位于5~23、24~42、45~55、60~71、78~87、99~106、107~111、134~140、149~166、171~182、189~197、203~220、224~228、237~252、259~270、280~298、311~318、322~332、336~385、390~399、413~426位氨基酸殘基或附近;利用AMPHI法和Rothbard-Taylor法預測DjTV-2a衣殼蛋白的T細胞抗原表位有10個,分別位于22~31、44~53、93~97、113~127、134~138、146~149、300~302、339~342、357~372、394~406位氨基酸殘基或附近(圖7)。綜合分析可知,DjTV-2a衣殼蛋白存在多個潛在的優勢抗原表位。
3 討論與結論
生物信息學在生命科學研究中發揮了重要作用,被廣泛用于預測蛋白質的理化性質、二級結構和抗原表位等[13]。對蛋白質進行生物信息學預測分析,可為蛋白質的進一步研究奠定基礎并提供理論支撐,減少試驗的盲目性和失敗率。
本研究利用生物信息軟件分析預測了DjTV-2a衣殼蛋白的理化性質、二級結構、三級結構以及蛋白抗原表位。DjTV-2a衣殼蛋白由449個氨基酸構成,理論等電點為5.98,不穩定指數為47.40,是不穩定的親水蛋白。DjTV-2a衣殼蛋白存在82個磷酸化位點和1個糖基化位點,推測蛋白受磷酸化調控和糖基化修飾,有助于形成抗原。蛋白質二級結構和抗原表位有很大聯系,DjTV-2a衣殼蛋白主要二級結構為無規則卷曲,其次為β-折疊和 α-螺旋,所以存在較多的抗原表位。因為氨基酸的一級結構是DNAStar的分析根本, 所以對參數的分析結果并不完全準確[14]。因此,必須與其他抗原性較大的蛋白進行比較或合成表位多肽驗證結果正確性[15-16]。綜合分析蛋白質的物理化學性質,可以推測DjTV-2a衣殼蛋白有21個B細胞抗原表位、10個T細胞抗原表位,該蛋白是容易識別的潛在優勢抗原,為后續基于血清學檢測DjTV-2a提供了理論依據。
參考文獻:
[1]Jiao K L,Han P J,Yang M L,et al. A new species of gall midge (Diptera:Cecidomyiidae) attacking jujube,Ziziphus jujuba in China[J]. Zootaxa,2017,4247(4):487-493.
[2]李 蘭,阿地力·沙塔爾,潘存德,等. 棗葉癭蚊在阿克蘇市的消長規律及其防治研究[J]. 新疆農業大學學報,2010,33(1):36-39.
[3]安尼瓦爾·斯力木.新疆棗癭蚊綜合防治研究[J]. 安徽農業科學,2015,43(34):185-186.
[4]Bigot Y,Rabouille A,Sizaret P Y,et al. Particle and genomic characteristics of a new member of the Ascoviridae:Diadromus pulchellus ascovirus[J]. The Journal of General Virology,1997,78(5):1139-1147.
[5]Asgari S,Bideshi D K,Bigot Y,et al. ICTV virus taxonomy profile:Ascoviridae[J]. The Journal of General Virology,2017,98(1):4-5.
[6]Wang J,Yang M L,Xiao H B,et al. Genome analysis of Dasineura jujubifolia toursvirus 2,a novel ascovirus[J]. Virologica Sinica,2020,35(2):134-142.
[7]廖穎茵,薛 亮,高珺珊,等. 諾如病毒分子結構特征及其衣殼蛋白功能研究進展[J]. 病毒學報,2021,37(2):459-464.
[8]黃曉慧,王 煒,王 倩,等. 生殖支原體P110蛋白的生物信息學分析[J]. 中國病原生物學雜志,2021,16(6):639-643,650.
[9]孫 敏,向 月,姜 華,等. 阪崎克羅諾桿菌OmpX蛋白的生物信息學分析[J]. 中國病原生物學雜志,2021,16(3):249-252,257.
[10]鮑佳佳,李 倩,孫銘艷,等. 銅綠假單胞菌YfiB蛋白的生物信息學分析[J]. 中國病原生物學雜志,2021,16(4):406-410.
[11]王 宇,李建云,武 健,等. 綿羊肺腺瘤病毒Gag蛋白的生物信息學分析及抗原表位預測[J]. 中國病原生物學雜志,2021,16(5):502-506.
[12]王曉哲,肖正泮,韋雙雙,等. 利用DNAStar軟件預測熱帶無爪螨主要致敏原Blo t 5的抗原表位[J]. 熱帶生物學報,2017,8(1):107-112.
[13]de Groot A S,Sbai H,Aubin C S,et al. Immuno-informatics:mining genomes for vaccine components[J]. Immunology and Cell Biology,2002,80(3):255-269.
[14]馬凡舒,張 蕾,王 洋,等. B細胞抗原表位預測方法的研究進展[J]. 中國畜牧獸醫,2016,43(1):63-67.
[15]Goyal B,Kumar K,Gupta D,et al. Utility of B-cell epitopes based peptides of RD1 and RD2 antigens for immunodiagnosis of pulmonary tuberculosis[J]. Diagnostic Microbiology and Infectious Disease,2014,78(4):391-397.
[16]楊 軍,劉 妮,張 婷,等. HBeAg的B細胞線性表位預測及鑒定[J]. 南方醫科大學學報,2013,33(2):253-257.A994FED6-A6C1-432E-85EC-58668DDCE5D0

