密碼子優化的吡喃糖氧化酶基因在畢赤酵母中的表達
王玥 高慶華 董聰 羅同陽 王慶慶
(河北省微生物研究所有限公司,保定 071051)
吡喃糖氧化酶(pyranose oxidase,PROD,簡稱P2O)又名吡喃糖-2-氧化酶或葡萄糖-2-氧化酶(pyranose-2-oxidase,glucose-2-oxidase),是以黃素蛋白為輔酶、以六元環吡喃單糖類化合物為底物的氧化還原酶類(EC 1.1.3.10),具有多底物催化等特征[1]。序列與結構分析比對發現,吡喃糖氧化酶與葡萄糖氧化酶、膽固醇氧化酶、膽堿氧化酶和甲醇氧化酶一樣同屬于葡萄糖-甲醇-膽堿(glucosemethanol-choline,GMC)氧化還原酶家族[2-3]。
研究發現,吡喃糖氧化酶在很多方面都起到重要作用,可降解木質纖維素[4],參與碳水化合物的生物轉化合成[5],還應用于生物燃料電池、生物傳感器以及臨床診斷分析中[6]。尤其是在臨床診斷分析中,P2O可以用于檢測糖尿病人血糖控制的重要指標1,5-脫水-D-葡糖醇。血清1,5-AG檢測的敏感性、特異性均較高,且不受忌、進食(餐前、餐后均可測)及性別、年齡、藥物等因素干擾,因此P2O具有更好的研究前景。
目前,有一些編碼吡喃糖氧化酶的基因序列被克隆且成功異源表達在大腸桿菌中,如隔孢伏 革 菌 屬 Peniophora sp.[7]、 多 色 栓 菌 屬 Trametes multicolor[4,8]、 黃 孢 原 毛 平 革 菌 Phanerochaete chrysosporium[9]、 彩 絨 革 蓋 菌 Coriolus versicolor[10]等白腐真菌中的吡喃糖氧化酶,還有來源于密褐褶孔菌Gloeophyllum trabeum[11]和松口蘑菌根菌Tricholoma matsutake[12]等褐腐真菌的吡喃糖氧化酶。但是這些表達的吡喃糖氧化酶的酶活都比較低,因此提高P2O的酶活就成為研究重點。
研究發現,許多外源基因在大腸桿菌表達體系中高效表達時,往往不能形成有一定空間結構的特定生物功能的蛋白質,而是以一種不可溶、無生物活性的沉淀即包涵體的形式存在于細胞內[13-15]。包涵體形成的原因有很多。研究發現,在表達量低時很少形成包涵體,表達量越高越容易形成包涵體[16]。原因可能是重組蛋白的合成速度太快,表達量短期內太大,大腸桿菌無法及時分泌出蛋白后期加工所需的酶類及輔助因子,以至于蛋白不能進行折疊,二硫鍵不能正確的配對,過多的蛋白進行非特異性結合,蛋白質無法達到足夠的溶解度等[16-17]。通常情況下,重組蛋白的氨基酸組成中含硫氨基酸越多越容易形成包涵體[17]。培養條件不佳,如溫度過高或胞內pH值接近蛋白的等電點時容易形成包涵體[18-19]。另外,重組蛋白是大腸桿菌的異源蛋白,由于缺少真核生物中翻譯后修飾所需酶類及輔助因子,如折疊酶、分子伴侶等,致使中間體大量積累,容易形成包涵體沉淀[20]。
在真核表達系統中,畢赤酵母分泌表達系統能對許多蛋白質產物進行分泌,便于產物提純。而且畢赤酵母表達系統具有可誘導的強啟動子AOX1,啟動外源基因高效表達,還有生長迅速等優點[21]。由于畢赤酵母對密碼子的偏愛性,為了消除稀有密碼子對蛋白表達量的影響,對目的基因密碼子序列進行改造十分必要[22]。目前研究發現,吡喃糖氧化酶只在大腸桿菌中成功異源表達,其在畢赤酵母中表達有待研究。
本研究以NCBI中登錄號XM_008046051.1的變色栓菌 pyranose 2-oxidase基因序列為基礎,根據畢赤酵母的密碼子偏愛性對該基因的密碼子序列進行優化,委托公司進行基因合成。經過轉化子的篩選,得到了高產吡喃糖氧化酶的重組菌株。在10 L發酵罐中擴大培養,并對其部分酶學性質進行了研究。為吡喃糖氧化酶在真核表達系統中的表達提供試驗及應用依據的同時,避免了在大腸桿菌中表達產生的弊端,開辟了一條全新的吡喃糖氧化酶的工業化高效生產途徑。
1 材料與方法
1.1 材料
1.1.1 菌株及質粒 吡喃糖氧化酶基因由安徽通用生物公司合成,合成的基因連接在pPIC9K表達載體上;大腸桿菌E.coli DH5α購自上海生工;酵母表達菌株GS115購于優寶生物。
1.1.2 主要試劑 質粒提取試劑盒購自全式金公司;Not I-HF酶、EcoR I-HF酶和Sac I酶均購自NEB 公司;DNA Marker購自康為公司;G418購自phytotechlab公司;ABTS購自Biotopped Life Sciences公司;辣根過氧化物酶購自源葉生物公司;其他試劑為國產分析純。
1.1.3 培養基 LB培養基、YPD培養基、YPDS培養基、BMGY培養基、YPCS培養基、BSM發酵培養基、PTM1微量溶液的配制均參照文獻[23]。
1.2 方法
1.2.1 吡喃糖氧化酶基因序列的密碼子優化及合成 參照NCBI中登錄號為 XM_008046051.1的變色栓菌 pyranose 2-oxidase基因序列,利用密碼子優化軟件(http://gcua.schoedl.de/)分析,發現吡喃糖氧化酶基因中存在多處畢赤酵母的稀有密碼子,利用密碼子優化軟件(http://www.jcat.de/)對該基因進行密碼子優化,在不改變氨基酸序列的基礎上,獲得優化后的吡喃糖氧化酶基因序列。在序列的5′端加上EcoR I限制性酶切位點,EcoR I限制性酶切位點為GAATTC;3′端加上6個組氨酸標簽后再加上Not I限制性酶切位點,Not I限制性酶切位點為GCGGCCGC,將優化構建的基因序列送安徽通用生物公司合成,合成的基因連接到pPIC9K表達載體上,得到重組表達質粒pPIC9K-P2O。
1.2.2 重組表達載體的驗證 安徽通用生物公司提供的質粒總量約為 2-5 μg,用 20-50 μL 滅菌后的雙蒸水或 pH 8.0 的 1×TE 緩沖液來溶解,溶解后的質粒濃度約為 100 ng/μL。同時提供含有目的基因的重組質粒的穿刺菌約 500 μL 備用。拿到的穿刺菌可以看到明顯的穿刺線,挑取穿刺線上的菌接種到LB固體平板,37℃過夜培養。利用全式金質粒提取試劑盒提取陽性菌株的質粒,通過EcoR I和Not I雙酶切驗證重組質粒pPIC9K-P2O。
1.2.3 陽性轉化子的獲得 將驗證好的重組質粒pPIC9K-P2O利用限制性內切酶Sac I進行線性化后,電轉表達宿主畢赤酵母Pichia pastoris GS115,構建重組表達菌株GS115/pPIC9K-P2O,涂布在終濃度250 μg/mL G418的YPDS固體平板上,30℃培養3 d后獲得陽性轉化子。
1.2.4 重組蛋白的誘導表達和SDS-PAGE檢測 將重組菌株GS115/pPIC9K-P2O挑取單菌落接種于5 mL YPCS(1%酵母提取物,2%蛋白胨,0.5%酪蛋白水解物,0.5%山梨醇)試管液體培養基中,14-18 h后加1%(V/V)甲醇,24 h和48 h均各加1%(V/V)甲醇誘導,72 h收菌,常溫12 000 r/min離心5 min收集上清,檢測吡喃糖氧化酶的酶活,同時進行SDS-PAGE檢測。所有試驗均設置3個重復。
1.2.5 吡喃糖氧化酶的酶活測定 吡喃糖氧化酶的酶活測定方法參照文獻[4,24]。在反應總體積為1 mL的體系中,依次添加濃度為50 mmol/L、pH 6.5的磷酸鉀緩沖液580 μL,濃度為0.01 mol/L的ABTS溶液100 μL,濃度為 1 mol/L 的 D-葡萄糖溶液 100 μL,濃度為100 U/mL的辣根過氧化物酶儲液20 μL,添加200 μL酶液啟動反應,測定該反應在吸收波長為420 nm處3 min之內的連續變化。
1.2.6 吡喃糖氧化酶的酶學性質分析 酶的最適作用pH和溫度以及pH穩定性和熱穩定性,金屬離子的影響和底物特異性的測定參照文獻[24-25]。所有試驗均設置3個重復。
1.2.7 10 L發酵罐放大表達P2O 選取試管水平上吡喃糖氧化酶活性最高的轉化子研究其發酵罐條件下的表達。挑取單克隆接種于5 mL的YPD液體培養基培養10 h,按 3% 接種量轉接于 150 mL BMGY培養基至 OD600≈6接種于發酵罐中。10 L發酵罐的裝液量為5.4 L的BSM培養基,滅菌后以10%發酵體積接種,以濃氨水控制pH值,培養溫度為30℃。發酵過程分為4個階段:菌體培養階段、碳源飼喂階段、饑餓培養階段和誘導表達階段具體內容參照文獻[21]。具體方法詳見Invitrogen 操作手冊。每隔12 h測定表達的吡喃糖氧化酶的活性,并同時進行SDS-PAGE監測表達量的累積。
2 結果
2.1 吡喃糖氧化酶基因的密碼子優化及人工合成
在保持氨基酸序列不變的基礎上,合成優化的基因序列中共替換了421個堿基。優化后的基因序列通過人工合成的方法獲得。基因序列如圖1所示,大小為1 904 bp。
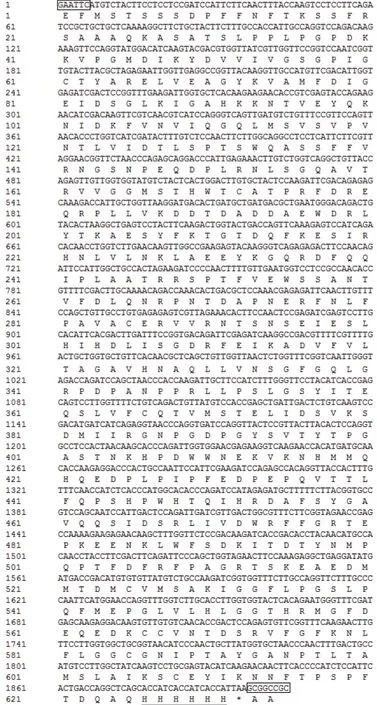
圖1 密碼子優化后的基因序列Fig.1 Gene sequence after the optimization of codons
2.2 重組表達載體的驗證
挑取穿刺菌保存管中穿刺線上的菌接種到LB固體平板上,37℃ 過夜培養。利用全式金質粒提取試劑盒提取陽性菌株的質粒,通過EcoR I和Not I雙酶切對重組質粒pPIC9K-P2O進行驗證。
由圖2可知,重組表達質粒pPIC9K-P2O經過EcoR I和 Not I雙酶切得到9 kb和1.9 kb左右的條帶,分別為載體片段和優化后的目的基因片段,與預期結果一致。
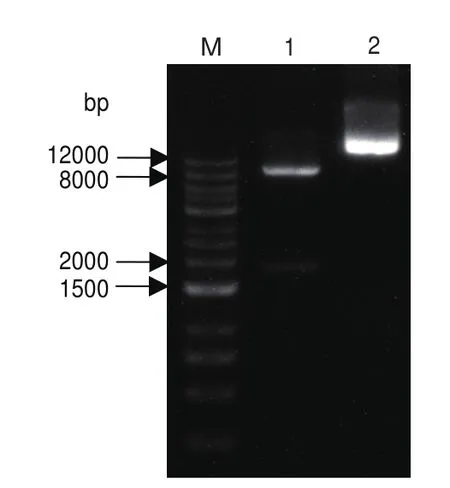
圖2 pPIC9K-P2O質粒雙酶切驗證Fig.2 Verification of pPIC9K-P2O digested by double enzymes
2.3 試管水平檢測吡喃糖氧化酶的表達
將獲得的陽性轉化子GS115/pPIC9K-P2O(圖3)按照上述試驗條件進行吡喃糖氧化酶在試管中的發酵。利用HRP-ABTS的方法測定吡喃糖氧化酶的酶活力。一個單位的吡喃糖氧化酶酶活(U)定義為每分鐘氧化2 μmol的ABTS所需的吡喃糖氧化酶的量。
圖3 轉化子的獲得Fig.3 Acquirement of transformants
首先對不同的單菌落進行了顏色篩選,反應體系添加酶液后由無色變為紅棕色,且顏色越深說明酶活越高。隨后選擇了20個顏色變化明顯的單菌落,測定其試管水平上的酶活。結果(圖4)顯示,有6個陽性轉化子誘導72 h后表達產物的酶活在18 U/mL以上,其中4號陽性轉化子的酶活較高且穩定,最高酶活約24 U/mL。因此,選擇菌株GS115/pPIC9KP2O-4進行下一步試驗研究。
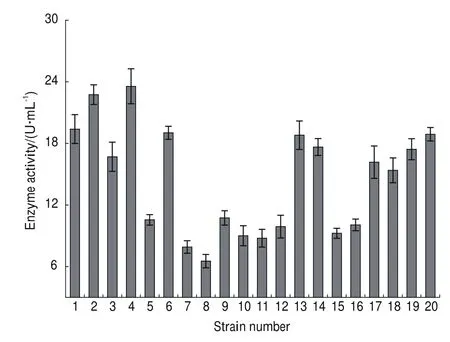
圖4 篩選P2O高表達量的重組菌株Fig.4 Screening of recombinant P.pastoris with high-yield P2O
將離心后的發酵上清液進行SDS-PAGE蛋白電泳,結果如圖5所示,pPIC9K-P2O表達載體轉化的重組畢赤酵母在85-100 kD之間有一條條帶,且pPIC9K空載體轉化的畢赤酵母沒有相似條帶,說明吡喃糖氧化酶在重組畢赤酵母中實現了外源分泌表達。前期優化基因序列時在3′端有6個組氨酸標簽,上清液超濾濃縮后采用Ni2+親和層析柱親和純化蛋白,并進行SDS-PAGE蛋白電泳,結果如圖6。
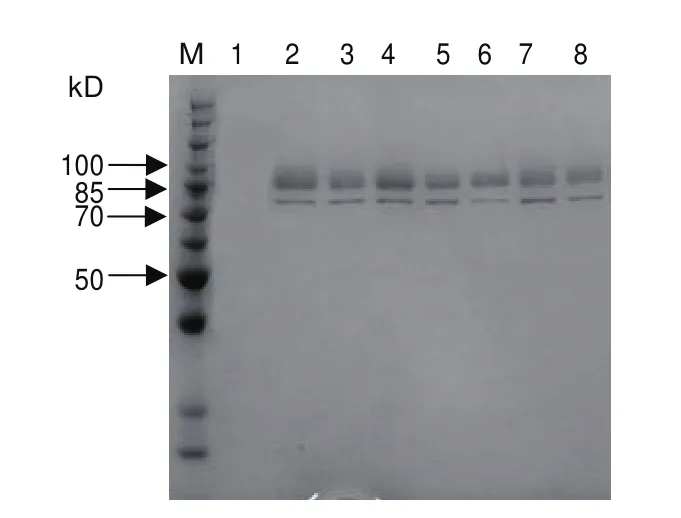
圖5 重組蛋白的SDS-PAGE結果Fig.5 SDS-PAGE result of recombinant protein
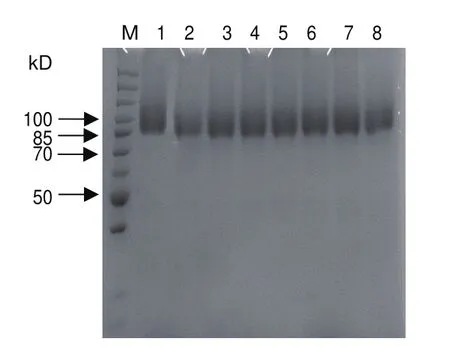
圖6 重組蛋白純化結果Fig.6 Purification results of recombinant protein
2.4 10 L發酵罐表達吡喃糖氧化酶
將重組菌P.pastoris GS115/pPIC9K-P2O-4按照上述試驗條件進行10 L發酵罐放大培養,結果如圖7所示。初始發酵溫度控制在30℃,用濃氨水控制pH 為5.0,通過調節轉速和通氣量控制溶氧。等到BSM培養基中的甘油耗盡,溶氧上升后,以12 mL/(h·L)的速度流加含有1.2%(V/V)PTM1的50%(W/V)甘油,待OD600長到150-180 時停止流加甘油,然后饑餓培養0.5-2 h,溶氧開始上升。這時,以3 mL/(h·L)的速度流加含有1.2%(V/V)PTM1 的100%甲醇,用濃氨水控制pH 為6.0,調節轉速和通氣量控制溶氧。
隨著甲醇的添加,吡喃糖氧化酶的酶活逐漸升高,誘導132 h時酶活達到約220 U/mL(圖7-A)。對不同誘導時間的發酵上清液進行SDS-PAGE 蛋白電泳,結果(圖7-B)顯示,隨著誘導時間的增加,在85-100 kD處的條帶變濃重,與酶活的增長趨勢相對應。
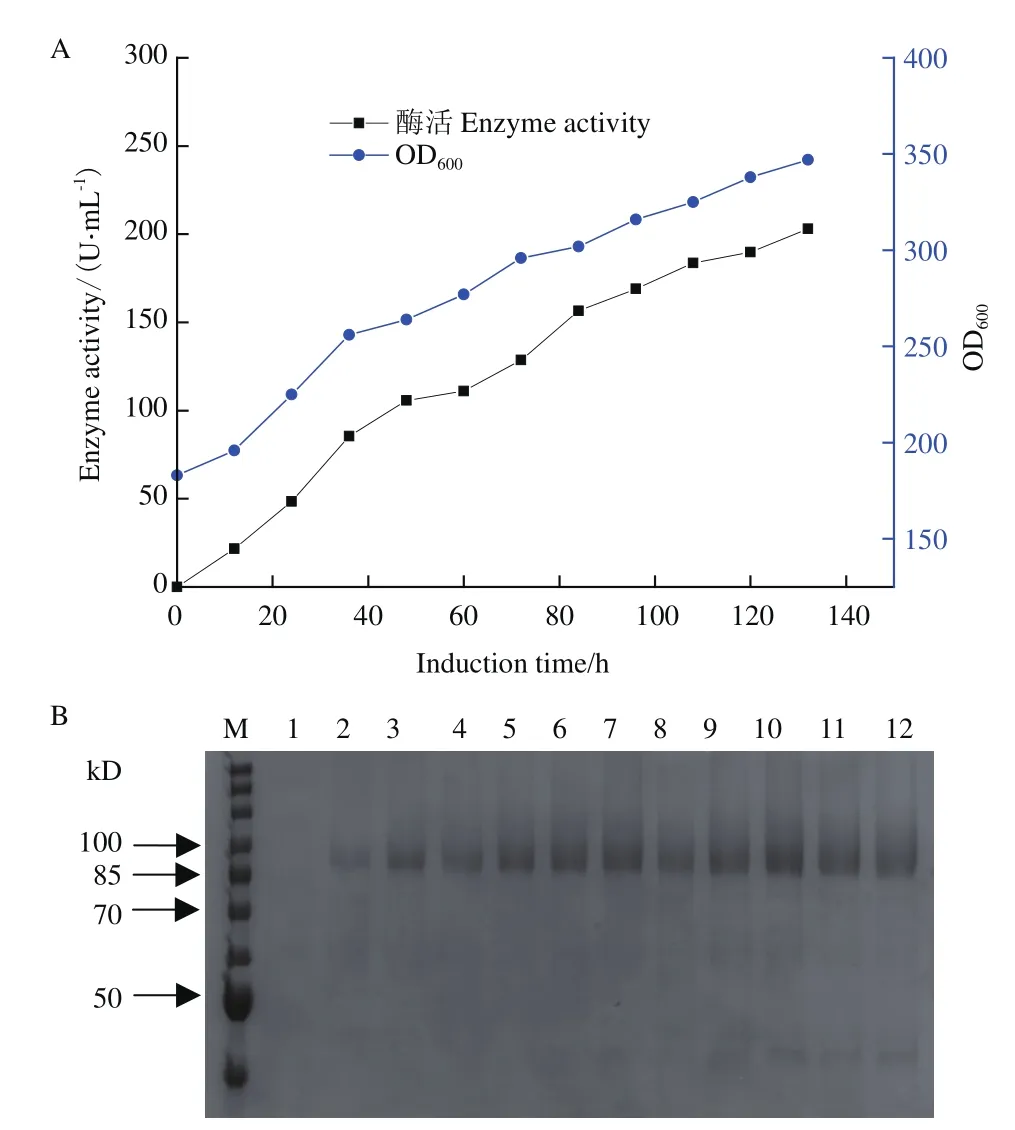
圖7 10 L 發酵罐高密度發酵生產 P2OFig.7 Production of P2O by high-density fermentation in 10 L bioreactor
2.5 重組吡喃糖氧化酶的酶學性質研究
重組吡喃糖氧化酶作用葡萄糖的最適pH為6.5(圖8-A)。在pH 5的檸檬酸鹽緩沖液和pH 9的甘氨酸-氫氧化鈉緩沖液中,P2O表現出約60%的相對活力。在pH 5-9范圍內,其相對酶活高于50%。當pH低于5或高于9時,酶活開始隨著pH的降低或升高急劇下降(圖8-A)。P2O在較廣的pH范圍內都表現出較高的穩定性,尤其是對堿性條件有較強的耐性。在pH 4-9的緩沖液中放置24 h,酶活仍在80%以上(圖8-B)。
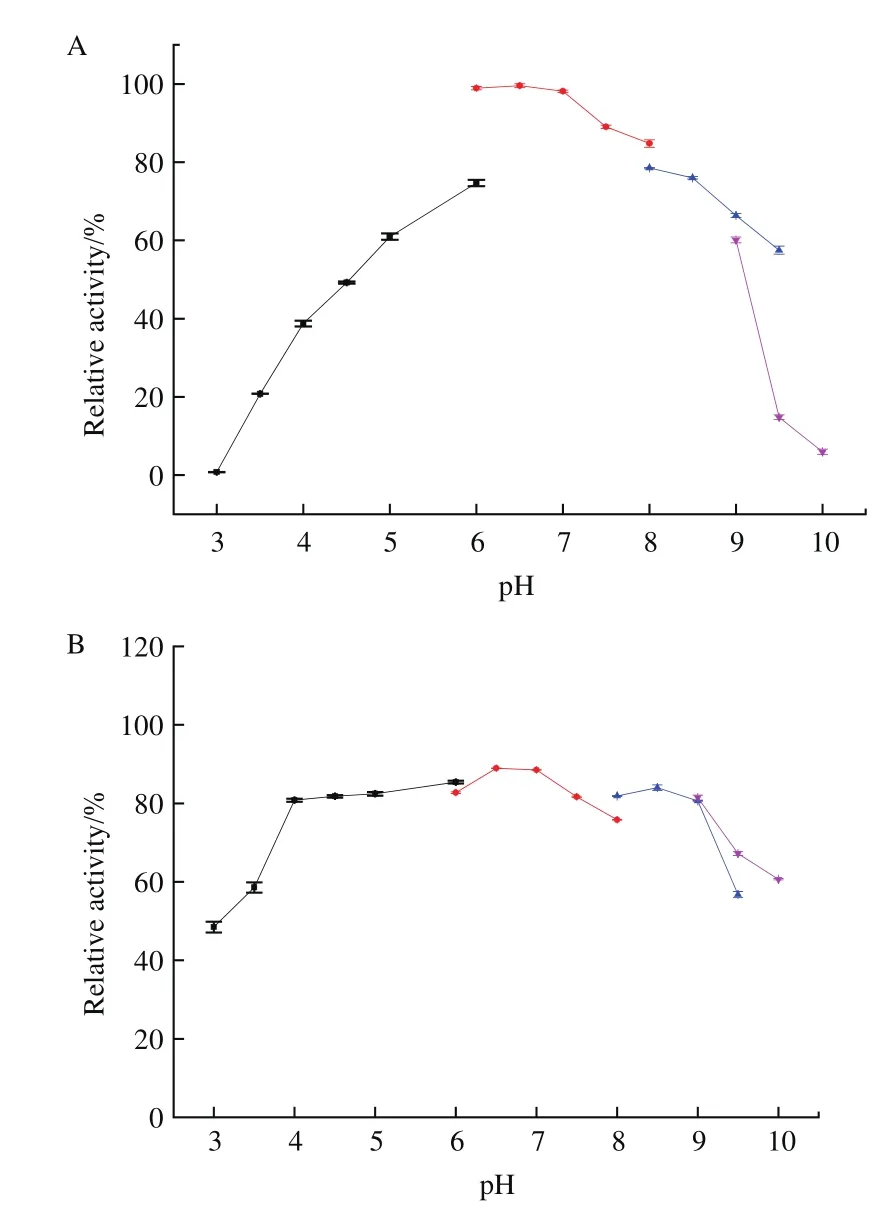
圖8 最適pH及pH穩定性Fig.8 Optimal pH and pH stability
P2O氧化葡萄糖的最適溫度為55℃(圖9-A),曲線呈典型的“鐘罩型”。溫度高于或低于55℃都導致其酶活下降。在30 min內,該酶在不超過60℃條件下熱穩定性良好(圖9-B)。當溫度升高至80℃時,30 min內 P2O完全失活。

圖9 最適溫度及溫度穩定性Fig.9 Optimal temperature and temperature stability
不同濃度的金屬離子對吡喃糖氧化酶的酶活影響如圖10所示。金屬離子Cu2+對該酶酶活的抑制作用較大,與周亞萍報道的研究結果一致[26-27]。在金屬離子濃度為 10 mmol/L 時,Mn2+、Co2+對其有激活作用(圖10),分析其原因可能是該濃度下的這兩個金屬離子與酶結合改變了酶的空間結構(尤其是活性部位的結構),對酶的活性有了促進作用,但其調控機制有待進一步深入研究。P2O的底物專一性較好,以葡萄糖為最適底物(圖11),對麥芽糖也有一定活性,對其他單糖或二糖不顯示催化活性。

圖11 P2O的底物特異性Fig.11 Substrate specificity of P2O
3 討論
吡喃糖氧化酶(P2O)是以黃素蛋白(FAD)為輔酶的氧化還原酶類,具有多底物催化特性,可催化葡萄糖、山梨糖、木糖等多種糖類化合物。近年來吡喃糖氧化酶越來越受到重視,該酶在降解木質素[2,25]、食品技術[2,28]、制作生物傳感器[29]等方面有重要作用。P2O還可以用于檢測糖尿病人血糖控制的重要指標 1,5-脫水葡萄糖醇(1,5-AG)[30]。葡萄糖氧化酶和己糖激酶只能作用于β-D-葡萄糖,而吡喃糖氧化酶能作用于α-和β-D-葡萄糖,對葡萄糖有更高的親和性,因此,吡喃糖氧化酶無需變旋即可檢測血液中或食物中的葡萄糖[31]。
目前,P2O已經在大腸桿菌中得到了異源表達,在真核表達系統中尚無報道。并且P2O在大腸桿菌中進行重組表達時容易形成包涵體,表達量低,不易分離,給工業應用帶來一定的限制,因此,利用基因工程技術實現吡喃糖氧化酶的大量生產成為了研究熱點。畢赤酵母表達系統是目前應用較廣、外源蛋白表達效果較理想的表達系統之一[21],與原核表達系統相比,具有很多優點,如生長迅速,遺傳操作簡單,有可誘導的強啟動子AOX1,啟動外源基因高效表達,并能正確翻譯和翻譯后加工,被廣泛用于各種具有工業用途的重組蛋白的生產。
研究發現,P2O廣泛分布于白腐真菌中,本研究選用的擔子菌綱變色栓菌(Trametes versicolor)是白腐真菌的一種,常用于實驗和科研檢測。我們在NCBI中選取了幾個含有吡喃糖氧化酶基因序列的真菌,分別對不同的基因序列進行密碼子優化,轉化到畢赤酵母中表達,通過酶活力和穩定性的檢測發現,本研究選用的基因序列優化后表達的吡喃糖氧化酶的酶活力較高,且穩定性較好。
本研究利用畢赤酵母表達系統表達吡喃糖氧化酶,通過分析影響蛋白表達量的因素,根據畢赤酵母密碼子偏愛性對該基因序列進行優化,提高該酶的表達量。合成基因序列的過程中,在該基因序列的3′端加入6個組氨酸標簽,可以采用Ni2+親和層析柱親和純化蛋白。在10 L發酵罐發酵培養時,經過132 h酶活達到了220 U/mL。畢赤酵母可通過高密度發酵培養大量生產重組蛋白,同時有利于簡化純化步驟,降低生產成本。本實驗還對重組吡喃糖氧化酶的部分酶學性質進行了研究,為該酶的應用和改造提供一系列必要的初始參數。尤其是在血糖檢測用酶,要求所用的酶有較高的催化效率,較窄的底物譜,同時需要有良好的熱穩定性。
本研究在為吡喃糖氧化酶在真核表達系統中的表達提供了試驗及應用依據,同時,有效避免了在大腸桿菌中表達產生的弊端,開辟了一條全新的吡喃糖氧化酶的工業化高效生產途徑。
4 結論
本研究利用畢赤酵母表達系統實現了吡喃糖氧化酶的分泌表達,根據畢赤酵母的密碼子偏好性對pyranose 2-oxidase基因進行密碼子優化,將優化后的基因序列克隆到畢赤酵母中,經過轉化子篩選,得到了高產P2O的重組畢赤酵母菌株。最佳培養條件下吡喃糖氧化酶酶活在試管水平達到24 U/mL,在10 L發酵罐中對重組畢赤酵母菌株放大培養,甲醇誘導132 h吡喃糖氧化酶酶活可達220 U/mL。進一步研究了其酶學性質,pH和溫度的穩定性良好,并且底物專一性較好。

